牙鲆芳香化酶Cyp19a多克隆抗体制备及其应用
2023-01-30王丽娟邹聪聪邹玉霞王国玉吴志昊
舒 畅, 王丽娟, 邹聪聪, 邹玉霞, 王国玉, 吴志昊, 李 泽, 尤 锋
牙鲆芳香化酶Cyp19a多克隆抗体制备及其应用
舒 畅1, 2, 3, 王丽娟1, 2, 邹聪聪1, 2, 3, 邹玉霞1, 2, 王国玉1, 2, 吴志昊1, 2, 李 泽1, 2, 3, 尤 锋1, 2
(1. 中国科学院 海洋研究所 实验海洋生物学重点实验室 海洋大科学中心 山东省实验海洋生物学重点实验室, 山东 青岛 266071; 2. 青岛海洋科学与技术试点国家实验室 海洋生物学与生物技术功能实验室, 山东 青岛 266237; 3. 中国科学院大学, 北京 100049)
芳香化酶Cyp19a在鱼类性别决定和性别分化中起关键作用, 通过调控体内雌、雄激素的转化来影响鱼类性别表型形成。为深入研究Cyp19a在牙鲆()性腺分化和发育过程中的表达规律及作用机制, 本文从牙鲆cDNA中克隆获得1 557 bp的基因编码序列, 并成功构建了原核重组表达质粒。经体外重组与纯化获得较高纯度的重组Cyp19a蛋白; 以此作为抗原免疫兔子, 制备多克隆抗体。用间接酶联免疫吸附剂测定(ELISA)技术检测抗血清效价, 评估其免疫原性。结果表明免疫结束后得到的抗体血清效价超过了1∶50 000, 且纯化后抗体具有较好活性。Western Blot (WB)检测结果表明Cyp19a兔多抗可以特异性识别牙鲆重组Cyp19a蛋白和内源性Cyp19a蛋白。蛋白水平的雌雄性腺差异表达分析显示, 牙鲆Cyp19a蛋白在卵巢中高表达, 在精巢中微量表达。利用Foxl2和Dmrt1重组蛋白处理牙鲆性腺分化期幼鱼可分别显著上调和下调Cyp19a的表达(<0.05)。综上所述, 本研究成功制备了牙鲆Cyp19a多克隆抗体并进行了应用, 为深入研究牙鲆等鱼类性别分化机制提供有力工具。
牙鲆(); Cyp19a; 重组蛋白; 多克隆抗体; 蛋白表达
芳香化酶是细胞色素P450(cytochrome P450)家族的成员之一, 是参与性激素转换的重要酶类, 由编码, 可以催化睾酮(T)生成雌二醇(E2), 也可以催化雄烯二酮(A)生成雌酮(E1)[1]。雌激素在鱼类卵巢分化和发育中起重要作用, 而转录水平和芳香化酶的活性将直接影响到内源雌激素的水平[2]。斑马鱼()中, 敲除基因会导致幼鱼体内雌激素水平降低, 卵巢消失[3]; 而外源雌激素处理会使的表达量增加, 出现雌性偏倚[4]。在多数鱼类中, 如虹鳟()、欧鲈()和尼罗罗非鱼()等,在性腺分化早期体细胞的前体细胞中开始表达, 在卵巢形成后的颗粒细胞中高表达, 暗示其通过调控雌激素的合成, 进而维持卵巢体细胞分化和卵母细胞发育[5-6]。研究表明, 鱼类的表达受到Foxl2、Dmrt1等转录因子的调控[7], Foxl2可激活的转录活性, 在卵巢分化与发育过程中发挥作用, 而Dmrt1可拮抗Foxl2, 抑制的表达, 参与鱼类雄性性别决定和分化[8-9]。
的功能作用形式是酶, 蛋白水平的研究能够更精确地解释其生物学功能, 对于探索其在鱼类雌性或雄性表型形成中的直接作用至关重要。利用商业化抗体对斑马鱼和银鲫()等鱼类中Cyp19a蛋白表达定位进行分析显示, 其存在性别二态性表达, 卵巢中表达量高于精巢; 在卵巢分化早期和发育期也主要表达在体细胞中, 后者主要表达在卵母细胞周围的颗粒细胞中[10-11], 说明Cyp19a在早期雌性性别分化中有着重要作用。尼罗罗非鱼中, 利用重组蛋白制备了Cyp19a特异性抗体, 通过Western Blot(WB)分析了高温诱导性腺分化过程中Cyp19a表达的变化[12]。但鱼类抗体相对开发较少, 其特异性也存在物种差异, 所以, 鱼种特异的抗体仍旧很缺乏, 这也在很大程度上限制了鱼类蛋白水平研究的开展。Cyp19a也是如此, 目前鱼类Cyp19a相关研究主要集中在生理生化性质预测, 以及利用商用或自行制备抗体进行的少数物种成体表达模式分析等, 功能研究几乎还未涉及。多克隆抗体可应用于免疫共沉淀(co-immunoprecipitation, co-IP)、酶联免疫吸附剂测定(enzyme linked immunosorbent assay, ELISA)、免疫组化(immunocytochemistry, IHC)、WB等实验, 以及蛋白相互作用网络、蛋白表达图谱、蛋白定性与定量等功能研究[13], 已成为蛋白研究的重要工具。因此, 为了明确Cyp19a蛋白水平的作用方式, 亟待进行其重组及特异性抗体的制备。
牙鲆()隶属于鲽形目(Pleuronectiformes)、牙鲆科(Paralichthyidae)、牙鲆属(), 是中国及日韩重要的海水养殖鱼类[14]。其生长存在明显的性别二态性, 雌性生长显著快于雄性, 研究其性别调控机制不仅具有理论价值也有实践意义。牙鲆在雌雄性腺中存在差异表达, 卵巢中表达较高[15]。然而, 牙鲆相关研究也主要集中在mRNA水平, 例如基因表达、DNA甲基化关联分析以及转录因子对其调控作用等[16-17], 蛋白水平的研究几乎未见报道。本研究构建了牙鲆Cyp19a原核表达质粒, 经表达和纯化获得了重组蛋白, 以此为抗原制备了Cyp19a兔多克隆抗体, 并分析了Foxl2和Dmrt1重组蛋白对Cyp19a表达的影响, 以期为精确研究Cyp19a在牙鲆等鱼类性别决定与分化中的作用奠定基础。
1 材料和方法
1.1 实验材料
成体雌雄牙鲆(358.5~562.5 g)购买于青岛南山市场, 在中国科学院海洋研究所水族楼鱼类培育室暂养7 d。期间每天投喂适口饵料2次, 换水2次。暂养结束后, 随机选取3尾雌鱼和3尾雄鱼, 用100 pmol/L间氨基苯甲酸乙酯甲磺酸盐(3-aminobenzoic acid ethyl ester methanesulfonate, MS-222, Sigma, 美国)麻醉, 采集卵巢和精巢组织。样品液氮速冻后, 置于–80 ℃超低温冰箱冷冻保存, 用于后续RNA和蛋白提取。
从日照凌跃水产养殖基地购买80尾雌性牙鲆幼鱼(32.0~43.5 g)暂养7 d后用于腹腔注射。鱼苗腹腔注射所用人工雌核发育牙鲆在威海圣航水产科技有限公司进行诱导, 诱导方法及参数参照本实验室已有报道[18], 受精卵孵化后培育至全长(total length, TL)1.2~1.5 cm 时, 将其运至海洋研究所鱼类培育室暂养7 d。期间供应充气海水, 每天定期换水2~3次, 培育水温19~20 ℃, DO≥6 mg/L, 投喂商用饵料5~6次。
1.2 总RNA提取及cDNA合成
采用Trizol (Toroivd, 英国)法提取样品总RNA, 通过NanoDrop 2000分光光度计和1.5%琼脂糖凝胶电泳检测RNA的浓度和质量。使用反转录试剂盒Hifair®Ⅲ 1st Strand cDNA Synthesis SuperMix for qPCR (gDNA digester plus)(Yeasen, 中国)合成第一链cDNA, 操作步骤按照说明书进行。
1.3 重组质粒构建与蛋白重组
基于转录组[15]和基因组数据(GeneBank accession no. XM_020079905.1), 获得牙鲆编码区序列(coding sequence, CDS)。利用SnapGene 6 (https://www. snapgene.com/)和Primer 3 (https://www.yeastgenome. org/primer3)设计的含同源臂的特异性引物Cyp19a-F: 5′-ATGGATCGGATCCCTGCCTG-3′, Cyp19a-R: 5′-GAGT GTTTGCCAGCTTCCTC-3′, PCR扩增牙鲆基因的编码区。PCR反应体系为25 μL, 按照2×Pfu Master Mix(康为世纪, 中国)的说明书配制。其反应程序为: 94 ℃预变性2 min; 94 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸2 min, 共35个循环; 72 ℃终延伸5 min。反应结束后, 用 1%琼脂糖凝胶电泳检测, 目的片段经胶回收试剂盒Gel Extraction Kit D2500 (Omega, 美国)回收后, 交由睿博兴科生物技术(北京)有限公司进行双向测序。
利用限制性内切酶R-V(TaKaRa, 日本)按照说明书对表达载体pET-30a (+)(Solarbio, 中国)进行酶切。0.8%琼脂糖凝胶电泳检测后, 用前述胶回收试剂盒进行胶回收。按照同源重组试剂盒Seamless Assembly Cloning Kit (Clone Smarter, 美国)说明书, 将纯化后的PCR产物与pET-30a线性化载体进行同源重组, 重组质粒转化至大肠杆菌DH5α (TransGen, 中国)感受态细胞, 过夜培养后, 挑取10个单克隆菌落进行菌液PCR检测。PCR反应体系为25 μL, 按照2×Es Taq Master Mix(康为世纪, 中国)的说明书配制。其反应程序为: 94 ℃预变性2 min; 94 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸1 min 30 s, 共35个循环; 72 ℃终延伸2 min。反应结束后, 送至睿博兴科生物技术(北京)有限公司进行测序鉴定, 测序正确的重组质粒交由武汉金开瑞生物工程有限公司进行体外重组与纯化。重组质粒转化至大肠杆菌表达感受态细胞, 宿主菌经IPTG (1 mmol/L)诱导后, 获得重组目的蛋白。菌体超声破碎后, 利用His-Tag镍柱亲和层析法对重组蛋白进行纯化, 10%聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate- polyacrylamide gel electrophoresis, SDS-PAGE)检测表达和纯化质量。
1.4 Cyp19a多克隆抗体制备
将纯化后的重组蛋白与弗氏完全佐剂(Sigma, 美国)等体积混合, 彻底乳化。选择2只健康兔子作为免疫动物, 免疫前采血作为阴性对照。采用皮下注射接种, 第1天免疫剂量为0.5 mg, 第14、28和42天加强免疫, 剂量减至0.3 mg。在第35、49和56天时采血, 离心分离血浆。采用间接ELISA法测定抗血清效价, 抗原以2 μg/mL的浓度进行包被, 免疫前血清按1∶2 000、1∶4 000、1∶8 000和1∶16 000倍比稀释后作为阴性对照, 待检样品按1∶2 000、1∶4 000作梯度稀释至1∶65 536 000, 稀释液作为一抗用于效价测定。利用 Protein G亲和层析柱(汇研生物, 中国)从最后1次采集的血清中纯化兔多抗。
1.5 抗体特异性检测
利用放射免疫沉淀测定(radio immunoprecipitation assay, RIPA)裂解缓冲液(Solarbio, 中国)提取牙鲆性腺总蛋白。用制备的anti-Cyp19a (1∶2 000)作为一抗和辣根过氧化物酶(horseradish peroxidase, HRP)标记羊抗兔IgG抗体(1∶6 000, BBI, 中国)作为二抗进行WB检测所获得抗体的特异性。β-tubulin (1∶2 000, ZEN-BIO, 中国)用作内参。将Cyp19a重组蛋白和牙鲆性腺组织蛋白样品经10% SDS-PAGE后, 置半干转电转仪(Bio-Red, 美国)转印至硝化纤维素(nitrocellulose, NC)膜(Amersham, 英国)上, 用无蛋白快速封闭液(Epizyme, 中国)室温封闭15~20 min, 一抗和二抗分别在4 ℃孵育过夜和室温孵育2 h。采用化学发光试剂(electrochemiluminescence, ECL, Solarbio, 中国)检测并拍照。
1.6 Foxl2和Dmrt1重组蛋白的腹腔注射
利用本实验室先前已体外重组、纯化并验证活性的Foxl2、Dmrt1和EGFP蛋白[19], 以腹腔注射方式处理雌性牙鲆幼鱼及性腺分化期鱼苗。将80尾暂养雌性牙鲆幼鱼随机分为4组: Foxl2、Dmrt1和EGFP重组蛋白处理组及未处理对照组, 每组20尾。在第0、2和4天用-jetPEI转染试剂(Polyplus, 美国)转染重组蛋白, 注射浓度均为100 μg/g体质量, 第5天收集样品。50 pmol/L MS-222麻醉后, 取其性腺, 置于液氮中速冻, 然后保存在–80 ℃冰箱中, 用于蛋白表达分析。
将性腺分化期鱼苗随机分为4组, Foxl2、Dmrt1和 EGFP重组蛋白处理组及未处理组, 置于90 L培育箱内, 每箱150尾, 每组2个重复。每7 d分别将重组蛋白Foxl2、Dmrt1和EGFP与转染试剂- jetPEI一起进行腹腔注射。注射时期覆盖其性腺分化敏感期: 雌性, 1.5~4.5 cm TL; 雄性, 1.5~7.0 cm TL[20]。1.2~1.5 cm TL注射浓度为10 μg/尾, 并在3.0 cm TL后随鱼苗的生长成比例增加, Foxl2组在4.5 cm TL增加至30 μg/尾, Dmrt1组在7.0 cm TL增加至100 μg/尾。EGFP组注射浓度与实验组保持一致, 一半鱼苗在4.5 cm TL时随Foxl2组停止注射, 而另一半鱼苗随Dmrt1组注射至7.0 cm TL。在鱼苗3.0、6.0和10.0 cm TL时采集各组样品。鱼苗用5 pmol/L MS-222麻醉后, 进行样品采集, 对于3.0 cm TL的个体, 取性腺区域, 6.0和10.0 cm TL的个体取性腺组织, 液氮速冻后, 在–80 ℃冰箱中保存, 用于蛋白表达分析。
2 结果与分析
2.1 牙鲆cyp19a基因克隆
根据已有转录组和基因组数据, 获取并验证牙鲆序列。以牙鲆性腺cDNA为模版, 进行PCR扩增, 得到目的片段。利用1%琼脂糖凝胶电泳进行检测, 可见约为1 600 bp(图1)的条带。测序后, 得到1 557 bp的牙鲆编码区序列, 将其重组至pET-30a表达载体, 并转化至DH5α感受态细胞, 测序正确的质粒进行后续蛋白体外重组。
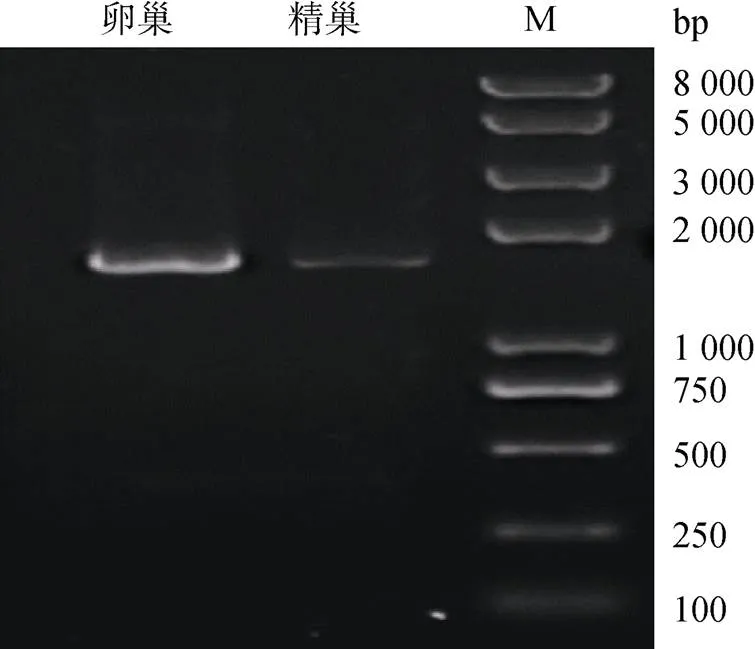
图1 牙鲆cyp19a基因的PCR扩增结果
2.2 重组Cyp19a蛋白的表达和纯化
SDS-PAGE结果显示, 与未经诱导的对照组相比, 转化重组质粒的宿主菌经诱导后, 在约74 kD的位置出现一条高表达的特异蛋白谱带(图2a), 推测为重组目的蛋白。Cyp19a重组蛋白大部分表达于沉淀中, 主要以不溶性包涵体形式存在。经His-tag镍柱亲和层析法分离纯化的重组蛋白, SDS-PAGE电泳检测显示在74 kD位置有一条清晰的条带, 且重组蛋白具有较高纯度(图2b)。
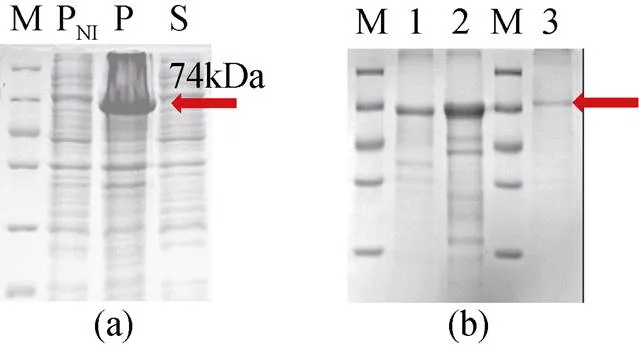
图2 牙鲆Cyp19a蛋白的原核表达与纯化
注: a. 蛋白表达的SDS-PAGE检测结果; b. 蛋白纯化的SDS- PAGE检测结果; M. marker; PNI. 未经诱导的沉淀; P. 沉淀; S. 上清; 1-3. 洗脱蛋白
a. SDS-PAGE analysis of protein expression; b. SDS-PAGE analysis of protein purification; M. marker; PNI. Non-induced recipitation; P. induced precipitation; S. induced supernatant; 1-3 eluted target proteins
2.3 Cyp19a多克隆抗体制备及其特异性检测
2.3.1 抗血清效价检测
经2只健康兔子免疫后, 收集血清利用ELISA检测效价。如图3所示, 阴性对照值均在0.1以下, 2只兔子的抗血清稀释度分别为128 000和256 000时, OD450值仍在0.5以上或接近0.5, 此时待测抗体值与阴性对照值之比大于2.1, 抗血清的效价均超过了1∶50 000, 说明体外重组纯化的Cyp19a重组蛋白可诱导兔子产生较好的免疫效果。
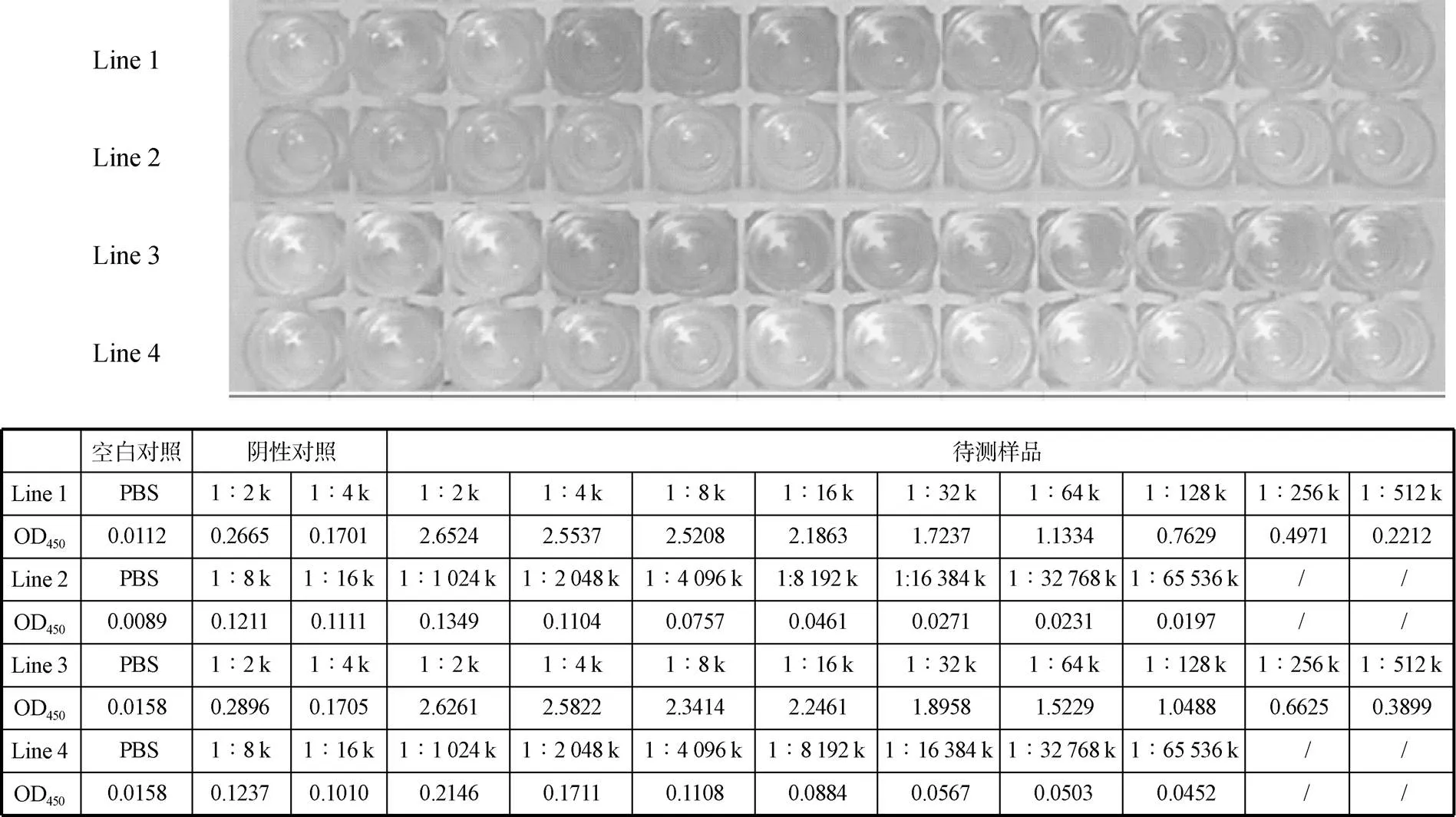
图3 ELISA检测牙鲆Cyp19a兔多抗血清效价
注: Line 1和Line 2. 第1只兔子血清; Line 3和Line 4. 第2只兔子血清; 第1列. 空白对照; 第2-3列. 阴性对照; 第4-12列. 待测样品; 表中为相应的稀释倍数下测定的抗血清效价
Line 1 and Line 2. 1st rabbit serum; Lines 3 and 4. 2nd rabbit serum; Column 1. blank control; Columns 2-3. negative control; Columns 4-12. positive sample; The following table shows the antiserum titers determined at the corresponding dilutions
2.3.2 抗体纯化及效价测定
利用SDS-PAGE电泳检测抗体纯化效果, 结果显示, 多克隆抗体在约55 kDa和25 kDa的位置出现了重链和轻链, 杂蛋白较少(图4), 说明Cyp19a抗体能够较好地从血清中分离出来, 且具有较高纯度。
利用ELISA对纯化后的抗体进行效价测定。纯化后抗血清稀释度为256 000时, OD450值仍可以维持在0.5以上, 此时待测抗体值与阴性对照值之比大于2.1(图5)。纯化后抗血清的效价超过1∶50 000, 说明纯化后的抗体具有较好活性, 可用于后续相关实验。
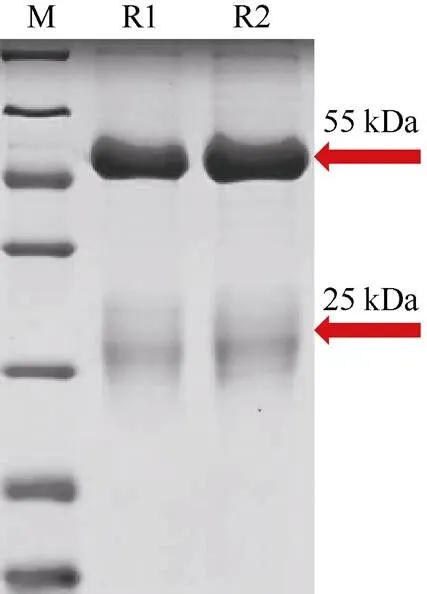
图4 Cyp19a纯化抗体的SDS-PAGE检测
M. marker; R1-R2. 纯化抗体
R1-R2. purified antibodies
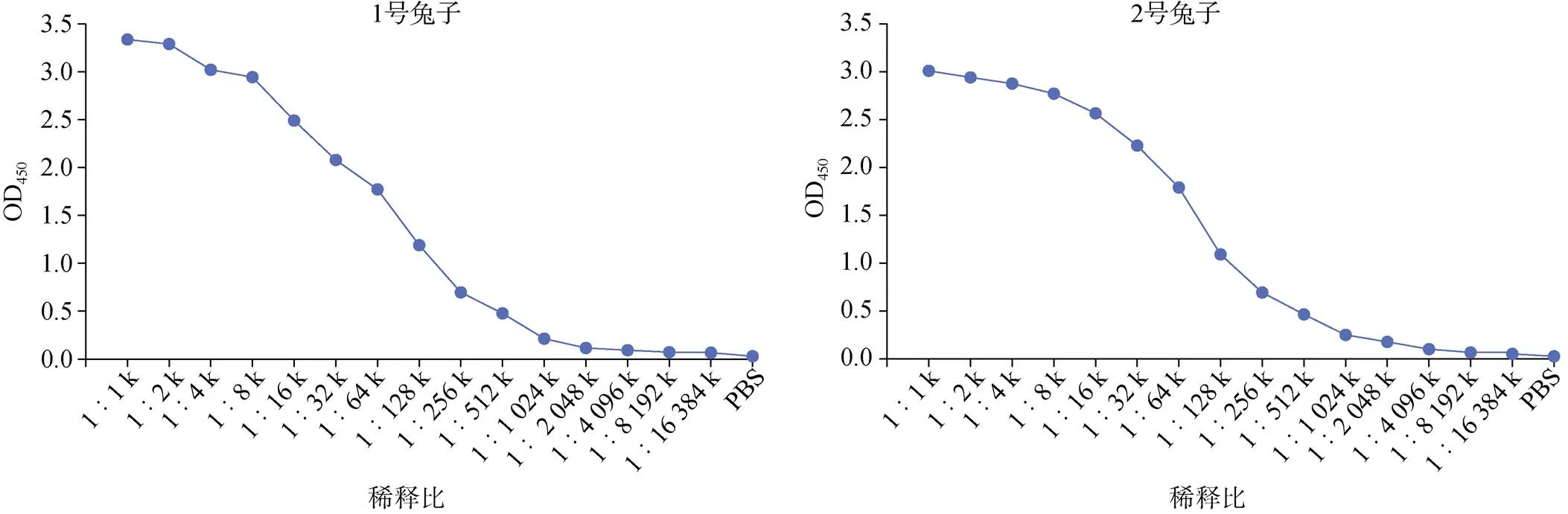
图5 ELISA 检测纯化抗体效价
2.3.3 Cyp19a抗体特异性检测
利用WB鉴定纯化抗体对重组蛋白的特异性。以免疫前血清作为阴性对照, 结果显示, 抗体能与重组蛋白特异性识别, 且条带单一, 与预期大小相符(图6a)。进一步利用牙鲆卵巢和精巢的总蛋白进行内源性检测, 也为单一条带, 表明制备的牙鲆Cyp19a抗体具有特异性。结果还显示Cyp19a蛋白主要在卵巢表达, 精巢中表达量较低(图6b)。

图6 Cyp19a的抗体特异性及雌雄性腺二态性表达
注: a. 重组蛋白; b. 牙鲆性腺; β-tubulin. 内参蛋白
a. recombinant protein; b. gonads of the flounder; β-tubulin. reference protein
2.4 Foxl2和Dmrt1重组蛋白对Cyp19a表达的影响
雌性牙鲆幼鱼腹腔注射重组Foxl2和Dmrt1蛋白后, 第5天性腺样品的WB检测结果显示, 未处理组和EGFP重组蛋白处理组间Cyp19a蛋白的表达无显著差异。与EGFP组相比, 重组Foxl2蛋白略微上调Cyp19a的表达, 而Dmrt1蛋白略微下调Cyp19a的表达, 但均不具有显著性差异(图7)。
对分化期鱼苗各处理组和未处理组的Cyp19a蛋白表达水平进行分析。结果如图8所示, EGFP组的Cyp19a表达水平与未处理组相比没有显著差异, 而用Foxl2重组蛋白处理, 会使Cyp19a的表达维持在一个较高水平, 且在6.0 cm TL时存在显著差异(<0.05); 而Dmrt1处理组中, Cyp19a表达水平在3.0 (0.05)、6.0(0.01)和10.0 cm TL(0.001)均显著降低。
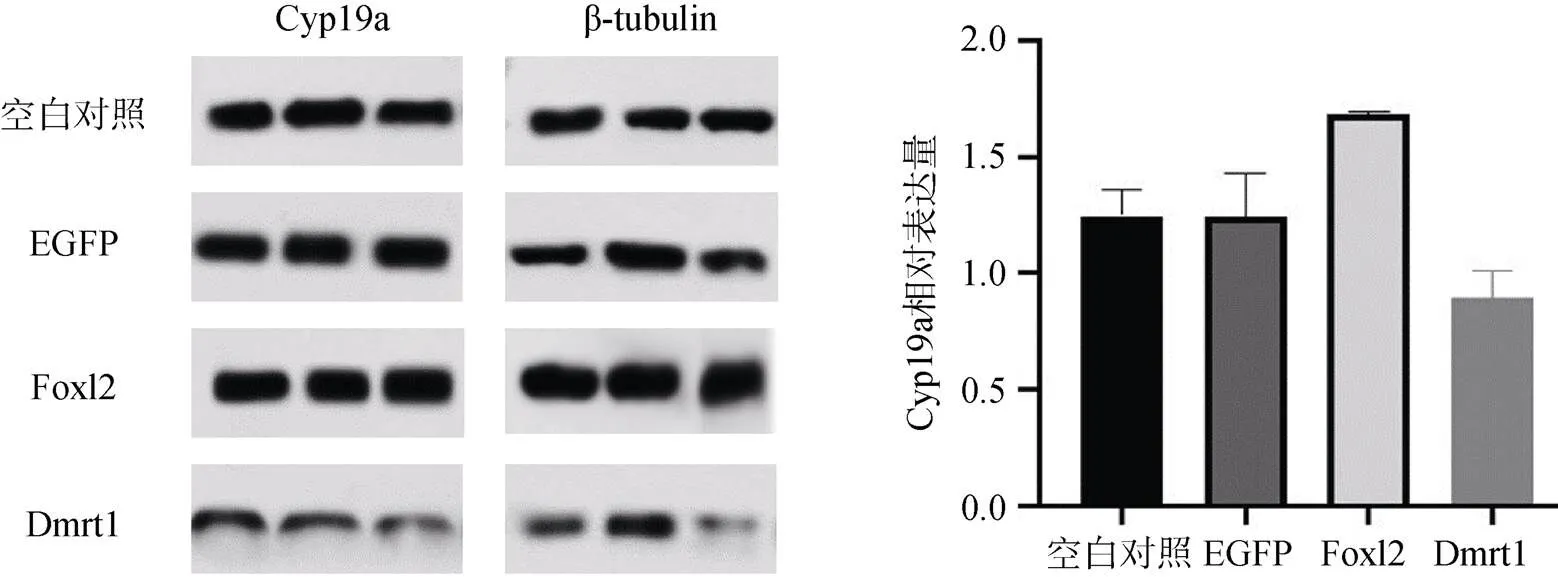
图7 重组Foxl2和Dmrt1蛋白注射雌性牙鲆幼鱼后Cyp19a蛋白水平变化(n =3)

图8 重组Foxl2和Dmrt1蛋白注射牙鲆分化期鱼苗后Cyp19a蛋白水平变化(n =3)
注: a. 3.0 cm TL; b. 6.0 cm TL; c. 10.0 cm TL; β-tubulin. 内参蛋白; 星号代表组间的显著差异, *.<0.05; **.<0.01; ***.<0.001
β-tubulin. Reference protein; The star represents significant difference between groups
3 讨论
本研究通过体外重组与纯化获得牙鲆Cyp19a重组蛋白, 并利用其制备了多克隆抗体。大肠杆菌表达系统具有高效、方便且成本低的优势, 常用于体外重组蛋白[21]。本研究中, 重组质粒转化至大肠杆菌表达感受态细胞后, 经IPTG诱导能够获得重组目的蛋白。外源蛋白在原核细胞的表达形式分为可溶性表达和包涵体表达, 其中, 包涵体蛋白虽然是非折叠状态的聚集体, 不具有生物学活性, 但具有纯度较高、表达量大等优势, 在纯化过程中加入尿素促进其溶解后, 便能获得较好的纯化效果[22], 可用于抗体制备和后续研究。本研究获得的重组Cyp19a蛋白主要以不溶性包涵体形式存在, 且具有较高浓度和纯度。金属螯合层析技术是利用蛋白质中部分氨基酸在中性水溶液中与特殊金属离子发生亲和吸附作用, 从而形成稳定的络合物进行分离的方法[23]。其中, 在较广的pH范围内(pH 6~8), 镍离子能与组氨酸的咪唑基团通过静电引力形成螯合物[24]。在本研究中, 重组Cyp19a蛋白中添加了His标签作为纯化标记物, 经镍柱亲和层析法纯化后的重组蛋白在SDS-PAGE电泳中杂蛋白较少。实验结果也说明该体外重组和纯化策略简单有效。
多克隆抗体是由多个B淋巴细胞克隆所产生的, 受到多种抗原决定簇刺激并可与多种抗原表位结合的抗体, 存在于免疫动物的血清中, 能够通过直接分离血清获得[25]。其制备过程相对较为简单, 免疫动物鼠、兔等经2~4次免疫, 收集抗血清, ELISA检测抗血清效价后, 经纯化即可获得多克隆抗体。制备方法高效、特异性良好、成本低且稳定性好, 已在多个科研和生产领域得到应用[26]。如利用该方法获得了尼罗罗非鱼特异性鼠源Cyp19a抗体, 并用于分析该蛋白在雌雄性腺中的表达规律, 以及高温诱导性腺分化对表达量的影响, 结果显示Cyp19a主要在卵巢中表达, 且高温能够抑制体内Cyp19a的表达[12]。斜带石斑鱼()的兔源Amh抗体, 不仅用于免疫组化研究其在石斑鱼卵巢与精巢中的差异表达, 还用于其及受体AmhrII在性腺中的功能验证[27]。本研究中, 对2只兔子进行4次免疫后, 抗血清的效价均超过了1∶50 000, 显示牙鲆Cyp19a重组蛋白可诱导兔子产生较好的免疫效果。经Protein G亲和层析柱纯化后的抗体, 具有较少杂蛋白, 纯度较高, 且效价与抗血清一致, 表明获得了具有较高活性的兔源牙鲆Cyp19a多克隆抗体。抗体特异性检测结果显示, Cyp19a多克隆抗体能特异性地识别牙鲆Cyp19a重组蛋白, 说明该抗体具有良好的免疫学活性; 进一步的内源性验证结果显示, 制备的Cyp19a兔多抗在牙鲆性腺中为单一条带, 说明制备获得的Cyp19a抗体可为深入研究牙鲆Cyp19a蛋白的生物学特性和功能提供分子工具。但是, 该抗体是否适用于其他鲆鲽鱼类等鱼种, 还需要后续实验进行测试。理论上, 与牙鲆Cyp19a氨基酸序列相似度高的物种有可能使用该抗体, 比如鲆鲽鱼类中的漠斑牙鲆(, 97.94%)、庸鲽(, 95.30%)和大菱鲆(, 88.38%)(GenBank accession nos. AAX55671.1、XP_034428940.1和XP_035483362.2)等。然而, 鱼类基因组复制等复杂性, 在一种鱼类中适用的Cyp19a抗体并不一定适用于另一些鱼类。因此, 鱼类中开展Cyp19a蛋白水平的研究多使用自行制备的特异性抗体, 如尼罗罗非鱼[28]、大西洋鲑()[29]和革胡子鲶()[30]等。
在鱼类中, 芳香化酶Cyp19a作为关键的雌激素生成酶, 已被证实在卵巢分化和维持中发挥主导作用[31-32]。在牙鲆等鱼类的研究发现,主要在卵巢中表达, 在精巢中微量表达[16], 对鱼类性别形成具有一定作用, 抑制基因的表达可能会导致鱼类性别失衡。本研究在内源性验证时也发现, Cyp19a蛋白的表达与mRNA水平一致, 主要在卵巢中表达, 精巢中低表达。转录因子Foxl2在鱼类卵巢分化敏感阶段能够上调的表达, 同时抑制雄性通路关键基因表达, 使雌激素水平升高, 促进颗粒细胞分化和卵泡生成[33]。mRNA水平研究显示,和的基因表达时序具有一定的相似性,对具有正调控作用, 其在性腺分化前便能激活的转录, 并在卵巢分化过程中参与转录水平的上调和维持[17, 34]。而转录因子Dmrt1在鱼类中则通过抑制和的表达, 进而降低雌激素水平, 拮抗雌性分化, 促进精巢分化和发育, 如半滑舌鳎()的ZZ个体敲除会导致出现类卵巢样的精巢[35-36]。牙鲆体外研究显示, Foxl2与Dmrt1可以分别转录激活和抑制的表达[17]。本研究也发现, 雌性牙鲆幼鱼注射重组Foxl2和Dmrt1蛋白后, Cyp19a蛋白的表达分别出现上调和下调趋势, 但没有显示出显著性, 这也许是注射剂量、注射间隔时间或检测时间尚待优化。根据本实验室前期报道, 牙鲆1.5 cm TL时, 性腺尚未开始分化, 卵巢分化开始于约3.8 cm TL, 精巢分化开始于约6.3 cm TL[20], 因此, 选择从原始性腺期开始重组Foxl2和Dmrt1蛋白的腹腔注射, 覆盖了牙鲆卵巢和精巢分化的敏感阶段, 可以对其性腺分化起到作用。组织切片观察结果也发现, 注射重组Foxl2和Dmrt1蛋白后, 其雌性率分别为100%和18%, 而两个对照组(未处理组和EGFP组)的雌性率均为100%[19]。蛋白表达分析结果显示, 在卵巢分化启动期(3.0 cm TL), 重组Foxl2蛋白开始上调Cyp19a蛋白的表达, 在随后的卵巢分化阶段(6.0 cm TL) Cyp19a的表达保持显著上调, 并在分化后(10.0 cm TL)维持较高水平。前期mRNA研究也有类似报道, 牙鲆mRNA水平在卵巢分化启动期3.0 cm TL时开始上调表达, 至分化后期表达仍然显著上调, 相应的雌二醇水平也明显升高, 从而促使了卵巢腔的形成和卵巢的分化[16, 19, 37]。我们的研究中发现类似的结果, 在卵巢分化启动期(3.0 cm TL), 重组Foxl2蛋白显著上调转录水平, 并略微上调Cyp19a蛋白的表达和体内17β-雌二醇水平, 随后的性腺分化期间也可检测到较高水平的转录水平、Cyp19a蛋白表达水平和17β-雌二醇水平, 研究结果与已有报道的假设一致[38]。进一步说明了Foxl2蛋白对的上调不仅是启动卵巢分化所必需的, 也是维持卵巢分化所必需的。在尼罗罗非鱼、斑马鱼等鱼类中已证实,在性腺分化早期开始表达, 对基因具有负调控作用, 使始终维持在较低转录水平, 可拮抗雌激素的合成, 阻断雌性化通路[39-40]。本研究中, Dmrt1处理组的Cyp19a蛋白表达在处理期间(即精巢分化的前、中、后期)也始终维持较低水平, 表明Dmrt1的确通过抑制芳香化酶Cyp19a的表达, 参与雄性性别表型的形成。
4 结论
本研究成功获得牙鲆Cyp19a重组蛋白, 以此作为抗原, 用弗氏佐剂为免疫增强剂, 经4次免疫后获得可特异性识别牙鲆Cyp19a蛋白的多克隆抗体, 且效价较高。利用该抗体分析Cyp19a蛋白在牙鲆雌雄性腺的表达, 发现其在卵巢中的表达明显高于精巢。性腺分化期幼鱼腹腔注射结果表明, 重组Foxl2和Dmrt1蛋白可分别显著上调和下调Cyp19a蛋白的表达。研究结果将为更深入研究Cyp19a在鱼类性腺分化和发育中的作用提供基础和有效工具。
[1] CONLEY A, HINSHELWOOD M. Mammalian aromatases[J]. Reproduction, 2001, 121(5): 685-695.
[2] 宋卓, 强俊, 朱昊俊, 等. 鱼类性别调控基因的研究进展[J]. 黑龙江畜牧兽医, 2022, 3: 25-29.
SONG Zhuo, QIANG Jun, ZHU Haojun, et al. Research progress of sex regulating genein fish[J]. Heilongjiang Animal Science and Veterinary Medicine, 2022, 3: 25-29.
[3] LAU E S W, ZHANG Z, QIN M, et al. Knockout of zebrafish ovarian aromatase gene () by TALEN and CRISPR/Cas9 leads to all-male offspring due to failed ovarian differentiation[J]. Scientific Reports, 2016, 6: 37357.
[4] WU K, SONG W Y, ZHANG Z W, et al. Disruption ofrescues the all-male phenotype ofmutant in zebrafish - a novel insight into the roles of aromatase/ estrogens in gonadal differentiation and early folliculogenesis[J]. Development, 2020, 147(4): dev182758.
[5] ESTERHUYSE M M, HELBING C C, VAN-WYK J H. Temporal expression of two cytochrome P450 aromatase isoforms during development in, in association with histological development[J]. Comparative Biochemistry and Physiology Part D: Genomics and Proteomics, 2008, 3(4): 297-306.
[6] BLÁZQUEZ M, GONZÁLEZ A, PAPADAKI M, et al. Sex-related changes in estrogen receptors and aromatase gene expression and enzymatic activity during early development and sex differentiation in the European sea bass ()[J]. General and Comparative Endocrinology, 2008, 158(1): 95-101.
[7] VON-SCHALBURG K R, GOWEN B E, LEONG J S, et al. Subcellular localization and characterization of estrogenic pathway regulators and mediators in Atlantic salmon spermatozoal cells[J]. Histochemistry and Cell Biology, 2018, 149(1): 75-96.
[8] YANG Y J, WANG Y, LI Z, et al. Sequential, divergent, and cooperative requirements ofandin ovary development and maintenance of zebrafish[J]. Genetics, 2017, 5(4): 1551-1572.
[9] CUI Z K, LIU Y, WANG W W, et al. Genome editing reveals dmrt1 as an essential male sex-determining gene in Chinese tongue sole ()[J]. Scientific Reports, 2017, 7: 42213.
[10] CHEN X W, JIANG S, GU Y F, et al. Molecular characterization and expression ofgene in[J]. Journal of Fish Biology, 2014, 85(2): 516- 522.
[11] LIU W, CHEN C, CHEN L, et al. Sex-dependent effects of microcystin-LR on hypothalamic-pituitary-gonad axis and gametogenesis of adult zebrafish[J]. Scientific Reports, 2016, 6: 22819.
[12] 王金. 尼罗罗非鱼多克隆抗体制备及高温诱导对其表达的影响[D]. 南昌: 南昌大学, 2014.
WANG Jin. Polyclonal antibody preparation ofgene in the Nile tilapiaand the influence by high temperature induced[D]. Nanchang: Nanchang University, 2014.
[13] 尹金良, 徐文, 郭占龙, 等. MDCK宿主细胞残留蛋白多克隆抗体的制备、纯化及初步应用[J]. 中国生物制品学杂志, 2021, 34(2): 176-180.
YIN Jinliang, XU Wen, GUO Zhanlong, et al. Preparation, purification and preliminary application of polyclonal antibody against residual host cell protein of MDCK cells[J]. Chinese Journal of Biologicals, 2021, 34(2): 176-180.
[14] YAMAMOTO E. Studies on sex-manipulation and production of cloned populations in hirame,(Temminck and Schlegel)[J]. Aquaculture, 1999, 173(1): 235-246.
[15] FAN Z F, YOU F, WANG L J, et al. Gonadal transcriptome analysis of male and female olive flounder ()[J]. Biomed Research International, 2014, 2014: 291067.
[16] FAN Z F, ZOU Y X, JIAO S, et al. Significant association ofpromoter methylation with environmental factors and gonadal differentiation in olive flounder[J]. Comparative Biochemistry and Physiology Molecular and Integrative Physiology, 2017, 208: 70-79.
[17] FAN Z F, ZOU Y X, LIANG D D, et al. Roles of forkhead box protein L2 () during gonad differentiation and maintenance in a fish, the olive flounder ()[J]. Reproduction Fertility and Development, 2019, 31(11): 1742-1752.
[18] YOU F, LIU J, WANG X C, et al. Anonymous, study on embryonic development and early growth of triploid and gynogenetic diploid left-eyed flounder,[J]. Chinese Journal of Oceanology and Limnology, 2001, 19(2): 147-151.
[19] SHU C, WANG L J, ZOU C C, et al. Function of Foxl2 and Dmrt1 proteins during gonadal differentiation in the olive flounder[J]. International Journal of Biological Macromolecules, 2022, 215: 141- 154.
[20] 孙鹏, 尤锋, 张立敬, 等. 牙鲆性腺分化的组织学研究[J]. 海洋科学, 2009, 33(3): 53-58.
SUN Peng, YOU Feng, ZHANG Lijing, et al. Histological evaluation of gonadal differentiation in olive flounder ()[J]. Marine Sciences, 2009, 33(3): 53-58.
[21] MANNING D S, LEONG J C. Expression in ofof the large genomic segment of infectious pancreatic necrosis virus[J]. Virology, 1990, 179(1): 16- 25.
[22] 余艳玲, 冯鹏霏, 潘传燕, 等. 尼罗罗非鱼TGF-beta1蛋白原核表达及多克隆抗体的制备[J]. 江苏农业学报, 2019, 35(6): 1407-1412.
YU Yanling, FENG Pengfei, PAN Chuanyan, et al. Prokaryotic expression and polyclonal antibodies preparation of TGF-beta1 protein in Nile tilapia[J]. Jiangsu Journal of Agricultural Sciences, 2019, 35(6): 1407-1412.
[23] LI R, CHEN P, ZHANG N, et al. Study on the affinity characteristics of proteins on the immobilized metal affinity chromatography column[J]. Analytical Methods, 2019, 11(34): 4341-4347.
[24] 李蓉, 邸泽梅, 陈国亮. 流动相组成、浓度和pH对蛋白质在金属螯合柱上的保留特性的影响[J]. 色谱, 2001, 19(5): 385-389.
LI Rong, QIU Zemei, CHEN Guoliang. Influences of the mobile phase constitution, salt concentration and pH value on retention characters of proteins on the metal chelate column[J]. Chinese Journal of Chromatography, 2001, 19(5): 385-389.
[25] 潘传燕, 冯鹏霏, 张永德, 等. 尼罗罗非鱼 PPARδ 的原核表达及其多抗制备和纯化[J]. 福建农业学报, 2019, 34(9): 1053-1058.
PAN Chuanyan, FENG Pengfei, ZHANG Yongde, et al. Prokaryotic expression, polyclonal antibody preparation and purification of PPARδ protein in Nile tilapia[J]. Fujian Journal of Agricultural Sciences, 2019, 34(9): 1053-1058.
[26] 李素一, 张丽娟, 陈华, 等. 创伤弧菌铁调基因fur的原核表达及多克隆抗体制备[J]. 福建农业学报, 2016, 31(9): 912-916.
LI Suyi, ZHANG Lijuan, CHEN Hua, et al. Prokaryotic expression and polyclonal antibody for ferric uptake regulator prepared fromFJ03-x2[J]. Fujian Journal of Agricultural Sciences, 2016, 31(9): 912-916.
[27] 韩玉龙. 斜带石斑鱼AMH/AMHRII基因克隆鉴定、原核表达及多克隆抗体制备[D]. 海口: 海南大学, 2016.
HAN Yulong. AMH/AMHRII cloning and identification, prokaryotic expression and preparation polyclonal antibody in orange-spotted grouper ()[D]. Haikou: Hainan University, 2016.
[28] ZHAO Y, CHEN H J, WANG Y Y, et al. Gonad development examination of high-temperature–treated genetically female[J]. Aquaculture, 2020, 515: 734535.
[29] VON-SCHALBURG K R, GOWEN B E, RONDEAU E B, et al. Sex-specific expression, synthesis and localization of aromatase regulators in one-year-old Atlantic salmon ovaries and testes[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2013, 164(4): 236-246.
[30] IBOR O R, ANDEM A B, ENI G, et al. Contaminant levels and endocrine disruptive effects inexposed to simulated leachate from a solid waste dumpsite in Calabar, Nigeria[J]. Aquatic Toxicology, 2020, 219: 105375.
[31] PIFERRER F, BLAZQUEZ M. Aromatase distribution and regulation in fish[J]. Fish Physiology and Biochemistry, 2005, 31(2/3): 215-226.
[32] SUN L N, JIANG X L, XIE Q P, et al. Transdifferentiation of differentiated ovary into functional testis by long-term treatment of aromatase inhibitor in Nile tilapia[J]. Endocrinology, 2014, 155(4): 1476-1488.
[33] DAI S F, QI S S, WEI X Y, et al. Germline sexual fate is determined by the antagonistic action ofand/in tilapia[J]. Development, 2021, 148(8): dev199380.
[34] YAMAGUCHI T, YAMAGUCHI S, HIRAI T, et al. Follicle-stimulating hormone signaling and Foxl2 are involved in transcriptional regulation of aromatase gene during gonadal sex differentiation in Japanese flounder,[J]. Biochemical and Biophysical Research Communications, 2007, 359(4): 935-940.
[35] ZHOU Q, CHEN S L. Progress in studies of sex determination mechanisms and sex control techniques in(half-smooth tongue sole)[J]. Frontiers of Agricultural Science and Engineering, 2016, 3(2): 113-123.
[36] STEVANT I, KUEHNE F, GREENFIELD A, et al. Dissecting cell lineage specification and sex fate determination in gonadal somatic cells using single-cell transcriptomics[J]. Cell Reports, 2019, 26(12): 3272-3283.
[37] CARUSO C C, BRETON T S, BERLINSKY D L. The effects of temperature on ovarian aromatase () expression and sex differentiation in summer flounder ()[J]. Fish Physiology and Biochemistry, 2016, 42(2): 795-805.
[38] GUIGUEN Y, FOSTIER A, PIFERRER F, et al. Ovarian aromatase and estrogens: a pivotal role for gonadal sex differentiation and sex change in fish[J]. General and Comparative Endocrinology, 2010, 165: 352-366.
[39] WANG D S, ZHOU L Y, KOBAYASHI T, et al. Doublesex- and mab-3-related transcription factor-1 repression of aromatase transcription, a possible mechanism favoring the male pathway in tilapia[J]. Endocrinology, 2010, 151(3): 1331-1340.
[40] JORGENSEN A, MORTHORST J E, ANDERSEN O, et al. Expression profiles for six zebrafish genes during gonadal sex differentiation[J]. Reproductive Biology and Endocrinology, 2008, 6: 25.
Polyclonal antibody preparation and application of aromatase Cyp19a in olive flounder
SHU Chang1, 2, 3, WANG Li-juan1, 2, ZOU Cong-cong1, 2, 3, ZOU Yu-xia1, 2,WANG Guo-yu1, 2, WU Zhi-hao1, 2, LI Ze1, 2, 3, YOU Feng1, 2
(1. CAS and Shandong Province Key Laboratory of Experimental Marine Biology, Center for Ocean Mega-Science, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China; 3. University of Chinese Academy of Sciences, Beijing 100049, China)
Aromatase Cyp19a plays a key role in fish sex determination and differentiation and could affect fish sex phenotype by regulating the conversion of estrogen and androgen. To further examine the expression and role of Cyp19a in gonadal differentiation and development of olive flounder, the coding sequence of thegene with the full length of 1, 557 bp was obtained from its cDNA, and the plasmid encoding recombinant Cyp19a protein was constructed. Followingrecombination and purification, high-purity recombinant Cyp19a protein was obtained. The protein was used as the antigen to immunize rabbits to prepare polyclonal antibodies. An indirect enzyme-linked immunosorbent assay was employed to detect the titers of the anti-serum and evaluate their immunogenicity. The titers of the poly-antibodies obtained were above 1: 50, 000, and the purified antibodies had good activity. Western blot detection revealed that the rabbit poly-antibodies of Cyp19a could specifically recognize the recombinant and endogenous Cyp19a proteins in flounders. The differential expression analysis of the female and male gonads at the protein level showed that Cyp19a protein was highly expressed in the ovary and slightly expressed in the testis. The treatment with the recombinant Foxl2 and Dmrt1 proteins could significantly upregulate and downregulate the expression of Cyp19a in undifferentiated gonads (<0.05), respectively. In conclusion, this study successfully prepared and applied rabbit-derived polyclonal antibodies against Cyp19a of flounders, which provides a powerful tool for the in-depth investigation of the sex differentiation mechanism in flounders or other fish.
; Cyp19a; recombinant protein; polyclonal antibody; protein expression
Jun. 15, 2022
S917.4
A
1000-3096(2022)11-0083-11
10.11759/hykx20220615001
2022-06-15;
2022-08-24
国家自然科学基金项目(31872558); 国家重点研发计划项目(2018YFD0900202); 青岛海洋科学与技术试点国家实验室海洋生物学与生物技术功能实验室青年科学基金项目(YQ2018NO01); 山东省重点研发计划项目(农业良种工程, 2021LZGC029); 山东省自然科学基金项目(ZR2022MC026)
[National Natural Science Foundation of China, No. 31872558; National Key R&D Program of China, No. 2018YFD0900202; Youth Research Fund of Marine Biology and Biotechnology Laboratory, Pilot National Laboratory for Marine Science and Technology (Qingdao), No. YQ2018NO01; The Key Research and Development Program of Shandong Province, No. 2021LZGC029; Natural Science Foundation of Shandong Province, No. ZR2022MC026]
舒畅(1997—), 女, 山东滨州人, 硕士研究生, 主要从事海水鱼类发育生物学研究, E-mail: shuchang@qdio.ac.cn; 王丽娟(1987—),通信作者, E-mail: wanglijuan@qdio.ac.cn; 尤锋(1963—), 通信作者, E-mail: youfeng@qdio.ac.cn
(本文编辑: 谭雪静)
