春季长江口及其邻近海域溶解有机物的分布、组成及降解行为研究
2023-01-30陈博洋杨桂朋
陈博洋, 陈 蓉, 陈 岩, 杨桂朋, 2
春季长江口及其邻近海域溶解有机物的分布、组成及降解行为研究
陈博洋1, 陈 蓉1, 陈 岩1, 杨桂朋1, 2
(1. 中国海洋大学 化学化工学院, 海洋化学理论与工程技术教育部重点实验室, 山东 青岛 266100; 2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266237)
2021年3月对长江口及其邻近海域9个断面溶解氨基酸(THAA)、溶解有机碳(DOC)和溶解有机氮(DON)的分布和组成进行了调查研究。结果表明: THAA的浓度范围为1.24~4.71 μmol/L, 平均浓度为(2.61±0.85)μmol/L; DOC的浓度范围为118.17~450.58 μmol/L, 平均浓度为(149.73±33.34)μmol/L; DON的浓度范围为10.48~24.45 μmol/L, 平均浓度为(13.80±1.81)μmol/L。THAA、DOC和DON的水平分布表现出近岸高于远岸的特点, 表明陆源输入对调查区域的THAA等分布有重要影响。而THAA与D-天门冬氨酸、D-谷氨酸、D-丝氨酸和D-丙氨酸的D/L比均呈显著负相关, 与天门冬氨酸/β-丙氨酸(Asp/β-Ala)呈正相关, 表明细菌活动是影响THAA浓度变化的重要因素。长江口及邻近海域的优势氨基酸为L型氨基酸, D型氨基酸和非蛋白型氨基酸的占比仅为7.34 %。基于C/N比值分析, 长江口及其邻近海域溶解有机物(DOM)的来源受到长江冲淡水和台湾暖流的共同影响。THAA-C %、THAA-N %、降解因子和反应活性指数表明: 水平方向上盐度接近于0的淡水区域和盐度高于34的远海区域降解程度较高; 垂直方向上随着深度的增加, 有机物的降解程度逐渐升高。调查区域有机物的降解程度主要受到陆源输入和细菌活动的影响。
溶解态氨基酸; 溶解有机碳; 溶解有机氮; 细菌降解; 长江口
海洋中的溶解有机物(dissolved organic matter, DOM)是地球上有机碳和有机氮的最主要的储库[1]。目前我们对海洋中溶解有机物的组成、来源和活性的了解仍然有限[2]。溶解有机碳(dissolved organic carbon, DOC)在海洋生物地球化学循环中具有重要作用[3], 而海洋中的溶解有机氮(dissolved organic nitrogen, DON)是表层海水中活性氮的主要来源[4]。研究这些有机物的化学特性是了解DOM生物地球化学行为的关键之一。海洋中的DON是组成复杂的有机物, 包括氨基酸、氨基糖、尿素、核酸和腐殖质等[5-6]。氨基酸(amino acids, AAS)是DON的重要组成部分, 也是一种易受到生物过程影响的海洋有机物[7]。Davis等[8]的培养试验表明AAS会被异养细菌优先利用, 占总有机碳的比例(THAA-C%)在20~30 d内可以下降50 %。氨基酸分为L型氨基酸和D型氨基酸, 前者主要由大部分初级生产者生产得到[9], 而后者主要来源于细菌的产生和L型氨基酸的外消旋作用, 但是L型氨基酸的转化速度非常缓慢, 转化时间一般以地质学所用的时间来衡量[9]。在有机物降解过程中, 相比于L型氨基酸, D型氨基酸通常会相对积累。因此氨基酸的D/L比在有机物降解指示方面可以作为表征细菌活动的重要指标。除D型氨基酸外, 2种非蛋白型氨基酸γ-氨基丁酸(γ-aminobutyric acid, GABA)和β-丙氨酸(β-alanine, β-Ala)是天冬氨酸(Aspartic acid, Asp)和谷氨酸(Glutamic acid, Glu)转化的产物, 随着有机物的降解程度的增加而相对积累[10-11]。氨基酸在指示有机物降解方面有独特的优势, 氨基酸中的碳对有机碳的贡献和氨基酸氮对有机氮的贡献以及单个氨基酸的相对比例都是海洋中有机物生产、迁移和分解的指示因子[10-13]。
长江口及邻近海域受多个水团影响, 主要包括低盐且富含营养盐的长江冲淡水和高盐寡营养盐的台湾暖流。作为典型的河口-陆架区域, 长江口及其邻近海域为研究有机物的生物化学循环提供了特殊环境。近年来, 国内已经不少关于长江口的氨基酸的分布以及有机物的降解程度方面的研究[14-15], 但关于涉及D型氨基酸和以D型氨基酸为基础的指示DOM降解行为的研究相对较少[16-17]。本文对长江口及其邻近海域水体中的21种溶解氨基酸(简称THAA, total hydrolyzed amino acids)、DOC和DON进行了分析测定, 并结合营养盐、叶绿素(Chl)等参数, 以D型氨基酸为重要降解指示物质, 对长江口及邻近海域的氨基酸的分布组成、有机物的来源和降解行为进行了分析。这对于进一步认识DOM在海洋中的来源、迁移和消除转化过程以及评估河口-陆架区域在全球生物化学循环中的重要性具有重要意义。
1 材料与方法
1.1 采样区域
在2021年3月搭载“润江号”科考船和“浙渔科号”科考船对长江口及邻近海域的9个断面进行科学考察, 调查站位如图1所示。依照具体站位深度, 分别采集表、中、底三层水样, 水浅时则采集表层水和底层水。
1.2 样品采集和保存
不同深度的水使用12 L的Niskin采水器进行采集。采集样品的同时, CTD对各站位的水深、盐度、温度等参数进行测定。采集后水样经孔径为0.7 μm的玻璃纤维滤膜(Whatman GF/F)进行过滤。过滤后的海水用样品瓶分装, 滤膜用锡纸包裹好, 均放入–20 ℃冷冻保存。玻璃纤维滤膜、玻璃样品瓶和锡纸均提前在马弗炉中以450 ℃的温度下灼烧4.5 h以去除有机物。
1.3 样品测定
1.3.1 氨基酸的测定
采用实验室建立的邻苯二甲醛, N-异丁酰基- L-巯基丙氨酸(N-Isobutyryl-L-cysteine, IBLC)柱前衍生液相色谱法[16, 18], 对长江口及邻近海域中的THAA进行测定。所用的液相色谱仪器为Waters Alliance高效液相色谱仪, 配备荧光检测器(e2475)和四元梯度泵(e2695)。流动相为: 甲醇、pH=7±0.05的25 mmol/L的醋酸钠缓冲溶液和pH=5.3±0.05的25 mmol/L的醋酸钠缓冲溶液。所需流动相均经过孔径为0.22 μm的聚醚砜膜(PALL Supor-450)过滤。荧光检测器激发波长为330 nm, 发射波长为450 nm。柱温为20 ℃。流速为0.8 mL/min。
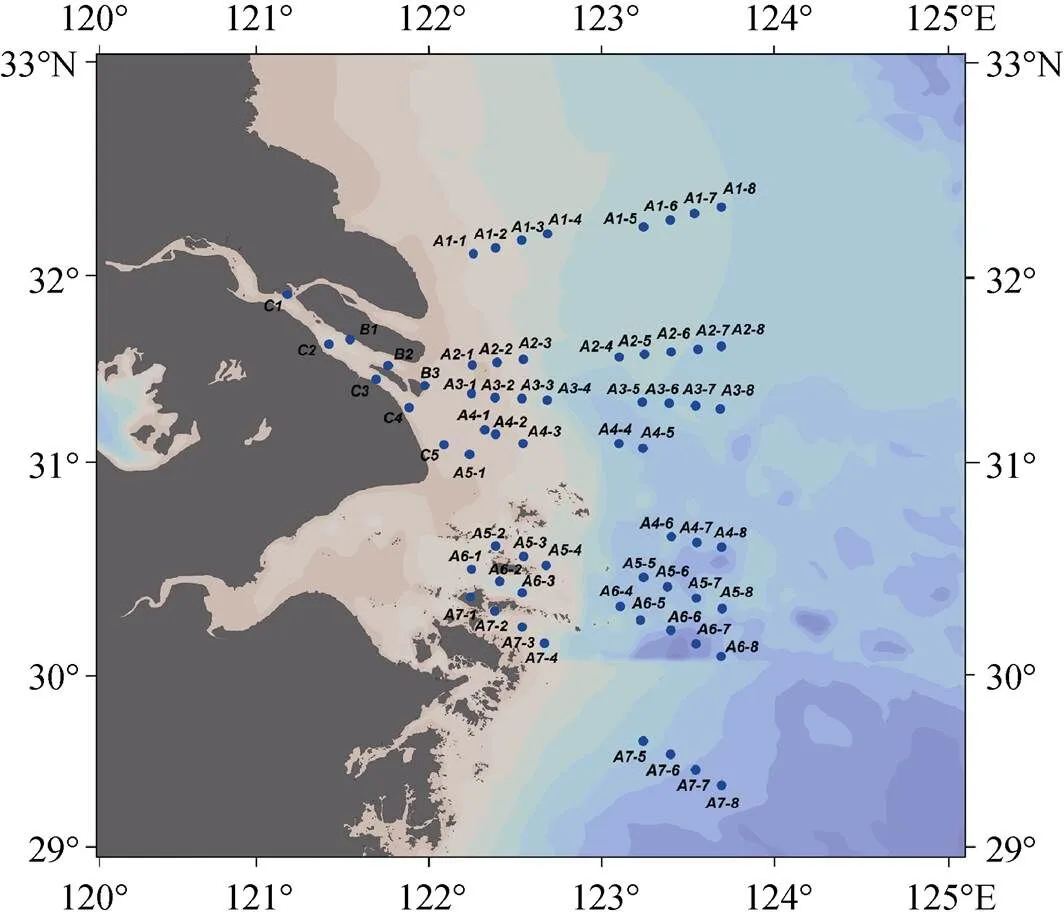
图1 2021年春季长江口及邻近海域的调查站位示意图
测定方法具体为在5 mL的安瓿瓶中加入2 mL的海水、2 mL的浓盐酸(13 mol/L)和40 μL的20% (质量/体积)抗坏血酸, 通高纯氮气1 min后密封。密封的安瓿瓶在110 ℃的环境下水解22 h。水解后取水解液在60 ℃下进行旋转蒸发。向蒸干后的样品中加入2 mL的Q水, 并超声振荡1 min让样品复溶。取溶解后的样品90 μL和IBLC衍生化药剂(pH=9.9) 60 μL超声混合, 避光衍生化2 min后上机测定。仪器测定得到的D型氨基酸的浓度通过文献[19]中公式进行校正, 用于消除L型氨基酸的消旋化影响。
1.3.2 DOC, TN的测定
用岛津总有机碳分析仪(TOC-L CPH/CPN)测定海水中的DOC和TN。TN测定原理是TN燃烧生成一氧化氮后进入化学发光检测器进行检测。仪器空白用Hansell实验室的大洋水校正。DOC和TN分别在680 ℃和720 ℃的温度下平行进样2~3次后取其平均浓度。DOC的相对标准偏差小于1.5%, 检出限为4 μg/L; 而TN的相对标准偏差小于3.0%, 检出限为5 μg/L。
1.3.3 Chl的测定和DIN的测定
Chl的测定方法为荧光法。测定前用90%(体积比)的丙酮水溶液在4 ℃的环境下避光萃取24 h。测定时离心后取上清液使用日立F-4500 荧光分光光度计测定。使用Seal Analytical AA3 营养盐自动分析仪分析NO3–等营养盐。其中NO3–检出限20 nmol/L, NO2–检出限为3 nmol/L, NH4+检出限40 nmol/L。
1.4 降解指示因子
(1) THAA-C%和THAA-N%:溶解有机物中氨基酸态碳对DOC和DON的贡献率。随着有机物降解的进行, THAA-C%和THAA-N%呈下降趋势, 因此经常作为有机物降解的指示因子。
(2)降解因子(degradation index, DI): Dauwe等[13]提出基于氨基酸的经验的降解指数, 利用主成分分析得到DI值:
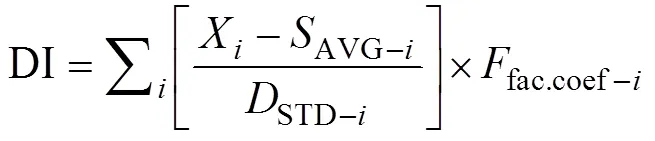
式中,X代表氨基酸的摩尔百分比;AVG-i代表氨基酸的平均值;STD-i代表氨基酸的标准偏差;fac.coef-i代表氨基酸的因子系数[10, 13]。DI越大, 有机物生物可利用性高。
(3) 反应活性指数(reactivity index, RI):
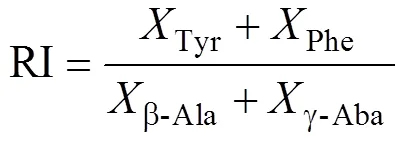
2 结果与讨论
2.1 长江口及邻近海域的水文特征和Chl a分布特征
长江口及邻近海域的温度范围在8.40~14.20 ℃, 平均值为11.70±1.46 ℃。盐度范围在0.19~33.50, 平均值为27.75±7.42。这与綦倩倩等[21]在3月长江口的观察结果相似。Chl范围在0.20~1.67 μg/L, 平均值为(0.71±0.24) μg/L, 低于陈佳玉等[22]的秋季长江口的结果。
长江口及周边区域的表层水文特征和Chl分布如图2所示。整体来看, 温度呈现出北部低于南部的趋势, 原因可能是海域北部受温度较低的南下的黄海沿岸流的影响, 南部受到温度较高的台湾暖流的影响。盐度受到长江冲淡水的影响, 呈现从口内到口外逐渐升高的趋势。Gong等[23]建议用31等盐度线作为长江冲淡水的外缘, 可以发现本次调查中长江冲淡水的覆盖范围主要在近口门区和杭州湾口。Chl的浓度大于1 μg/L的站位均出现在盐度小于10的近岸站位, 而Chl的浓度小于0.5 μg/L的站位集中在高盐区域。出现此现象可能是低盐的长江冲淡水的营养盐(例如NO3–、PO43–等)浓度很高, 促进浮游植物的繁殖生长。
C-A5断面包含了淡水、咸淡水混合和海水站位(C断面在长江口内, A5断面在长江口外), 所以C-A5断面是研究长江口以及附近海域的各参数的垂直分布的典型断面。C-A5断面的水文特征和Chl分布如图3所示。盐度小于10的C断面的温度分布均匀, 而盐度大于30的A5断面受台湾暖流的影响, 从表层到底层逐渐升高。由于低盐的长江冲淡水和高盐的台湾暖流的影响, 随着离岸距离和深度的增加, 盐度呈现出增大趋势。而长江冲淡水的丰富营养盐和较高的陆源输入使得Chl的高值集中在低盐站位, 与水平分布类似。
之前的研究表明, 盐度小于30.5的站位主要受到长江冲淡水的影响, 大于33.5的站位受到台湾暖流的影响, 盐度介于两者之间的站位同时受到冲淡水和台湾暖流的影响[24]。而在这次调查中, 除C断面外, A5-1和A5-2站位的表层水主要受到长江冲淡水的影响, 而A5-7和A5-8站位的底层水主要受到台湾暖流的影响, 其余站位均受到两者共同影响。
2.2 长江口及邻近海域的THAA的分布及影响因素
整个调查海域的THAA的浓度为1.24~ 4.71 μmol/L, 平均浓度为(2.61±0.85) μmol/L, 高于南海[16]、西太平洋[25]、日本伊势湾[26]和东海[27]的浓度, 但低于黄海[28]的浓度。

图2 初春长江口及邻近海域各化学要素的水平分布
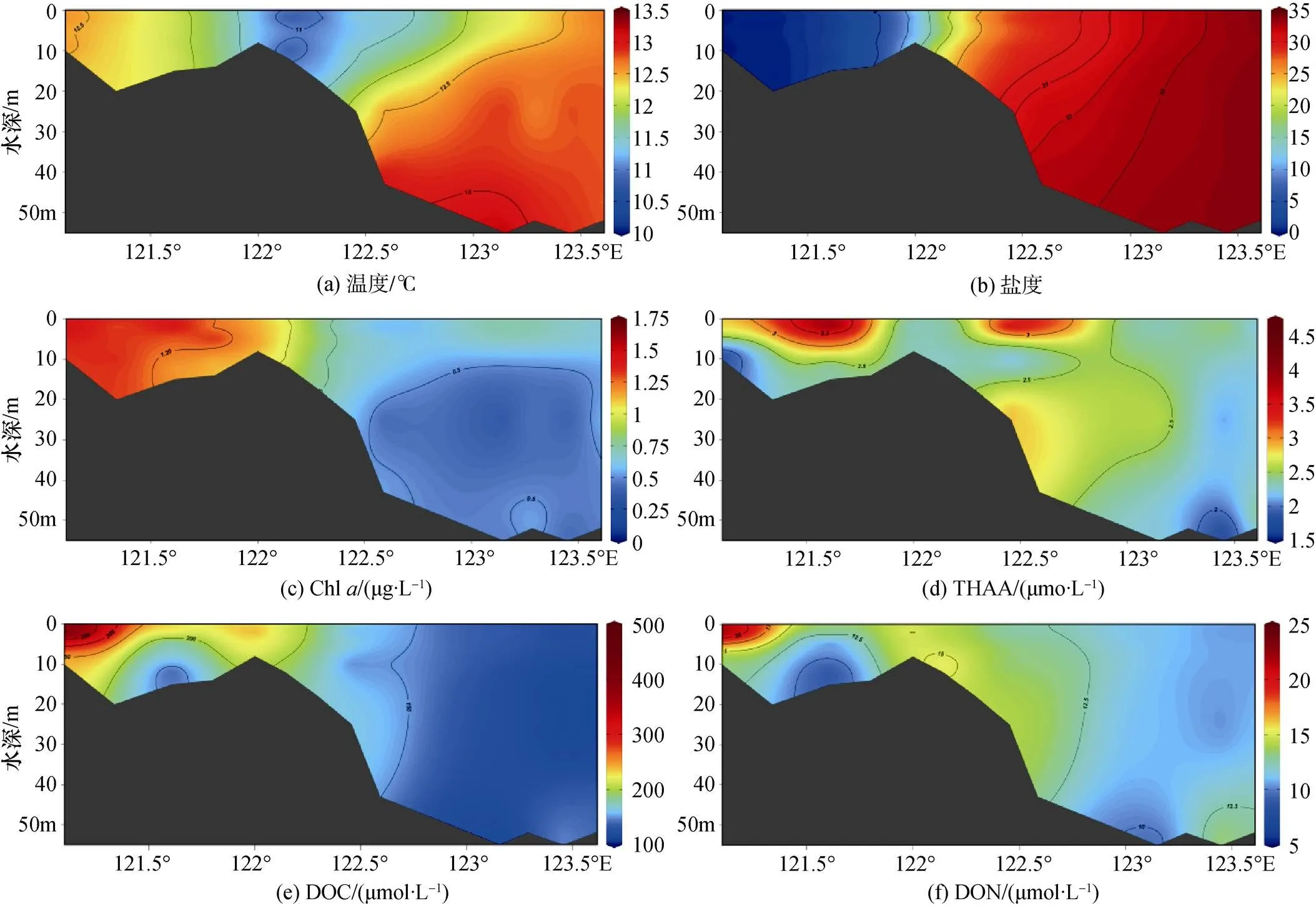
图3 初春C-A5断面的各化学要素的垂直分布
表层THAA的浓度整体呈现近岸高于远岸的趋势。THAA大于3 μmol/L的站位出现在盐度小于33.5的近岸海域, 而THAA低于2 μmol/L的站位分布在盐度高于34的远岸海域。这说明陆源输入对THAA的分布有较大影响, 例如近岸的受陆源影响严重的A1-1的THAA浓度大于4 μmol/L。在长江口区域, 径流输入是陆源输入的重要组成部分。而且THAA与盐度有显著的相关性(= –0.309,<0.01), 也证明长江冲淡水的输入对THAA的浓度变化具有显著影响。长江三角洲会产生大量含有DOM的污水进入长江冲淡水中, 进而影响到长江口及邻近海域的THAA分布。径流输入对THAA的类似影响在珠江口区域也有体现[16]。但除C3站位附近, 盐度接近于0的长江水体的THAA浓度不高, 可能与长江径流中高浓度的悬浮颗粒物有关。沈志良等[29]发现长江口区域悬浮颗粒物对DON(包括THAA)具有吸附性, 会降低长江水体的THAA的浓度。而C3表层站位THAA的浓度偏高可能与高Chl浓度有关(1.67 μg/L), 浮游植物的生产在该站位具有重要影响。在A4-5附近区域也出现高浓度的THAA, 可能与A4-5附近Chl相对较高的浓度有关。A4-5的天门冬氨酸和β-丙氨酸的比值(Asp/β-Ala)以及谷氨酸和γ-氨基丁酸的比值(Glu/γ-Aba)均偏高。并且A4-5的D-天门冬氨酸(D-Asp)、D-谷氨酸(D-Glu)、D-丝氨酸(D-Ser)和D-丙氨酸(D-Ala)的D/L比值偏低。β-Ala和γ-Aba作为细菌降解的中间产物[10-11], 而Asp和Glu为被降解的氨基酸。Asp/β-Ala和Glu/ γ-Aba的比值说明细菌活动的重要影响[10-11]。而在细菌消耗L型氨基酸的过程中D型氨基酸会相对保留, 且细菌也是D型氨基酸的主要来源, 所以氨基酸的D/L比越高, 细菌活动的影响越大[9]。总之较低Asp/β-Ala和Glu/γ-Aba以及4种氨基酸的D/L比表明该区域细菌活动不频繁, 对THAA的利用偏低, 增强了水体中THAA的保留。A4-5的降解指示因子偏低表明该区域的有机物的降解程度较低, 也侧面说明细菌活动不频繁。整体说明除陆源输入的影响, 长江口及邻近海域的浮游植物生产和细菌活动也是影响THAA的浓度和分布的不可忽略的因素。而且因为3月是长江口径流量低值期, 相较于夏季, 径流输入减弱, 浮游植物生产和细菌活动等因素的影响增强。
在C-A5断面上, 由于有机物主要在表层生成, THAA的浓度大体上表现为从表层到深层逐渐递减的趋势。这在其他长江口的探究中也出现类似现象[30]。THAA浓度的最高值出现在C3站位的表层。但是在A5-1至A5-5站位的底层水体中THAA浓度也较高, 可能是该区域偏高的水温和较低的溶解氧浓度使细菌等异养生物对有机物的分解速度降低[31-33], 也可能与沉积物间隙水的上浮有关[34]。
THAA浓度受多种因素共同影响。长江口及邻近海域的THAA与Chl之间不存在显著相关性, 且THAA和Chl的水平分布不一致也表明了浮游植物的生产不是THAA浓度分布的决定性因素。在南黄海[35]和南海[16]的调查中, THAA和Chl的相关性也不显著。Meon等[36]的中胚层实验中也发现THAA的主要组成部分结合态氨基酸(DCAA)的浓度与Chl也没有显著相关性。THAA与构成肽聚糖的4种D型氨基酸(D-Asp、D-Glu、D-Ser和D-Ala)的D/L比都具有显著的负相关性(D-Asp:= –0.265,<0.01; D-Glu:= –0.303,<0.01; D-Ser:= –0.296,<0.01; D-Ala:= –0.390,<0.01), 且与Asp/β-Ala存在明显的正相关(=0.331,<0.05)。这体现出细菌等微生物的生产和降解对THAA浓度具有重要影响。海洋溶解有机物的碳通量(包括THAA)在很大程度上是由微生物活动介导的[37]。细菌内部富含D-氨基酸[38], 且部分古菌的蛋白质和游离氨基酸也含有大量的D-Asp、D-Glu、D-Ser和D-Ala[39]。当病毒感染等因素破坏细胞后, 细菌等微生物的内部组分会释放到水体中, 进而影响到THAA的分布[40]。例如, 有研究表明, 一部分肽聚糖被细菌释放之后长时间不被降解, 因此肽聚糖内的D型氨基酸得到保留[41]。随着降解的进行, 肽聚糖内的D型氨基酸在THAA中得到富集, 进而影响THAA的分布[42]。
2.3 长江口及邻近海域DOC和DON的分布及影响因素
DOC含量范围为118.17~450.58 μmol/L, 高于Ji等[30]对长江口的调查。而DON的含量范围为10.48~24.45 μmol/L, 高于Chen等[27]关于东海的研究。盐度大于10的海水站位的DOC和DON的平均浓度分别为(159.44±25.05) μmol/L和(13.48± 1.55) μmol/L, 盐度接近于0的淡水站位的DOC和DON的平均浓度为(241.18±58.01) μmol/L和(15.91± 3.51) μmol/L。由此可见, 淡水站位的DOC和DON浓度均明显高于海水站位的浓度。
表层DOC浓度的水平分布表现出随着离岸距离增加浓度逐渐下降的趋势, 这与Ji等[30]在长江口的调查结果类似。从水平分布和垂直分布可以看出, DOC高值全部出现在淡水站位和咸淡水站位, 低值出现在距离长江口较远的远海站位。这可能是含有大量DOC的陆源物质输入到长江冲淡水从而对长江口及邻近海域的DOC的分布带来影响。而且相关性分析显示DOC与盐度呈现负相关性(= –0.549,< 0.01), 这也说明长江冲淡水、台湾暖流等水团的混合对DOC的分布产生重要影响。除此以外, DOC的分布与Chl呈现正相关性(=0.397,<0.01), 这表明DOC的浓度也受到浮游植物生产的影响。
DON的高值主要出现在淡水区域和南部的近岸区域, 整体水平分布呈现出近岸高于远岸的特征。但淡水区域中存在低值站位, 可能与浊度大的长江水体中悬浮颗粒物对DON的吸附有关[29]。从相关性上讲, DON与Chl、盐度和几种D-氨基酸的D/L比的相关性均不显著。DON相对于DOC而言, 含量低而且成分复杂, 生物可利用性强[43]。DON的主要消耗来自于细菌的消耗[44], 而浮游植物也可以将DON作为部分氮源进行使用[45]。浮游植物和细菌对DON的影响是一种复杂的过程。而长江口作为陆源输入的严重区域, 陆源物质对DON的影响也是一个无可忽略的因素, 但3月为长江口径流量较低的时期, DON的径流输入的影响会减弱。
2.4 春季长江口及邻近海域的表层海水中溶解氨基酸的组成特点
长江口及其邻近海域的各单体氨基酸占THAA的相对组成如图4所示。THAA中含量较高的氨基酸为L-谷氨酸(L-Glu)、L-丙氨酸(L-Ala)、L-亮氨酸(L-Leu)和L-赖氨酸(L-lys)、L-天门冬氨酸(L-Asp)、L-丝氨酸(L-Ser)、甘氨酸(Gly), 总体约占据THAA总量的67.8%。长江口及邻近海域的藻类以硅藻为主[46], 而L-Asp、L-Ser、L-Glu和Gly等是硅藻细胞内部蛋白质的主要构成部分[47]。浮游植物死亡或者被浮游动物和细菌摄食后会释放内部的THAA, 进而改变海水中THAA的组成。因此这些单体氨基酸占总THAA比例较高。
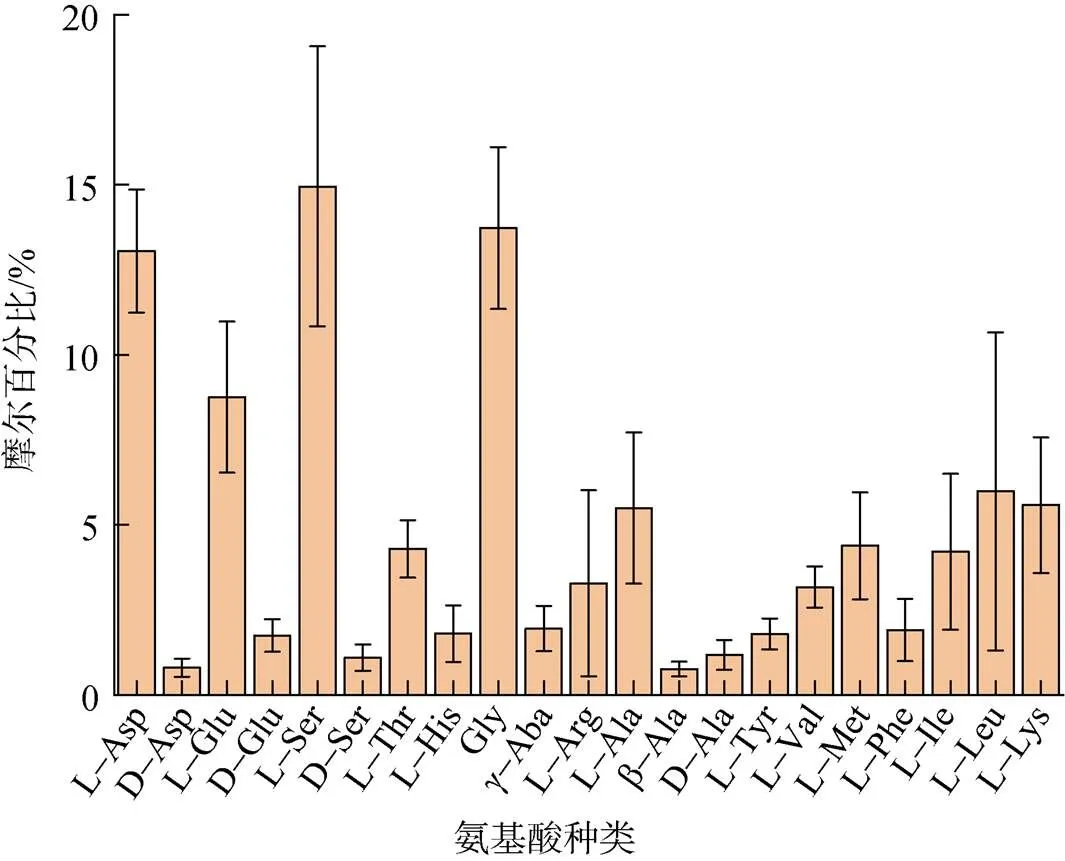
图4 初春长江口及邻近海域的个体氨基酸占THAA的摩尔百分比
注: Asp代表天门冬氨酸; Glu代表谷氨酸; Ser代表丝氨酸; Thr代表苏氨酸; His代表组氨酸; Gly代表甘氨酸; γ-Aba代表γ-氨基丁酸; Arg代表精氨酸; Ala代表丙氨酸; Tyr代表酪氨酸; Val代表缬氨酸; Met代表蛋氨酸; Phe代表苯丙氨酸; Ile代表异亮氨酸; Leu代表亮氨酸; Lys代表赖氨酸。
本次调查测定的D型氨基酸是D-Asp、D-Ser、D-Glu和D-Ala。从图4可以看出, 4种氨基酸的L型的含量明显高于D型的含量。D-Asp、D-Ser、D-Glu和D-Ala占THAA的比例分别为0.81%、1.71%、1.05%和1.11%。2种非蛋白质类氨基酸γ-Aba和β-Ala占THAA的比例分别是1.92%和0.74%。这6种氨基酸在THAA中占比均很低。这说明L型氨基酸在THAA的结构中占据主要优势。
长江口及邻近海域的海水中4种D型氨基酸在对应氨基酸的单体占比分别是: Asp为(5.98±1.76)%, Glu为(17.44±6.16)%, Ser为(7.16±2.77)%, Ala为(19.08±6.85)%。长江口及邻近海域的D-氨基酸所占单体的比例低于南海的相应D-氨基酸的比例[16], 又低于北大西洋的近岸海水D-氨基酸中的比例[48]。对比L型, D型氨基酸在有机物降解过程相对富集, 因此D/L比可以作为有机物降解程度的指示因子之一。长江口的D-氨基酸在单体所占的比例相对较低, 初步表明了长江口的有机物的降解程度低于南海和北大西洋。
2.5 长江口及邻近海域DOM的来源指示分析
浮游植物或细菌并不是固定比例地吸收碳和氮。Mulholland等[49]提出在河口区域, N优先被吸收, 导致DOC/DON增加, 所以C/N比可用于区分有机物的陆源与海源。长江口及邻近海域的C/N比范围在10.2~18.6。陆地上的维管植物富含纤维素, 比海洋浮游植物具有更高的C/N比, 为20~400[50-51]; 而浮游植物的C/N比为4~6, 细菌的C/N比小于4[52]。而海源有机物一般小于8, 陆源有机物一般大于12[50, 52]。以前的研究显示长江口及邻近海域颗粒物的C/N比为10~20[53], 而东海DOM的C/N比为4.9~25.1[27]。综合来看, 即使在3月径流输入较小的时期, 长江口及邻近海域也是一个受到陆源影响较严重的区域。
从表层分布上看, 由于陆源物质的影响, 随着离岸距离的增加, C/N比逐渐降低。如图5所示, 盐度接近于0的长江水体的C/N比大于15, 而盐度30~32的海域受到长江冲淡水和江苏沿岸流的影响, 其C/N比大于12, 表明以陆源有机物为主。C/N低值站位出现在盐度大于34的东南部海域, 该区域可能更多的是受到台湾暖流的海源有机物的影响。
C-A5断面的C/N的垂直分布如图6所示。C断面的C/N值范围为15.3~18.4, 而A5断面的C/N值为10.3~14.9, 表明A5断面作为外海区域的断面, 更容易受到海源有机物的影响。A5断面底层的DOM的C/N比出现高于12的情况, 这可能与沉积物孔隙水的渗透和细菌降解有关。William等[54]指出沉积物孔隙水中存在氮的消耗优先于碳的情况, 从而认为由于孔隙水的上浮, 随着海洋深度的增加, 溶解有机物的C/N比也会逐渐升高。除此以外, 细菌降解有机物的时候, 氮的降解优于碳的降解[43, 54-55], 因此会导致随着深度的增大, 有机物的氮比碳减少更快, 使C/N比增大。
调查区域的C/N比与细菌活动有很大关系。前面已经介绍, 氨基酸的D/L比是细菌活动的重要指标。C/N比与Ala的D/L(= –0.305,<0.05)和Asp/β-Ala (=0.471,<0.05)具有显著的相关性证明细菌活动对C/N比的来源指示的干扰作用。随着有机物逐渐降解, 作为有机物来源的指示因子, C/N比的效果会越来越弱。细菌定植会使陆源有机物的C/N比降低[56], 而细菌对海源有机物选择性地除氮又会使海源有机物的C/N比升高[57]。所以C/N比的变化不仅与来源有关, 还与细菌活动有关。
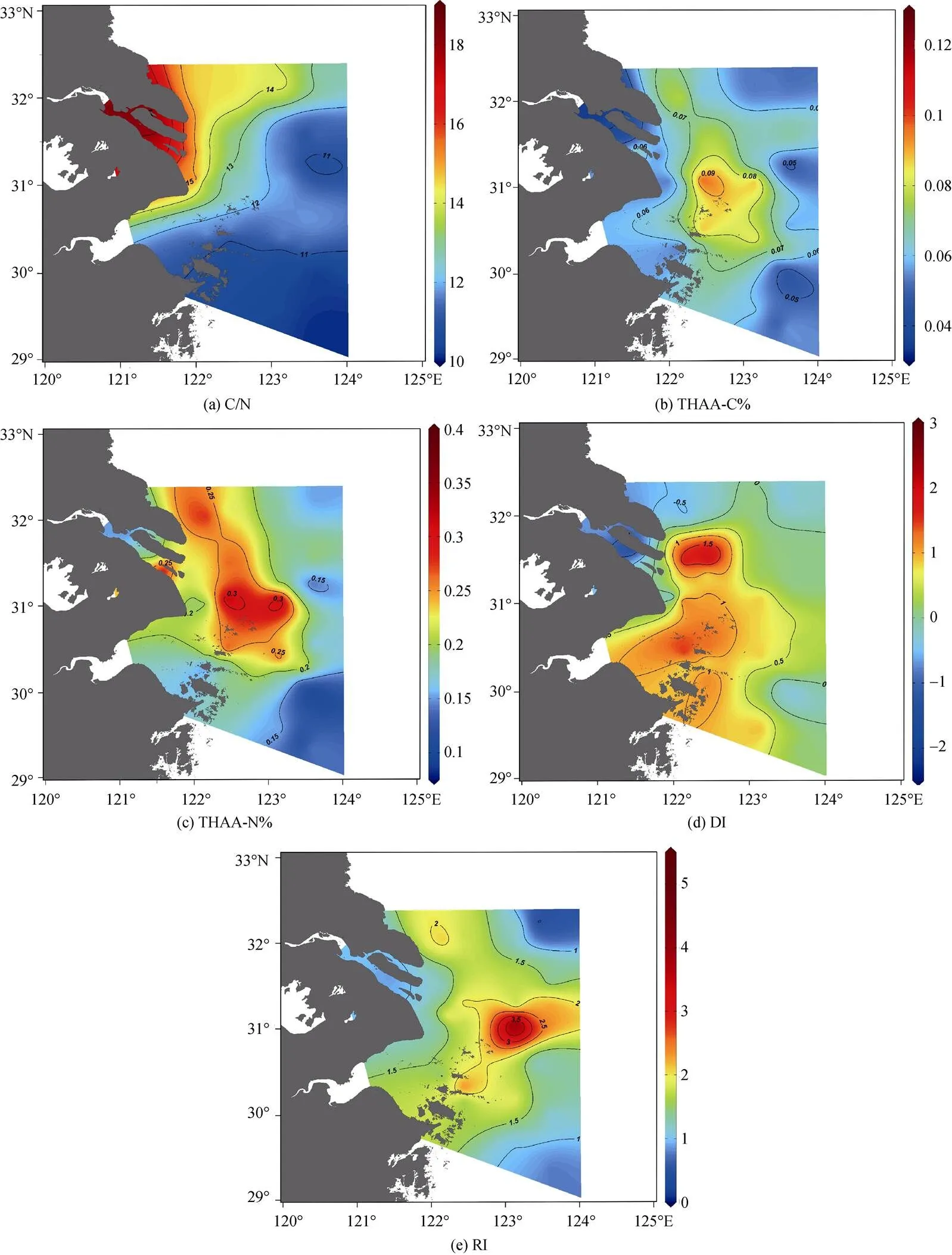
图5 初春长江口及邻近海域表层碳氮比和各降解因子的水平分布
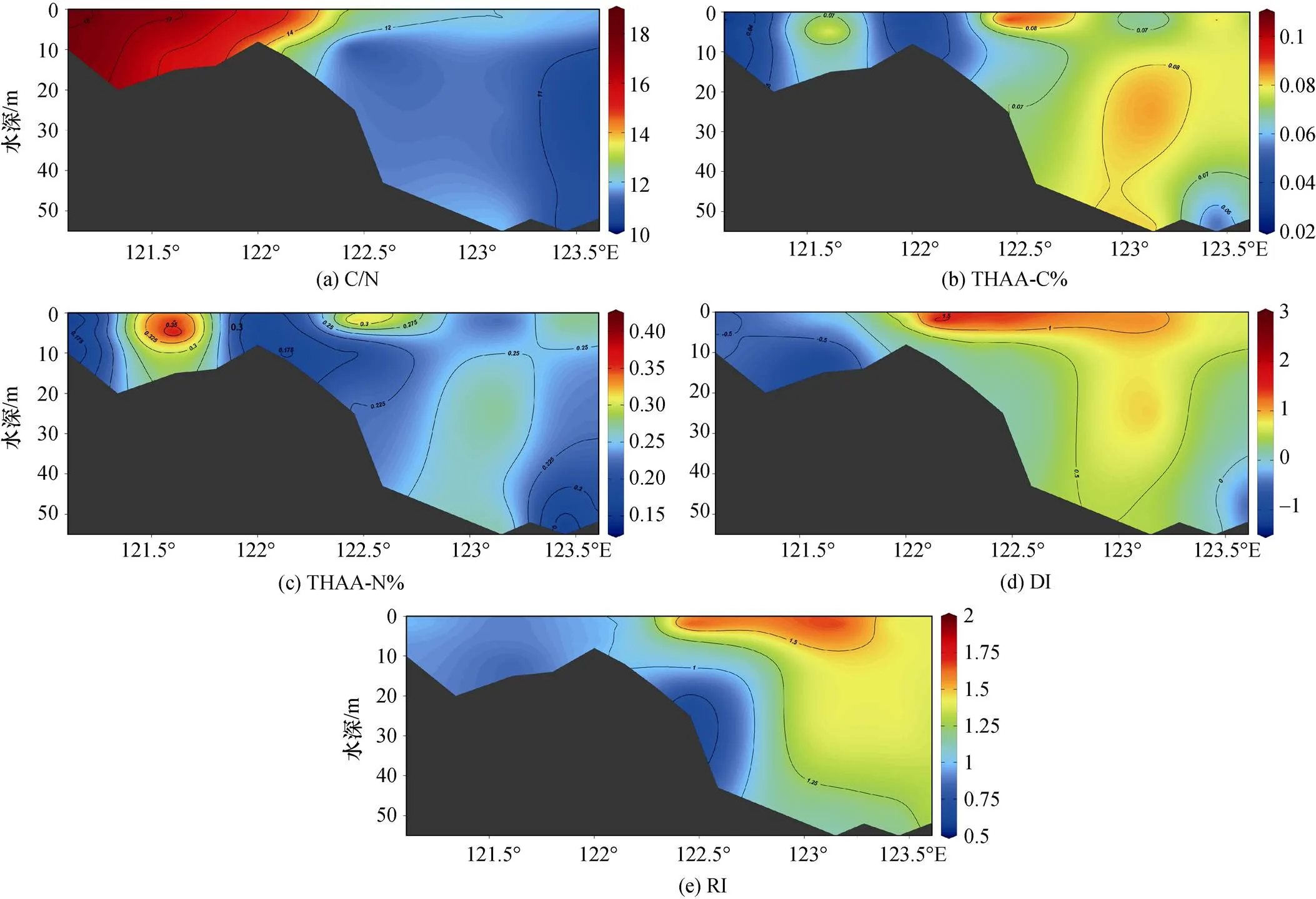
图6 初春C-A5断面碳氮比和各降解因子的垂直分布
2.6 氨基酸指示长江口及邻近海域的DOM的降解行为及影响因素
本次研究我们通过THAA-C%、THAA-N%、RI和DI对长江口及邻近海域的溶解有机物的生物可利用性进行探究。如图5, 图6所示, 长江口及邻近海域的THAA-C%的范围是3.55%~12.25%, 平均值为(6.40± 1.64)%, 高于南海[16]、东海[27]和西太平洋[25], 但远低于一般浮游植物体内24%~49%的THAA-C%的范围[58]。THAA-N%的范围是8.59%~34.81%, 平均值为(20.04± 6.15)%, 整体高于东海溶解有机物的THAA-N%[27]。整体的DI的范围在–2.05~2.85, 平均值为0.45±0.90, 整体高于Ji等[30]对冬季长江口的调查, 也高于南海北部[16]、日本伊势湾[26]和西太平洋[25]。RI的范围在0.69~5.25, 平均值为1.57±0.65, 整体高于南海北部[16]。降解指示因子的高值代表长江口及邻近海域的有机物的生物可利用性优于南海、东海和西太平洋。
盐度接近于0的长江水体的THAA-C%、DI和RI的平均值分别为(4.57±1.16)%、(–1.00±0.75)%和(0.91± 0.04)%; 而盐度高于10的邻近海域的THAA-C%、DI和RI的平均值分别为(6.66±1.56)%、(0.66±0.75)%和(1.66±0.65)%。这与Ji等[30]的调查是相似的, 综合说明河口的DOM的降解程度高于海洋DOM的降解程度。通常源自陆地上土壤以及生活污水的DOM会被高度降解, 长江水体生物可利用性较低的原因可能是受到陆源高度降解的有机物影响。除此之外, 淡水站位的Asp和Glu的D/L比值也高于海水站位, 这说明细菌活动也可能影响到长江水体中有机物的生物可利用性。史君贤等[59]在长江口的研究发现, 细菌丰度从长江口到远岸逐渐减少。细菌丰度高可能导致细菌对有机物的降解也相对较高。C3站位出现THAA-C%和THAA-N%的高值, 由于Chl也较高, 应与C3站位的浮游植物生产有关。调查区域东部的远海站位的降解指示因子偏低, 且Chl也偏低。远海站位降解程度高的原因可能是低生产力制约了THAA的生产, 现有的THAA会经过长时间的细菌消耗和光降解使其降解程度很高[8, 58]。
C-A5断面上, 由于有机物主要在表层产生, 所以THAA-C%等降解指示因子的高值通常出现在表层。但在A5-5附近出现底层THAA-C%和THAA-N%偏高的情况(8.52%和28.44%), 这或许是沉积物间隙水的作用引起的。Lomestein等[34]研究发现沉积物孔隙水的THAA-C%较高, 为9.2%。该数值不仅与本研究中底层水体的THAA-C%值接近, 而且氨基酸的组成也与该站位的DOM的氨基酸组成差异不大。除此以外, 邵亮等[14]发现在附近区域的底层沉积物有悬浮现象, 细菌对底层悬浮颗粒物的降解可能对底层站位的THAA-C%产生影响。长江口DI和RI没有出现中层或底层高于表层的现象。相关分析显示THAA-C%与DI、RI呈正相关(DI:=0.476,<0.01; RI:=0.368,<0.05), 整体说明C-A5断面中层和底层的降解程度还是高于表层。
从影响因素上讲, C/N比表明长江口及邻近海域的DOM的降解行为受到高度降解的陆源有机物的影响。3种降解指示因子均与Chl缺乏相关性, 这表明浮游植物生产不是影响生物可利用性的决定性因素。3种降解指示因子与盐度也缺乏相关性, 说明径流输入也不是长江口溶解有机物的降解程度的决定性因素。这可能与3月径流量较低, 径流输入的影响弱于丰水期有关。THAA-C%和THAA-N%与表征细菌活动的Asp和Glu的D/L比呈负相关(THAA-C%和Asp:= –0.333,<0.01; THAA-C%和Glu:= –0.283,< 0.05; THAA-N%和Asp:= –0.439,<0.01; THAA-N%和Glu:= –0.288,<0.05), 证明细菌降解对长江口的DOM的生物可利用性起到重要作用。据估计, 海洋微生物群由超过十万种不同的以细菌、古菌和真核生物等为代表的微生物组成[60-61], 而海洋微生物群具有生产和消费有机物的多种生态和代谢策略[62-63], 会对有机质的降解产生巨大影响。不仅如此, 降解过程中, 细菌以及其残留物在水体中的降解速度比其他物质要慢[35], 例如肽聚糖、革兰氏阴性细菌的细胞膜蛋白[64-65]。而且细菌还会将生物可利用性高的有机物转化为难分解的有机物[66]。这些由细菌产生或转化的有机物会影响到有机物降解的整体过程。
3 结论
本次调查发现长江口及邻近海域THAA、DOC和DON的表层分布呈现出近岸高于远岸的特征, 而在垂直断面上高浓度的站位主要出现在表层。除陆源输入和长江冲淡水的影响, 细菌活动也影响THAA浓度和分布。但DOC在长江口附近主要受到植物生产及陆源输入的影响, 细菌活动不是主要因素, 而DON更是受多种因素的复杂影响。关于THAA组成, L型氨基酸为优势氨基酸, 占总THAA的92.66%。D型氨基酸的D/L比较低说明长江口及邻近海域的降解程度偏低。作为来源指示因子, C/N比与表征细菌活动的氨基酸D/L比有相关性, 说明长江口海域附近细菌活动会影响C/N比的指示作用。降解指示因子表明近岸站位的降解程度低于受陆源影响严重的淡水站位和受生产力限制的远海站位, 而底层海水的降解程度低于表层海水的降解程度。除陆源影响外, 细菌活动是长江口及附近海域有机物降解的重要因素。
致谢: 本研究的数据及样品采集得到国家自然科学基金委员会共享航次计划项目(项目批准号: 42049903)的资助。该航次(航次编号: NORC2021-03)由“浙渔科2”号/“润江1”号科考船实施, 在此一并致谢。
[1] HEDGES J I, OADES J M. Comparative organic geochemistries of soils and marine sediments[J]. Organic Geochemistry, 1997, 27: 319-361.
[2] AMON R M W, FITZNAR H P, BENNER R. Linkages among the bioreactivity, chemical composition, and diagenetic state of marine dissolved organic matter[J]. Limnology and Oceanography, 2001, 46: 287-297.
[3] HEDGES J I. Global biogeochemical cycles: Progress and problems[J]. Marine Chemistry, 1992, 39: 67-93.
[4] LETSCHER R T, HANSELL D A, KADKO D, et al. Dissolved organic nitrogen dynamics in the Arctic Ocean[J]. Marine Chemistry, 2013, 148: 1-9.
[5] ANTIA N J, HARRISON P J, OLIVEIRA L. The role of dissolved organic nitrogen in phytoplankton nutrition, cell biology and ecology[J]. Phycologia, 1991, 30: 1-89.
[6] BRONK D A. Dynamics of DON[M]//HANSELL D A, CARLSON C A. Biogeochemistry of marine dissolved organic matter. Academic Press, Inc. New York, 2002: 153-257.
[7] LEE C, WAKEHAM S, ARNOSTI C. Particulate organic matter in the sea: the composition conundrum[J]. Ambio, 2004, 33: 565-575.
[8] DAVIS J, KAISER K, BENNER R. Amino acid and amino sugar yields and compositions as indicator of dissolved organic matter diagenesis[J]. Organic Geochemistry, 2009, 40(3): 343-352.
[9] BADA J L. Racemization of amino-acids in nature[J]. Interdisciplinary Science Reviews, 1982, 7(1): 30-46.
[10] DAUWE B, MIDDELBURG J J, HERMAN P M J, et al. Linking diagenetic alteration of amino acids and bulk organic matter reactivity[J]. Limnology and Oceanography, 1999, 44(7): 1809-1814.
[11] COWIE G L, HEDGES J I. Biochemical indicators of diagenetic alteration in natural organic-matter mixtures[J]. Nature, 1994, 369: 304-307.
[12] KEIL R G, TSAMAKIS E, HEDGES J I. Early diagenesis of particulate amino acids in marine systems[M]// Goodfriend G A. Perspectives in amino acid and protein geochemistry. New York: Oxford University Press, Inc. 2000: 69-82.
[13] DAUWE B, MIDDELBURG J J. Amino acids and hexosamines as indicators of organic matter degradation state in North Sea sediments[J]. Limnology and Oceanography, 1998, 43(5): 782-798.
[14] 邵亮. 长江口及其毗邻海区颗粒态氨基酸的分布[D]. 上海: 华东师范大学, 2010.
SHAO Liang. Distribution of particulate amino acid in Changjiang estuary and its adjacent area[D]. Shanghai: East China Normal University, 2010.
[15] 张星君, 纪明侯. 渤海湾、黄河口和长江口海域海水中颗粒氨基酸含量的分布[M]//孙松. 海洋科学集刊, 北京: 科学出版社, 2004: 91-99.
ZHANG Xingjun, JI Minghou. Studies on the distribution of the contents of particulate amino acids in the sea water of Bohai Bay, Yellow River estuary and Changjiang river estuary[M]//SUN Song. Studia Marina Sinica, Beijing: Science Press, 2004: 91-99.
[16] 陈岩, 杨桂朋, 纪崇霄, 等. 南海北部海水中氨基酸的分布及其对溶解有机物降解行为的指示研究[J]. 海洋学报, 2017, 39(9): 58-70.
CHEN Yan, YANG Guipeng, JI Chongxiao, et al. Distributions of amino acids and their indications for the degradation of dissolved organic in the northern South China Sea[J]. Haiyang Xuebao, 2017, 39(9): 58-70.
[17] 周卜, 袁华茂, 宋金明, 等. 胶州湾沉积物中氨基酸对有机质降解及细菌源贡献的指示作用解析[J]. 海洋学报, 2018, 40(8): 29-41.
ZHOU Bu, YUAN Huamao, SONG Jinming. Amino acids as indicator of organic matter degradation state in particulate matters and surface sediments of Jiaozhou Bay[J]. Haiyang Xuebao, 2018, 40(8): 29-41.
[18] FITZNAR H P, LOBBES J M, KATTNER G. Determination of enantiomeric amino acids with high-performance liquid chromatography and pre-columnderivatisation with o-Phthaldialdehyde and n-isobutylcysteine in seawater and fossil sample (mollusks)[J]. Journal of Chromatography A, 1999, 832: 123-132.
[19] KAISER K, BENNER R. Erratum: hydrolysis-induced racemization of amino acids[J]. Limnology and Oceanography: Methods, 2005, 3(8): 318-325.
[20] JENNERJAHN T C, ITTEKKOT V. Organic matter in sediments in the mangrove areas and adjacent continental margins of Brazil.1. amino acids and hexosamines[J]. Oceanologica Acta, 1997, 20(2): 359-369.
[21] 綦倩倩, 何真, 杨桂朋, 等. 春季长江口及其邻近海域海水和大气中CH3I、CH2Br2和CHBr3的浓度分布与海-气通量[J]. 中国海洋大学学报(自然科学版), 2021, 51(6): 59-69.
QI Qianqian, HE Zhen, YANG Guipeng, et al. Distributions and sea-to-air fluxes of CH3I, CH2Br2and CHBr3in the Changjiang River estuary and its adjacent marine area in spring[J]. Periodical of Ocean University of China, 2021, 51(6): 59-69.
[22] 陈佳玉, 张洪海, 李江萍, 等. 秋季长江口及邻近海域一氧化碳的分布、通量与微生物消耗速率[J]. 中国海洋大学学报(自然科学版), 2020, 50(12): 78-87.
CHEN Jiayu, ZHANG Honghai, LI Jiangping, et al. Distribution, flux and biological consumption of carbon monoxide in the Changjiang River estuary and its adjacent area[J]. Periodical of Ocean University of China, 2020, 50(12): 78-87
[23] GONG G C, CHEN Y L L, LIU K K. Chemical hydrography and chlorophyll a distribution in the East China Sea in summer: implications in nutrient dynamics[J]. Continental Shelf Research, 1996, 16: 1561-1590.
[24] SU Y, WENG X. Water masses in China seas[M]// ZHOU Di, LIANG Yuanbo, ZHENG Chengkui. Oceanology of China Seas, Vol.1, Kluwer Academic, Inc. Netherlands, 1994: 3-16.
[25] 张宁, 陈岩, 高先池, 等. 西北太平洋低纬度区域海水中溶解氨基酸的分布及组成研究[J]. 海洋科学, 2020, 44(5): 60-70.
ZHANG Ning, CHEN Yan, GAO Xianchi, et al. Distribution and composition of dissolved amino acids in seawater of low-latitude Northwest Pacific[J]. Marine Sciences, 2020, 44(5): 60-70.
[26] GARRASI C, DEGENS T, MOPPER K. The free amino acid composition of seawater obtained without desalting and preconcentration[J]. Marine Chemistry, 1979, 8(1): 71-85.
[27] CHEN Y, YANG G P, LIU L, et al. Sources, behaviors and degradation of dissolved organic matter in the East China Sea[J]. Journal of Marine Systems, 2016, 155: 84-97.
[28] 陈岩, 杨桂朋. 春季北黄海表层海水中溶解游离氨基酸的分布与组成研究[J]. 中国海洋大学学报(自然科学版), 2010, 40(7): 93-98.
CHEN Yan, YANG Guipeng. Study on dissolved free amino acid(DFAA) in the surface water of the North Yellow Sea[J]. Periodical of Ocean University of China, 2010, 40(7): 93-98.
[29] 沈志良, 刘群, 张淑美. 长江总氮和有机氮的分布变化与迁移[J]. 海洋与湖沼, 2003, 34(6): 577-585.
SHEN ZhiliangL, LIU Qun, ZHANG Shumei. Distribution variation and removal patterns of total nitrogen and organic nitrogen in the Changjiang river[J]. Oceanologia et Limnologia Sinica, 2003, 34(6): 577-585.
[30] JI C X, Chen Y, Yang G P. Seasonal Variation, degradation, and bioavailability of dissolved organic matter in the Changjiang estuary and its adjacent East China Sea[J]. Journal of Geophysical Research-Oceans, 2021, 126(3): 1-20.
[31] KUMLU M, EROLDOGAN O T, AKTAS M. Effects of temperature and salinity on larval growth, survival and development of[J]. Aquaculture, 2000, 188(1/2): 167-173.
[32] PARADO-ESTEPA F D. Survival ofpostlarvae and juveniles at different salinity and temperture levels[J]. The Israeli Journal of Aquaculture Bamidgeh, 1998, 50(4): 174-183.
[33] O’ BRIEN C J. The effect of temperature salinity on growth and survival of juvenile tiger prawn(Haswell)[J]. Journal of Experimental Marine Biology and Ecology, 1994, 183(1): 133-145.
[34] LOMESTEIN B A, JENSEN A G U, HANSEN J W, et al. Budgest of sediment nitrogen and carbon cycling in the shallow water of Knebel Vig, Denmark[J]. Aquatic Microbial Ecology, 1998, 14: 69-80.
[35] CHEN Y, YANG G P, XIA Q Y, et al. Enrichment and characterization of dissolved organic matter in the surface microlayer and subsurface water of the South Yellow Sea[J]. Marine Chemistry, 2016, 182: 1-13.
[36] MEON B, KIRCHMAN D L. Dynamic and molecular composition of dissolved organic material during experimental phytoplankton blooms[J]. Marine Chemistry, 2001, 75: 185-199.
[37] MORAN M A, KUJAWINSKI E B, STUBBINS A, et al. Deciphering ocean carbon in a changing world[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(12): 3143-3151.
[38] JØRGENSEN N O G, TRANVIK L J, BERG G M. Occurrence and bacterial cycling of dissolved nitrogen in the Gulf of Riga, the Baltic Sea[J]. Marine Ecology Progress Series, 1999, 191: 1-18.
[39] NAGATA Y, TANAKA K, IIDA T, et al. Occurrence of D-amino acids in a few archaea and dehydrogenase activities in hyperthermophile Pyrobaculum islandicum[J]. Biochimica et Biophysica Acta-Protein Structure and Molecular Enzymology, 1999, 1435: 160-166.
[40] FUHRMAN J A. Marine viruses and their biogeochemical and ecological effects[J]. Nature, 1999, 399: 541-548.
[41] KITAYAMA K, HAMA T, YANAGI K. Bioreactivity of peptidoglycan in seawater[J]. Aquatic Microbial Ecology, 2007, 46: 85-93.
[42] PEDERSEN A G U, THOMSEN T R, LOMSTEIN B A, et al. Bacterial influence on amino acid enantiomerization in a coastal marine sediment[J]. Limnology and Oceanography, 2001, 46(6): 1358-1369.
[43] HOPKINSON C S, FRY B, NOLIN A L. Stoichiometry of dissolved organic matter dynamics on the continental shelf of the northeastern USA[J]. Continental Shelf Research, 1997, 17: 473-489.
[44] CONNOLLY J P, COFFIN R P, LANDECK R E. Modeling carbon utilization by bacteria in natural water systems[M]// HURST C J. Modeling the Metabolic and Physiologic Activities of Micro-organisms. Wiley, Inc. New York, 1992: 249-276.
[45] BRONK D A, GLIBERT P M. Application of a15N tracer method to the study of dissolved organic nitrogen uptake during spring and summer in Chesapeake Bay[J]. Marine Biology, 1993, 115: 501-508.
[46] 吴波. 长江口区藻类分布格局及其与环境因子相关性的研究[D]. 上海: 华东师范大学, 2015.
WU Bo. Study of algal distribution pattern and its correlation with environmental factors in Changjiang River estuary area[D]. Shanghai: East China Normal University, 2015.
[47] KIRCHMAN D, HODSON R. Inhibition by peptides of amino acid uptake by bacterial populations in natural waters: implications for the regulation of amino acid transport and incorporation[J]. Applied and Environmental Microbiology, 1984, 47(4): 624-631.
[48] KAWASAKI N, BENNER R. Bacterial release of dissolved organic matter during cell growth and decline: molecular origin and composition[J]. Limnology and Oceanography, 2006, 51: 2170-2180.
[49] MULHOLLAND M R, BONEILLO G, MINOR E C. A comparison of N and C uptake during tide () blooms from two coastal bays on the east coast of the USA[J]. Harmful Algae, 2004, 3: 361-376.
[50] HEDGES J I, CLARK W A, QUAY P D, et al. Compositions and fluxes of particulate organic material in the Amazon River[J]. Limnology and Oceanography, 1986, 31: 717-738.
[51] OPSAHL S, BENNER R. Characterization of carbohydrates during early diagenesis of five vascular plant tissues[J]. Organic Geochemistry, 1999, 30(1): 83-94.
[52] AITKENHEAD J A, MCDOWELL W H. Soil C: N ratio as a predictor of annual riverine DOC flux at local and global scales[J]. Global Biogeochemical Cycles, 2000, 14: 127-138.
[53] TAN F C, CAI D L AND EDMOND J M. Carbon isotope geochemistry of the Changjiang Estuary[J]. Estuarine, Coastal and Shelf Science, 1991, 32: 395-404.
[54] WILLIAMS P M, CARLUCCI A F, OLSON R. A deep profile of some biologically important properties in the central North Pacific gyre[J]. Oceanologica Acta, 1980, 3(4): 471-476.
[55] MARTIN J H, KNAUER G A, KARL D M, et al. Vertex: carbon cycling in the northeast Pacific[J]. Deep Sea Research Part A, 1987, 34(2): 267-285.
[56] KAISER K, BENNER R. Organic matter transformations in the upper mesopelagic zone of the North Pacific: Chemical composition and linkages to microbial community structure[J]. Journal of Geophysical Research-Oceans, 2012, 117(1): C01023.
[57] MIDDELBURG J J, HERMAN P M J. Organic matter processing in tidal estuaries[J]. Marine Chemistry, 2007, 106: 127-147.
[58] COWIE G L, HEDGES J I. Sources and reactivities of amino acids in a coastal marine environment[J]. Limnology and Oceanography, 1992, 37(4): 703-724.
[59] 史君贤, 陈忠元, 宁修仁, 等. 长江口及其附近海域细菌和三磷酸腺苷的分布特征[J]. 海洋与湖沼, 1992, 23(3): 288-296.
SHI Junxian, CHEN Zhongyuan, NING Xiuren, et al. The distribution patterns of bacteria and ATP in the Changjiang river estuary and its adjacent East China Sea[J]. Oceanologia et Limnologia Sinica, 1992, 23(3): 288-296.
[60] SUNAGAWA S, COELHO L P, CHAFFRON S, et al. Structure and function of the global ocean microbiome[J]. Science, 2015, 348(6237): 126-1359.
[61] GIBBONS S M, CAPORASO J G, PIRRUNG M, et al. Evidence for a persistent microbial seed bank throughout the global ocean[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(12): 4651-4655.
[62] GANESH S, PARRIS D J, DELONG E F, et al. Metagenomic analysis of size-fractionated picoplankton in a marine oxygen minimum zone[J]. ISME Journal, 2014, 8(1): 187-211.
[63] MORAN M A, BUCHAN A, GONZALEZ J M, et al. Genome sequence of Silicibacter pomeroy reveals adaptations to the marine environment[J]. Nature, 2004, 432(7019): 910-913.
[64] JORGENSEN N O G, STEPANAUKAS R, PEDERSEN A G U, et al. Occurrence and degradation of peptidoglycan in aquatic environments[J]. Fems Microbiology Ecology, 2003, 46(3): 269-280.
[65] TANOUE E, NISHIYAMA S, KAMO M, et al. Bacterial-membranes-possible source of a major dissolved protein in seawater[J]. Geochimica et Cosmochimica, 1995, 59: 2643-2648.
[66] BROPHY J E, CARLSON D J. Production of biologically refractory dissolved organic carbon by natural seawater microbial populations[J]. Deep Sea Research Part A, 1989, 36(4): 497-507.
Distribution, composition, and degradation behavior of dissolved organic matter in the Changjiang River Estuary and its surrounding area in spring
CHEN Bo-yang1, CHEN Rong1, CHEN Yan1, YANG Gui-peng1, 2
(1. College of Chemistry and Chemical Engineering, Ocean University of China, Qingdao 266100, China; 2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China)
The composition of dissolved amino acids (THAA), dissolved organic carbon (DOC), and dissolved organic nitrogen (DON) were determined in nine transections of the Changjiang River Estuary and its adjacent area in March 2021. The results demonstrated that the concentrations of THAA ranged from 1.24 to 4.71 μmol/L, with an average of (2.61±0.85) μmol/L; the concentrations of DOC ranged from 118.17 to 450.58 μmol/L, with an average of (149.73±33.34) μmol/L; the concentrations of DON varied from 10.48 to 24.45 μmol/L, with an average of (13.80±1.81) μmol/L. The concentrations of THAA were higher on the near shore than offshore, indicating that terrestrial input had a significant influence on the THAA distribution. THAA was negatively correlated with the D/L ratio of four D-amino acids (D-Asp, D-Glu, D-Ser, and D-Ala) and positively correlated with Asp/β-Ala ratios, suggesting that bacterial activity was an important factor in regulating the THAA concentration change. The dominant amino acids in the seawater were L-amino acids. The proportion of D-amino acids and non-protein amino acids was 7.34%. The C/N ratio is an effective factor in indicating the source of organic matter. The C/N ratio indicated that the source of dissolved organic matter in the study area was affected by the Changjiang Diluted Water and Taiwan Warm Current. THAA-C%, THAA-N%, degradation factor and reactivity index illustrated that the degradation degree was higher at stations with salinity near zero and offshore stations with salinity over 34. On a vertical scale, the degradation degree of organic matter increased gradually with the increase of depth. The degradation degree of organic matter in the survey area was mainly affected by terrestrial input and bacterial activity.
dissolved amino acid; dissolved organic carbon; dissolved organic nitrogen; bacterial degradation; Changjiang River Esturay
Feb. 6, 2022
P734
A
1000-3096(2022)11-0001-14
10.11759/hykx20220206001
2022-02-06;
2022-03-13
山东省自然科学基金项目(ZR2020MD075); 国家自然科学基金项目(41976038); 中国科学院海洋生态与环境科学重点实验室(中国科学院海洋研究所)开放基金项目(KLMEES202001)
[the Shandong Provincial Natural Science Foundation, No. ZR2020MD075; the National Natural Science Foundation of China, No. 41976038; the Open Fund of CAS Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, No. KLMEES202001]
陈博洋(1997—), 男, 天津人, 硕士研究生, 主要从事海洋中溶解氨基酸的研究, E-mail: 15222380896@163.com; 陈蓉(1969—),通信作者, E-mail: chenrong@ouc.edu.cn
(本文编辑: 赵卫红)
