DCE-MRI及DWI对乳腺良恶性病变的鉴别价值*
2023-01-30汪雅琪鲁梦甜
汪雅琪,鲁梦甜
(1.湖北科技学院生物医学部,湖北 咸宁 437100;2.咸宁市中心医院放射科)
乳腺恶性病变患者早期接受规范治疗,存活率较高,病理学检查是诊断乳腺疾病的金标准,但穿刺活检存在定位困难、采样不足等缺点。非侵袭性的影像学检查成为鉴别乳腺良恶性病变的重要手段。MRI有多方位、多序列成像的优势,对乳腺微小病变、多中心病变及多灶病变的检出具有较高的敏感性。磁共振动态增强(dynamic contrast-enhancement MRI,DCE-MRI)已被常规用于乳腺病变的诊断,通过连续监测病变处造影剂的变化,获得时间-信号强度曲线(time-signal intensity curve,TIC),从而评估组织血管生成和血管通透性[1]。DCE-MRI诊断乳腺恶性肿瘤的敏感性较高,可达88%以上[2-3],但其特异性不佳。磁共振弥散加权成像(diffusionweighted imaging,DWI)是一项不使用造影剂的技术,通过描述水分子的随机运动,反映组织的微观结构特征。表观弥散系数(apparent diffusion coeffcient,ADC)作为DWI定量标准,对于乳腺良恶性病变的诊断有一定的价值,但良恶性病变的ADC值仍有部分重叠[4]。本文主要研究DCE-MRI及DWI对乳腺良恶性病变的鉴别价值。
1 资料与方法
1.1 一般资料
回顾性分析咸宁市中心医院2018年6月至2022年6月收治的174例乳腺病变患者的临床及影像资料。所有患者均为女性,年龄23~74岁,平均(46.27±10.49岁)
纳入标准:经病理确诊;未合并其他严重疾病;进行MRI检查且图像清晰,MRI包含DWI序列和DCE-MRI序列;病变为肿块样强化;检查前未行手术、放疗或化疗;患者或家属知情且同意。排除标准:病变为微小病灶;合并其他严重疾病;临床或影像资料缺失。
1.2 检查方法
应用GE Silent 3.0T MR扫描仪及8通道乳腺专用线圈,患者采用俯卧位,双侧乳腺自然垂于乳腺线圈内。扫描序列包含:①T1WI序列,轴位,FOV=320mm×320mm,TE=5.9ms,TR=725ms,层厚4mm;②T2WI序列,使用反转恢复抑脂技术,轴位参数为FOV=320mm×320mm,TE=86.0ms,TR=6954ms,层厚4mm;矢状位参数为FOV=200mm×200mm,TE=87.8ms,TR=3000ms,层厚4mm;③DWI序列,轴位,FOV=320mm×320mm,TE=66.7ms,TR=6686.3ms,层厚4mm,b值分别取0s/mm2、1000s/mm2;④DCE-MRI,采用横断位3D容积扫描,脂肪抑制快速扰相梯度回波序列,FOV=320mm×320mm,TE=1.9ms,TR=6.8ms,层厚1.4mm。设定7期扫描时相,第1期为预扫描,预扫描完成后注射Gd-DTPA,其余时相为连续扫描。
1.3 观察指标
①DWI:在病灶显示的最大层面选取感兴趣区(避开液化、坏死及出血区),在高b值(1000s/mm2)DWI图像上测量病灶的ADC值,若病例为多发病灶,则根据病理结果选择相应的病灶。②DCE-MRI:分析病灶的形态学改变,包括形状、边缘以及强化均匀度。在病灶异常强化的区域选取感兴趣区,分析该区的TIC。TIC分为3型:Ⅰ型(流入型)表现为信号强度在整个动态过程中持续稳定增加;Ⅱ型(平台型)表现为信号强度迅速达到峰值之后保持稳定,呈现平台状态;Ⅲ型(流出型)表现为信号强度迅速达到峰值后降低,幅度超过10%。
两位高资质医师根据上述指标给出分析结果,意见不统一时经讨论达成一致。
1.4 统计学方法
2 结 果
2.1 病理分类
所有病例中多发病灶17例,单发病灶157例;良性病变61例,恶性病变113例。患者的组织病理亚型见表1。

表1 良、恶性乳腺病变的组织病理亚型
2.2 形态学及强化特征比较
恶性乳腺病变形态规则、边界清晰、强化均匀所占的比例均低于良性乳腺病变,差异有统计学意义(P<0.05),详见表2。

表2 良、恶性乳腺病变的形态、边缘及强化特征比较[n(%)]
2.3 TIC类型分布
良性与恶性乳腺病变的TIC分型(Ⅰ型、Ⅱ型、Ⅲ型)相比差异显著(F=65.639,P<0.05),详见表3。典型病例的乳腺DCE-TIC类型见图1~3。
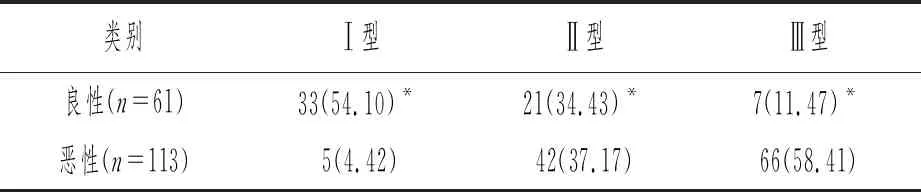
表3 良、恶性乳腺疾病的TIC类型分布比较[n(%)]
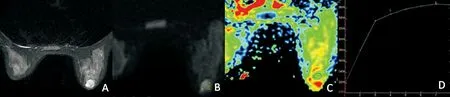
A:T2WI示左乳内下象限结节灶,边界清晰;B:DWI示病灶呈稍高信号;C:ADC图,病灶ADC值约为1.51×10-3mm2/s;D:病灶DCE-TIC呈Ⅰ型(流入型)
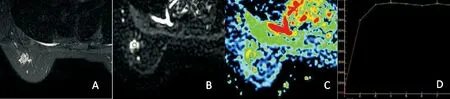
A:T2WI示左乳外上象限结节灶,病灶形态不规则,边界稍模糊;B:DWI示病灶呈高信号;C:ADC图,病灶ADC值约为1.47×10-3mm2/s;D:病灶DCE-TIC呈Ⅱ型(平台型)

A:T2WI示左乳内上象限结节灶,呈分叶状;B:DWI示病灶呈高信号;C:ADC图,病灶ADC值约为0.908×10-3mm2/s;D:病灶DCE-TIC呈Ⅲ型(流出型)
2.4 ADC值分析
DWI表明,良性病变平均ADC值明显高于恶性病变,差异有统计学意义(t=13.952,P<0.05),详见表4。
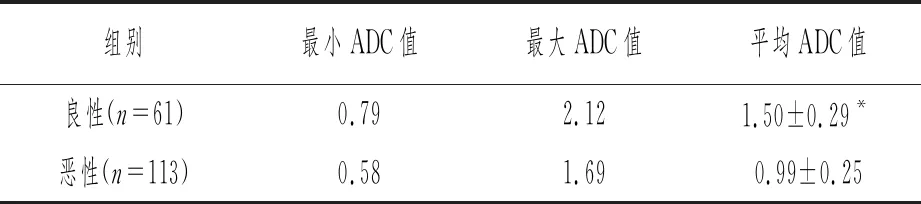
表4 良、恶性乳腺病变的ADC值范围比较(×10-3mm2/s)
2.5 单独及联合检查的诊断结果及价值
174例患者中,DWI诊断出恶性病变105例、良性病变69例;DCE-MRI诊断出恶性病变118例、良性病变56例;DCE-MRI联合DWI诊断出恶性病变108例、良性病变66例。详见表5。
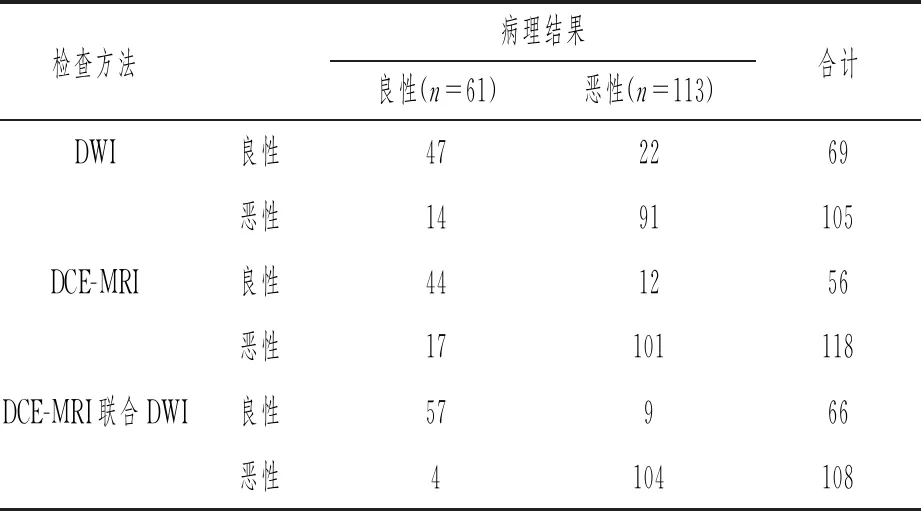
表5 DCE-MRI、DWI及二者联合诊断结果比较(n)
DCE-MRI联合DWI诊断的灵敏度、特异度、准确率、阳性和阴性预测值均高于单独诊断,差异有统计学意义(P<0.05),详见表6。

表6 DCE-MRI、DWI及二者联合诊断效能比较[%(n/n)]
3 讨 论
乳腺病变是危害女性身心健康的常见病、多发病,其致病因素较复杂。乳腺良性病变主要包括纤维腺瘤、囊肿等,恶性病变主要包括乳腺癌。MRI在乳腺病变的检出、病变性质的鉴别等方面有着独特的优势,合理序列的应用可以精简扫描程序,提高检测效率。
乳腺良恶性病变在形态学上有一定的差别。本研究显示乳腺恶性病变多表现为形态不规则、边界模糊、强化不均匀,而良性病变相反,这与李沉鲛等[4]研究结果一致。仅根据形态学表现来鉴别乳腺良恶性病变较困难。
DCE-MRI可通过评估血管生成及血管通透性来鉴别良恶性病变[1]。本研究结果表明TIC为I型大部分为良性病变,Ⅲ型大部分为恶性病变,其主要原因是恶性肿瘤新生血管较多,血管通透性高,造影剂进出血管速度较快[5]。良性病变(如肉芽肿性小叶性乳腺炎)局部肉芽组织增生、毛细血管通透性增加可致血供增加;另外,良性叶状肿瘤也可以出现丰富的血供,TIC表现为Ⅱ型和Ⅲ型。
DWI可以通过检测水分子的微观运动来反映不同组织成分的水分子在病理状态下的功能变化[6]。恶性肿瘤细胞增殖速度较快、细胞密度较大、核-质比较大、细胞外间隙较小,表现为DWI扩散受限[7]。本研究表明,乳腺良性病变ADC值高于恶性病变。目前对于识别乳腺良恶性病变ADC的临界值没有统一的标准,不同文献中提到的ADC值范围在(0.9~1.76)×10-3mm2/s,临界值定为1.23×10-3mm2/s[8]。本研究中部分良性病变的DWI表现为扩散受限,可能是乳腺炎性病灶中大分子蛋白含量增加以及炎性细胞浸润的结果。有研究表明[6],在乳腺良性病变中,DWI扩散受限主要表现在病灶中心部位,而恶性病变表现为病灶周围扩散受限。
DCE-MRI和DWI技术单独使用均有一定的局限性,二者联合在乳腺良恶性病变中的诊断效能较高。本研究结果表明,DCE-MRI联合DWI诊断的灵敏度、特异度、准确率、阳性预测值和阴性预测值均高于单独诊断。这与卢冬莹[9]的研究结果一致。
综上所述,乳腺形态不规则、边界模糊、强化不均匀的病变,ADC值较低的病变以及TIC呈Ⅲ型的病变很可能是恶性。此外,DCE-MRI联合DWI可以提高乳腺良恶性病变的诊断效能,为临床提供更精准的影像学评估。本研究对乳腺肿块样强化病变进行了较大样本的分析,但也存在一定的局限性,首先,本研究只对DCE-TIC类型进行了分析,未能对强化峰值(SImax)、达峰时间(TTP)、早期强化率(slope)及信号增强比率(SER)等其他半定量参数进行分析;其次,本研究中的乳腺病变均为肿块样强化,非肿块样强化病变未纳入研究,结果有一定的局限性;最后,本研究未对比腋窝淋巴结肿大在乳腺良恶性病变中的差异。今后的研究应扩大样本范围并引入其它参数综合分析,从而提高乳腺病变诊断的准确性。
