基于术前脾脏CT影像组学列线图预测胃癌的浆膜浸润
2023-01-28沈宁喆郑经纬潘步建章巍腾陈孝冬
沈宁喆,郑经纬,潘步建,章巍腾,陈孝冬,
1.温州医科大学 第一临床医学院(信息与工程学院),浙江 温州 325035;2.温州医科大学附属第二医院 胃肠外科,浙江 温州 325027;3.温州医科大学附属第一医院 胃肠外科,浙江 温州 325015
胃癌(gastric cancer, GC)是世界上第五大最常见的癌症,目前是世界上第三大癌症相关死亡的原因[1]。术前能否准确评估胃癌分期非常重要,因为它决定了最合适的治疗方案[2]。T4a期指肿瘤已侵及胃浆膜层,此时宜先行新辅助化疗而后手术切除[3-4]。对于T4期伴有淋巴结转移的患者,术前新辅助化疗可使肿瘤降期从而获取更大手术收 益[5]。因此,术前能否准确评估有无浆膜浸润具有重要意义。此外,免疫微环境可能改变肿瘤的生长阶段和侵袭程度。本研究拟利用胃癌患者脾影像学资料,建立基于脾影像学特征的预测模型,探究胃癌患者脾脏特征与浆膜浸润的相关性。同时,构建列线图以帮助术前预测胃癌有无浆膜层浸润。
1 资料和方法
1.1 一般资料 选取2015年1月至2019年12月在温州医科大学附属第一医院行胃癌手术的患者656例。所有患者术前均进行CT扫描,并经胃镜活检病理诊断为胃癌,同时进行根治性胃切除术;所有手术均由完成超过200例胃癌根治术的外科医师完成。围术期的胃癌治疗和管理以日本2010版胃癌治疗指南为基础,参考中国抗癌协会胃癌诊疗指南。纳入标准:年龄大于18岁;病理学检查证实为原发性胃癌并接受手术治疗者;术前行腹部增强CT扫描,非急诊手术者。排除标准:①拒绝手术的患者;②术前无影像学检查或无影像学资料的患者;③术后诊断与本研究不符的患者;④合并其他肿瘤或其他严重器质性疾病的患者。有无浆膜浸润以术后标本的病理结果为金标准,诊断标准参照美国癌症联合委员会第八版胃癌指南和国际抗癌联盟肿瘤-淋巴结-转移分期。本研究经温州医科大学附属第一医院伦理委员会批准(审批号YS2002-598),所有患者均签署知情同意书。
1.2 影像组学的特征提取 所有患者均在术前 30 d内行腹部增强CT扫描。检查机器为64排128层的螺旋CT(德国西门子公司)。将所有CT图像上传到ITK-SNAP 3.8.0,半自动测绘脾脏检测区域。具体过程为先由1位经验丰富的普外科医师勾画出脾脏,然后另一位放射科医师检查。采用NRRD格式的医学数字图像文件保存原始CT和目标区域图像。使用基于python架构的Pyradiomics 3.7.2自动提取特征。总共收集到18个初级特征(一阶),14个图形特征(3D外形),22个GLCM特征,16个GLRLM(灰度运行长度矩阵)特征,16个GLSZM(灰度大小区域矩阵)功能,5个NGTDM(邻近的灰色色调差异矩阵)特征和14个GLDM(灰度相关矩阵)特征,小波分解后共有833特征。
1.3 预测特征的筛选和肿瘤浸润评分的确定 为了筛选脾脏相关特征和确定肿瘤浸润评分,将656例患者按2:3的比例随机分为建模组和验证组。将656例患者的833个特征进行z-score标准化,选取浆膜浸润脾脏特征中P<0.1者进行进一步的套索回归。最后以cv套索中最小λ的套索模型来构建浆膜浸润风险预测模型[7-8]。选择验证组对肿瘤浸润预测模型进行准确性的验证。
1.4 建立联合预测模型 根据脾脏特征建立肿瘤浸润评分后,通过对建模组及验证组进行单变量和多变量分析获得预测因素。建模组中的833个特征经单变量Logistic回归分析后,筛选出P<0.1的特征进行进一步的套索回归用于建立影像组学肿瘤浆膜浸润预测的列线图模型,并通过C指数校准曲线下面积和决策曲线分析对预测模型的稳定性和可靠性进行评估。
1.5 统计学处理方法 采用SPSS25.0进行统计学分析,计量资料以±s表示,2组间比较采用Mann-WhitneyU检验;计数资料以例和率表示,2组间比较采用χ2检验或Fisher确切概率法,采用单因素及多因素Logistic回归分析分类变量,P<0.05为差异有统计学意义。
2 结果
2.1 患者的临床特征 2组患者的个体特征及病理结果差异无统计学意义(P>0.05),见表1。

表1 2组患者的临床特征比较
2.2 基于脾脏特征的肿瘤浸润评分的筛选和确定 本研究通过套索回归得到一份详细的脾脏影像组学特征表,用于制定肿瘤的浆膜浸润评分。套索回归的最小λ值为-4.357,共有14个特征进入最终的预测模型(见图1)。模型的曲线下面积(area under the curve, AUC)为0.69,P<0.001,验证组AUC为0.62,P=0.001。肿瘤浆膜浸润的风险与影像组学肿瘤浸润评分呈正相关,在最大约登指数(-0.335)下取截断值,以肿瘤浸润评分≤-0.335为低危组,>-0.335为高危组。
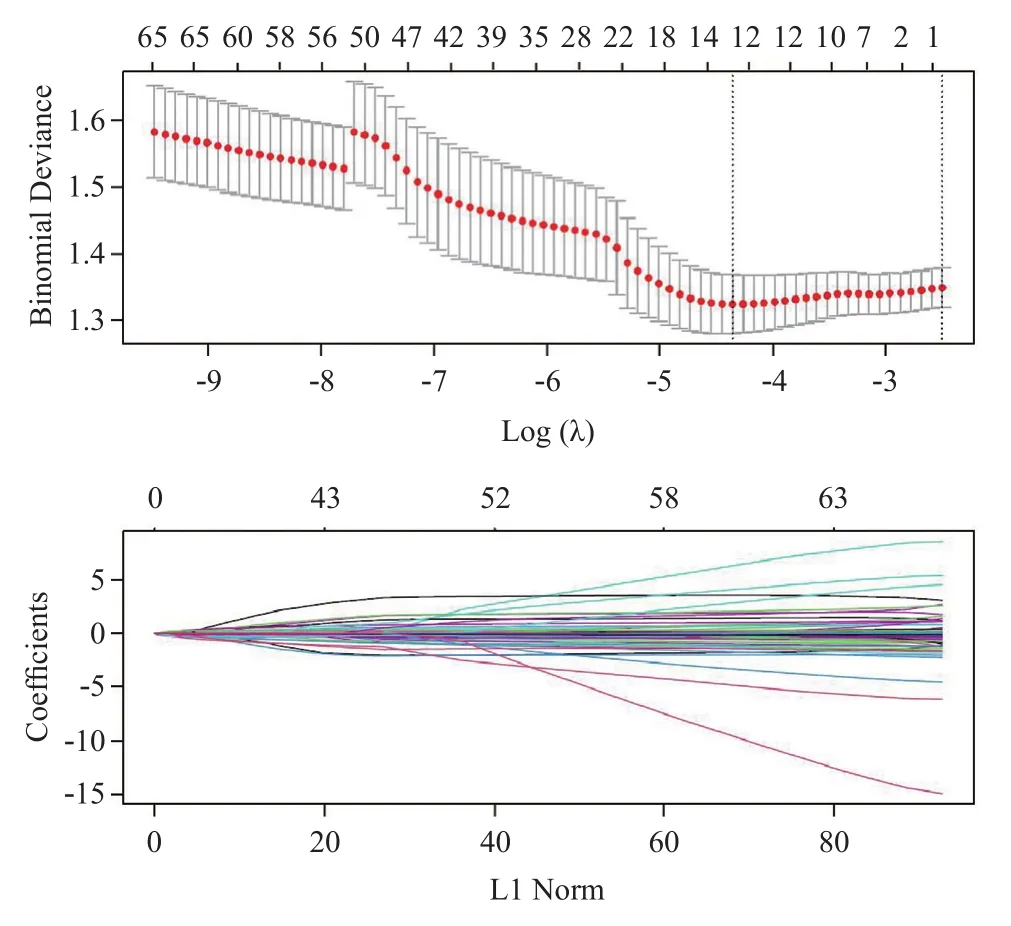
图1 建模组脾脏特征的套索回归分析
2.3 影像组学肿瘤浸润评分与患者基本特征的相关性分析 高危组和低危组间BMI、T、N和TNM分期的差异有统计学意义(P<0.05),而其他临床特征差异无统计学意义(P>0.05),见表2。

表2 不同影像组学肿瘤浸润评分患者临床资料比较
2.4 浆膜浸润影响因素的单因素和多因素Logistic 回归分析 单因素Logistic分析显示,影像组学肿瘤浸润评分、中性粒细胞与淋巴细胞比值(neutrophilto-lymphocyte ratio, NLR)、血小板与淋巴细胞比值(platelet-to-lymphocyte ratio, PLR)、术前血红蛋白、分化程度、BMI与浆膜浸润存在相关性(见表3)。多因素Logistic回归分析表明,影像组学肿瘤浸润评分(P<0.001)、PLR(P=0.004)、分化程度 (P<0.001)和术前白蛋白(P=0.003)是评估浆膜浸润的独立影响因素(见表3),高危组浆膜被浸润的概率要比低危组高得多(OR=2.9)。
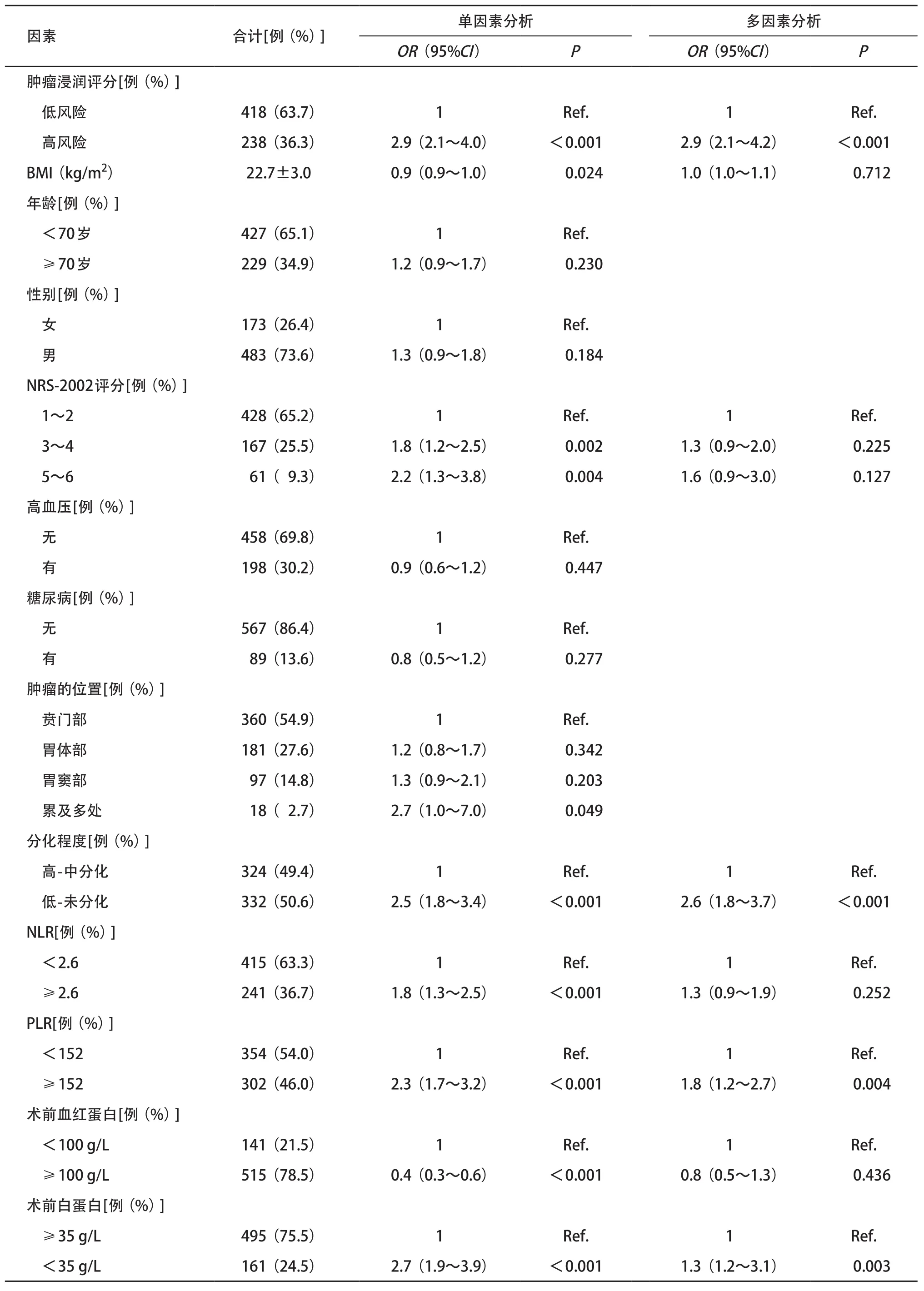
表3 浆膜浸润的单因素和多因素Logistic回归分析结果
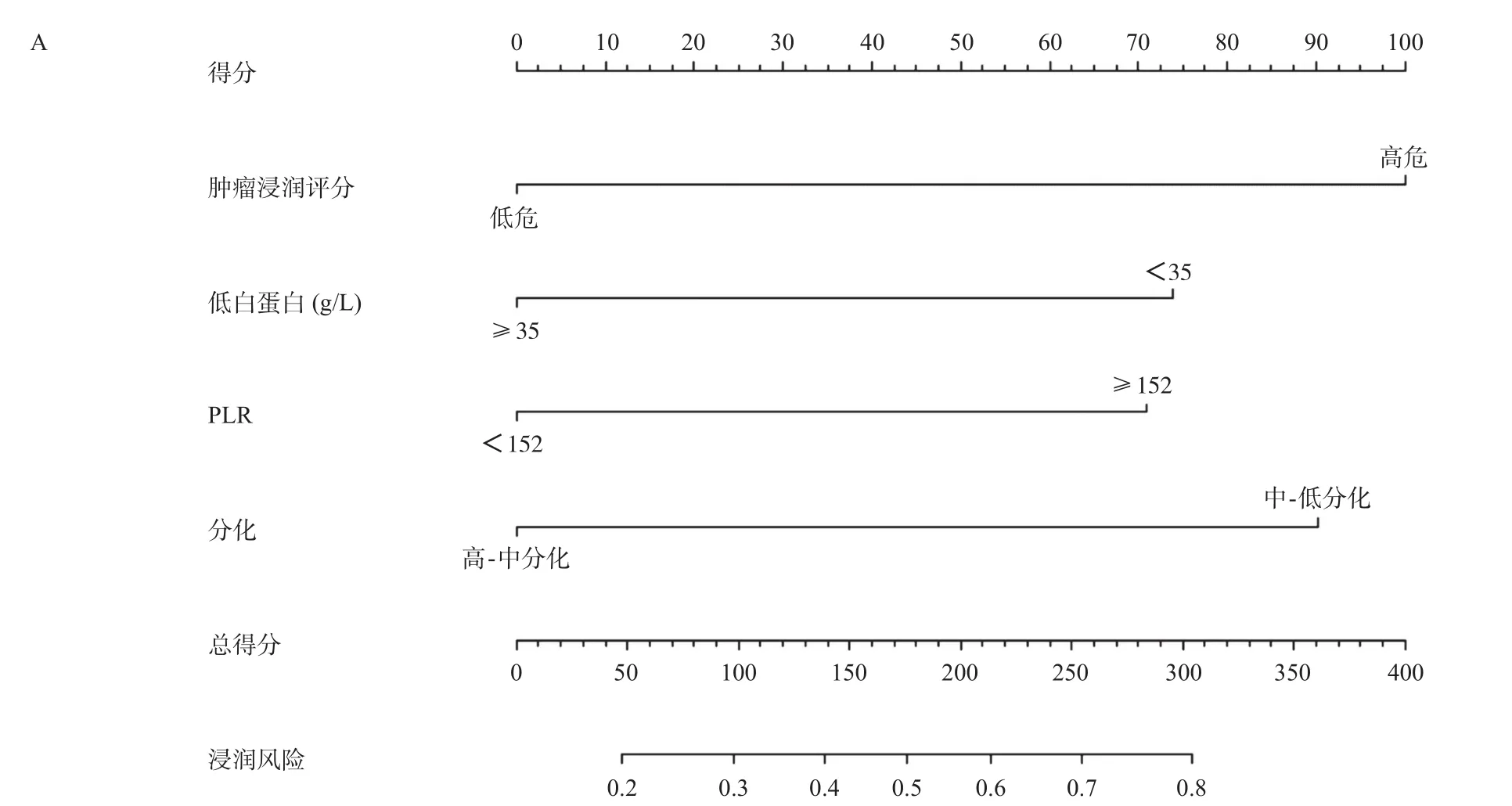
2.5 预测模型的构建与验证 基于影像组学肿瘤浸润评分、PLR以及术前白蛋白这四个指标建立预测肿瘤浆膜有无浸润的列线图模型,见图2A。该列线图能够结合临床检验指标及影像组学肿瘤浸润评分计算出每例患者的浆膜浸润概率。列线图的校正曲线显示预测风险与实际浸润概率之间有较好的一致性,见图2B。
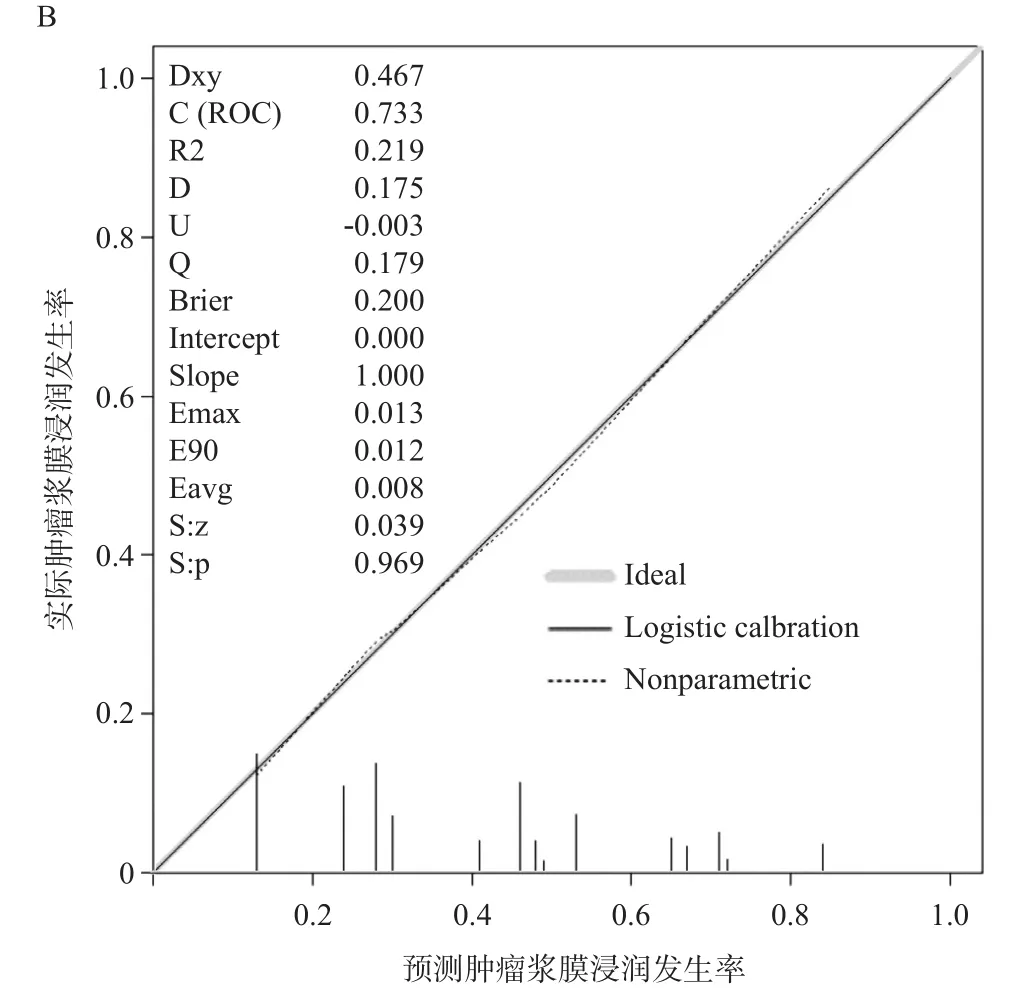
图2 基于影像组学肿瘤浸润评分及临床指标的列线图和一致性检验曲线图
2.6 模型效益 此模型的AUC达到0.733,说明模型整体上是较可靠的,见图3A。决策曲线表明,如果肿瘤建模浸润实际的发生率≥10%,使用影像组学列线图预测浆膜肿瘤浸润的方法相比起全部治疗或者都不治疗的方案将会带来更多益处,见图3B。由此可知,使用影像组学列线图获得的净收益更高。

图3 预测模型的AUC图和决策曲线分析图
3 讨论
准确的术前分期对于确保患者得到最合适的治疗非常重要[3,9]。中国临床肿瘤学会指南推荐T4a及以上胃癌患者实施术前新辅助化疗(neoadjuvant chemotherapy)治疗,但不推荐T3胃癌患者使 用[10-11]。内镜超声鉴别肿瘤T3与T4期的准确率约为65%,据报道相较于病理报告,CT扫描检查对T3的诊断率会过高,T4则过低,总体准确率约为77%。为了避免不必要的新辅助化疗,准确区分出T3和T4a患者显得十分重要[12-13]。
鉴别T3和T4a的关键在于有无浆膜的浸润。因此,寻找一种简单、准确、特异的检测方法非常重要[14-16]。脾脏与肿瘤的发展密切相关,通过脾脏 的影像学特征可以预测肿瘤的发展[17-18]。此外,影像组学具有能够定量识别组织特征的能力,这些组织特征往往与生物学预后或基因存在因果关系,可由此构建组织结构和生物学特征之间的关 联[19-21]。
过去许多类型的肿瘤研究发现脾脏能够促进肿瘤的进展和转移。如GAY等[19]发现,肿瘤微环境的非白细胞群体,如血小板可促进肿瘤转移。此外,HAN等[20]在肝癌小鼠模型中发现,脾脏红细胞样细胞(Ter细胞)能够促进肿瘤进展。这说明脾脏与肿瘤密切相关,可以利用脾脏的特定特征来预测肿瘤的发展。由此我们筛选出部分与浆膜浸润有关的脾脏特征,并利用这些特征建立一个新指标,影像组学肿瘤浸润评分。该评分受肿瘤大小和位置的影响较小,适用于大多数胃癌患者。通过验证组的验证,该评分可用于预测胃癌浆膜浸润。
根据影像组学肿瘤浸润评分将患者分为高危组和低危组,并对患者的临床基本特征进行统计分析。本研究发现2组间TNM和T分期差异有统计学意义,高危组多为TNM和T分期晚期。有研究表明,癌症患者的脾脏通常比正常人大,尤其是晚期癌症患者,这提示脾脏的大小与肿瘤的进展密切相关[21]。本研究通过多因素Logistic回归分析显示,高危组发生严重浸润的风险通常较高。
在本研究中,我们构建了一个临床检验指标结合影像组学肿瘤浸润评分的预测模型,用于胃癌患者浆膜浸润的术前预测。基于多因素Logistic回归分析得到的4个独立危险因素,建立的浆膜浸润预测模型,有助于胃癌患者浆膜浸润的术前预测。最终的可视化列线图可以根据图表中各指标的得分计算出每个患者的浆膜浸润概率。列线图的校准曲线表明,预测风险与实际发生的概率一致性较高。决策曲线显示,在临床应用中,如果浆膜浸润发生率≥10%,则使用联合列线图模型预测浆膜浸润比单纯应用临床指标或影像组学评分更有效[22-23]。更重要的是,该模型的判读一致性指数为0.733,且模型各项参数均可由术前常规检查获取,无需额外行特殊检查。此外,据我们所知,这是第一个揭示脾脏影像特征和肿瘤浆膜浸润之间内在联系的研究。
当然本项研究存在几个局限性。首先,本研究只纳入了确诊的胃癌患者,这可能高估了肿瘤浸润评分对区分胃癌分期的能力。第二是患者人数相对较少,因此,需要更大规模的研究来证实这些结果。第三,缺乏先进的降维技术可能导致了一些偏差。最后,本研究仅使用机器学习算法构建模型,使用最先进的深度学习技术值得今后研究。
综上所述,本研究发现基于脾脏影像的肿瘤浸润评分结合术前白蛋白、肿瘤分化程度和PLR可以区分T4胃癌患者,使T4患者更早接受NAC治疗。
