小分子基温敏聚合物纳米粒子的制备及在近红外二区荧光成像与光热治疗中的应用
2023-01-25陈尚钰沈清明孙鹏飞范曲立
陈尚钰,沈清明,孙鹏飞,范曲立
(南京邮电大学先进材料研究所,南京 210023)
近年来,精准诊断与实时治疗并存的光诊疗平台在精准医疗领域备受关注[1,2].其中,可以将吸收的光子能量同时转换为荧光信号与热能的光诊疗平台备受瞩目,该平台可以实现高分辨、深穿透的荧光成像(FI)和实时、非入侵的光热治疗(PTT)[3~7].与传统的生物窗口(波长<900 nm)相比,波长在1000~1700 nm范围的近红外二区(NIR-Ⅱ)生物窗口具有更高的成像分辨率和更深的组织穿透能力,这是因为生物组织在该窗口的光子散射和自发荧光较弱[8~14].因此,基于该窗口实施的NIR-ⅡFI及其介导的PTT光诊疗平台极具发展前景.迄今,已经发展了多种具有NIR-Ⅱ荧光特性的光诊疗分子[15~18].其中,没有重金属毒性威胁的有机分子,包括有机小分子和共轭聚合物,更具有临床转换的潜力[19~21].然而,大部分报道的有机分子都缺乏功能性设计,并且面临固有的疏水问题,导致不可避免的严重聚集,从而引起这些有机分子NIR-Ⅱ荧光的猝灭,显著影响了生物成像的质量,不利于最终的诊疗[22~25].因此,设计功能性、水溶的有机分子,提高其NIR-Ⅱ荧光亮度是亟待解决的问题.
本文以有机小分子4,9-二(5-9H-芴-2-基-噻吩-2-基)-6′,7-联苯[1,2,5]噻二唑并[3,4-g]喹喔啉(TQF)为前驱体,将其修饰成可逆加成-断裂链转移聚合(RAFT)链转移剂[TQF-苯基硫代链转移剂(CTA)],以TQF-CTA为链转移剂,以偶氮二异丁腈(AIBN)为引发剂,成功引发温敏单体N-异丙基丙烯酰胺(NIPAAm)和亲水单体甲基丙烯酸寡聚乙二醇酯(OEGMA)发生RAFT聚合反应,合成了具有良好水溶性和较低临界溶解温度(LCST)的温敏共聚物TQF-P(NIPAAm-co-OEGMA)(TPNO).以该聚合物制备的纳米粒子TPNO NPs在温度从LCST以下升高至LCST以上时表现出明显的粒径变化和显著的荧光增强行为(2.2倍),并伴随有良好的光热转换能力(PCE=29.8%).最后,TPNO NPs被成功应用于明亮、高分辨NIR-ⅡFI引导的PTT,在精准医疗领域展现出极大的应用前景.
1 实验部分
1.1 试剂与仪器
4-氰基-4-[(苯基硫代羰基)硫代]戊酸、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(EDC)、N-异丙基丙烯酰胺(NIPAAm)和甲基丙烯酸寡聚乙二醇酯(OEGMA),纯度97%,上海百灵威科技有限公司;四氢呋喃(THF)、二氯甲烷(DCM)、1,4二氧六环、N,N-二异丙基乙胺(DIPEA)、三乙胺和偶氮二异丁腈(AIBN),纯度98%,上海西格玛奥德里奇公司;4T1细胞、DMEM培养基、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)毒性试剂盒和4T1荷瘤裸鼠,南京凯基生物股份有限公司.
Bruker Ultra Shield Plus 400 MHz型核磁共振波谱仪(NMR),瑞士Bruker公司;Shim-pack GPC-80 X型凝胶渗透色谱(GPC),日本岛津公司;日立HT7700型透射电子显微镜(TEM,100 kV),日立江苏苏美达仪器设备有限公司;ALV-7004型光散射光谱仪(DLS),德国郎根公司;Shimadzu UV-3600型紫外-可见-近红外(UV-Vis-NIR)分光光度计,日本岛津公司;Fluorolog-3型近红外二区荧光光谱仪,美国Horiba公司;LR-ISP-808型半导体激光器,808 nm,10 W,长春新产业光电科技有限公司;Fotric 225型光热成像仪,日本岛津公司;640×512像素体内/体外NIR-Ⅱ荧光成像仪,配有50/100 mm透镜和640×512像素的二维InGaAs阵列,武汉光映美科技有限公司.
1.2 TQF-CTA TPNO的合成
目标化合物的合成路线如Scheme 1所示.参照文献[12]方法合成TQF.

Scheme 1 Synthetic route of TPNO
在除水除氧条件下,将168 mg(0.1 mmol)TQF,50 mg(0.5 mmol)三乙胺和3 mL干燥除水的THF加入10 mL圆底烧瓶中,于室温下搅拌30 min,逐滴滴加30 mg(0.48 mmol)乙二胺,反应12 h,经二氯甲烷和水多次萃取后,收集有机相并经旋转蒸发除去溶剂,得到的绿色固体粗产物无需纯化可直接进行下一步反应.
将上一步反应产物、93 mg(0.3 mmol)4-氰基-4-[(苯基硫代羰基)硫代]戊酸和97 mg(0.5 mmol)EDC完全溶解于2.5 mL干燥除水的二氯甲烷中,在除氧冰浴条件下,缓慢滴加0.2 mL(0.95 mmol)DIPEA,最后在室温下反应12 h;经二氯甲烷和水多次萃取后,收集有机相并通过旋转蒸发除去溶剂,再经石油醚沉降对其进行纯化,最终得到188 mg绿色固体产物TQF-CTA,产率为71%.
将60 mg(0.023 mmol)TQF-CTA,0.54 mg(0.0034 mmol)AIBN,500 mg(0.9 mmol)NIPAAm和120 mg(0.9 mmol)OEGMA溶解于2.5 mL 1,4二氧六环溶剂中,在N2气保护下,于65℃搅拌反应6 h;最后通过石油醚沉降提纯得到450 mg绿色固体TPNO,产率为63%.
1.3 TPNO的LCST温度测定
将TPNO溶于水即可制备TPNO NPs.制备2 mg/mL的TPNO NPs储备液,稀释成0.1 mg/mL,通过DLS及其配套的温控设备,监测并记录其在不同温度条件下的粒径尺寸(流体动力学直径,Dh)和代表浊度的光散射强度(Is/I0)变化.以温度为横坐标,Dh和Is/I0分别为纵坐标,绘制关系曲线,其中拐点对应的温度即代表聚合物TPNO的LCST温度.
1.4 TPNO NPs的组织穿透能力测定
将制备的TPNO NPs母液装入直径为1 mm的细管中,然后将超市购买的鸡胸肉切成不同厚度的薄片,用直尺比对鸡肉高度并覆盖于装了TPNO NPs溶液的小管上,利用近红外二区荧光成像仪对其进行测试.将检测的信号用计算机软件分析处理后,得到不同成像深度的NIR-ⅡFI图片,通过对比、分析其NIR-Ⅱ荧光强度值以评估TPNO NPs的组织穿透能力.
1.5 TPNO NPs的血管与肿瘤的高分辨NIR-ⅡFI
本文涉及的所有小动物实验均按照江苏省实验动物管理局批准的《中国国家实验动物饲养管理条例》规范进行,并获得先声生物科技有限公司动物伦理委员会批准.在尾静脉注射150μL TPNO NPs母液到4T1荷瘤裸鼠体内10 min后,利用异氟烷对小鼠进行气体麻醉,固体好身位后通过NIR-Ⅱ活体成像仪对其全身血管,尤其是腹部和后肢腿部的血管脉络进行高分辨的NIR-ⅡFI.同时还监测了不同时间点小鼠肿瘤处荧光信号的富集情况.最后,通过软件处理分析图片结果并得到相应的荧光信号强度值.荧光信号强度与背景噪音信号强度的比值(SBR)按公式SBR=Is/In计算,其中参数Is和In分别代表目标区域的荧光信号强度值和远离目标区域的正常组织,即背景的噪声信号强度值.
1.6 TPNO NPs的光热转化能力
为研究TPNO NPs的光热转化能力,将150μL 0.1 mg/mL的TPNO NPs装入200μL离心管中,用808 nm激光器以生物组织最大允许功率曝光(MPE)的强度(0.33 W/cm2)持续照射5 min,随后关闭激光器使其自然冷却,并用光热成像仪记录其温度变化,以每隔30 s的温度变化值绘制升温降温曲线.参考文献[26]方法计算得到TPNO NPs的光热转化效率(PCE).
1.7 TPNO NPs对细胞的PTT评估
利用MTT法,取2组培养好的96孔细胞板,分别加入不同浓度用不含血清的DMEM稀释的TPNO NPs溶液,将其放入培养箱中继续培养4 h;取出96孔板,吸出溶液,加入新鲜的不含血清的DMEM培养液,用808 nm激光器对其中一个96孔板做5 min光照处理.更换培养基后,让细胞自然凋亡12 h,再在每个孔中加入20μL 5 mg/mL的MTT溶液,继续培养4 h后吸出所有液体,加入200μL二甲亚砜,用酶标仪测定每个孔在490 nm处的吸收值(该吸收值大小对应细胞活性高低),分析处理数据后可评估TPNO NPs在体外对细胞PTT的疗效.
2 结果与讨论
2.1 温敏聚合物TPNO的的合成与表征
首先利用1H NMR对TQF-CTA的化学结构进行表征与确认,结果见本文支持信息图S1.随后对其光学性能进行了表征.由本文支持信息图S2可知,TQF-CTA在THF中表现出较宽的近红外吸收(600~900 nm)以及NIR-Ⅱ发射(900~1400 nm)峰形,其最大吸收与发射峰位置分别位于734 nm和988 nm.经计算得出TQF-CTA在最大吸收处的摩尔消光系数为4.8 L·g-1·cm-1,表明该小分子基链转移剂具有较好的光吸收能力(图S3,见本文支持信息).在808 nm激光辐照下,测得TQF-CTA在THF中的荧光量子效率(QY)为10.3%(图S4,见本文支持信息).以上结果表明,TQF-CTA有潜力实现明亮的NIR-ⅡFI.
以TQF-CTA为基础,通过一步简单的RAFT聚合,合成了含有温敏单体NIPAAm和亲水单体OEGAM的温敏共聚物TPNO.图S5(见本文支持信息)给出TPNO的1H NMR谱图,δ3.5和4.0附近为NIPAAm和OEGMA单体的信号,同时由图S6(见本文支持信息)的GPC数据可知,TPNO的数均分子量(Mn)和分子量分布值分别为22000和1.41,这些数据证明了聚合反应的成功进行.
2.2 TPNO NPs的制备及其温敏性能与光学性能表征
Scheme 2给出TPNO NPs的模拟组装示意图.在该LCST型温敏聚合物TPNO中,NIPAAm提供温敏特性,OEGMA提供水溶性.同时,基于对LCST型聚合物的一个普通认知,当温度低于LCST时,TPNO在纳米粒子内是溶解舒展的,有着较好的水溶性,所以表现为粒径较小、分散较为均匀的纳米粒子;而当温度高于LCST时,TPNO在纳米粒子内呈收缩状态,此时聚合物水溶性变差,聚合物疏水部分自发聚集在一起,从而表现出较大的纳米粒子粒径.
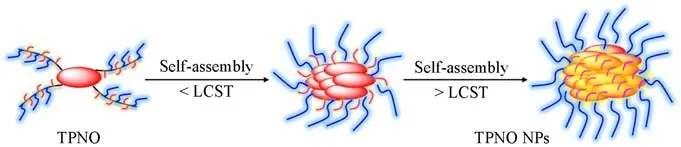
Scheme 2 Schematic illustration of the self-assembly process of TPNO NPs
为验证上述推测,首先通过DLS测定了该温敏聚合物的LCST,通过监测不同温度条件下Dh和光散射强度的变化,测得TPNO的LCST约为35℃[图1(A)].随后,研究了TPNO NPs的温敏性能对其粒径的影响.在不同温度下通过DLS对TPNO NPs的Dh进行监测.由图1(B)可见,在低于LCST温度的测试条件下,TPNO NPs的Dh和PDI分别为92 nm和0.181,而当温度高于LCST达到37℃时,其Dh和PDI值分别增大至188 nm和0.363.同样的结果在图1(C)和(D)中也可以观察到,随着温度升高至LCST以上,从TEM照片中可以观察到显著的粒径变化.这些结果都有力地证实了上述的组装推测.
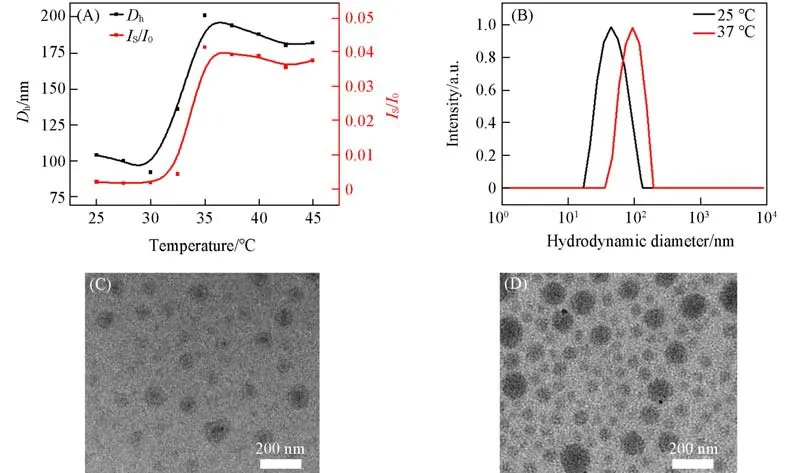
Fig.1 LCST measurement of TPNO NPs(A),D h(B)and TEM images of TPNO NPs under 25℃(C)and 37℃(D)
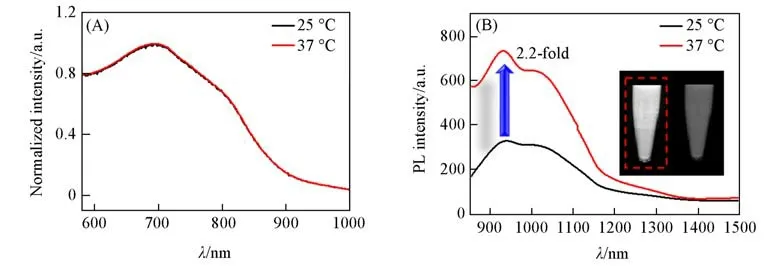
Fig.2 Normalized absorption spectra(A)and NIR-II fluorescence spectra(B)of TPNO NPs aqueous solutions at different temperatures
图2(A)示出水相中测得的不同温度下TPNO NPs的吸收光谱图.可以看出,温度对其吸收峰形的影响较小,不同温度条件下测得的吸收图谱基本一致.TPNO NPs的吸收主峰位于690 nm,相对于有机相蓝移了44 nm.图2(B)为TPNO NPs在不同温度下的荧光发射图谱.与有机相类似,TPNO NPs在水相中也有着较好的NIR-Ⅱ荧光信号,并在LCST温度以上表现出一个2.2倍高的荧光信号增强.从图2(B)插图中的NIR-Ⅱ荧光照片亦可以直观地观察到荧光亮度的变化.同时,随着温度的升高,TPNO NPs的荧光发射主峰从941 nm移动到931 nm处.该峰的蓝移也间接证明了由于NIPAAm性质的变化起到的保护作用.此时的疏水染料核被收缩的NIPAAm单体紧密包裹起来,显著降低了其染料核之间的聚集程度,从而增强了荧光强度.计算得到的TPNO NPs的QY值为1.5%(见本文支持信息图S7).图3(A)示出了对TPNO NPs的组织穿透能力的评估情况,可见TPNO NPs在鸡肉厚度增加到8 mm时仍可观察到NIR-Ⅱ荧光信号,证明其有着较好的组织穿透能力.图3(B)结果表明,在TPNO NPs浓度为0.1 mg/mL时,连续使用0.33 W/cm2的808 nm激光器对其照射30 min,TPNO NPs的温度快速从室温上升,并在30 min时达到约70℃.但此时其在808 nm处的吸收值仍基本保持不变.这些优异的光学性能使得TPNO NPs有潜力应用于后续的活体NIR-ⅡFI.

Fig.3 Fluorescence intensity of the inset NIR-II images at different depth(A)and absorption changes of TPNO NPs at 808 nm(A808)under 808 nm laser irradiation for 30 min(B)
2.3 TPNO NPs对血管与肿瘤的高分辨NIR-Ⅱ荧光成像
通过尾静脉注射150μL 2 mg/mL的TPNO NPs到4T1荷瘤鼠中以实现其对小鼠的NIR-ⅡFI,并利用NIR-Ⅱ活体成像仪实时监测其目标区域的荧光信号.由图4可以清晰观察到小鼠全身的血管脉络.对小鼠后肢腿部(蓝色虚线框)和腹部(红色虚线框)进行局部放大并分析其对应的荧光信号强度(图5和图6),可以估算出目标区域单根血管的血管宽度,分别为0.75 mm和0.45 mm,并计算得到各自对应血管处的SBR,分别为16.7与12.5.这些结果证明了TPNO NPs具有优异的体内NIR-ⅡFI能力.由图4可以看出,随着时间的延长,小鼠肿瘤处的荧光信号逐渐增强,并在12 h时达到最大.从对应的肿瘤处量化的荧光信号值变化情况(图6)也可以得出相同结论.最后,在24 h时,断颈处死小鼠后得到解剖离体的肿瘤与主要脏器以评估TPNO NPs在小鼠体内的代谢分布情况.从图7可以发现,肿瘤、肝脏与脾脏处表现出明显的NIR-Ⅱ荧光信号,证明了TPNO NPs在其中的高富集.

Fig.4 NIR-II fluorescence images of 4T1 tumor-bearing mice treated with TPNO NPs(2 mg/mL,150μL)at different monitoring time under 808 nm laser irradiation
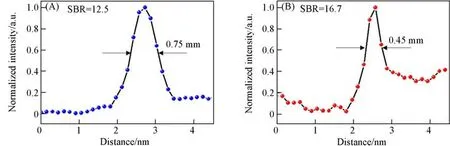
Fig.5 The corresponding cross-sectional intensity profile along the red dotted line in Fig.4 after 10 min injection

Fig.6 The corresponding quantification analysis of fluorescence intensity from tumor region

Fig.7 The ex vivo NIR-II images of tumors and major organs as well as their corresponding fluorescence intensity
2.4 TPNO NPs的体外光热性能与细胞PTT研究
鉴于TPNO NPs较好的光吸收能力以及在808 nm处较强的吸收,进一步对其光热性能进行了研究.使用808 nm激光器,以PTT最大允许功率(0.33 W/cm2)对TPNO NPs溶液(0.1 mg/mL,150μL)照射来进行升温降温实验,并通过热成像仪实时记录TPNO NPs温度值的变化.从图8(A)的温度变化曲线可以看出,TPNO NPs在5 min内可以快速升温到约65℃,该温度可有效杀伤肿瘤细胞.通过对应降温曲线的分析及线性曲线拟合,并结合文献报道的光热公式,计算得出TPNO NPs的光热转换效率为29.8%.多次反复对TPNO NPs进行激光照射与自然冷却实验[图8(B)],发现TPNO NPs有着良好的光热稳定性能.这些优异的光热性能为TPNO NPs实现理想PTT提供了可能性.
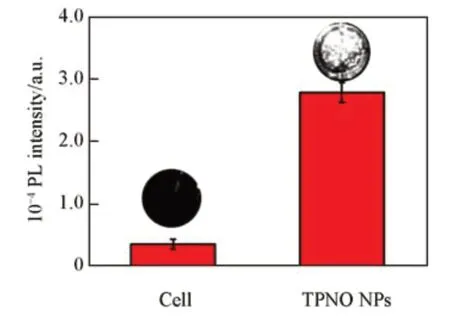
Fig.9 NIR-II fluorescence intensity of 4T1 cells incubated with TPNO NPs
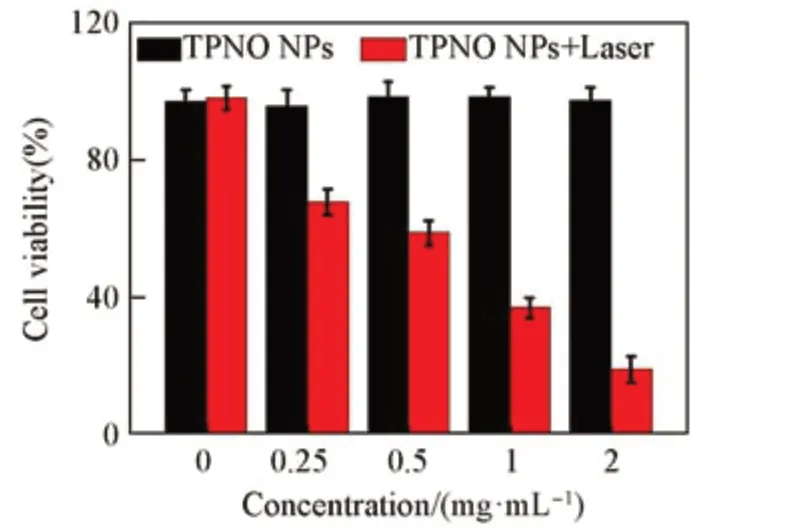
Fig.10 Cell viability of 4T1 cells treated with TPNO NPs at different concentrations without or with 808 nm laser irradiation(0.33 W/cm2)
选用4T1肿瘤细胞,通过MTT法进一步评估了TPNO NPs对体外细胞的PTT疗效.首先,通过NIR-Ⅱ荧光成像仪证明了TPNO NPs在与癌细胞共培养12 h后可以很好地被肿瘤细胞摄取,其荧光信号强度明显高于纯细胞对照组(图9).图10为通过MTT法评价的TPNO NPs的潜在细胞暗毒性与光照毒性.可见,在不同浓度的TPNO NPs与4T1细胞共培养24 h后,光照处理5 min的实验组表现出显著的细胞活性抑制效果,其细胞活性出现明显下滑状态,尤其是在TPNO NPs为2 mg/mL的高浓度下其细胞活性不足20%.而对于无光照处理的纯细胞实验组,即使在2 mg/mL的浓度下也表现出95%以上的细胞相对活性,这说明TPNO NPs未表现出明显的体外细胞毒性.图11所示共聚焦成像结果也证明了TPNO NPs在光照后产生的热可以起到一个很好的细胞杀伤效果,可以观察到细胞基本全部从绿色的活细胞变为红色的由光热诱导产生的凋亡细胞.所有这些数据均表明TPNO NPs对体外肿瘤细胞有着良好的PTT效果.
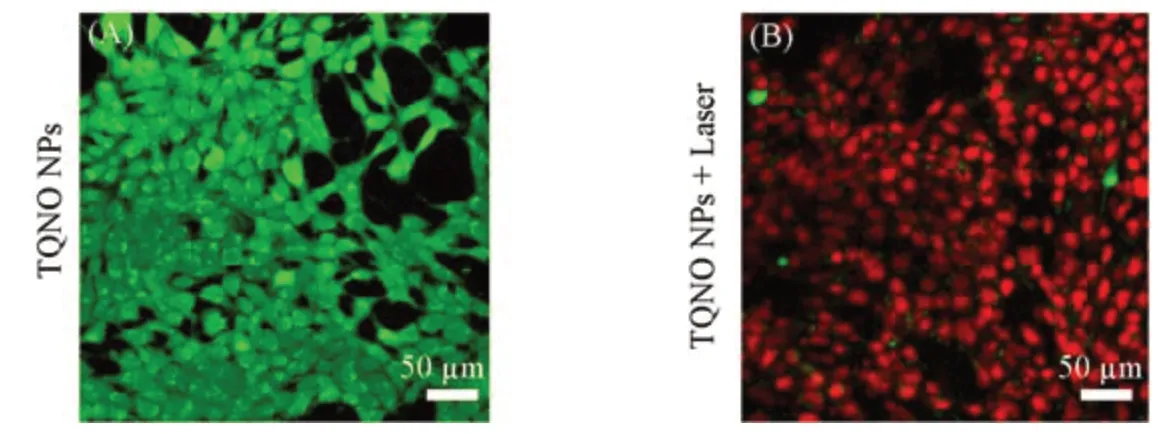
Fig.11 Fluorescence images of live(green)(A)and dead(red)cells(B)without or with 808 nm laser irradiation
3 结 论
开发了一种基于小分子TQF-CTA的温敏聚合物TPNO,该聚合物可直接溶于水形成温敏纳米粒子TPNO NPs.当温度高于LCST时,TPNO NPs表现出显著的荧光增强(2.2倍)行为,计算得到的QY为1.5%,可以实现对活体小鼠的高分辨NIR-ⅡFI.同时,TPNO NPs还具有良好的光热性能,光热转换效率为29.8%,并在体外的细胞实验中表现出对4T1肿瘤细胞的显著PTT疗效.综上所述,这种温敏的TPNO NPs在生物成像与光诊疗领域表现出潜在的应用前景.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/20220392.
