影响冠状动脉慢性完全闭塞病变正向经皮冠状动脉介入治疗结局的因素分析△
2023-01-24陈俊邦杨粤龙曹希明王慧敏杨峻青
陈俊邦,杨粤龙,曹希明,王慧敏,冉 鹏,杨峻青,李 光,刘 辉
[1.南方医科大学第二临床医学院,广州 510000;2.广东省人民医院(广东省医学科学院)放射科,广州 510080;3.广东省心血管病研究所广东省人民医院(广东省医学科学院)心内科,广州 510080]
冠状动脉慢性完全闭塞病变(chronic total oc⁃clusion,CTO)能在20%的冠状动脉血管造影(cor⁃onary angiography,CAG)案例中发现[1],经皮冠状动脉介入(percutaneous transluminal coronary inter⁃vention,PCI)治疗的成功实施能改善患者的症状,提升生活质量[2-6],避免冠状动脉旁路移植术(cor⁃onary artery bypass grafting,CABG)[7-8],并可改善疾病预后[9-12]。随着影像技术的发展、介入材料的改进以及对CTO 病变认识的不断更新,CTO-PCI治疗技术亦发展迅速,可分为正向PCI 及逆向PCI治疗。与逆向技术相比,正向技术材料准备容易,学习曲线短,X 线曝光时间短和手术时间短及使用对比剂量少[13],是大多数CTO 开通的首选。在既往研究中,正向策略相关评分[14-20]总结了影响闭塞段正向介入治疗结局的临床及病变影像学特征,旨在区分CTO 正向开通的难度,预测手术成功率。但常用的正向CTO 评分系统[14-20]多局限于临床资料及病变的CAG 图像特征,很少结合冠状动脉计算机断层扫描(computed tomography,CT)血管成像(coronary computed tomography angiography,CCTA)图像特征或者仅局限于CCTA 图像特征,忽视了CAG 图像特征;而且其研究终点多为30 min内导丝成功通过,导致临床验证时预测效果不稳定。目前对正向CTO-PCI 治疗失败的因素分析尚不完善,本研究探讨影响CTO 患者正向PCI 治疗结局的临床特点、CCTA 及CAG 图像特征,以进一步明确导致闭塞段正向开通失败的影响因素。
1 资料和方法
1.1 研究对象
本研究是单中心、回顾性病例对照研究。回顾性分析南方医科大学第二临床医学院2011 年9月22 日至2018 年8 月8 日期间患者的临床资料。入选标准:(1)CAG 结果提示病变完全闭塞;(2)行CCTA 后30 d 内接受正向PCI 治疗;(3)PCI 治疗部位与闭塞部位一致。排除标准:(1)3 个月内曾有相应部位的心肌梗死;(2)图像缺失或者图像无法判定;(3)闭塞血管曾经接受CABG 治疗;(4)闭塞段曾经接受支架植入术。所有行CTO-PCI 治疗操作的病变均视为独立研究对象。共有564 例次患者同时在本院行CCTA 与PCI 治疗,在CCTA 检查后30 d 内行PCI 治疗为264 例次,CAG 证实为PCI 治疗部位100%闭塞后为167 例,排除3 个月内曾有相应部位的心肌梗死者、图像缺失或者图像无法判定、闭塞血管曾经接受CABG 治疗、闭塞段曾经接受支架植入术、施行逆向PCI 治疗技术、临床资料不完整后,最终共纳入CTO 病变患者108例,其中男88 例(81.5%),年龄(61.6±10.6)岁,其中有8 例患者同时存在2 支CTO 病变,每支CTO 病变血管单独进行分析,病变血管总数为116 支。本研究通过了广东省人民医院伦理审查委员会审批[批号:No.GDREC2017198H(R1)]。所有研究对象均已签署知情同意书。
1.2 检查方法
1.2.1 冠状动脉计算机断层扫描血管成像检查方法 本研究中使用的CT 扫描仪及高压注射器分别为飞利浦Brilliance iCT/BolusPro 高压注射器和德国西门子Somatom Definition Flash 双源CT/Ulirich 双筒高压注射器。患者连接心电监测仪,仰卧位,屏气,扫描序列为前瞻性心电门控,选用对比剂自动跟踪触发技术,由头往足扫描。范围为气管分叉下1 cm 至左膈顶水平以下2 cm,扫描由具有5 年以上工作经验的影像科技师完成。所有图像传至工作站(Extended Brilliance Workspace/Siemens Syngovia)进行后处理。两位有经验的放射科医师判断成像质量后筛选最佳图像,通过曲面重组、多平面重建、三维容积再现和最大密度投影等后处理技术图像及原始横截面图像独立完成分析及测量。评价指标包括入口形态、闭塞段病变直径、CTO 病变近端与远端直径、负性重构、闭塞段长度、闭塞段内线样强化、钙化病变横截面积大于50%及远端血管是否可见等8 类指标。当对CTO 的评测结果出现争议时,经讨论后做出判断。
1.2.2 冠状动脉血管造影及经皮冠状动脉介入治疗方法 术者术前认真阅读CTA 图像,采用标准Judkins 法完成造影,充分显示靶血管及闭塞病变情况,CAG 图像特征测量分析、治疗策略及手术实施均由PCI 治疗经验10 年以上的心血管内科医师完成。手术终止时间由术者自行决定。评价内容包括病变累及的血管、入口附近边支、闭塞段残端入口形态、闭塞段迂曲、是否存在钙化、侧支循环灌注分级等6 个指标。
1.2.3 相关研究指标定义 正向PCI 治疗成功定义为以导丝正向通过病变同时术后远端冠状动脉血流心肌梗死溶栓治疗试验(thrombolysis in myocardial infarction,TIMI)Ⅲ级,残余狭窄不超过20%,患者症状缓解,住院期间未发生包括穿孔、急性心肌梗死和心源性死亡等并发症[21]。正向PCI 治疗失败定义为导丝未能正向通过闭塞病变,或出现上述并发症。CCTA 评估指标定义:闭塞残端入口形态分为锥形和非锥形。闭塞段、闭塞病变近端及远端直径测量均选择与血管长轴垂直的最小径线。负性重构[22]定义为靶病变血管外膜直径/参考段平均血管外膜直径小于0.95。闭塞段长度[20]定义为近端对比剂充盈消失位置到远端对比剂充盈位置之间的最短距离,测量闭塞段长度使用正向短缩最少及两个以上互相垂直的体位。闭塞段内线样强化[23]定义为闭塞段内存在细线样的对比剂充盈影像。钙化病变横截面大于50%[24]定义为闭塞段内钙化(CT 值>130 HU)最严重处钙化横截面积大于管腔面积50%。CAG 评估指标定义:入口附近边支[25]被定义为在入口附近3 mm 范围内的边支。入口形态定义同CCTA。闭塞段迂曲[20]定义为闭塞血管在任一造影体位中存在>45°的成角。侧支循环分级水平采用Rentrop 分级方法评价。
1.2.4 临床基线资料 纳入CTO-PCI 治疗前患者的临床资料,包括年龄、性别、吸烟史、原发性高血压(高血压)病史、糖尿病史、高脂血症、既往同一闭塞段的PCI 治疗病史、肌酐、三酰甘油(triacylg⁃lycerol,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein choles⁃terol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、糖化血红蛋白(glycosylated hemoglobin,HbA1C)、血红蛋白(he⁃moglobin,Hgb)等。
1.3 统计学分析
应用SPSS 22.0 软件进行数据分析。对于缺失值的处理,采用均值插补。数据先行正态性检验及方差齐性检验,服从正态分布的连续变量采用()表示,组间比较采用独立样本t检验。分类变量采用[n(%)]表示,无序变量组间比较采用卡方(χ2)检验或者Fisher确切概率法,有序变量组间比较使用非参数秩和检验。绘制受试者工作特征曲线(receiver operating characteristic curve,ROC),利用约登指数寻找预测CTO-PCI 治疗失败的闭塞段直径最佳临界值。纳入上述分析中P<0.05 的变量进行二元Logistic 回归分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者基线资料比较
本研究最终共纳入CTO 病变患者108 例,其中8 例患者同时存在2 支不同血管的CTO 病变,每处病变单独进行分析,CTO 病变总数为116 处。其中男性93 例(80.2%),年龄(61.3±10.7)岁。PCI与CTA 检查相隔(10.5±6.2)d。正向成功开通81 处(69.8%)。根据正向PCI 治疗结局分为正向PCI 治疗失败组与正向PCI 成功组。两组患者临床基线资料比较,差异均无统计学意义(均P>0.05),详见表1。
表1 两组患者基线资料比较 [n(%),±s]

表1 两组患者基线资料比较 [n(%),±s]
注:该表的数据统计分析按照所有行CTO-PCI 治疗的病变均视为独立研究对象进行
2.2 冠状动脉计算机断层扫描血管成像及冠状动脉血管造影图像特征比较
116处病变累及血管中左前降支50处占43.1%,左回旋支19处占16.4%,右冠状动脉47处占40.5%。
闭塞段CCTA 图像特征中:入口形态、病变近端直径、病变远端直径、闭塞段长度、闭塞段内线样强化、钙化病变横截面积大于50%、远端血管是否可见等特征两组比较,差异无统计学意义(P>0.05);而闭塞病变直径、负性重构两个特征在正向PCI 失败组与成功组间差异有统计学意义(P<0.05),详见表2。
表2 两组患者闭塞段CCTA 图像特征比较 [n(%),±s]

表2 两组患者闭塞段CCTA 图像特征比较 [n(%),±s]
CAG 图像特征中:入口附近边支、入口形态、有无钙化、侧支循环灌注分级等特征在正向PCI治疗失败组与成功组中比较,差异无统计学意义(P>0.05);而非左前降支、闭塞段迂曲两个特征比较,差异具有统计学意义(P<0.05),详见表3。
表3 两组患者闭塞段CAG 图像特征比较 [n(%),±s]
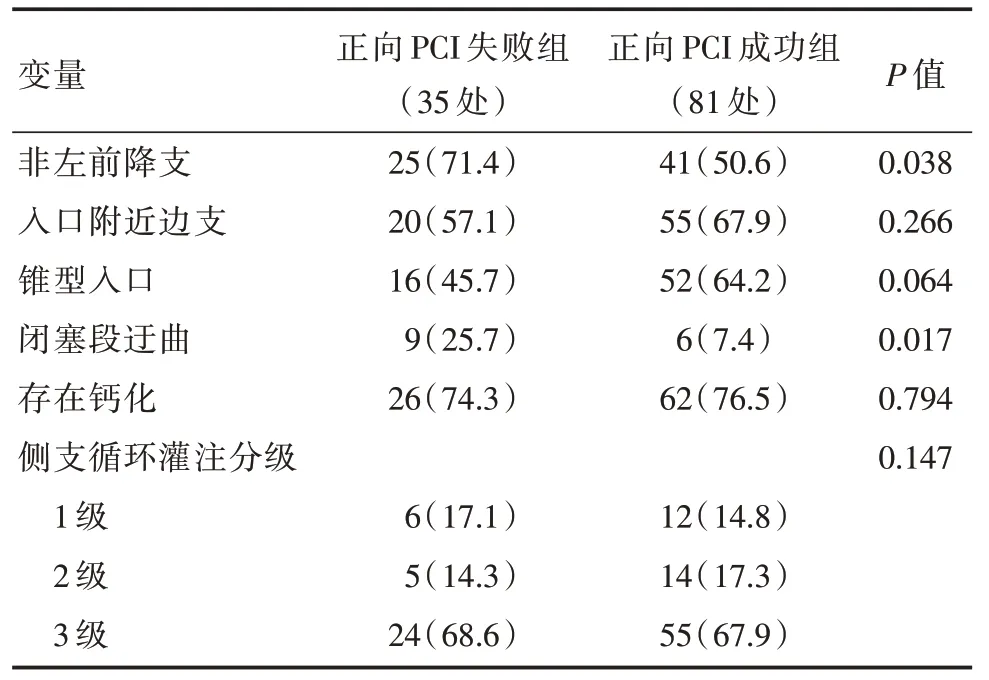
表3 两组患者闭塞段CAG 图像特征比较 [n(%),±s]
2.3 确定连续变量界值点
在单因素分析得出的有统计学意义的特征中,唯有闭塞段直径为连续型变量。ROC 分析结果显示,闭塞段直径临界值为2.95 mm 时,约登指数最大,预测正向PCI 治疗失败的灵敏度和特异度分别为74.3%,71.6%,ROC 曲线下面积(AUC)为0.736(见图1)。
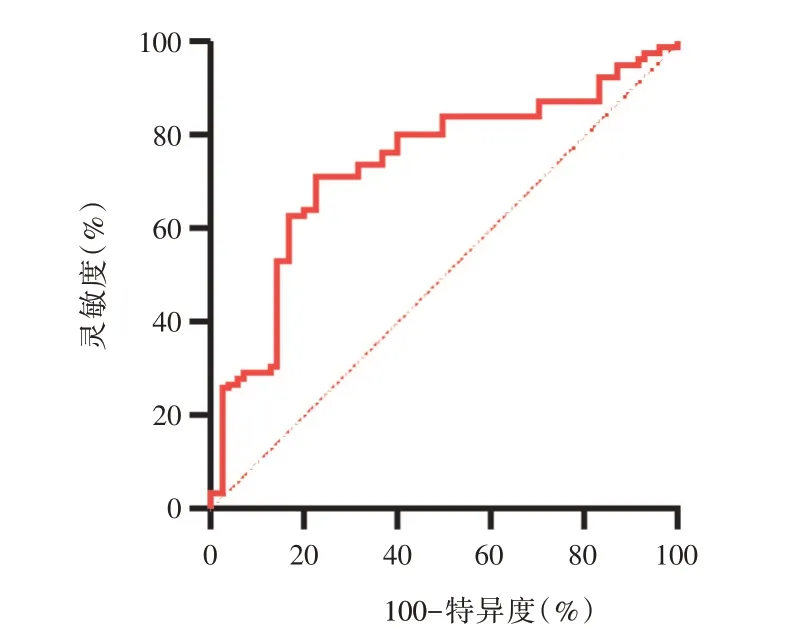
图1 闭塞段直径对正向PCI 治疗失败预测的ROC 图
2.4 多因素二元Logistic 回归分析
将上述差异有统计学意义的变量纳入二元Logistic回归分析,结果显示闭塞段直径小于2.95 mm(OR=9.129,95%CI:3.102~26.863,P<0.001)、非左前降支(OR=2.807,95%CI:1.033~7.632,P=0.043)、闭塞段迂曲(OR=5.021,95%CI:1.350~18.674,P=0.016)为正向CTO-PCI 治疗失败的独立预测因子,详见表4。
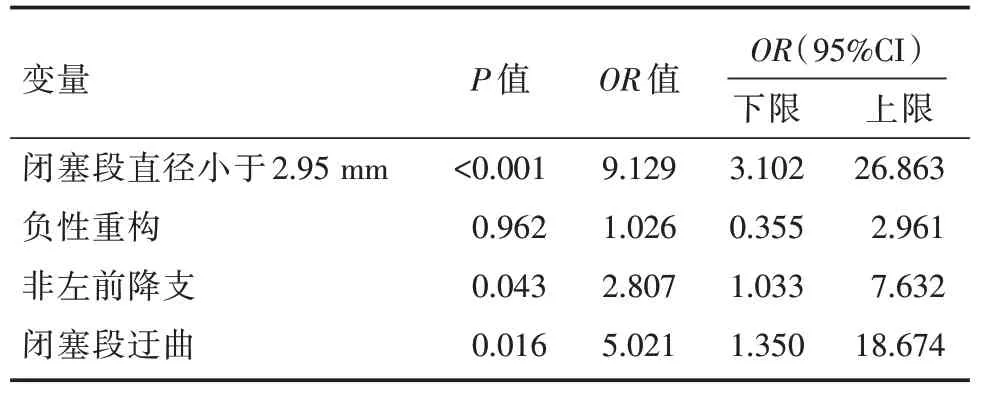
表4 二元Logistic 回归分析结果
2.5 不同危险因素组合后正向经皮冠状动脉介入治疗的成功率
将不同危险因素组合发现,随着危险因素的增加,手术成功率明显降低,详见表5。

表5 不同危险因素组合后正向PCI 治疗成功率
3 讨论
CTO-PCI 治疗难度大、成功率低、并发症率高,被称为冠状动脉PCI 治疗的最后“堡垒”[26]。术前准确预测正向CTO-PCI 治疗结局有助于精准选择最佳治疗策略。本研究通过综合评估患者临床资料、CCTA 及CAG 图像特征发现,闭塞段直径小于2.95 mm、非左前降支以及闭塞段迂曲是正向CTO-PCI 治疗失败的独立预测因子。当CTO 病变不存在上述3 个因素时,前向CTO-PCI 治疗的成功率为96.4%;仅有1 个危险因素,前向CTO-PCI治疗的成功率为78.0%;存在2 个因素时,成功率为41.2%,3 个危险因素均存在时,手术成功率为25.0%。
闭塞段直径小于2.95 mm 是预测PCI 治疗失败的独立预测因子。CTO 多起源于急性冠状动脉综合征,闭塞段大多由血栓和动脉粥样硬化性斑块组成;随着病程发展,病灶内疏松的富含胆固醇酯质的斑块逐渐被质硬的纤维组织所替代,纤维组织越多,管径越小。同时,导丝前行时容易偏向阻力小的方向,在致密坚硬的纤维组织的阻碍下,导丝难以穿过闭塞段且容易进入内膜下,加大PCI治疗的难度和风险。
本研究中CTO 的负性重构在PCI 治疗失败组(42.9%)明显高于成功组(23.5%),同样,在KCCT评分研究[27]中,负性重构在PCI 治疗失败组(25%)比成功组(17%)多,但两组间比较,差异无统计学意义(P>0.05)。而在Ehara 等[28]的研究中,失败组的负性重构(29%)明显高于成功组(4%),并证实负性重构是导丝不能通过闭塞部位的重要预测因素;在一个CTA 与CAG 相结合的评分研究[29]中,负性重构在PCI 治疗失败组(50%)明显比成功组(1%)更多;并证实负性重构是正向CTO-PCI 治疗失败最强的独立预测因子(OR=137.82)。本研究中二元Logistic 回归分析结果表明其并非正向CTO-PCI 治疗失败的独立预测因子。考虑原因可能为:(1)负性重构患者,通过术前CCTA 预判,转为其他治疗方案;(2)负性重构不能反映闭塞段纤维化程度。
在PROGRESS CTO 研究[30]中,左回旋支CTO病变与PCI 治疗失败相关;在CL 评分[20]中,非左前降支CTO 病变是与手术失败明显相关的独立危险因素之一,本研究结果也证实,非左前降支是正向CTO-PCI 失败的独立预测因子。与左前降支相比,左回旋支及右侧冠状动脉血管路径迂曲,行PCI 操作时,血管迂曲会导致导管同轴性下降,降低了支撑力;同时迂曲的路径也分解了导丝前进的力量,使导丝通过病变的难度增大;另外,经过迂曲的路径,球囊、支架前向力也下降。
本研究结果证实闭塞段迂曲是正向CTO-PCI治疗失败的独立预测因子,这一点在J-CTO[14]、CT-J-CTO[15-16]及W-CTO[19]评分系统中也得到证实。原因考虑包括:(1)闭塞段迂曲,使得导丝穿过坚硬的纤维帽后,容易进入内膜下,难以到达远端真腔,从而明显增加手术难度;另外,导丝在内膜下返回真腔往往需要结合逆向导丝的技术;(2)导丝经过迂曲的闭塞段后,与闭塞段同轴性下降,前向力被按平行四边形法分解,导丝穿透力下降,难以穿过病变;(3)血管迂曲可增加球囊扩张难度及夹层风险。
闭塞段的钙化情况、入口形态、病变长度等特征,在CL 评分[20]、J-CTO 评分[14]、CT-J-CTO[15-16]及W-CTO[19]研究中均为重要的影响因素。但是在本研究中,未发现其对PCI 治疗结果产生明显影响。可能原因考虑:(1)因为术前CCTA 能呈现病灶的横截面、立体空间结构,有助于准确发现血管重要解剖特征,对于初步预测单纯行正向PCI 治疗成功率不高的部分患者转向其他治疗方案,导致研究资料数值偏差;(2)CCTA 能找出最佳体位投射角度,与术中CAG 匹配,可指导术者选择导丝走行最佳路径[15-16];同时随着CTO 专用材料的普及,以及术者技能的增加,操控导丝避开难点更容易顺利通过病变[31]。
特殊病变位置如分叉病变、开口病变在既往部分研究[29]中也被认为是影响手术成功的重要因素。但因技术水平迥异、治疗策略不一以及选择材料不同,其在不同研究中的结果存在争议。本研究中,发现闭塞位置对闭塞段的成功开通并无显著影响,考虑可能与术前CCTA 的预判、材料充分和技术成熟有关。
除此之外,年龄>75 岁[32]、心肌梗死病史[20]、既往CABG 病史[20]、既往同一闭塞段PCI 失败史[14]也作为影响因素被纳入在部分研究中。虽然在本研究中差异无统计学意义,但是在临床实践中,有必要对拟行CTO-PCI 患者的既往病史与临床特点进行综合评价。
本研究中创新性包括以下几方面内容:首先,研究终点为导丝正向通过闭塞段,相对某些评分系统30 min 通过闭塞段的研究终点,更接近临床实践需要;其次,研究终点将正向PCI 治疗失败转为逆向PCI 治疗成功患者纳入正向PCI 治疗失败组,相对其他评分系统,只单纯评估导致正向PCI治疗失败的影响因素,更能准确反映影响正向CTO-PCI 治疗失败的独立预测因子,对判断PCI治疗中正逆向技术的转换时机有重要意义;再者,CCTA 为PCI 治疗前1 个月内,更能反映CTO 病变近期的状态;最后,CCTA 作为目前临床应用广泛的非侵入性检查,部分患者根据CCTA 结果转向其他治疗方案,更符合真实世界。
本研究局限性包括以下几方面内容:首先,本研究是单中心研究,会存在样本选择性偏倚;其次,本研究为回顾性研究,仅关注正向PCI 治疗结局,而PCI 治疗中对正向PCI 及逆向PCI 的选择条件没有具体界定。
本研究结果显示CTO 病变直径小于2.95 mm、非左前降支以及闭塞段迂曲是正向CTO-PCI 治疗失败的独立预测因子。当闭塞段存在2 个以上因素时,建议尽早尝试逆向PCI 治疗;若不存在相关条件,建议转介至经验丰富的心血管中心。
