1-磷酸鞘氨醇、1-磷酸鞘氨醇受体2在急性主动脉夹层患者外周血中的表达及其与预后的关系
2023-01-24王期峰
王期峰,路 霖
(青海省心脑血管病专科医院心外科,西宁 810000)
急性主动脉夹层(acute aortic dissection,AAD)是临床较为常见的心血管急危重症,其起病急、病情凶险、进展快、预后差,严重威胁患者生命安全[1]。目前,AAD 发病机制尚未完全解释清楚,但学者认为其发病与外伤、免疫调节、原发性高血压(高血压)、动脉粥样硬化、血管发生、血管炎症反应等密切相关[2-3]。有关报道显示,1-磷酸鞘氨醇(sphingosine 1-phosphate,S1P)是一种具有多效性的脂质分子,其可能在动脉粥样硬化发病过程中起重要作用,S1P 可能是减轻动脉粥样硬化疾病的新靶标[4]。另外,1-磷酸鞘氨醇受体2(sphingo⁃sine-1-phosphate receptor 2,S1PR2)属于G 蛋白耦联受体家族成员之一,其在冠状动脉粥样硬化性心脏病(冠心病)患者血清中表达失调,S1PR2 通过微小RNA-126 负调控,进而在冠状动脉粥样硬化进展中发挥重要作用[5]。但S1P、S1PR2 在AAD中的表达及其与预后的关系尚未发现有关报道,基于此,本研究通过检测AAD 患者外周血单个核细胞(peripheral blood mononuclear cells,PBMC)中S1P、S1PR2 表达,分析其与预后的相关性,以期为临床诊断、评估AAD患者预后提供一定参考价值。
1 资料与方法
1.1 一般资料
选取2015 年1 月至2018 年1 月青海省心脑血管病专科医院收治的AAD 患者85 例进行研究,称AAD组,其中男57例,女28例;年龄(47.85±6.97)岁。并选取同时间段内本院体检健康者85 名进行对照研究,称对照组,其中男53 例,女32 例;年龄为(48.32±7.89)岁。两组性别比例、年龄比较,差异无统计学意义(P>0.05),具有可比性。
诊断标准:参考《2014 年欧洲心脏病学会主动脉疾病诊治指南解读》相关AAD 判定标准进行诊断[6]。纳入标准:(1)患者均符合AAD 有关诊断标准,均结合患者临床体征、症状、磁共振成像等影像学确诊;(2)入院前无视听障碍、无精神系统疾病,意识清楚,无沟通障碍者;(3)患者病理检查资料齐全、可靠;(4)无严重脏器、肢体缺血症状者。排除标准:(1)合并急、慢性感染或炎症性风湿病、自身免疫性疾病的患者;(2)入院前3 个月内服用免疫抑制剂、非甾体抗炎药的患者;(3)合并结缔组织疾病、恶性肿瘤的患者;(4)合并肝及肾功能不全的患者;(5)近半年内行外科手术、创伤者。
患者预后情况:本组85 例AAD 患者均进行深低温停循环+单侧或双侧脑灌注技术的手术治疗,2 d 内共死亡29 例,存活56 例,存活定义为预后良好,死亡定义为预后不良。
所有患者及其家属对本研究均知情同意,并签署知情同意书,本研究符合《赫尔辛基宣言》,报经本院伦理委员会审核、批准后实施。
1.2 主要试剂与仪器
Ficoll 淋巴细胞分离液(货号:P8900)购买于上海恒斐生物科技有限公司;Trizol Reagent(货号:15596-026)购买于上海联硕生物科技有限公司,PrimeScript RT Master Mix(货号:RR036A)购买于广州威佳科技有限公司,SYBR Green PCR Mas⁃ter Mix(货号:YDM6206)购买于上海羽朵生物科技有限公司。
紫外分光光度计(型号:DU-730)购买于上海普迪生物技术有限公司,qRT-PCR 仪(型号:LightCycler®480II)购自罗氏诊断产品(上海)有限公司。
1.3 样本收集
收集所有受试者于晨起空腹状态下外周静脉血4 mL,置于含有肝素抗凝管中,采用Ficoll-Hypaque密度梯度离心法分离各样本PBMC,于-80℃冰箱中保存,用于检测S1P、S1PR2、基质金属蛋白酶-9(matrix metalloproteinase 9,MMP-9)表达。
1.4 qRT-PCR法检测PBMC中S1P、S1PR2、MMP-9表达
于-20 ℃冰箱中取出PBMC 样本,冰上溶解,依照TRIzol 试剂盒说明书添加TRIzol 裂解液,从PBMC 样本中提取总RNA。采用紫外分光光度计测定抽提RNA 样本在260 nm、280 nm 波长处的吸光度(Absorbance,A),并以抽提RNA 样本A260/A280比值在1.8~2.1 之间为合格检测样本,继续下一步操作。以2 μL 总RNA 为模板,按照PrimeScript RT Master Mix 说明书进行反转录,得cDNA。参考SYBR Green PCR Master Mix 说明书配制扩增反应体系,将cDNA 扩增、检测。S1P、S1PR2、MMP-9 及内参GAPDH 引物序列见表1。以2-ΔΔCT法计算S1P、S1PR2、MMP-9 相对表达。

表1 S1P、S1PR2、MMP⁃9 及内参GAPDH 的引物序列
1.5 统计学分析
本组所得实验数据均利用SPSS 25.0 软件进行统计学分析。经正态性检验,计量数据均符合正态分布,以()的形式表示,组间数据比较,进行独立样本t检验。计数资料以[n(%)]表示,组间数据比较,采用卡方(χ2)检验。以Pearson 相关性分析法分析AAD 患者PBMC 中S1P、S1PR2 表达与MMP-9 的相关性。以Logistic 回归分析法分析AAD 预后的影响因素:以AAD 预后是否良好(预后良好=0,预后不良=1)为因变量,以冠心病(否=0,是=1)、S1P(连续变量)、S1PR2(连续变量)、MMP-9(连续变量)为自变量。采用受试者工作特征曲线(receiver operating characteristic curve,ROC)评估PBMC 中S1P、S1PR2、MMP-9 表达对AAD 患者预后的的诊断效能。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组受试者PBMC 中S1P、S1PR2、MMP-9 表达比较
与对照组相比,AAD 组患者PBMC 中S1P 表达明显降低,S1PR2、MMP-9 表达明显升高,差异有统计学意义(P<0.05),详见表2。
表2 两组受试者PBMC中S1P、S1PR2、MMP-9表达比较 [n=85,±s]

表2 两组受试者PBMC中S1P、S1PR2、MMP-9表达比较 [n=85,±s]
2.2 AAD 患者PBMC 中S1P、S1PR2 表达与MMP-9的相关性
Pearson 相关性分析结果显示,AAD 患者PBMC中S1P 表达与MMP-9 均呈负相关(r=-0.477,P<0.05),S1PR2 表达与MMP-9 呈正相关(r=0.487,P<0.05),详见图1、2。

图1 AAD 患者PBMC 中S1P 表达与MMP-9 的相关性散点图

图2 AAD 患者PBMC 中S1PR2 表达与MMP⁃9 的相关性散点图
2.3 两组不同预后AAD 患者临床资料及PBMC中S1P、S1PR2、MMP-9 表达比较
与存活组相比,死亡组AAD 患者冠心病比例、S1PR2、MMP-9 表达均显著升高,S1P 表达明显降低,差异有统计学意义(P<0.05),详见表3。
表3 两组不同预后AAD 患者临床资料及PBMC 中S1P、S1PR2、MMP-9 表达比较 [n(%),±s]
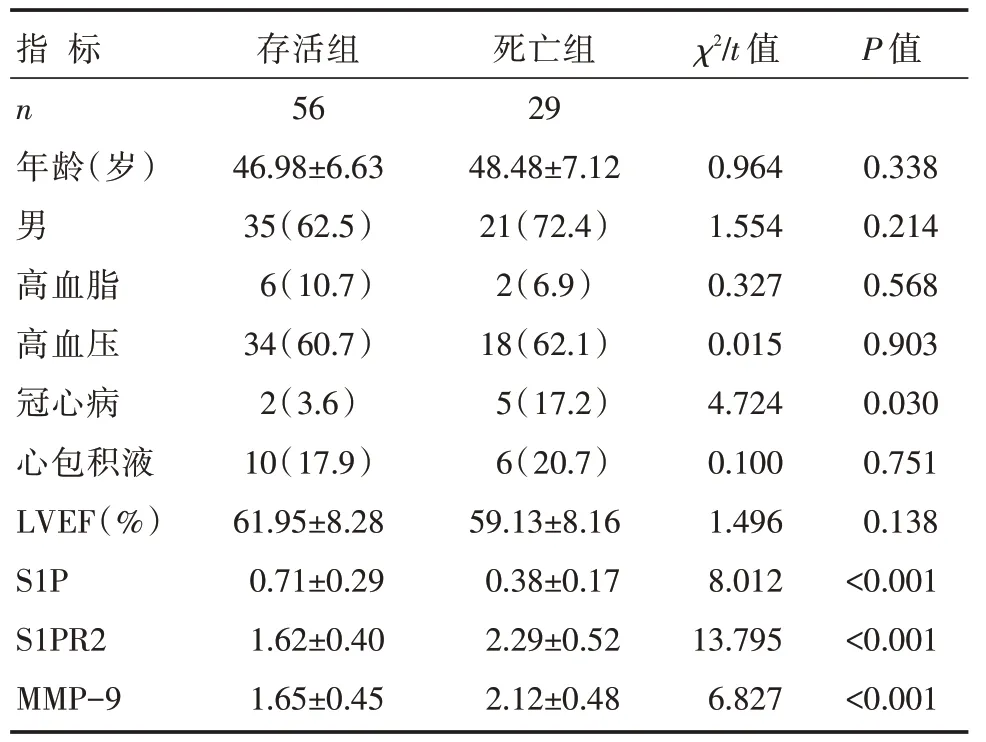
表3 两组不同预后AAD 患者临床资料及PBMC 中S1P、S1PR2、MMP-9 表达比较 [n(%),±s]
2.4 Logistic 回归分析分析主动脉夹层患者预后的影响因素
以AAD 预后是否良好为因变量,以冠心病、S1P、S1PR2、MMP-9 表达为自变量,行Logistic 回归分析,结果显示,S1PR2、MMP-9 为AAD 预后的危险因素(均P<0.05),S1P 为AAD 预后的保护因素(P<0.05),详见表4。

表4 影响AAD 患者预后的Logistic 回归分析
2.5 PBMC 中S1P、S1PR2、MMP-9 表达对AAD 患者预后的评估价值
ROC 分析结果显示,PBMC 中的S1P、S1PR2表达预测AAD 不良预后的曲线下面积(area undercurve,AUC)分别为0.866、0.875,两者诊断价值高于MMP-9,血清S1P、S1PR2 联合预测AAD 不良预后的AUC(0.927),其灵敏度、特异度分别为90.6%、83.5%,详见表5、图3。
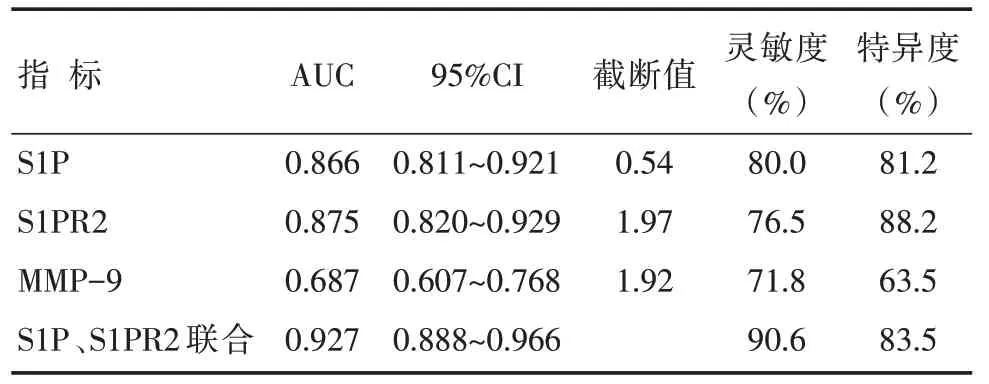
表5 各项指标对AAD 不良预后的诊断效能
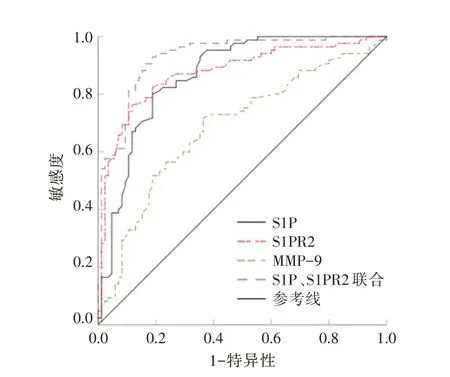
图3 PBMC 中S1P、S1PR2、MMP-9 表达对AAD 患者预后的ROC 图
3 讨论
AAD 主要是由主动脉破裂引起的心血管疾病,以主动脉中层弹力纤维变性断裂、平滑肌坏死为病理基础,以急性胸痛为主要临床症状,可导致死亡[7-8]。目前,临床多采用影像学诊断AAD,但影像学诊断费用较高,且搬动患者过程中易使动脉瘤破裂,造成严重后果。因此,寻找可有效诊断AAD、评估患者预后的生物标志物,对改善AAD患者生存质量有一定积极意义。
S1P 是一种膜磷脂类代谢产物,可通过与细胞表面的S1PR2 等受体作用,进而参与免疫调节、心肌缺血再灌注损伤、血管舒张、血管生成及内皮保护等生物学过程[9-10]。近期研究显示,S1P 通过与特异性G 蛋白偶联受体结合介导心脏炎症等反应,其可能是治疗缺血再灌注损伤及冠心病的潜在靶标[11]。此外,Kitano 等[12]研究认为S1P 可调节血管平滑肌细胞增殖及迁移,进而引起血管重建,造成动脉粥样硬化和再狭窄,且S1P 信号通路在血管损伤后的新内膜增生中起重要作用。以上研究表明,S1P 表达异常可能与血管异常疾病关系密切。本研究中AAD 组患者PBMC 中S1P 表达明显低于对照组,提示S1P 可能在AAD 病理进展中具有重要作用,推测低水平S1P 可能通过与其受体相结合,进而调节血管炎症反应、血管新生,从而促进AAD 发展。S1PR2 在调节血管舒张度、血管通透性等方面起重要作用,S1PR2 可通过影响血管平滑肌细胞迁移功能、血管内皮细胞屏障通透性及血管发生、发育等过程,进而影响血管稳态,促进炎症反应,从而影响心血管系统疾病进程[13]。既往研究认为,S1PR2 在动脉粥样硬化内皮病变中浓度显著升高,其可通过影响信号传导进而影响内皮炎症反应,从而在心血管疾病发生、发展中发挥重要作用[14]。本研究中AAD 组患者PBMC 中S1PR2 表达明显高于对照组,提示S1PR2表达异常可能与AAD 病变过程有关,究其原因,高浓度S1PR2 可能通过影响血管稳态,促进血管炎症反应,从而在AAD 发展中发挥促进作用。
MMP-9 是造成主动脉中层弹力纤维变性、平滑肌坏死的重要酶类之一,其在AAD 患者血清中浓度显著上升,具有诊断AAD、评估患者预后的潜在价值[15]。本研究中AAD 患者PBMC 中MMP-9表达显著上调,与孟少志等[15]研究一致,提示MMP-9 可能在AAD 疾病进展中起重要作用,推测高浓度MMP-9 可引起主动脉弹力蛋白及胶原纤维降解,导致血管壁薄弱,进而造成主动脉持续扩张至破裂,促进AAD 病情发展。本研究显示,AAD 患者PBMC 中S1P 表达与MMP-9 均呈负相关,S1PR2 表达与MMP-9 呈正相关,提示S1P、S1PR2 可能与MMP-9 相互作用,进而影响AAD 发展,但具体作用机制有待深入探究。
本研究中死亡组AAD 患者冠心病比例、S1PR2、MMP-9 表达均显著高于存活组,S1P 表达明显低于存活组,提示冠心病、S1P、S1PR2、MMP-9 均可能影响AAD 患者预后情况。进一步研究显示,S1PR2、MMP-9 为AAD 预后的危险因素,S1P为AAD 预后的保护因素,提示PBMC 中S1P 表达浓度、S1PR2、MMP-9 浓度升高均可能会增加AAD患者发生不良预后的风险,早期监控S1P、S1PR2、MMP-9 浓度,有利于改善AAD 患者预后情况。研究发现,PBMC 中S1P、S1PR2 浓度预测AAD 不良预后的AUC 分别为0.866、0.875,当S1P 相对表达量<0.54 或S1PR2>1.97 时,AAD 患者发生不良预后的风险较高,提示S1P、S1PR2对AAD不良预后有一定的评估价值,且两者诊断价值高于MMP-9;S1P、S1PR2 联合预测AAD 不良预后的AUC 为0.927,其灵敏度90.6%,特异度为83.5%,提示S1P、S1PR2联合诊断AAD 不良预后的灵敏度高于单独诊断,两者联合可提高AAD 不良预后的预测价值。
综上所述,AAD 患者S1P 表达降低,S1PR2 表达升高,两者可能与AAD 发病过程相关,两者联合可有效提高对AAD 不良预后的预测价值,可更好地评估AAD 患者预后情况。但本研究未深入探讨S1P、S1PR2 在AAD 发病中的机制,后期将增加样本量进行研究。
