高效“物理化学”课堂的构建
——以“水的相图”教学为例
2023-01-19胡娅琪杨莉宁余丽丽
胡娅琪 秦 蓓 杨莉宁 余丽丽
(西安医学院 药学院,陕西 西安 710021)
相平衡是热力学在相变化过程中的重要应用之一。研究有关多相系统的相平衡在化学、化工的科研和生产中有重要的意义[1],比如溶解、蒸馏、结晶、萃取、提纯、分离、合金制备、金属冶炼、化工产品生产等方面均要用到相平衡的知识。相平衡不仅仅与工业过程息息相关,与我们的日常生活也关系密切,因此相平衡是“物理化学”课程的重要章节。相较于热力学的教学内容,相平衡这一章虽然涉及的基本概念和公式少,推导过程简单易懂,但是由于缺乏一定的基础知识,很多学生在相平衡的学习过程中仍感觉困难,教师也感到有一定的教学难度。主要包括:(1)在基本概念(物种数、组分数、自由度等)的理解上由于涉及多个组分(单、双、三组分)、多个相态(气、液、固)和多个变量参数(如温度、压力、组成),造成知识点较为零散,学生经常出现混淆,造成对基本概念的理解出现了偏差。(2)重要内容抽象难懂,如相律和杠杆规则应用性强且多变,涉及的都是一些很实际的过程,比如蒸馏、结晶等,学生很难将实验过程与理论联系起来且做到举一反三。(3)相图作为相平衡的核心内容,图形复杂多样,最基本的相图掌握不到位,后续会造成对复杂相图理解的严重偏差。如何将这些抽象且多样的理论化作易于理解的直观实际应用,或者如何将实际应用与抽象的理论紧密联系,是相平衡的教学目标。水的相图是相平衡中最基本也是最重要的相图[2],是学生接触到的第一个相图。在学习水的相图之前,学生已经学习了基本概念、吉布斯相律和单组分系统两相平衡的克劳修斯-克拉珀龙方程,这些是学习相图的理论基础。深刻理解水的相图,熟练掌握相关知识对于后续其他相图的学习以及对实际问题的分析具有重要的意义。
针对物理化学相平衡中相图抽象多变的特点,在传统教学方法的基础上,作者采用基于问题驱动的启发式教学方法[3,4],结合具体实际案例对水的相图知识点进行了探讨,旨在引导学生充分发挥自主思考学习能力,提高学生的逻辑思维能力,激发学生的实验探索兴趣,培养其解决实际问题的创新思维,进一步提高教学效果。
1 课前发布任务
1.1 绘制水的相图
学生自己查阅文献,通过不同温度下水的相平衡数据绘制水的相图[5],利用克拉珀龙方程试分析水的相图中应该有几条线?每条线的区别与联系是什么?有哪些区域?通过绘制水的相图,帮助学生理解相图中各点、线、面所代表的意义,从而更科学地解释实际问题。
1.2 小组讨论
在学习通平台发布讨论话题:高压锅为什么煮饭快于敞口容器?青霉素为什么制成粉针剂保存?复冰现象是怎样产生的?水作为自然界最普遍的存在,水的蒸发、雨和冰雹的形成、寒冬里冰雪的消失等自然现象,怎么运用物理化学的知识去解释这些实际问题,学生很难下手。对这些问题的认识引导学生从水的相图出发,通过直观的图形在认识了水的聚集状态与温度、压力的关系后,得到科学的解释。课前问题铺垫能充分发挥学生的主观能动性,对于知识点的掌握将会事半功倍。
2 课堂解决问题
收集学生小组讨论的结果,针对性地进行讲授。首先通过相律分析f=C-Φ+2,单组分体系C=1,相数Φ最小为1,因此最大自由度f为2。以温度T作为横坐标,压强p作为纵坐标的二维图可完整地描述单组分体系的状态。这既巩固了基本概念和相律,又从相律角度使得学生对于水的相图有初步的认知。利用课前发布的问题引导学生进行思考。在实际分析水的相图(图1)时,主要从:(1)点、线、面的意义;(2)条件发生改变时,体系状态的变化两个方面进行分析,从简单到复杂,从静态到动态,将认识单组份相图的过程呈现一种递进式认识。
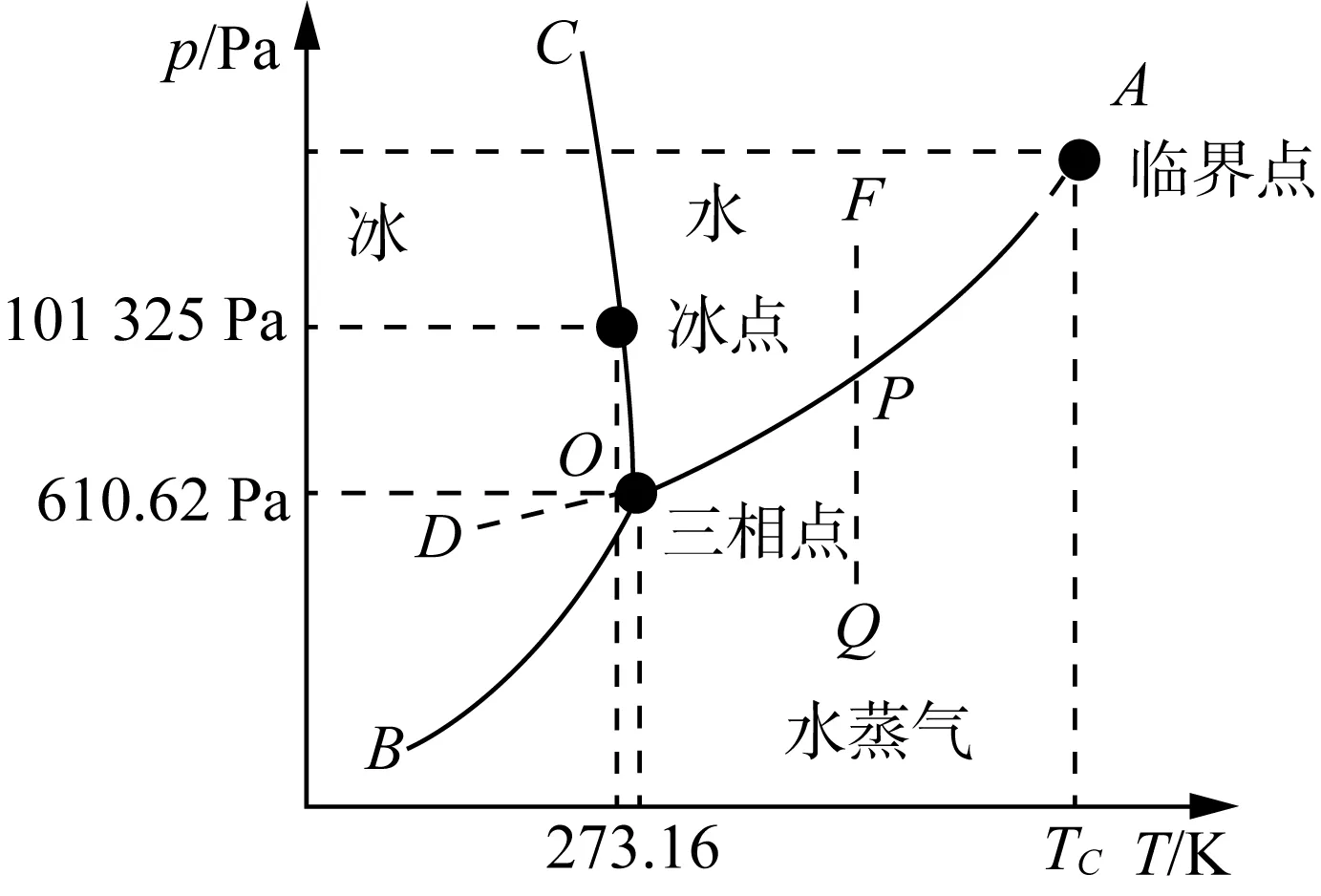
图1 水的相图
2.1 点、线、面的意义
点:在图1中,O点是三相点,气-液-固三相共存,Φ=3,f=0。三相点的温度和压强皆由体系自定,H2O的三相点温度为273.16 K,压强为610.62 Pa(图2A)。而与三相点容易搞混淆的是冰点的概念,冰点是指在大气压强下,水、冰两相共存的温度(图2B)。当大气压强为101 325 Pa时,冰点温度为273.15 K,改变外压,冰点也随之改变。冰点温度比三相点温度低0.01 K是由两种因素造成的:外压增加和水中溶有空气。
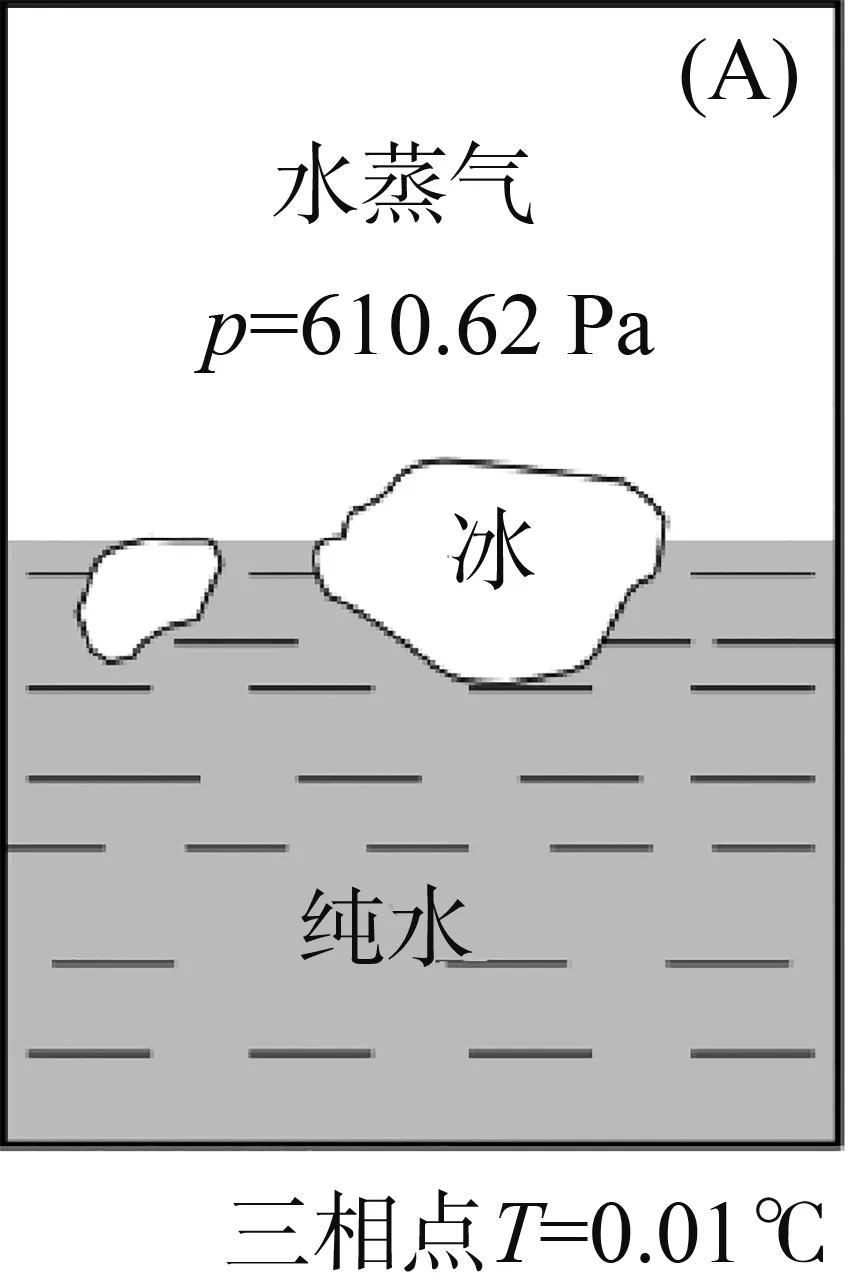
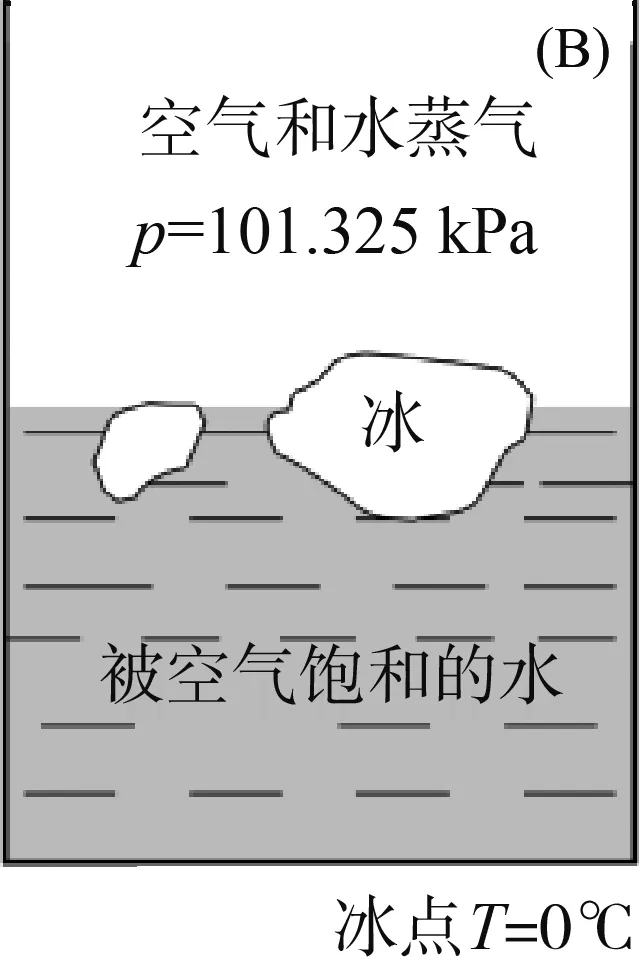
图2 密闭容器中的三相点(A)和敞口容器中的冰点(B)
线:图1中三条线分别对应两相平衡,OA是气-液两相平衡线,即水的蒸气压曲线。它不能任意延长,终止于临界点A。临界点临界温度时,气体与液体的密度相等,这时气-液界面消失。高于临界温度,不能用加压的方法使气体液化。OB是气-固两相平衡线,即冰的升华曲线,理论上可延长至0 K附近。OC是液-固两相平衡线,当C点延长至压强大于2×108Pa 时,相图变得复杂,有六种不同晶形结构的冰生成。结合克拉珀龙方程、克劳修斯-克拉珀龙方程,由于液-气、固-气、固-液平衡线的相变热的数值不同,因此三条平衡线的斜率有正、负。
OA线:dlnp/dT=ΔvapHm/RT2ΔvapHm>0,斜率为正。
OB线:dlnp/dT=ΔsubHm/RT2ΔsubHm>0,斜率为正。
OC线:dp/dT=ΔfusHm/TΔfusVΔfusHm>0,ΔfusV<0,斜率为负。
OD是AO的延长线,是过冷水和水蒸气的介稳平衡线。在相同温度下,过冷水的蒸气压大于冰的蒸气压,所以OD线在OB线之上。过冷水处于不稳定状态,一旦有凝聚中心出现,就立即全部变成冰。在两相平衡线上,Φ=2,f=1,T与p只能改变一个,即指定了压力,则温度由体系自定。f=1,可与克劳修斯-克拉珀龙方程相联系,达到两相平衡时T与p具有函数关系。
面:图1中COB、BOA、AOC三个面分别对应水的三种状态,即固态(冰)、气态(水蒸气)和液态(水)。三个面均为单相区,f=C-Φ+2,C=1,Φ=1,即f=2,处于单相区时,要确定水的状态,T与p独立地有限度的变化不会引起相的改变,需要同时确定温度和压力。
条件发生改变时,体系状态发生变化,在两相平衡线上的任何一点都可能有三种情况。如图1中OA线上的P点:处于F点的纯水,保持温度不变,逐步减小压强,在无限接近于P点之前,气相尚未形成,体系自由度f=2。用升压或降温的办法保持液相不变。到达P点时,气相出现,处于气-液两相平衡。压力与温度只有一个可变,f=1。继续降压,离开P点时,最后液滴消失,成单一气相,f=2。
2.2 案例讲授
水的正常沸点为100 ℃,对应的状态是气-液平衡,根据OA线,增大压强沸点会升高,高压锅是利用压强越大,里面的液体的沸点就越高的原理,因此能在较短的时间煮熟食物。举一反三,高原上食物不易煮熟和工业上通过使用锅炉保持4倍于外界大气压的压强获得高压蒸气也是同样的道理。
制药工艺要用到升华,如某些抗生素或生物制品等在水中不稳定又不易精制得到,在制成粉针剂时,先将盛这类药物水溶液的安瓿瓶快速深度冷冻,短时间内使溶液全部结冰,同时降低压强,在低压时冰升华而除去溶剂,得到疏松粉末状的稳定药物,即可以长时间贮存的粉针剂,避免了药物在干燥过程中受热分解,临时使用时加水快速溶解即可。根据水的相图,当低于三相点时,水将结冰,到了固相区,再将体系压强降至OB线以下,冰升华变成了水蒸气。
复冰现象是指冰由于压强增大而熔化,然后在压力恢复常值时重新结冰的现象。当人在滑冰时,冰鞋所施加的巨大压强和摩擦力的作用下降低了水的凝固点,造成固态冰融化为水形成又薄又滑的水膜。水膜在冰鞋或滑雪板和雪之间起着润滑剂的作用。一旦压力消失,熔点提高至原来的水平,水又凝结成冰。该现象也说明了冰的熔点随压强的增大而降低。通过这些教学案例的分析,可以加深学生对水的相图的进一步认知。
3 小结与拓展
总结水的相图的基本特点,以及学习相图的一般方法,通过水的相图学习分析硫的相图。
查阅有关水的相图的最新科研进展。
4 结束语
针对相平衡一章相图多变的知识特点,阐述了提高课堂教学效果的一点思路。在“物理化学”课堂中要充分利用问题驱动的启发式方法进行教学,一方面增强学生探究问题,解决问题的兴趣,增进课堂教学互动效果;另一方面增加理论知识与实际问题的联系,提升了教学效果。
