2-烯-甘草次酸酯及其脱氧化合物的合成与抗肿瘤活性研究
2023-01-18傅谟宏孟艳秋
傅谟宏,孟艳秋*
(1.杭州市建德生态环境监测站,浙江 杭州 311600;2.沈阳化工大学 制药工程教研室,辽宁 沈阳 100142)
18β-甘草次酸(GA)可从天然植物甘草中大量提取,具有广泛的药理活性,可以抑制人胃癌细胞[1]、人乳腺癌细胞[2]、人肺癌细胞[3]、人结肠癌细胞[4]的增殖、侵袭,促进肿瘤细胞凋亡,已作为抗炎药物被广泛应用于临床。目前对18β-甘草次酸的研究主要集中在对A环的改造及C30位的结构修饰[5-7]。18β-甘草次酸的C11位羰基被还原后,假性醛固酮增多症的副作用会明显降低[8-10]。鉴于此,作者以18β-甘草次酸为起始原料,经C11位羰基还原、C30位羧基酯化、C3位羟基取代和消除等反应,合成一系列2-烯-甘草次酸酯和2-烯-11-脱氧甘草次酸酯,通过IR、1HNMR、MS对其结构进行表征,并采用MTT法探究其对人宫颈癌细胞(HeLa)、人肝癌细胞(HepG2)、人胃癌细胞(BGC-823)的抑制活性。2-烯-甘草次酸酯和2-烯-11-脱氧甘草次酸酯的合成路线如图1所示。
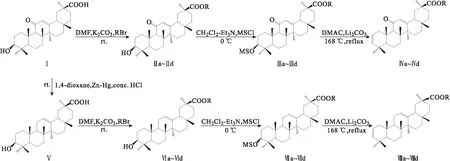
a~d,R=C2H5,Bn,CH2COOC2H5,CH(CH3)2
1 实验
1.1 材料、试剂与仪器
人宫颈癌细胞(HeLa)、人肝癌细胞(HepG2)、人胃癌细胞(BGC-823),由中国医学科学院协和医科大学药物研究所传代保种。以上细胞均用RPMI-1640培养基(含10%胎牛血清、100 μg·mL-1青霉素、100 μg·mL-1链霉素)培养。
实验所用试剂为化学纯或分析纯。
Thermo Nicolet 470FT型红外光谱仪(KBr压片);LCQ型质谱仪,热电-菲尼根;Bruker ARX-300型核磁共振波谱仪; B-545型熔点仪,Büchi; MC0175型CO2培养箱,SANYO;IX70型倒置显微镜,Olympus; MODEL68型酶标仪,Bio-Rad。
1.2 合成方法
1.2.1 化合物Ⅴ的合成
将18β-甘草次酸(0.25 mmol)充分溶解于10 mL 1,4-二氧六环中,加入1 g锌汞齐,充分搅拌,缓慢滴加浓盐酸并控制反应温度在10~15 ℃;TLC监测反应进程,反应完全后加入适量1,4-二氧六环,滤去锌汞齐粉;旋蒸去除溶剂,加入15 mL水,析出白色固体,过滤后干燥,得到白色粉末状化合物Ⅴ。
将18β-甘草次酸(0.22 mmol)溶解于5 mLN,N-二甲基甲酰胺(DMF)中,加入60 mg无水碳酸钾,室温下搅拌,缓慢滴加相应溴代烃(0.85 mmol);TLC监测反应进程,反应完全后旋蒸去除过量的溴代烃,加入适量水,用乙酸乙酯萃取3次,有机相用无水硫酸钠干燥,过滤后蒸干,得到白色粉末状化合物Ⅱa~Ⅱd。
用化合物Ⅴ替代18β-甘草次酸,同法合成白色粉末状化合物Ⅵa~Ⅵd。
1.2.3 化合物Ⅲa~Ⅲd、Ⅶa~Ⅶd的合成
将化合物Ⅱa~Ⅱd(0.21 mmol)溶解于二氯甲烷(5 mL)-三乙胺(1.5 mL)混合液中,缓慢滴加1 mL甲基磺酰氯(MSCl),控制反应温度0 ℃左右;TLC监测反应进程,反应完全后过滤,用稀盐酸调至溶液呈弱酸性,用乙酸乙酯萃取3次,有机相用无水硫酸钠干燥,过滤后蒸干,得到白色粉末状化合物Ⅲa~Ⅲd。
用化合物Ⅵa~Ⅵd替代化合物Ⅱa~Ⅱd,同法合成白色粉末状化合物Ⅶa~Ⅶd。
1.2.4 化合物Ⅳa~Ⅳd、Ⅷa~Ⅷd的合成
将化合物Ⅲa~Ⅲd(0.20 mmol)溶解于8 mLN,N-二甲基乙酰胺(DMAC)中,加入无水碳酸锂(70 mg,0.95 mmol),168 ℃回流0.5 h;反应液冷却至室温后过滤,加入适量水,用乙酸乙酯萃取3次,有机相分别用稀盐酸和清水洗涤,无水硫酸钠干燥,过滤后蒸干,得到白色粉末状化合物Ⅳa~Ⅳd。
用化合物Ⅶa~Ⅶd替代化合物Ⅲa~Ⅲd,同法合成白色粉末状化合物Ⅷa~Ⅷd。
1.3 抗肿瘤活性测试
将处于对数生长期的HeLa、HepG2和BGC-823细胞接种于96孔培养板中,每孔100 μL,约5 000个细胞。将细胞于37 ℃、5%CO2的温箱中培养24 h;药物组分别加入梯度浓度的化合物Ⅳa~Ⅳd、Ⅷa~Ⅷd溶液,阴性对照组加入等体积的溶剂,空白组只加培养基;继续培养48 h后,弃去培养液,每孔加入10 μL MTT(5 mg·mL-1)溶液;继续培养 4 h后,弃去上清液,每孔加入150 μL DMSO,低速振荡溶解结晶物。用酶标仪测定490 nm处吸光度(OD),重复测定3次,结果取平均值。按下式计算化合物Ⅳa~Ⅳd、Ⅷa~Ⅷd对细胞的抑制率,并以化合物浓度的对数值对抑制率作线性回归曲线,计算IC50值。
一个企业如果想要很好的发展,仅仅只是做出一份市场营销策略是远远不够的。企业需要引导自己相关的企业部门不断对自己企业的具体情况展开深入的分析与研究。不同时期的企业所面临的企业风险和挑战是不同的,不同阶段的企业实力也是不同的。所以,只有随时对企业实力和其所面临的市场状况进行研究,才可以及时发现企业的问题并加以整改,从而促进企业不断地完善自己的市场营销策略,提高自己企业的竞争实力,借此来全面的推广自己企业的产品,为企业自身带来更为客观的收益[4]。
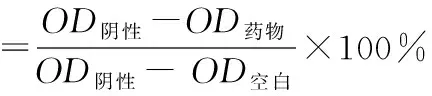
2 结果与讨论
2.1 结构表征
化合物Ⅳa:柱层析分离(洗脱剂V石油醚∶V乙酸乙酯=30∶1),产率42%,m.p.157~159 ℃。IR(KBr),ν,cm-1:3 427,2 958,2 870,1 724,1 655,1 466,1 386,1 214,1 153,1 088,726;1HNMR(300 MHz,CDCl3),δ:5.68(s,1H,H-12),5.41(m,2H,H-2,3),4.16(m,2H,COOCH2CH3),3.05(dd,1H,J=17.6 Hz、5.5 Hz,H-1),2.42(s,1H,H-9),1.27(t,3H,J=6.9 Hz,COOCH2CH3),1.42,1.16,1.15,1.14,0.97,0.92,0.82(7s,each3H,-CH3);ESI-MS,m/z:503.0[M+Na]+。
化合物Ⅳb:柱层析分离(洗脱剂V石油醚∶V乙酸乙酯=30∶1),产率37%,m.p.133~136 ℃。IR(KBr),ν,cm-1:3 429,2 951,2 868,2 845,1 727,1 655,1 454,1 385,1 219,1 166,1 088,734,695;1HNMR(300 MHz,CDCl3),δ:7.39(s,5H,C6H5),5.60(s,1H,H-12),5.42(m,2H,H-2,3),5.25(d,1H,J=12.3 Hz,COOCHH),5.11(d,1H,J=12.3 Hz,COOCHH),3.06(dd,1H,J=17.4 Hz、5.7 Hz,H-1),2.41(s,1H,H-9),1.37,1.18,1.18,1.16,0.98,0.93,0.76(7s,each3H,-CH3);ESI-MS,m/z:543.4[M+H]+。
化合物Ⅳc:柱层析分离(洗脱剂V石油醚∶V乙酸乙酯=30∶1),产率35%,m.p.85~87 ℃。IR(KBr),ν,cm-1:2 958,2 869,1 762,1 740,1 659,1 458,1 384,1 205,1 151,1 090,1 048,1 022,886,725;1HNMR(400 MHz,CDCl3),δ:5.72(s,1H,H-12),5.41(m,2H,H-2,3),4.62(m,2H,COOCH2COO),4.23(q,2H,J=7.1 Hz,CH2COOCH2CH3),3.05(dd,1H,J=17.8 Hz、5.3 Hz,H-1),2.42(s,1H,H-9),1.27(t,3H,J=7.1 Hz,CH2COOCH2CH3),1.37,1.21,1.16,1.16,0.96,0.92,0.86(7s,each3H,-CH3);ESI-MS,m/z:539.5 [M+H]+。
化合物Ⅳd:柱层析分离(洗脱剂V石油醚∶V乙酸乙酯=30∶1),产率28%,m.p.150~153 ℃。IR(KBr),ν,cm-1:3 416,2 961,2 936,2 870,1 720,1 656,1 618,1 467,1 386,1 220,1 168,1 109,1 085,720;1HNMR(400 MHz,CDCl3),δ:5.66(s,1H,H-12),5.41(m,2H,H-2,3),5.04(m,1H,COOCH),3.03(dd,1H,J=17.5 Hz、5.8 Hz,H-1),2.42(s,1H,H-9),1.24(d,3H,J=6.2 Hz,OOCHCH3),1.21(d,3H,J=6.2 Hz,OOCHCH3),1.35,1.17,1.16,1.10,0.97,0.92,0.82(7s,each3H,-CH3);ESI-MS,m/z:517.0 [M+Na]+。
化合物Ⅷa:柱层析分离(洗脱剂V石油醚∶V乙酸乙酯=65∶1),产率34%,m.p.128~131 ℃。IR(KBr),ν,cm-1:3 430,2 956,1 727,1 465,1 381,1 212,1 174,1 152,1 089,1 018,727;1HNMR(400 MHz,CDCl3),δ:5.41(m,2H,H-2,3),5.30(brs,1H,H-12),4.15(m,2H,COOCH2CH3),1.27(t,3H,J=7.1 Hz,COOCH2CH3),1.34,1.19,1.15,1.11,1.01,0.91,0.79(7s,each3H,-CH3);ESI-MS,m/z:467.4[M+H]+,490.9 [M+Na]+。
化合物Ⅷb:柱层析分离(洗脱剂V石油醚∶V乙酸乙酯=80∶1),产率31%,m.p.87~89 ℃。IR(KBr),ν,cm-1:3 445,2 953,1 724,1 463,1 380,1 213,1 172,1 148,1 083,1 021,726;1HNMR(400 MHz,CDCl3),δ:7.37(s,5H,C6H5),5.41(m,2H,H-2,3),5.20(d,1H,J=12.0 Hz,COOCHH),5.09(d,1H,J=12.4 Hz,COOCHH),1.56,1.31,1.15,1.00,0.97,0.91,0.75(7s,each3H,-CH3);ESI-MS,m/z:550.4 [M+Na]+。
化合物Ⅷc:柱层析分离(洗脱剂V石油醚∶V乙酸乙酯=60∶1),产率29%,m.p.80~83 ℃。IR(KBr),ν,cm-1:3 458,2 954,1 739,1 462,1 381,1 314,1 285,1 208,1 146,1 089,1 026,803,725;1HNMR(300 MHz,CDCl3),δ:5.41(m,2H,H-2,3),5.34(brs,1H,H-12),4.62(d,2H,J=3.9 Hz,COOCH2COO),4.23(q,2H,J=7.2 Hz,CH2COOCH2CH3),1.29(t,3H,J=7.2 Hz,CH2COOCH2CH3),1.38,1.36,1.16,1.00,0.97,0.90,0.82(7s,each3H,-CH3);ESI-MS,m/z:547.0 [M+Na]+。
化合物Ⅷd:柱层析分离(洗脱剂V石油醚∶V乙酸乙酯=60∶1),产率28%,m.p.104~106 ℃。IR(KBr),ν,cm-1:3 426,2 956,1 725,1 455,1 382,1 310,1 216,1 168,1 110,1 085,1 025,804,728;1HNMR(400 MHz,CDCl3),δ:5.41(m,2H,H-2,3),5.29(brs,1H,H-12),5.04(m,1H,COOCH),1.23~1.25(3H,d,J=6.3 Hz,COOCHCH3),1.34,1.15,1.11,1.01,0.97,0.91,0.79(7s,each3H,-CH3);ESI-MS,m/z:503.4 [M+Na]+。
2.2 抗肿瘤活性
采用MTT法测试化合物Ⅳa~Ⅳd、Ⅷa~Ⅷd对HeLa、HepG2和BGC-823细胞的抑制活性,以吉非替尼(Gefitinib)和依托泊苷(VP-16)为阳性对照,作用时间为48 h,结果见表1。
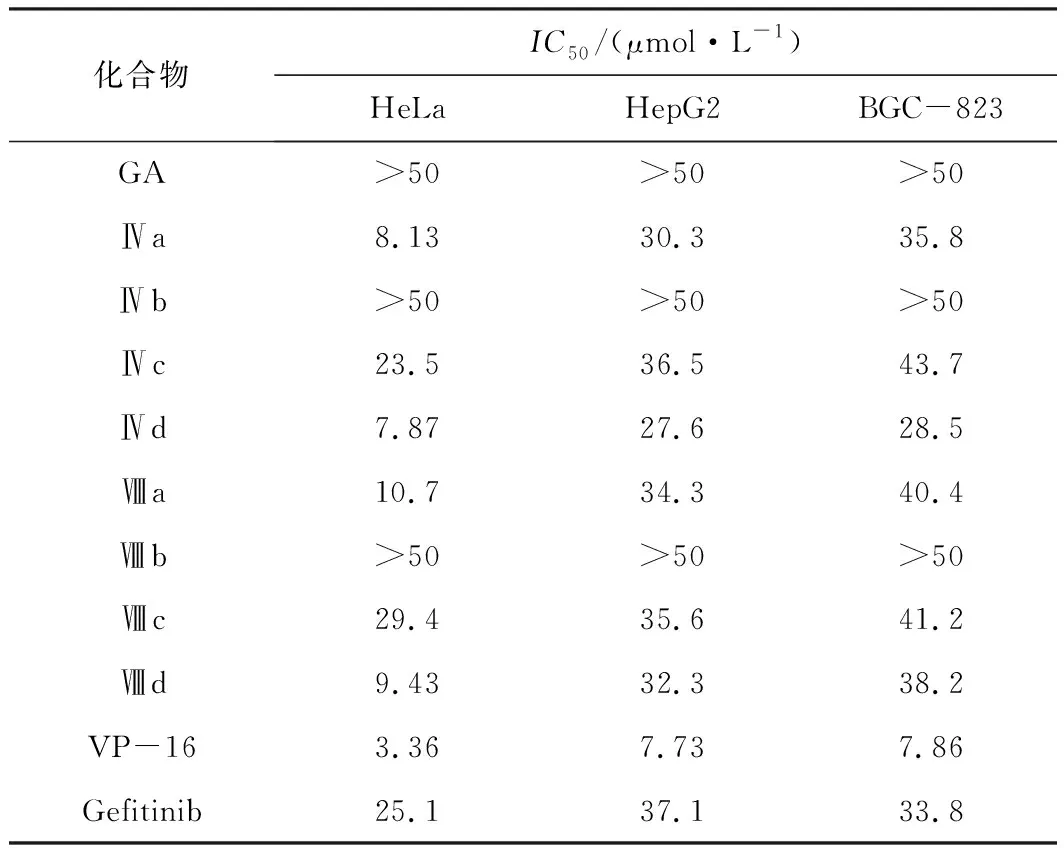
表1 化合物Ⅳa~Ⅳd、Ⅷa~Ⅷd的体外抗肿瘤活性
由表1可以看出,化合物Ⅳa、Ⅳd、Ⅷa、Ⅷd对HeLa细胞具有较高的抑制活性,IC50值分别为8.13 μmol·L-1、7.87 μmol·L-1、10.7 μmol·L-1、9.43 μmol·L-1,其抗肿瘤活性明显高于吉非替尼和18β-甘草次酸,与依托泊苷接近;化合物Ⅳa、Ⅳd、Ⅷa、Ⅷd对 HepG2、BGC-823细胞的抑制活性接近于吉非替尼;化合物Ⅳc、Ⅷc对HeLa、HepG2细胞的抑制活性与吉非替尼接近;化合物Ⅳb、Ⅷb对HeLa、HepG2和BGC-823细胞的IC50值均大于50 μmol·L-1。可以看出,同系列中乙酯和异丙酯衍生物较其它酯类衍生物的抗肿瘤活性高。比较化合物Ⅳa和Ⅷa、Ⅳd和Ⅷd的抗肿瘤活性发现,2-烯-11-脱氧甘草次酸酯的抗肿瘤活性略低,但其假性醛固酮增多症的副作用更低。综上,对18β-甘草次酸的A环、C30、C11进行结构改造及修饰可提高其抗肿瘤活性、降低假性醛固酮增多症副作用。
3 结论
以18β-甘草次酸为起始原料,经C11位羰基还原、C30位羧基酯化、C3位羟基取代和消除等反应,合成了一系列2-烯-甘草次酸酯(Ⅳ)和2-烯-11-脱氧甘草次酸酯(Ⅷ)。抗肿瘤活性测试结果表明,化合物Ⅳa、Ⅳd、Ⅷa、Ⅷd对HeLa、HepG2、BGC-823细胞均有一定的抑制活性,尤其对HeLa细胞具有较强的抑制活性,IC50值分别为8.13 μmol·L-1、7.87 μmol·L-1、10.7 μmol·L-1、9.43 μmol·L-1。
