不同强度光强胁迫对海带(Saccharina japonica)幼苗光合生理的影响*
2023-01-17牛建峰冯泽中孙振杰王伟伟张晓雯梁广津王立军李晓捷王广策
牛建峰 冯泽中 孙振杰 王伟伟 张晓雯 梁广津 王立军 李晓捷① 王广策①
不同强度光强胁迫对海带()幼苗光合生理的影响*
牛建峰1, 2, 6冯泽中1, 4孙振杰1, 4王伟伟3张晓雯5梁广津3王立军1, 2, 6李晓捷3①王广策1, 2, 6①
(1. 中国科学院海洋研究所实验海洋生物学重点实验室 山东青岛 266071; 2. 青岛海洋科学与技术试点国家实验室海洋生物学与生物技术功能实验室 山东青岛 266237; 3. 山东东方海洋科技股份有限公司 山东省海藻遗传育种与栽培技术重点实验室 山东烟台 264003; 4. 青岛农业大学 山东青岛 266109; 5. 农业农村部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 山东青岛 266071; 6. 中国科学院海洋大科学研究中心 山东青岛 266071)
海带()是我国藻类生产的主要品种之一, 其栽培面积和产量均居世界首位。2021~2022年产季, 山东荣成海带主产区先后暴发了大规模病烂灾害, 给当地水产经济造成了巨大损失。引起病烂的原因可能来自多方面, 其中藻体所受光照过强及水体营养盐水平较低可能起到了一定作用, 为此, 基于海带幼苗的最小饱和光强、烟台高新区牟平自然海区海水氮磷浓度及不同海水深度下的光照强度测定结果, 研究了梯度强光在不同海水营养盐水平下对海带生理的影响, 以期为“烂菜”现象的病因分析提供一定的线索。结果显示, 海带幼苗在700~900 μE/(m2s)强光胁迫3 d后,v/m可恢复至对照水平, 光合色素合成活跃, 营养盐含量较高的海水更有助于PSII的修复, 但1 300~1 500 μE/(m2s)的强光辐射导致PSII不能恢复, 岩藻黄素、叶绿素及β-胡萝卜素含量显著降低。整个胁迫实验中, 藻体总抗氧化能力(T-AOC)及其他抗氧化酶比活力大体上在强光胁迫的起始至第3天上调, 而在胁迫第5天时又出现下降趋势, 且在营养盐含量较高的处理组中, 各样本活性均高于天然海水处理组样本。抗氧化酶基因的表达也呈现类似的变化趋势。在低于900 μE/(m2s)的光照条件下, 抗氧化酶活性可以得到较好的维持, 而海水中相对较为丰富的营养盐则有利于藻体抗氧化能力的维持。研究结果为荣成海带病烂暴发的原因分析提供了一定的借鉴。
强光胁迫; 活性氧清除; 光系统修复; 海带幼苗; 抗氧化酶; 岩藻黄素; β-胡萝卜素
海带()属褐藻门(Phaeophyta), 褐藻纲(Phaeophyceae), 海带目(Laminariales), 海带科(Laminariaceae), 糖藻属() (水产辞典编辑委员会, 2007), 由假根状固着器、柄和叶片组成, 通过固着器附着于岩石、养殖筏架上生长。海带是我国渔业生产的主要藻类之一, 栽培规模和产量均居世界首位, 据国家藻类产业技术体系监测调查情况及相关统计数据显示, 2008~2018年, 全国海带栽培面积呈上升趋势, 2018年栽培面积相比于10年前增加了约34.63%, 占全国藻类栽培面积的31.29%。目前我国海带主要分布在东南沿海和渤海湾地区, 其中福建省占总栽培面积的45.23%, 山东省占比约为38.04%, 辽宁省占比13.47%; 浙江省、江苏省和广东省也有零星栽培, 占比不到4% (国家藻类产业技术体系, 2021)。海带不仅是海藻化工和农业肥料等行业的重要原料, 也是一种营养丰富的海洋食蔬。我国已形成一个集海带育种、育苗、栽培、加工、藻类化工为一体的产业链条, 海带产业在促进就业、渔民增收, 为社会提供健康食品, 改善生态环境, 缓解水体富营养化等方面作出了重要贡献(国家藻类产业技术体系, 2021)。
在海带的生长发育过程中, 不可避免地会受到众多环境因子的影响, 光照就是其中一个重要因子。海水透明度可影响自然海区海带的垂直分布, 随海水透明度的提高, 其分布的深度会相应增加。在海带的人工栽培中, 水体透明度也是被考虑的重要环境因子, 在受江河入海口影响而水质较浑浊的海区, 海带一般栽培于海水表层, 在海水透明度高的区域, 海带则被栽培在较深层海水中(苏丽, 2018)。有研究表明, 海带对光照强度的需求存在一个适宜范围(即光补偿点与光饱和点之间), 在此范围内, 随光照强度增加海带光合作用加快, 而当光照强度超过饱和点后, 光合作用则减弱甚至受到抑制(陈书秀等, 2021)。
长期生产实践积累的经验表明, 过强或过弱的光照条件均可能抑制海带的生长, 甚至引起海带病变发生。在光强范围300~10 000 lx内, 不同大小海带的光合活性均随光照强度增强而升高(姚南瑜等, 1981)。张起信(1994)通过总结经验数据提出海带光补偿点大约为345 lx, 在养殖前期(幼苗期和凹凸期), 光照强度不宜超过800 lx, 正常栽培时期比较合理的光照范围为14 000~22 000 lx, 此光照条件下海带生长正常, 且不易发病。这个光照强度所对应的水层深度基本与透明度相当, 被称为海带的合理受光水层。程晓鹏等(2020)在测定养殖海域海带孢子体生长参数的基础上, 设置暂养实验, 测定了在不同光合有效辐射(PAR)梯度下海带的光合活性变化, 发现快速光曲线随着光合有效辐射的增强呈先升后降的趋势, 海域养殖海带孢子体干重生长率变化与快速光曲线变化一致。
目前, 关于光照条件对海带生长的影响, 主要集中在生长速率、形态变化及产量方面, 而从藻类生理生化角度的探讨相对较少。在低于1 200 lx的不同光照条件下, 培养3 d后的海带幼苗多酚、可溶性糖及可总溶性蛋白含量随光强降低而降低, 而叶绿素和β-胡萝卜素含量则呈相反趋势(黄健等, 2002)。程晓鹏等(2020)通过模拟实验, 综合分析了海带孢子体对温度和光照的生理响应。梁洲瑞等(2019)研究了极北海带()幼苗在不同光照条件下的抗氧化酶活性, 认为这些酶在响应强光胁迫的过程中发挥作用。本文则通过设置营养盐与光照强度组合的不同培养条件, 研究了强光对海带幼苗光合作用及抗氧化酶的影响, 以期为海带人工栽培提供理论指导。
1 材料与方法
1.1 材料
实验用海带()幼苗藻体长度为20~30 cm, 2022年2月17日从福建移栽青岛即墨海区暂养3 d, 期间水温5 °C, 苗绳捆坠石沉入水下2 m。后转运至(山东东方海洋科技股份有限公司高新区分公司)暂养1 d后进行不同胁迫条件下的处理。暂养条件为: 温度4 °C; 光照强度50 μE/(m2s); 光周期12L:12D。
1.2 方法
1.2.1 光响应曲线测定 取暂养后的藻体, 暗适应10 min后, 通过双通道调制叶绿素荧光仪Dual-PAM-100 (Heinz Walz, Effeltrich, 德国)原位测定海带光响应曲线。光化光(PAR)强度设定为16、26、75、131、353、795、1 701和3 444 μE/(m2s), 每一PAR梯度下的照射时间为10 s, 2次光化光间隔为20 s, 记录至少3组不同光化光下的ETR(II)值, 取平均值后通过软件Origin 9.0, 利用Eilers等(1988)建立的方程进行光响应曲线的耦合, 方程公式为: ETR=PAR/ (×PAR2+×PAR+), 计算得出PSII最大量子得率, 最大电子传递速率ETRmax, 以及半饱和光强或最小饱和光强Ik。
1.2.2 海区光照强度与海水深度关系测定 于2022年2月24日正午, 在烟台高新区海区(37°28′N, 121°47′E)进行了不同深度水体中光照强度的测定。测定以水下光温探头(Pendant, HOBO, 美国)与透明度盘结合进行, 将探头固定于透明度盘表面, 随透明度盘逐渐下沉水下, 从水体表面开始至水下5 m, 每下降1 m保持1 min, 进行数据采集, 采集频率设定为10次/min, 同时, 对海区透明度对应的水体深度也进行1 min的光强数据采集。
1.2.3 不同光照强度及不同营养盐浓度处理 以烟台高新区自然海区抽取的海水, 经沉淀、砂滤后作为本实验低营养盐培养用海水。同时, 在海水中添加硝酸盐和磷酸盐, 配制营养海水(氮终浓度10 mg/L, 磷终浓度1 mg/L)。分别在营养海水及自然海水中设置高强度[1 300~1 500 µE/(m2s)]、中等强度[700~900 µE/(m2s)]和低强度[约200 µE/(m2s)]胁迫光照条件, 对海带幼苗进行处理, 不同强度的光照条件基于正午水面光照强度, 水下1 m处光照强度及水体透明度条件下对应的光照强度设定。连续进行5 d胁迫处理, 每日处理时间为6 h。在强光处理的第1、3和5天, 光照处理结束后, 测定藻体光合作用参数, 收集材料, 吸水纸吸干, 液氮速冻, –80 °C保存备用。同时, 在胁迫处理的第2天和第4天, 强光处理前对藻体光合参数进行测定。
本实验以高亮度Led灯提供光照条件, 温度监测显示整个实验期间温度维持在4~6 °C。
1.2.4 光合参数测定 藻体在不同营养盐浓度、胁迫光照条件处理后暗适应10 min, 使用调制叶绿素荧光仪Dual-PAM-100 (Heinz Walz, Effeltrich)测定其光合作用参数。具体测定程序: 初始荧光(o), 以12 µE/(m2s)的测量光测定获得; 最大荧光参数(m), 使用饱和脉冲[SP, 强度6 000 µE/(m2s), 持续时间300 ms]测定; 可变荧光(v)由m和o的差值获得。测定过程中光化光强度设定为57 µE/(m2s), 通过系统自带程序, 测得光合作用各参数, 利用Origin 9.0软件进行数据处理并作图。
1.2.5 色素提取和含量测定 参考Thayer和Enriquez等人建立的方法(Thayer, 1990; Enriquez, 2010), 将–80 °C储存的藻体约100 mg, 置研磨管, 液氮预冻, 于研磨仪(JX-FSTPRP-24, 净信科技, 中国上海) 60 Hz震荡破碎50 s, 暂停10 s, 连续破碎三次, 悬浮于甲醇/丙酮(1/1,/)中, 冰浴30 min, 3 000离心5 min (4 °C), 沉淀再次加入一定体积甲醇/丙酮提取液, 离心、收集合并上清。色谱测定前, 上清液用0.22 μm滤膜过滤, 所有步骤在黑暗低温状态下进行。
色素测定采用高压液相色谱系统(Agilent 1200,美国)进行, 色谱柱为C18反相柱(4.6×250 mm), 流动相包括A (水)、B (甲醇)、C (乙腈)和D (乙酸乙酯), 具体色谱程序为: 0~15 min, I (15% A, 30% B, 55% C, 0% D)到II (0% A, 15% B, 85% C, 0% D)线性梯度; 15~17 min, II到III (15% A, 15% B, 35% C, 35% D)线性梯度; 17~40 min, III到IV (0% A, 30% B, 0% C, 70% D)线性梯度。柱温50 °C, 流速0.75 mL/min, 检测波长443 nm。色素定量标准品岩藻黄素、叶绿素及β-胡萝卜素购于Sigma (Sigma-Aldrich, 美国)。色素标准曲线通过不同浓度标准品的峰面积绘制, 样本中色素浓度根据标准曲线计算获得。
1.2.6 过氧化氢(H2O2)和丙二醛(MDA)含量测定 取适量–80 °C冻存样品, 按上述方法磨碎, 加适量过氧化氢测定试剂盒(南京建成)提取液, 再次震荡后, 12 000, 4 °C离心10 min, 收集上清。按试剂盒操作步骤加样, 酶标仪(M1000Pro, Tecan Ifinite, 瑞士)测定吸光值, 计算各样本中H2O2含量。
采用植物MDA试剂盒(南京建成), 材料研磨及样本制备方法同前。按照说明书步骤, 以无水乙醇为空白对照, 以10 nmol/mL的MDA标准品作为标准管, 使用酶标仪(M1000Pro, Tecan Ifinite, 瑞士), 测定波长340 nm, 对样本中MDA含量进行测定。
1.2.7 总抗氧化能力及抗氧化酶比活性测定 样本研磨及酶提取液的制备方法同1.2.6。使用T-AOC试剂盒(南京建成)测定不同条件下样本总抗氧化能力的强弱, 测定波长593 nm, 吸光度的大小反应样本中所含抗氧化物质的总体的抗氧化能力。
样本研磨及酶提取液的制备方法同前。各抗氧化酶测定试剂盒均购自南京建成。超氧化物歧化酶(SOD)的测定基于WST-8的显色反应, 通过比色法对样本中相应的酶活进行测定; 过氧化氢酶(CAT)活性通过单位时间内405吸光度的变化计算获得; 过氧化物酶(POD)活性通过单位时间内420吸光度的变化量测定获得; 抗坏血酸过氧化物酶(APX)活性根据单位时间内290吸光度的减少值计算。
1.2.8 抗氧化酶的实时荧光定量(qRT-PCR)检测
(1) RNA提取 不同处理样本的总RNA使用RNAprep Pure Plant Kit (中国北京天根)提取, 得到的RNA浓度通过Nanodrop Photometer分光光度计(IMPLEN, CA, 美国)测定。
(2) 反转录 依据TaKaRa反转录试剂盒操作说明书进行, 每个反应含总RNA 200 ng, 用量据前述RNA浓度测定确定。具体操作步骤包括: 1) 基因组DNA去除。5´gDNA Eraser Buffer 2 μL, gDNA Eraser 1 μL, Total RNA (200 ng), 添加RNase Free dH2O至10 μL; 42 °C 2 min; 2) 反转录反应。向步骤1)的反应液中加入PrimeScript RT Enzyme Mix I 1 μL, RT Primer Mix 1 μL, 5´Primescript Buffer 4 μL, RNase Free dH2O 4 μL; 37 °C 15 min, 85 °C 5 s, 4 °C维持。cDNA模板置–20°C备用。
(3) 引物设计 以海带胁迫条件下转录组数据为基础, 筛选每种抗氧化酶基因中表达上调最明显的基因序列为转录研究对象, Tublin ()为内参, 通过海带基因组数据获得目标分子核酸序列, Primer Premier 5.0设计引物。基因名称及引物序列见表1。

表1 目标基因引物序列及PCR产物长度
(4) qRT-PCR条件优化及基因表达量测定 通过调整PCR反应参数, 对各引物扩增条件进行优化。扩增的片段连接PMD19-T载体, 转化感受态细胞, 测序验证。EZNATMplasmid mini kit质粒提取试剂盒提取质粒, 10倍梯度稀释, 进行引物扩增效率检测。选择扩增效率在90%~110%的引物进行qRT-PCR实验。
使用StepOne Plus Real-Time (ABI, Foster, 加州, 美国)多色实时荧光定量PCR仪, 2´SYBR Green Master Mix (Roche, 德国), 每个样本设3个重复, 进行抗氧化酶基因转录水平的测定。qRT-PCR反应体系20 μL, 包括1 μL cDNA模板, 10 μL 2´SYBR Green Master Mix, 上下游引物各0.5 μL (浓度为10 μmol/L), 8 μL RNase-free水。反应程序: 预变性: 95 °C 10 min; 变性: 95 °C 10 s、退火: 根据不同引物设定, 退火时间15 s, 延伸: 72 °C 25 s, 40个循环; 65 °C 30 s, 61个循环。反应结束后, 通过2–ΔΔCt的方法计算目标基因相对表达强度(Livak, 2001)。
2 结果
2.1 海带幼苗快速光响应曲线
如图1所示, 随光合有效辐射的增强, 海带幼苗PSII电子传递速率[rETR(II)]呈先快速上升后缓慢下降的趋势, 在光饱和点处达到最大相对电子传递速率。根据快速光曲线拟合结果, 计算得到PSII的最大量子得率α为0.394, 光饱和点下ETRmax约为64 μE/(m2s), 最小饱和光强Ik为163 μE/(m2s)。
2.2 海区光照强度与海水深度的对应关系
光照强度监测数据显示(图2), 2月24日正午水面光照强度可达到1 500 μE/(m2s), 而在水下1 m时迅速下降到约600 μE/(m2s), 此时, 受表层海水流动及波动的影响, 监测数据呈现锯齿状波动, 至水下2 m的区域, 光强下降到350 μE/(m2s), 随着深度的增加, 光照强度的降低呈现减少的趋势, 但在水下5 m的区域, 光强也可以达到约80 μE/(m2s)的水平。经测定, 本次测量水体透明度约为2.8 m, 此条件下光照强度约为200 μE/(m2s)。
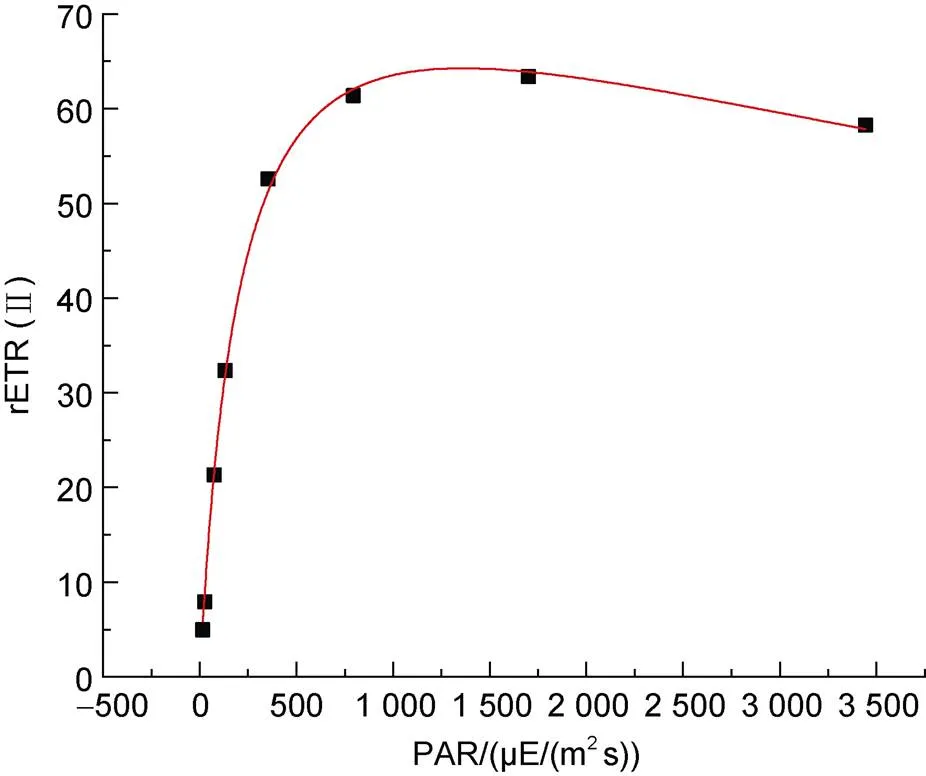
图1 海带幼苗饱和光强曲线
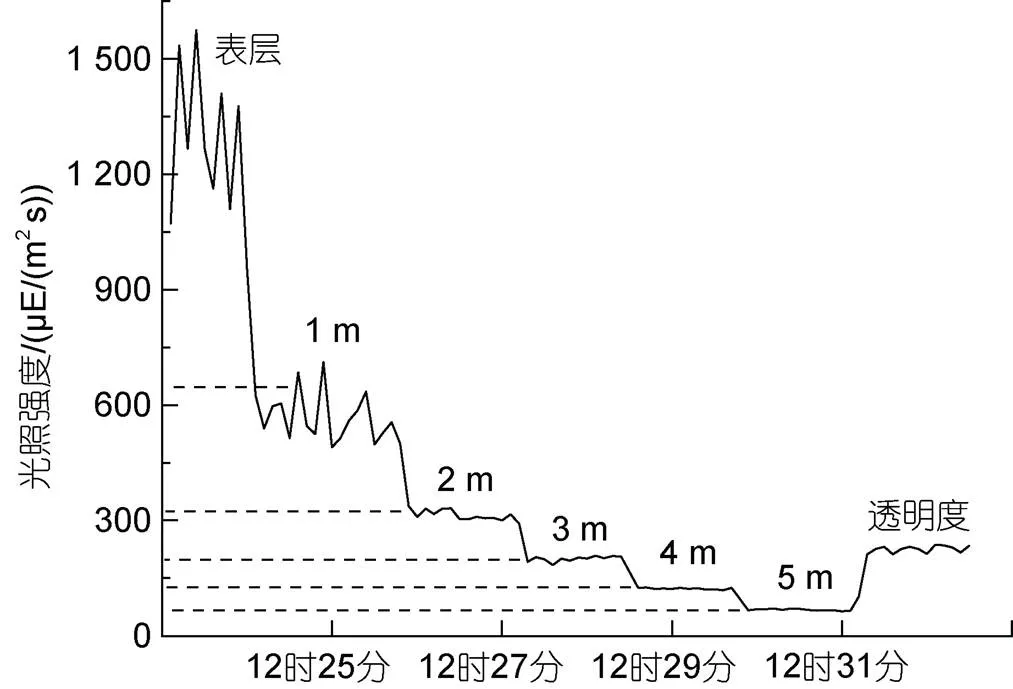
图2 不同海水深度对应的光照强度
2.3 强光胁迫对海带幼苗光合作用参数的影响
如图3所示, 在光照强度约200 μE/(m2s)条件下, 室内连续培养过程中, 样本v/m均呈现持续降低的趋势, 其中自然海水条件下下降更为迅速, 至第5天时降为初始值的三分之一; 而营养海水条件下, 虽然v/m也逐渐降低, 但下降速率和程度均显著低于自然海水条件, 至第5天时, 仍达到了实验开始时一半的水平。在经历中等强光[700~900 μE/(m2s)]胁迫后, 与低强光[200 μE/(m2s)]培养条件相比, 藻体v/m呈现显著降低的趋势。在营养海水培养条件下, 样本v/m在胁迫的第3~5天一直维持在0.3上下, 而自然海水培养条件下的藻体v/m持续降低, 直至第5天的0.2。高强光[1 300~1 500 μE/(m2s)]胁迫的藻体中, 无论营养海水还是自然海水培养条件下,v/m在胁迫的第1天就出现较强烈的下降, 而在后续高强光处理下, 虽然光合能力同样持续下降, 但营养盐条件对其影响不显著,v/m基本均维持在0.1。
强光胁迫前, 海带藻体v/m为0.72, 在不同强光胁迫1 d后, 高强光组及中等强光组, 无论在营养海水还是自然海水培养条件下, 藻体v/m均无法恢复至原初状态(图4); 而在低强光[200 μE/(m2s)]营养海水胁迫处理第4天后依旧可以恢复至原初水平, 低强光自然海水组在前3 d的强光处理下无明显变化, 仅在第4天后降低至约0.6 (图4)。另一方面, 在营养海水条件下, 中等强度高光处理1 d及3 d后,v/m恢复程度明显高于自然海水条件下的样本。
2.4 不同条件下海带幼苗光合色素含量测定
如图5所示, 除高强光导致的β-胡萝卜素含量降低外, 其他强光处理各时间点β-胡萝卜素含量均高于对照, 且在胁迫的第3天, β-胡萝卜素含量相对较高。1 300~1 500 µE/(m2s)高强光处理下, 所有样本中岩藻黄素含量均低于对照。同时发现, 在胁迫的第5天, 无论哪种程度的强光胁迫下, 岩藻黄素含量亦均低于对照, 且随光强的减弱而含量有所升高, 营养海水培养下的藻体岩藻黄素含量高于自然海水。叶绿素含量与岩藻黄素的变化趋势一致, 1 300~1 500 µE/(m2s)强光处理下明显降低, 而在胁迫的第5天, 所有样本中叶绿素含量均低于对照, 且在营养海水培养下的藻体叶绿素含量明显高于自然海水(图5)。
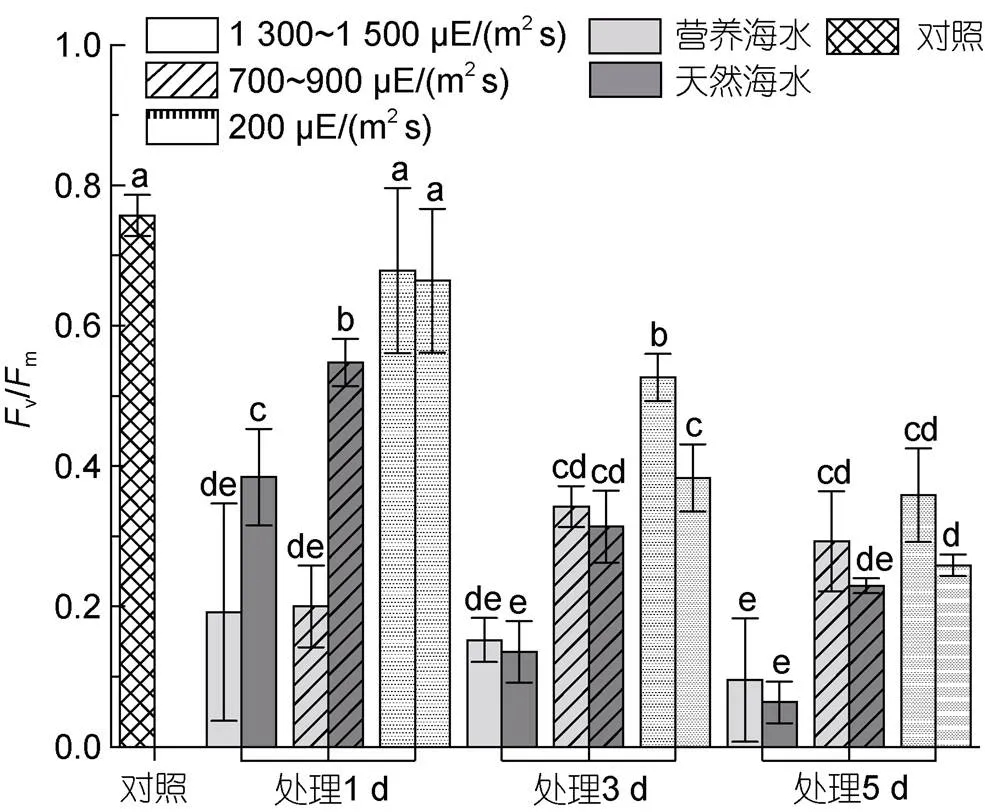
图3 不同光照强度、营养盐条件下海带幼苗Fv/Fm的变化
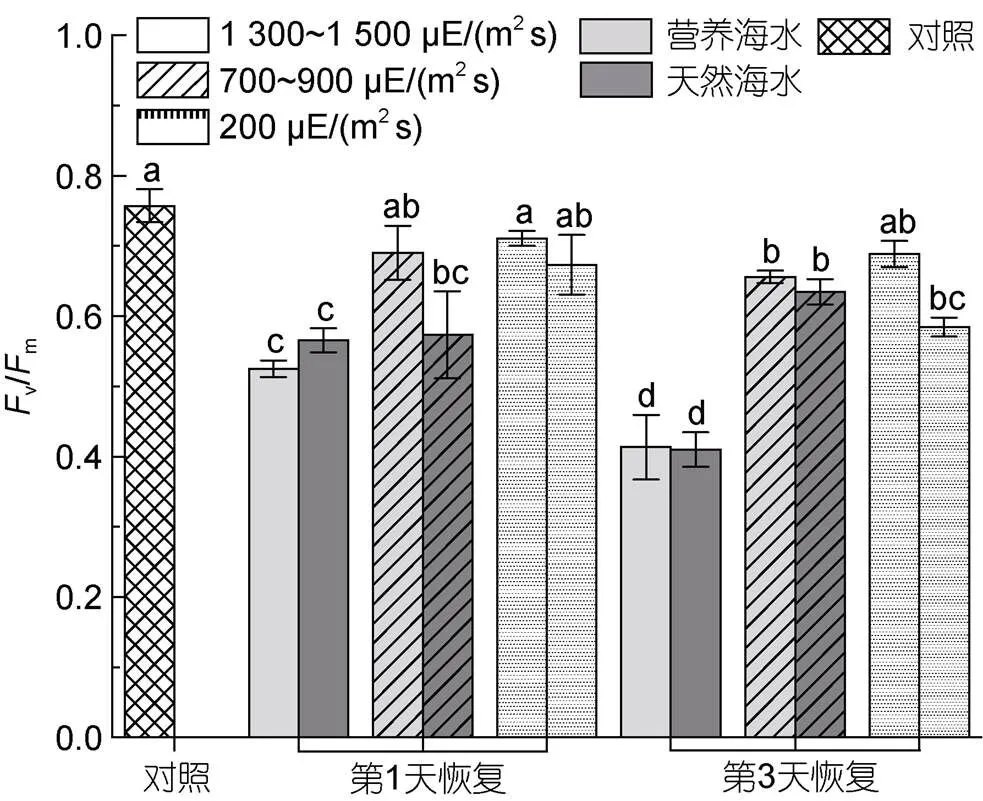
图4 胁迫处理不同时间海带幼苗Fv/Fm的恢复
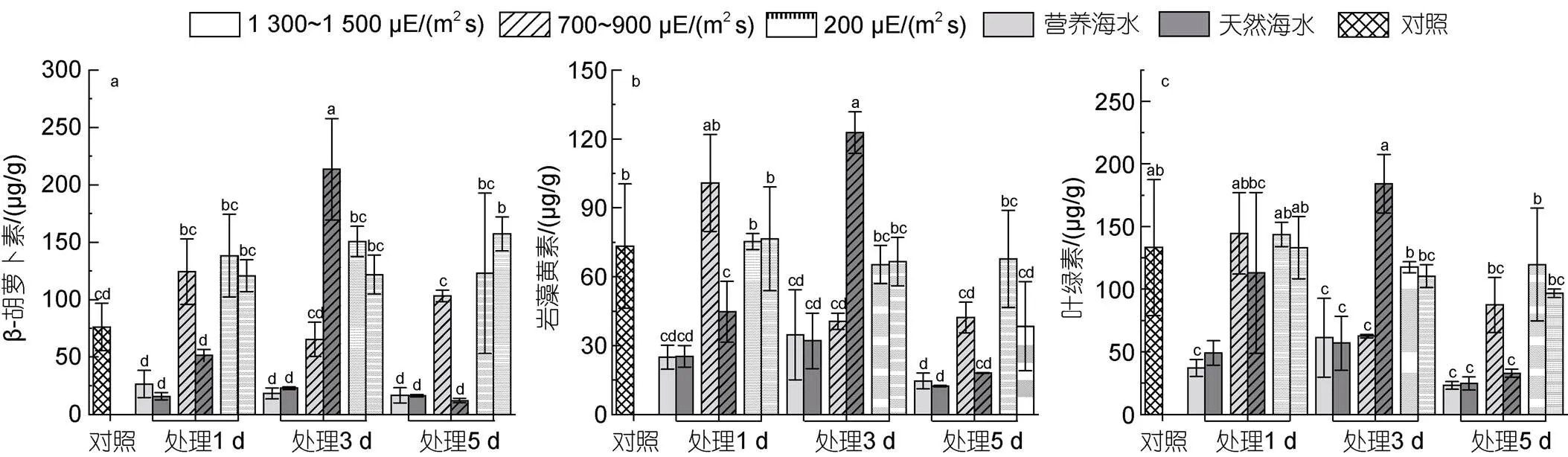
图5 不同光照强度、营养盐条件下海带幼苗光合色素含量的变化
注: a. β-胡萝卜素; b.岩藻黄素; c.叶绿素
2.5 不同条件下海带幼苗过氧化氢及丙二醛含量测定
如图6所示, 自然海水培养条件下, 强光胁迫过程中, 过氧化氢(H2O2)含量在不同强度胁迫光下均表现出先升后降的趋势; 营养海水培养条件下, H2O2含量变化趋势大致相同, 且随胁迫时间的延长, 各样本H2O2含量上调程度变得更加明显。在胁迫的第5天, 营养海水培养条件下H2O2含量显著高于同条件下自然海水中培养的藻体。
无论在自然海水还是营养海水培养条件下, 高强度强光下MDA含量随胁迫时间呈现逐渐下降的趋势, 中等及低等强光胁迫下, MDA含量呈现先上调再下降的趋势, 但直至实验结束, 藻体MDA含量均高于对照, 且营养海水培养条件下MDA含量高于自然海水培养下的含量(图7)。
2.6 不同条件下海带幼苗抗氧化酶比活力测定
整个强光胁迫实验过程中, 各样本总抗氧化能力(T-AOC)均高于对照, 且呈现随胁迫时间延长先升高后降低的趋势, 至实验结束时, 藻体T-AOC已经出现明显降低。此外, 在营养海水培养条件下, 藻体T-AOC显著高于自然海水培养条件下的总抗氧化能力(图8)。
与T-AOC相比, 整个光强胁迫实验过程中, SOD仅在个别样本中出现上调, 如在中等强光或低强光胁迫处理的中后期(图8)。自然海水培养条件下, SOD比活性随胁迫时间延长基本维持不变或略有下降; 营养海水培养条件下, 藻体SOD在中等强光胁迫下先上升再下降, 在低等强光照条件下, SOD比活性持续增加。自然海水条件下, POD比活性在强光胁迫下随胁迫时间延长, 大体上呈现先上调再下降的趋势; 而在营养海水条件下, POD活性在胁迫的起始和中间时段均略低于对照, 但在胁迫实验结束时, 其活性出现显著上调, 且上调程度随光照强度增加而增强。GR
活性因藻体不同差异较大, 大体上在营养海水培养条件下活性较高。在胁迫至第5天时, 低强光下藻体GR酶活高于中等强光处理藻体, 中等强光下藻体GR酶活又高于高强光处理藻体。
2.7 不同条件下海带幼苗抗氧化酶基因的表达变化
实时荧光定量结果显示, 强光胁迫条件下, SOD表达除个别样本外, 在大多数样本中均上调, 且高强光组SOD表达随胁迫时间延长而逐渐降低, 中等强度与低强度强光组表达大体上呈现先升高后降低的趋势。同时, 营养海水培养条件下SOD表达量一般高于同光照下自然海水培养条件。在胁迫处理的中后期, SOD的表达呈现随胁迫强光增加而其表达下调的趋势。
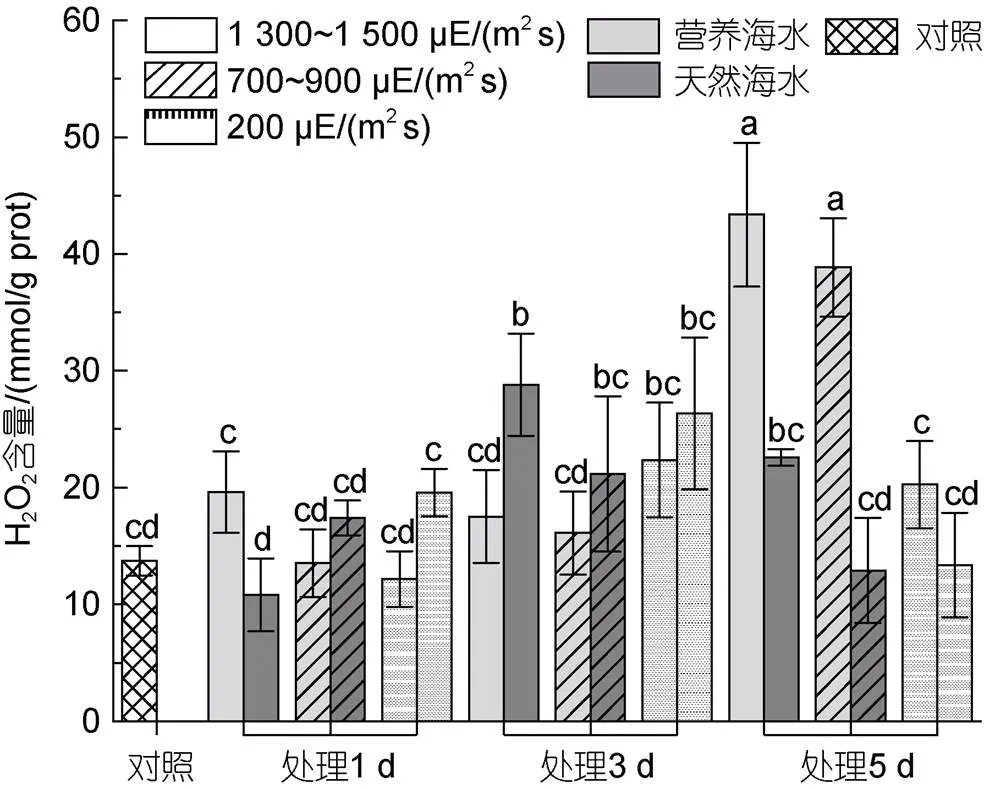
图6 不同光照强度、营养盐条件下海带幼苗H2O2的含量
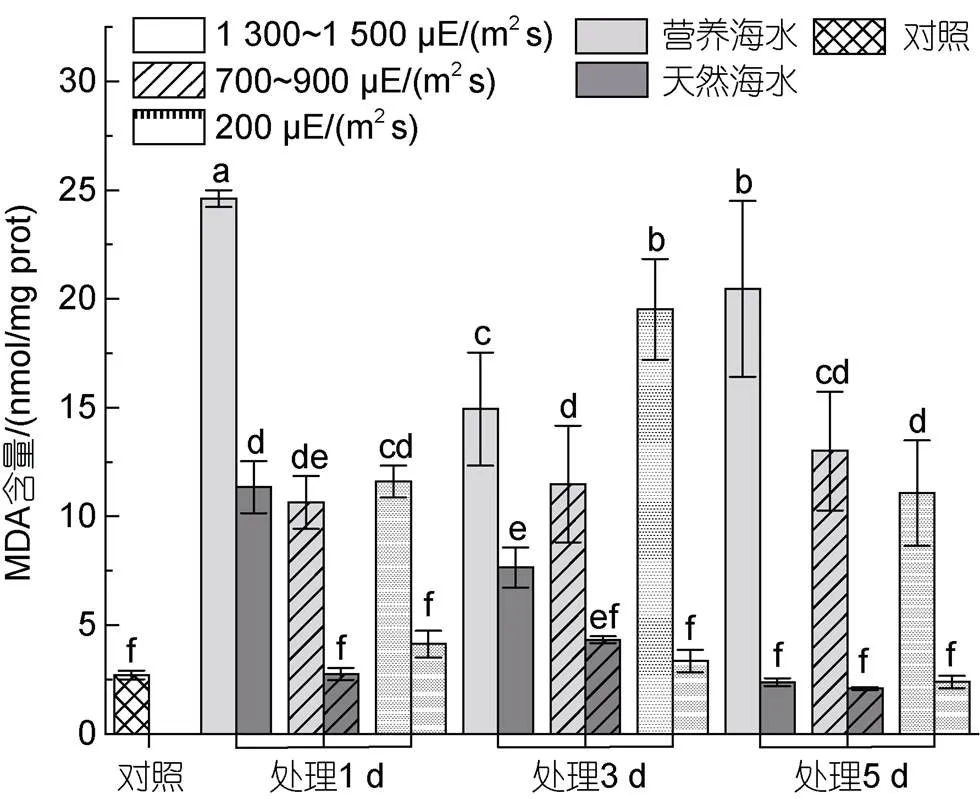
图7 不同光照强度、营养盐条件下海带幼苗MDA含量
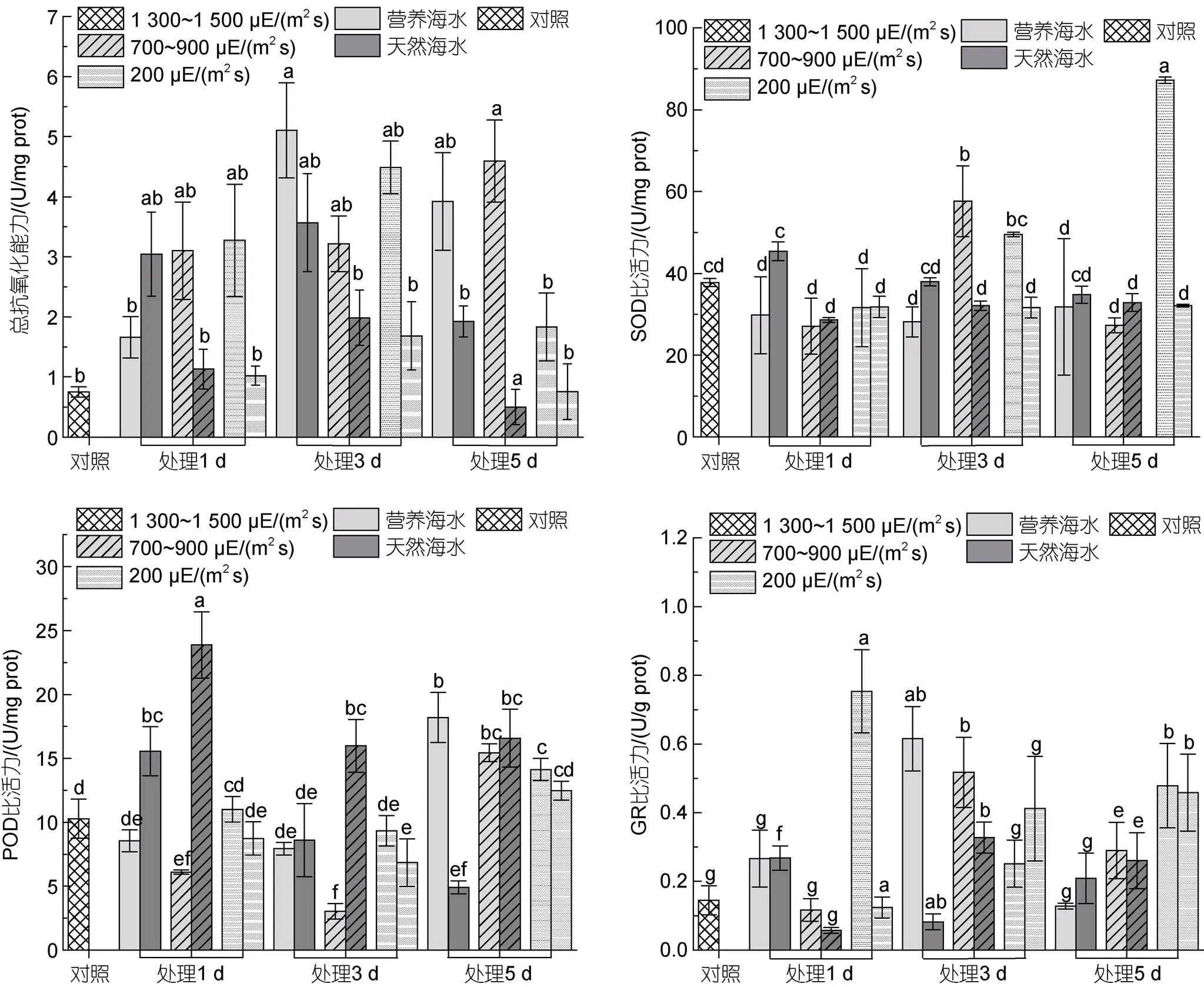
图8 海带幼苗不同处理条件下抗氧化活性变化
注: a. 总抗氧化能力; b. SOD比活力; c. POD比活力; d. GR比活力
POD的表达变化较为剧烈, 自然海水培养条件下, 其表达在高强光下几乎被抑制, 中等程度强光下, 其表达呈现先升后降的趋势, 但上调程度基本与对照无明显差别, 低强光下, 其表达在胁迫的起始阶段明显上调, 后持续降低, 至实验末期不能检测到其mRNA的表达。营养海水条件下, 除低强光胁迫下POD呈现先上调再下降的趋势外, 其他条件下POD表达变化趋势与自然海水培养的类似, 且表达水平高于自然海水培养的POD表达。
不同营养盐条件下, GR的表达均出现显著上调, 且在高强光条件下随胁迫时间延长其表达持续降低, 而在低强度高光条件下, 自然海水培养藻体中, GR表达持续降低, 而营养海水培养下藻体GR表达呈现先升后降的趋势。与未经胁迫的对照相比, 高强光胁迫下, GPX表达呈逐渐下调趋势, 只有低强度强光胁迫时, 藻体GPX表达明显上调, 且上调趋势随胁迫时间延长而逐渐降低, 同时发现, 大多数情况下, 营养海水培养条件下GPX表达量高于自然海水培养条件下GPX的表达。
3 讨论
3.1 海带饱和光强与藻体大小及生长环境密切相关
植物对光照强度的适应或需求存在一定的适宜范围, 在合适的光照范围内, 随光照强度的增加, 光合效率增加, 但当超过饱和光强后, 光合作用反而会受到影响, 严重时还可能导致光合作用元件遭受损伤。关于海带的饱和光强, 本实验测定结果显示其最小饱和光强(半饱和光强)为163 μE/(m2s), 明显高于程晓鹏等(2020)的测定结果。研究表明, 海带耐受的光照强度随孢子体的变大而减弱(段德麟等, 2015), 我们使用的实验材料为海带幼苗, 长度在20~30 cm之间, 而程晓鹏等(2020)测定的海带孢子体样品叶长为(71.8±11.2) cm, 这可能是造成明显差异的直接原因。而另据报道, 在海区分苗后的正常栽培时期, 海带比较合理的光照范围为14 000~22 000 lx, 约280~440 μE/(m2s) (张起信, 1994)。综上, 关于海带的饱和光强, 因藻体大小、生理状态或测定方法, 抑或测定环境不同, 导致具体结果存在较大差异。但可以肯定的是, 其饱和光强相对较低。
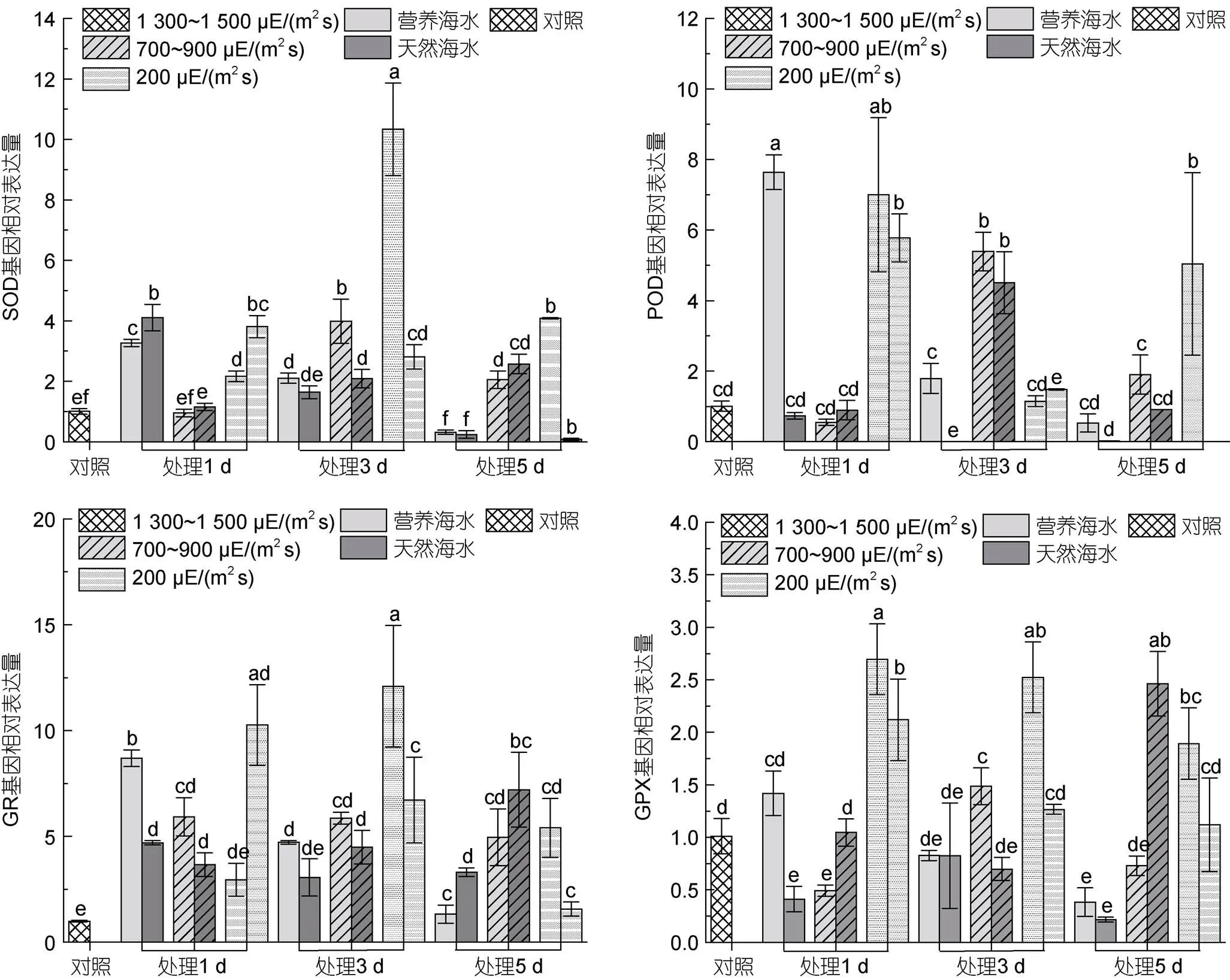
图9 海带幼苗不同处理条件下抗氧化酶基因的表达变化
注: a. SOD基因相对表达量; b. POD基因相对表达量; c. GR基因相对表达量; d. GPX基因相对表达量
3.2 强光对海带幼孢子体光合作用的影响
v/m是光系统Ⅱ(PSⅡ)最大光化学效率, 代表了PSⅡ反应中心原初光能转化效率, 是光化学反应的重要参数, 在正常环境条件下, 植物v/m极少变化, 而当v/m明显下降时, 就表示植物受到了强烈胁迫(卢从明等, 1995)。本实验中无论是较低的200 μE/(m2s)强光处理组, 还是中等或1 300~ 1 500 μE/(m2s)的高强光处理组,v/m值均出现逐渐下降的趋势。在不同光照强度处理组间, 相同处理条件下, 200 μE/(m2s)组v/m高于700~900 μE/(m2s)处理组, 又明显高于1 300~1 500 μE/(m2s)处理组。说明实验中使用的光照强度确实对测试的海带藻体产生了胁迫伤害, 导致其v/m随处理时间增加而降低。另外, 导致藻体v/m值逐渐降低的可能原因还包括实验材料较大, 水体体积相对较小, 无流水刺激等。
PSII对环境的变化非常敏感, 在不利或者胁迫环境条件下PSII的活性比其他生理活性下降更快(Demmig-Adams, 1992; Aro, 1993; Andersson, 1997)。PSII的修复循环是叶绿体适应胁迫环境的重要机制之一, 但当PSII的损伤速率超过修复速率时, 就会导致藻体PSII无法被修复而降低(Tikkanen, 2014)。条斑紫菜中, Kang等(2022)认为酸处理后, 如果藻体v/m0.183, 则复苏后光合作用可以得到恢复, 但当胁迫后v/m低于0.183时, 藻体PSII就可能已经遭受到了不可逆的损伤, 藻体光合作用会随时间推移而持续下降。造成光合作用持续下降的原因可能是PSII的修复受到了影响。本研究中, 海带在1 300~1 500 μE/(m2s)强光下胁迫6 h后, 自然海水培养下的藻体v/m降至0.2以下, 营养海水培养下的v/m降至约0.4, 但即使过夜复苏, 也不能恢复至正常对照水平。但在700~900 μE/(m2s)光照强度下, 即使连续胁迫3 d,v/m已降至0.3, 过夜后也可恢复。由此可见, 海带PSII能够较长时间耐受700~900 μE/(m2s)的强光胁迫, 而且营养盐含量较高的海水可能有助于PSII的修复。
对PSII造成破坏的最主要环境因素是强光, 强光导致的光抑制最显著的结果是PSII光化学效率和光合碳同化量子效率的降低, 显著特征之一是PSII的结构和功能的破坏。而在强光条件下, 低温胁迫又明显地促进了PSII光抑制的发生(Öquist, 1993)和PSII蛋白合成的抑制(Allakhverdiev, 2004)。因此, 低温与强光共同作用下, 藻体光合作用更容易受到影响。植物光合作用是温度、光照、营养盐水平等诸多因素共同作用的结果(刘露等, 2013), PSII复合体中被破坏的蛋白质的周转对维持其功能状态非常重要, 即高效的蛋白合成系统及营养盐供应可能也是影响植物适应能力的重要因素。正如本研究所示, 在实验进行的第3天开始, 营养海水培养条件下, 在强光处理及复苏后的v/m值均高于天然海水培养的藻体, 这种差别在实验进行的后期更为明显(图3和图4)。据此推测, 水体营养盐水平对海带响应逆境胁迫具有积极意义, 即在营养盐相对较丰富的水体中, 藻体具有更高的逆境耐受能力。
3.3 海带幼孢子体对波动光的适应
本研究中, 我们采用了恒定强光对海带进行了胁迫处理。虽然我们的研究结果表明, 200 μE/(m2s)的光照强度已经构成了海带幼苗的胁迫光强, 但自然界中光合生物总是处在不断变化的光照条件下的, 海水表面的饱和太阳光强可以达到2 000 μE/(m2s), 有时甚至更强(Long, 1994)。此外, 海洋因具有规律且连续的波浪、棱镜效应, 从而产生亮带或斑块的水平波(Schubert, 2001), 导致海洋藻类频繁地暴露在不断波动的光环境中。由于海带藻体在波浪作用下的相互遮挡造成的光强变化, 也导致海带处在一种光照条件剧烈波动的环境中。据报道, 在翻滚培养(tumbled culture)模式下, 50 000 lx可见光及400 μW/cm2紫外光共同作用10~20 s的条件下, 海带最大荧光得率未表现出明显下降, 而且在此光照条件下, 对海带处理50~60 s, 低温复苏24 h后, 其光合作用可以得到完全恢复(Pang, 2008)。这很好地解释了为什么不同研究人员测定得到的海区栽培海带饱和光强显著低于海区实际光照强度, 而海带仍可以正常生长的原因。即自然栽培的海带在海浪的作用下, 藻体间通常会出现彼此的遮挡, 从而使得藻体不至于长时间处于胁迫强光照射下, 同时, 也可能因为海带因具有适应这种波动光照条件的能力, 故可正常生长发育。
海带之所以能够适应波动光, 是因为其光能捕获系统由叶绿素/-岩藻黄素-叶绿素蛋白复合物FCP (fucoxanthin-chlorophyll proteins)构成。这种捕光色素系统不仅在弱光条件下能有效捕获光能, 最大限度地吸收蓝光和绿光, 在强光条件下还能耗散多余能量(Wang, 2019)。在此领域研究较多的是具有极高生理“柔性”, 可适应复杂和动态环境的海洋硅藻(Kooistra, 2007)。研究证明, 硅藻中FCP复合物可通过岩藻黄素及其相关蛋白的相互作用的改变或修饰, 实现向光系统转移多余能量(Tanabe, 2020), 从而发挥能量耗散的作用, 这种机制在藻类应对光胁迫时至关重要(Derks, 2015; Wang, 2019)。
这种机制可能包括两个过程, 分别为短期(S/min)的质子梯度和光系统活性调节, 以及长期(h/d)的光合色素和Rubisco等碳代谢酶(Long, 1994)的合成。质体MEP途径中的DXS (一种光诱导的酶, 通过促进类胡萝卜素合成实现光保护)在剧烈的波动光下增加(Athanasakoglou, 2019), 光照条件的剧烈波动还可能会严重刺激这些依赖光的基因表达。本研究中, 我们虽仅使用了恒定强光开展了胁迫实验, 结果显示海带中β-胡萝卜素含量除在1 300~1 500 µE/(m2s)强光处理下降低外, 其他条件下均上调, 说明β-胡萝卜素的合成对海带响应强光胁迫具有重要作用, 而岩藻黄素与叶绿素的合成随胁迫时间的延长出现明显的降低, 尤其在实验末期, 说明强光降低了叶绿体中类囊体的数量, 并对叶绿素及岩藻黄素的合成产生负面影响(Lichtenthale, 1983), 这也暗示藻体状态可能受到了较严重的影响, 导致各色素含量降低。同时发现, 在胁迫的第3天, 虽然在自然海水培养条件下具有相对较高的色素含量, 但在胁迫实验的末期, 营养海水中培养的藻体具有更强的强光耐受能力。
3.4 强光胁迫导致的抗氧化酶活性降低影响了海带幼孢子体光合生理活性
光抑制条件下, PSII的原初电子受体被过度还原(Vass, 1992), 或者PSII的受体侧及供体侧之间的电荷发生重组而产生活性氧自由基(ROS) (Keren, 1997)。这些ROS如不能被及时清除, 就可能直接攻击PSII的光化学反应中心。研究发现, 在外源H2O2添加或H2O2清除酶被抑制的条件下, PSII的修复受到了抑制(Nishiyama, 2001)。因此, 叶绿素吸收的过多的光能可能导致PSII光化学反应中心失活(Ohnishi, 2005), 而胞间H2O2和1O2的水平的增加可明显抑制PSII修复, 增加光抑制的程度(Nishiyama, 2001, 2004; Allakhverdiev, 2004)。
逆境中藻体产生的ROS主要通过抗氧化系统被清除, 这包括酶促抗氧化系统和非酶促抗氧化系统, 而总抗氧化能力是用来衡量机体抗氧化系统功能状况的综合性指标, 反映了机体对外来刺激的代偿能力及机体自由基代谢的状态。本文结果显示, T-AOC在强光胁迫的第3天上调, 而在胁迫第5天时又呈下降趋势。同时发现, 在营养盐含量较高的处理组中, 各样本T-AOC均高于天然海水处理组样本(图8), 说明在整个强光胁迫处理过程中, 海带总抗氧化能力在一定程度上得到了诱导, 尤其在营养盐相对丰富的条件下。然而强光胁迫或实验中培养条件的限制, 最终影响了海带正常生理过程, 导致末期T-AOC下调。
生物体酶促抗氧化系统包括SOD、POD、CAT及GR等多种抗氧化酶, 其中, SOD存在于所有需氧生物, 通过歧化作用将O2–转化为O2和H2O2, 形成了植物在逆境中清除ROS的第一道防线。本研究结果显示, 在强光胁迫6 h的条件下, 藻体内SOD活性均受到了抑制, 而在胁迫处理的第3天, SOD比活性的微弱上调(图8), 说明海带细胞内SOD在对强光胁迫的适应过程中发挥重要作用, 而胁迫培养的末期, 高营养盐条件下SOD活性相对较高, 也证明水体营养盐含量对抗逆机制的维持确实具有一定意义。与酶活测定结果不同的是, SOD的表达除在1 300~1 500 μE/(m2s)高强光胁迫的第5天外, 其他营养海水培养条件下的表达均上调, 且在胁迫的第3天, SOD表达最为活跃(图9), 同样证明海带在强光胁迫的第3天具有最强的抗氧化响应能力。而在处理的第5天, SOD的表达已受到抑制, 受影响程度随光照强度增加而增加。
梁洲瑞等(2019)报道, 极北海带幼苗中, SOD和POD可协同作用清除细胞内由高光导致的ROS累积, 对高光逆境发生积极响应。本研究也发现在天然海水处理组, 各强光处理的第3天, POD活性最高, 而营养盐含量较高的海水中, POD活性上调时间出现后移, 因此, POD的活性与藻体的营养状态存在较强的关联。从POD基因的表达方面, 也得到类似结果。因此, 强光胁迫与营养缺乏的叠加, 最终会导致细胞受到越来越严重的氧化损伤, POD表达及比活下降。叶绿体中的H2O2主要是通过Halliwell-Asada途径被清除, 极北海带幼苗产生的H2O2主要通过抗坏血酸过氧化物酶(APX)和GR进行了清除(梁洲瑞等, 2019)。本研究发现GR比活性在胁迫处理的第5天, 强度大于700~900 μE/(m2s)的光照条件下, GR活性显著降低, 因此, 在光照强度大于700~900 μE/(m2s)的条件下, 无论是天然海水还是营养盐含量较高的海水中, 海带幼体均受到了较为严重的氧化损伤。GR的转录结果也显示, 在胁迫处理的第3天具有相对较强的胁迫响应能力, 而在胁迫的第5天藻体表达GR的能力均受到了一定程度的抑制。
在胁迫条件下, 植物细胞中酶促和非酶促过程均会导致ROS产生的增强, 各种形式的ROS在抗氧化酶的作用下最终转化成毒性较小的H2O2而被代谢。细胞内H2O2的水平不仅与其清除有关, 而且与其产生密切关联。本实验起始阶段, 强光下H2O2的累积说明藻体可能已经受到较为严重的损伤, 导致积累的H2O2不能被及时清除。这种累积效应在低营养盐培养的样本中更为明显, 因此导致H2O2在强光胁迫的第3天出现明显的累积。相比较而言, 在高营养盐处理组中, H2O2的积累在胁迫的第5天发生, 因此, 高营养盐培养下的藻体具有更强的抗氧化能力。而此时海水处理组H2O2水平下调, 说明藻体中合成H2O2的代谢可能已经受到了抑制。形成的过氧化氢, 即使在低浓度下, 也会通过氧化酶蛋白的巯基来抑制酶的活性(Noctor, 1998)。通过Haber-Weiss反应, H2O2可以转化为羟自由基而引起脂质过氧化, 从而导致细胞膜的氧化损伤(Kehrer, 2000)。本实验中, 不同强光胁迫下, 营养海水培养组中海带藻体均具有较高的MDA含量, 但其光合活性及抗氧化能力均高于天然海水处理组, 其原因有待进一步研究。
4 结论
海带光合捕光色素蛋白复合体由叶绿素/-岩藻黄素-叶绿素蛋白复合物(FCP)构成, 这使得其对自然海区剧烈波动的光照条件具有较高的生理适应“柔性”。在弱光条件下, 可以最大限度地吸收蓝光和绿光, 而在瞬时强光条件下, 又可对过剩的能量吸收进行有效耗散。然而, 岩藻黄素属于还原性分子, 容易被氧化失活, 持续强光照射对海带捕光色素复合体可能造成较严重伤害。本研究证明海带幼苗可较长时间耐受700~900 μE/(m2s)的强光胁迫, 而在海区栽培的现场条件下, 波浪引起的藻体摆动及藻体间相互遮挡等效应, 可较大幅度地提升藻体可耐受强光的能力。另一方面, 海带抗氧化酶活性在强光胁迫时上调, 抗氧化酶基因表达上调, β-胡萝卜素合成增加, 这也是海带应对强光胁迫的重要生理机制之一。同时,海水营养盐水平对光系统的修复及抗氧化能力的维持均具有重要意义。因此, 在水流和波浪较大的栽培海区, 海水交换充分, 营养供应充足, 海带接受的光照强度处于剧烈变动状态, 生长通常较好; 但当栽培海区长时间水流不畅, 波浪较小, 水质太过清澈的时候, 海带遭受持续的强光胁迫, 就可能导致其光系统损伤的发生, 并最终引发病烂发生。
致谢 特别感谢福建省国家级学会创新驱动服务站(中国海洋湖沼学会-福建一嘉海带苗业有限公司)董志安提供实验用海带幼苗; 江苏省启东市连涛水产养殖专业合作社李平在山东青岛即墨海区对材料的适应性暂养。谨致谢忱。
水产辞典编辑委员会, 2007. 水产辞典[M]. 上海: 上海辞书出版社.
卢从明, 张其德, 匡廷云, 1995. 水分胁迫对小麦叶绿体激发能分配和光系统Ⅱ原初光能转换效率的影响[J]. 生物物理学报, 11(1): 82-86.
刘露, 丁柳丽, 陈伟洲, 等, 2013. 不同温度下CO2浓度增高对坛紫菜生长和叶绿素荧光特性的影响[J]. 生态学报, 33(13): 3916-3924.
苏丽, 2018. 与海带品种培育相关的繁殖与栽培问题的研究[D]. 青岛: 中国科学院大学(中国科学院海洋研究所).
张起信, 1994. 海带生长与光照的关系[J]. 中国水产(6): 34-35.
陈书秀, 孙娟, 李霞, 等, 2021. 光照强度和光照周期对笼目海带配子体发育的影响[J]. 渔业研究, 43(2): 153-159.
国家藻类产业技术体系, 2021. 海带产业发展报告[J]. 中国水产(8): 23-41.
段德麟, 缪国荣, 王秀良, 等, 2015. 海带养殖生物学[M]. 北京: 科学出版社.
姚南瑜, 李建之, 1981. 海带光合特性研究[J]. 植物生理学通讯, 27(4): 18-20, 34.
黄健, 唐学玺, 段德麟, 等, 2002. 不同光照条件下海带体内各种化合物的含量及光合作用和呼吸作用的变化[J]. 海洋科学, 26(4): 55-58.
梁洲瑞, 刘福利, 杜欣欣, 等, 2019. 光强对极北海带幼苗生长和生化特性的影响[J]. 渔业科学进展, 40(4): 115-122.
程晓鹏, 章守宇, 林军, 等, 2020. 海带孢子体光合活性对不同温度和光照的响应[J]. 水产学报, 44(2): 234-244.
ALLAKHVERDIEV S I, MURATA N, 2004. Environmental stress inhibits the synthesis de novo of proteins involved in the photodamage-repair cycle of photosystem II insp. PCC 6803 [J]. Biochimica et Biophysica Acta (BBA) - Bioenergetics, 1657(1): 23-32.
ANDERSSON B, ARO E M, 1997. Proteolytic activities and proteases of plant chloroplasts [J]. Physiologia Plantarum, 100(4): 780-793.
ARO E M, VIRGIN I, ANDERSSON B, 1993. Photoinhibition of photosystem II. Inactivation, protein damage and turnover [J]. Biochimica et Biophysica Acta (BBA) - Bioenergetics, 1143(2): 113-134.
ATHANASAKOGLOU A, KAMPRANIS S C, 2019. Diatom isoprenoids: advances and biotechnological potential [J]. Biotechnology Advances, 37(8): 107417.
DEMMIG-ADAMS B, ADAMS W W, 1992. Photoprotection and other responses of plants to high light stress [J]. Annual Review of Plant Physiology and Plant Molecular Biology, 43: 599-626.
DERKS A, SCHAVEN K, BRUCE D, 2015. Diverse mechanisms for photoprotection in photosynthesis. Dynamic regulation of photosystem II excitation in response to rapid environmental change [J]. Biochimica et Biophysica Acta (BBA) - Bioenergetics, 1847(4/5): 468-485.
EILERS P, PEETERS J, 1988. A model for the relationship between light intensity and the rate of photosynthesis in phytoplankton [J]. Ecological Modelling, 42: 199-215.
ENRIQUEZ M M, LAFOUNTAIN A M, BUDARZ J,, 2010. Direct determination of the excited state energies of the xanthophylls diadinoxanthin and diatoxanthin from[J]. Chemical Physics Letters, 493(4/5/6): 353-357.
KANG E J, KIM J H, 2022. Development of an efficiency criterion for the removal of pest organisms (ulvoid green algae and diatoms) fromaquaculture using the acid wash (pH shock) method [J]. Aquaculture, 548: 737677.
KEHRER J P, 2000. The Haber-Weiss reaction and mechanisms of toxicity [J]. Toxicology, 149(1): 43-50.
KEREN N, BERG A, VAN KAN P J M,, 1997. Mechanism of photosystem II photoinactivation and D1 protein degradation at low light: the role of back electron flow [J]. Proceedings of the National Academy of Sciences of the United States of America, 94(4): 1579-1584.
KOOISTRA W H C F, GERSONDE R, MEDLIN L K,, 2007. The origin and evolution of the diatoms: their adaptation to a planktonic existence [M] // FALKOWSKI P G, KNOLL A H. Evolution of Primary Producers in the Sea. Boston: Academic Press: 207-249.
LICHTENTHALE H K, BURGSTAHLER R, BUSCHMANN C,, 1983. Effect of high light and high light stress on composition, function and structure of the photosynthetic apparatus [M] // MARCELLE R, CLIJSTERS H, POUCKE M. Effects of Stress on Photosynthesis. Dordrecht: Springer: 353-370.
LIVAK K J, SCHMITTGEN T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCtmethod [J]. Methods, 25(4): 402-408.
LONG S P, HUMPHRIES S, FALKOWSKI P G, 1994. Photoinhibition of photosynthesis in nature [J]. Annual Review of Plant Physiology and Plant Molecular Biology, 45: 633-662.
NISHIYAMA Y, ALLAKHVERDIEV S I, YAMAMOTO H,, 2004. Singlet oxygen inhibits the repair of photosystem II by suppressing the translation elongation of the D1 protein insp. PCC 6803 [J]. Biochemistry, 43(35): 11321-11330.
NISHIYAMA Y, YAMAMOTO H, ALLAKHVERDIEV S I,, 2001. Oxidative stress inhibits the repair of photodamage to the photosynthetic machinery [J]. The EMBO Journal, 20(20): 5587-5594.
NOCTOR G, ARISI A C M, JOUANIN L,, 1998. Glutathione: biosynthesis, metabolism and relationship to stress tolerance explored in transformed plants [J]. Journal of Experimental Botany, 49(321): 623-647.
OHNISHI N, ALLAKHVERDIEV S I, TAKAHASHI S,, 2005. Two-step mechanism of photodamage to photosystem II: step 1 occurs at the oxygen-evolving complex and step 2 occurs at the photochemical reaction center [J]. Biochemistry, 44(23): 8494-8499.
ÖQUIST G, HURRY V M, HUNER N P A, 1993. Low-temperature effects on photosynthesis and correlation with freezing tolerance in spring and winter cultivars of wheat and rye [J]. Plant Physiology, 101(1): 245-250.
PANG S J, SHAN T F, 2008. Temperature and light tolerance of representative brown, green and red algae in tumble culture revealed by chlorophyll fluorescence measurements [J]. Acta Oceanologica Sinica, 27(4): 137-146.
SCHUBERT H, SAGERT S, FORSTER R M, 2001. Evaluation of the different levels of variability in the underwater light field of a shallow estuary [J]. Helgoland Marine Research, 55(1): 12-22.
TANABE M, UENO Y, YOKONO M,, 2020. Changes in excitation relaxation of diatoms in response to fluctuating light, probed by fluorescence spectroscopies [J]. Photosynthesis Research, 146(1/2/3): 143-150.
THAYER S S, BJÖRKMAN O, 1990. Leaf xanthophyll content and composition in sun and shade determined by HPLC [J]. Photosynthesis Research, 23(3): 331-343.
TIKKANEN M, MEKALA N R, ARO E M, 2014. Photosystem II photoinhibition-repair cycle protects Photosystem I from irreversible damage [J]. Biochimica et Biophysica Acta (BBA) - Bioenergetics, 1837(1): 210-215.
VASS I, STYRING S, HUNDAL T,, 1992. Reversible and irreversible intermediates during photoinhibition of photosystem II: stable reduced QA species promote chlorophyll triplet formation [J]. Proceedings of the National Academy of Sciences of the United States of America, 89(4): 1408-1412.
WANG W D, YU L J, XU C Z,, 2019. Structural basis for blue-green light harvesting and energy dissipation in diatoms [J]. Science, 363(6427): eaav0365.
EFFECTS OF STRONG LIGHT STRESS ON PHOTOSYNTHESIS AND PHYSIOLOGY OFSEEDLINGS
NIU Jian-Feng1, 2, 6, FENG Ze-Zhong1, 4, SUN Zhen-Jie1, 4, WANG Wei-Wei3, ZHANG Xiao-Wen5, LIANG Guang-Jin3, WANG Li-Jun1, 2, 6, LI Xiao-Jie3, WANG Guang-Ce1, 2, 6
(1. Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China; 3. Provincial Key Laboratory of Algae Genetic Breeding and Cultivation Techniques of Shandong, Shandong Oriental Ocean Sci-tech Co. Ltd., Yantai 264003, China; 4. Qingdao Agricultural University, Qingdao 266109, China; 5. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China; 6. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao, 266071, China)
is one of the main species of algae cultivated in China, and its cultivation scale and yield rank first in the world. In the production season of 2021~2022, a large-scale disease disaster outbreak occurred in the area of Rongcheng, Shandong, causing huge losses to the local aquatic economy. The causes of the disease may come from many aspects. Among them, the excessive strong solar irradiance and the low nutrient level in the seawater could be accounted. Based on the results of the minimum saturated light intensity of, the concentrations of nitrogen and phosphorus in natural seawater, the effects of different strong light on the physiology ofat different seawater nutrient levels were studied. Results showed that the PSII of seedlings ofcould be well maintained under 700~900 μE/(m2s) for a long time and the relatively high nutrient level of seawater contributed to the repairment of PSII under high light stress conditions. However, under the light condition of 1 300~1 500 μE/(m2s), the recovery of PSII was damaged and the contents of fucoxanthin, chlorophylland β-carotene decreased significantly. Through the whole experiment of light stress, the total antioxidant capacity (T-AOC) and specific activities of antioxidant enzymes of the algae were generally up-regulated from the beginning of treatment to the third day, but decreased on the fifth day of experiment. Moreover, the enzyme activities of the algae incubated with nutrient seawater were higher than those incubated with the natural seawater. The expression of antioxidant enzyme genes also showed a similar trend. In summary, the antioxidant enzyme system was active for several days below 900 μE/(m2s) and the addition of exogenous nutrients could extend the activity maintenance period. This provided some clues to understanding of outbreak of disease disaster in Rongcheng.Key words high light stress; scavenging of reactive oxygen species; repairment of photosystem;seedlings; antioxidant enzymes; fucoxanthin; β-carotene
Q539; Q51
10.11693/hyhz20220500127
*国家重点研发计划“蓝色粮仓科技创新”重点专项项目, 2018YFD0901500号; 财政部和农业农村部: 国家现代农业产业技术体系资助, CARS-50号。牛建峰, E-mail: jf_niu@qdio.ac.cn
李晓捷, 硕士生导师, 研究员, E-mail: yeslxj@sina.com; 王广策, 博士生导师, 研究员, E-mail: gcwang@qdio.ac.cn
2022-05-11,
2022-07-04
