合成MRI技术研究基于弛豫时间的脑恶性肿瘤异质性*
2023-01-16姚婷语李建婷武文奇张润梅牛金亮
姚婷语 李建婷 武文奇 张润梅 牛金亮,*
1.山西医科大学医学影像学院 (山西 太原 030001)
2.山西医科大学第二医院影像科 (山西 太原 030001)
肿瘤异质性是指肿瘤内与肿瘤间存在形态、功能差异的肿瘤细胞,在脑恶性肿瘤中普遍存在,表现为肿瘤细胞对化学药物敏感性、浸润和转移、生长速度等生物学特性不同,与肿瘤发生发展、诊疗及预后密切相关[1-2]。目前扩散加权成像、磁共振波谱、动态增强MRI等MRI功能成像方法是定量研究脑肿瘤异质性的影像学方法,可以从水分子的扩散能力、代谢产物的含量及微循环血流灌注等多角度分析肿瘤组织的生物学特点,全面分析肿瘤时间及空间的异质性[3-7]。T1、T2弛豫时间和质子密度(PD)是MRI描述组织的磁化强度矢量特性的基本参量,也是定量分析人体组织生物特性的关键指征,常规MRI扫描由于软硬件条件制约,T1、T2弛豫时间无法应用于临床。合成MRI(synthetic magnetic resonance imaging,SyMRI)技术一次扫描就可以获得组织的T1、T2及PD值,并能实时重建多种MRI加权图像[8],从而以弛豫时间的不同为定量地探讨肿瘤组织的异质性。本文选择两种较普遍的颅内恶性肿瘤:高级别胶质瘤(high grade glioma,HGG)和脑转移瘤(brain metastasis,BM),通过对SyMRI技术在脑恶性肿瘤中的应用进行了分析。
1 资料与方法
1.1 临床资料对51名临床诊断为HGG及BM的患者进行了随访。本研究共纳入20名HGG患者及31名BM患者,其中HGG患者男8名,女12名,平均年龄为17至67岁;BM患者男21名,女10名,平均年龄为25至70岁;7例为单发性BM,24例为双发或多发BM,27例为肺癌,2例为乳腺癌,1例为肾癌,1例为子宫内膜癌。
纳入标准:经组织活检证实为 HGG或BM;全部患者都知情同意。排除标准:原发BM是恶性黑色素瘤;初次诊断,未接受放射治疗或化学治疗;影像品质达不到诊断标准。
1.2 检查方法用3.0T超导型磁共振扫描仪(GE公司,3.0T Pioneer)头部线圈扫描患者,头部先进,仰卧位。进行头颅SyMRI和常规序列平扫和增强扫描,造影剂为钆双胺,剂量为0.1 mmol/kg,经肘静脉注射。SyMRI序列扫描参数:TR=4011ms,TE=20.4ms,FOV=24×24cm,层厚=6.0mm,层间距=1.0mm,NEX=1.00。常规序列扫描:T1FLAIR、T2WI、T2FLAIR平扫,T1FLAIR增强扫描。T1FLAIR扫描参数为:TR=2522.2ms,TE=18.3ms,FOV=24×24cm,NEX=1.00。T2WI扫描参数为:TR=4879ms,TE=105.4ms,FOV=24×24cm,NEX=1.00。T2FLAIR扫描参数为:TR=8000ms,TE=99.5ms,FOV=24×24cm,NEX=1.00。T1FLAIR增强扫描参数为:TR=2637ms,TE=24ms,FOV=24×24cm,NEX=1.00。常规序列扫描的层厚、层间距及解剖定位与SyMRI序列一致。
1.3 MRI图像后处理与测量SyMRI序列扫描后,在主机上生成定量参数图和重建T1FLAIR、T2FLAIR、T2WI等图像上勾画感兴趣区(regions of interest,ROI),肿瘤实质ROI在肿瘤最大层面勾画,并避开出血坏死、囊变区,瘤旁ROI在瘤体旁1cm内的瘤周组织勾画。所有ROI由两名资深放射科医师共同选择,每个ROI测量3次,并取平均值。
1.3.1 SyMRI合成图像与常规图像肿瘤-瘤周对比度的测量 在SyMRI合成的MRI加权像和相应的常规MRI序列图像上勾画 ROI后测量其信号强度SI。肿瘤-瘤周对比度=(SI肿瘤-SI瘤周)/SI瘤周。
1.3.2 HGG和BM肿瘤实质及瘤周组织T1值、T2值、PD值及增强T1值的测量 在生成的定量参数图上确定ROI,测量平扫T1值、T2值、PD值及增强T1值,计算肿瘤实质增强前、后T1值变化的百分比,即(平扫T1值-增强T1值)/增强T1值×100%。
1.4 统计学分析采用SPSS 26.0软件,对所有的测量值行方差齐性检验和正态性检验,若服从,则采用配对样本t检验分析SyMRI合成图像及常规图像肿瘤-瘤周对比度的差异,采用独立样本t检验分析HGG和BM肿瘤实质及瘤周组织各个参数的差异,测量数据用均数±标准差表示。若不服从方差齐性检验和正态性检验,则采用Wilcoxon符号秩检验或Mann-Whitney U检验进行分析,测量数据用中位数(下四分位数,上四分位数)表示。绘制受试者工作特征曲线(receiver operating characteristic curve,ROC),计算曲线下面积(area under ROC curve,AUC),并分析各测量值对HGG和BM的鉴别诊断价值,P<0.05表示差异有统计学意义。
2 结果
2.1 SyMRI序列合成加权图像与常规序列肿瘤-瘤周对比度的比较51例脑肿瘤平扫SyMRI-T2FLAIR和增强SyMRI-T1FLAIR肿瘤-瘤周对比度均高于相应的常规MRI加权像,差异有统计学意义(P均<0.05)。平扫SyMRI-T1FLAIR、SyMRI-T2WI与常规MRI加权像的肿瘤-瘤周对比度的差异均无统计学意义(P均>0.05)(见表1,图1~图4)。
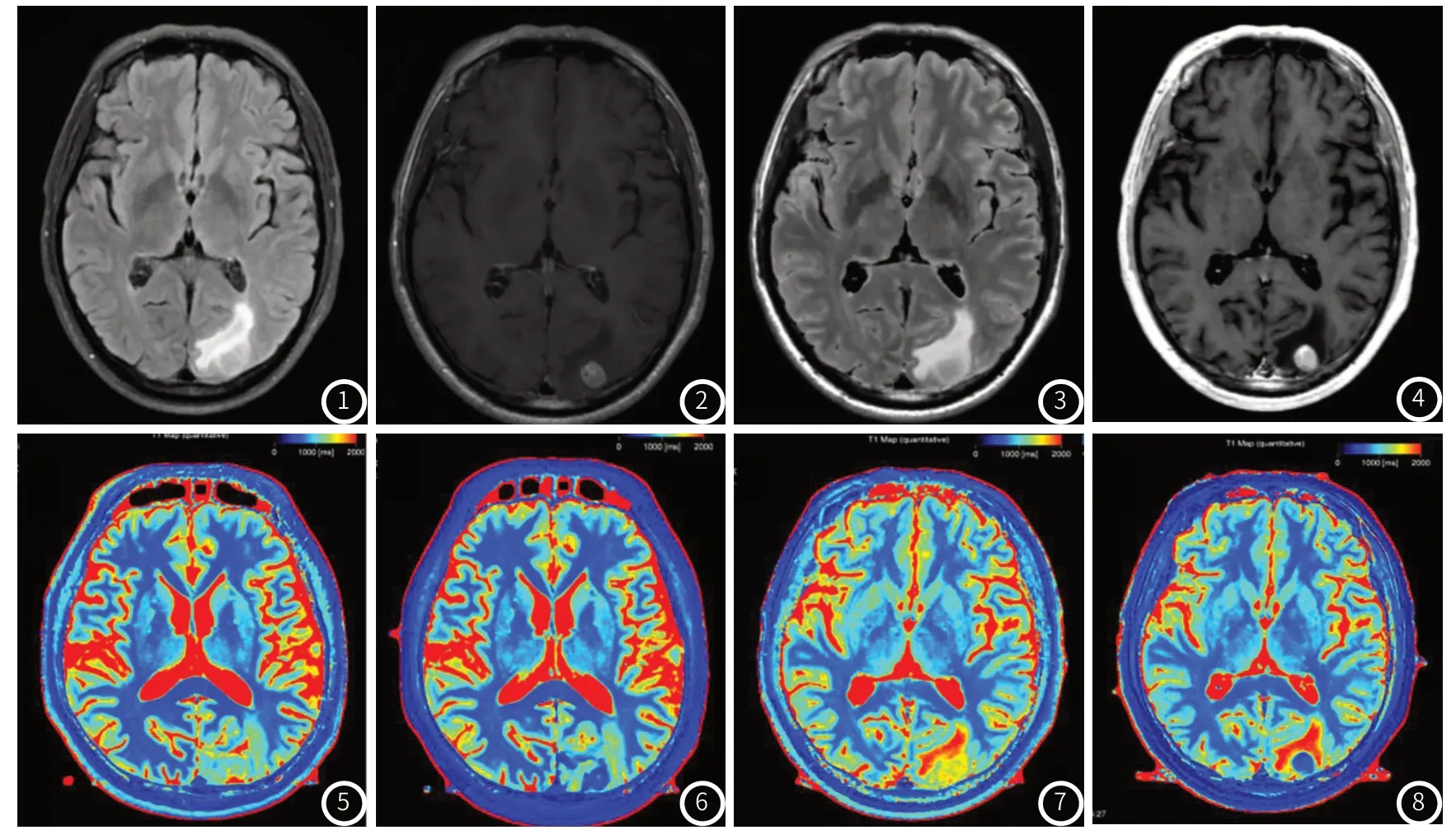
图1~图4 同一BM患者增强扫描前的常规图像与SyMRI图像。图1~图2为常规MRI序列平扫的T2 FLAIR及增强T1 FLAIR,图3~图4为SyMRI-T2 FLAIR及增强SyMRI-T1 FLAIR。图5~图6 为HGG患者,男,55岁,图7~图8 为BM患者,男,48岁。从左至右分别为平扫SyMRI T1 MAP、增强T1 MAP。

表1 SyMRI合成图像与常规图像肿瘤-瘤周对比度差异的比较
2.2 HGG和BM患者肿瘤实质及瘤周组织定量参数值比较HGG肿瘤实质平扫T1值及增强前、后T1值变化百分比均大于BM,增强T1值小于BM,差异有统计学意义(P均<0.05)。HGG瘤周组织平扫T1值小于BM,差异有统计学意义(P<0.05)。余定量参数差异均无统计学意义(P均>0.05)(见表2,图5~图8)。

表2 20例HGG患者和31例BM患者肿瘤实质和瘤周组织增强前、后各参数的比较
2.3 定量参数值对HGG和BM的鉴别价值HGG和BM肿瘤实质的平扫T1值、增强T1值、增强前、后T1值变化百分比以及HGG和BM瘤周组织的平扫T1值作为自变量,以HGG为因变量行多因素分析,表明肿瘤实质增强T1值是鉴别HGG和BM的独立影响因素(OR=1.010,95%CI=1.001~1.020,P=0.039)(见表3)。肿瘤实质增强T1值的AUC为0.857(P=0.007,95%CI=0.696~1.000),最佳截断点为543.5ms,此时敏感度为76%,特异性为83.3%(见图9)。
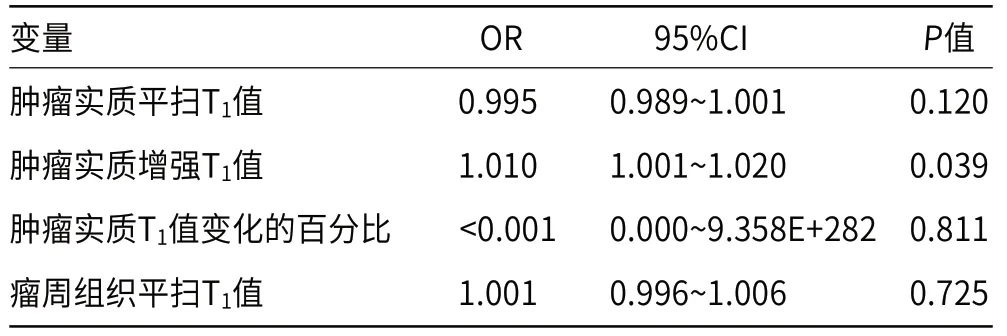
表3 HGG和BM患者的多因素Logistic回归分析

图9 HGG及BM肿瘤实质增强T1值的ROC曲线
3 讨论
3.1 SyMRI技术概述目前常规MRI诊断疾病是根据不同组织间的灰度对比,无法定量分析组织的T1、T2、PD值[9]。与常规定量MRI扫描的多回波自旋加权序列相比,SyMRI技术采取了多回波多延迟饱和恢复自旋回波序列,采集时间约为4至6分钟,一次扫描可以获得5种组织的定量值:T1、T2、R1、R2、PD值。而R1和R2两个定量图谱可合成10个不同的对比加权像,包括T1W、T2W、PDW、T1W FLAIR、T2W FLAIR、短时间反转恢复序列、双翻转白质成像序列、双翻转灰质成像序列(double inversion recovery whitematter,DIR WM)、相位敏感翻转恢复成像序列、相位敏感翻转恢复亮血成像,以上加权图像能够在SyMRI成像的基础上借助调节回波时间(TE),重复时间(TR)和反转时间(TI)计算生成,避免了扫描参数设置不一致带来的差异[10]。
3.2 SyMRI技术加权图像肿瘤-瘤周对比度分析本研究结果表明,平扫SyMRI-T2FLAIR和增强SyMRI-T1FLAIR的肿瘤-瘤周对比度均高于常规MRI加权图像,说明SyMRI在显示病灶方面优于常规MRI。可能的原因是SyMRI重建的对比加权图像是借助一次扫描后计算TE、TR、TI生成的,比常规MRI显示病灶更灵敏。研究表明,SyMRI-DIR WM图像得以同时抑制脂肪、脑脊液信号,增强局部组织间的对比度,图像具备更高的对比度和对比噪声比,病灶显示效果更好[11]。
3.3 SyMRI技术定量参数对脑肿瘤异质性的研究在脑恶性肿瘤异质性的研究中,扩散加权成像的表观扩散系数与HGG肿瘤细胞密度及Ki-67表达呈负相关[3],进一步通过体素内不相干运动成像发现肿瘤D和f值与Ki-67表达呈中度负相关[4],可用于评价肿瘤恶性程度。磁共振波谱(magnetic resonance spectroscopy,MRS)研究发现Cho/Cr、NAA/Cr、NAA/Cho在不同分级胶质瘤间存在差异,胶质瘤瘤体实性区域各代谢物比值与Ki-67显著相关,表明MRS可用于胶质瘤的分级及反映肿瘤细胞的增殖性[12]。动态增强MRI研究表明初始强化率对界定脑胶质瘤级别具有较高的敏感性及特异性[7]。磁敏感加权成像研究发现HGG磁敏感信号分级高于低级别组,可用于胶质瘤的分级评估[13]。MRI灌注加权成像研究表明脑血容量可作为鉴别高低级别胶质瘤的生物学指标[14]。
T1、T2弛豫时间和质子密度(PD)是MRI描述组织磁化矢量特性的基本参数,其中T1、T2弛豫时间主要受脑组织细胞外水含量的影响,而PD值主要受组织质子含量的影响[15-16]。本研究中,HGG肿瘤实质平扫T1值大于BM,这可能是鉴于HGG肿瘤实质内血供丰富[17],肿瘤微血管密度高,通透性较高,细胞外水分子的比例增加,从而致使T1值升高。HGG瘤周组织平扫T1值小于BM,可能BM瘤周为血管源性水肿[18],而HGG瘤周的浸润性水肿含有大量瘤细胞,单位体积内水分子比例减小,T1值降低[19-20]。本研究中,HGG肿瘤实质增强T1值小于BM、肿瘤实质增强前后T1值变化百分比大于BM,可能是HGG破坏血脑屏障,在原有的基础上更进一步提高细胞间隙钆含量,缩短T1值比BM更明显。本研究HGG与BM的肿瘤实质及瘤周组织的T2、PD值无统计学意义。
本研究的局限性在于仅对BM和HGG进行了弛豫时间的定量分析,其他颅内恶性肿瘤的异质性有待进一步研究。
综上所述,平扫SyMRI-T2FLAIR及增强SyMRI-T1FLAIR在显示脑部恶性肿瘤方面优于常规的MRI序列加权成像。SyMRI定量参数值能够借助弛豫时间的差异评价脑恶性肿瘤的异质性,为临床诊断、治疗和预后评估予以影像学信息。
