“平喘汤”通过调控TGF-β1/Smad信号通路抑制哮喘大鼠气道重塑机制研究
2023-01-16沈王丰梁小红冯高华刘美秀
沈王丰 肖 磊 梁小红 冯高华 刘美秀
(南京中医药大学附属张家港医院,江苏张家港 215600)
支气管哮喘(以下简称哮喘)是儿童和成人最普遍的一种慢性呼吸系统疾病,约有3亿人患有此病[1],我国大陆地区成年人哮喘的患病率约1.24%[2-3]。临床常使用皮质类固醇治疗哮喘,但长期应用此类药物易产生依赖性,故患者依从性差。哮喘的发病机制涉及气道炎症、气道高反应性和气道重塑。气道重塑以往被认为是反复炎症损伤与修复的结果,发生于慢性炎症下的疾病后期。但近年来研究发现,气道重塑与疾病发展平行进行,早期和轻度哮喘患者也存在一定程度的气道重塑[4-5]。转化生长因子-β1(TGF-β1)/Smad信号通路在哮喘的气道重塑中起着关键作用[6-8],成为哮喘预防和治疗的重要靶点。
平喘汤是由三拗汤和三子养亲汤化裁而来的经验方,可宣肺化痰、止咳平喘,具有较好的临床疗效[9]。前期实验研究发现,平喘汤可以减轻哮喘模型动物肺组织炎性细胞浸润,抑制TGF-β1表达,改善哮喘气道炎症[10-11],但平喘汤是否可通过TGF-β1/Smad通路减轻哮喘模型动物的气道重塑尚不明确。本研究制备哮喘大鼠模型,观察平喘汤对模型大鼠TGF-β1/Smad通路相关蛋白的影响,为临床治疗应用提供实验依据。
1 实验材料
1.1 实验动物36只8周龄SPF级SD大鼠,雌雄各半,体重(220±20)g,购自南京市江宁区青龙山动物繁殖场,生产许可证号:SCXK(苏)2017-0001,动物饲养在温度为22~24 ℃、湿度为40%~70%的SPF环境中,自由进食和饮水,适应性喂养1周后进行实验。本实验经南京中医药大学附属张家港医院伦理委员会批准同意(批准编号:2021-08-75)。
1.2 实验药物平喘汤药物组成:炙麻黄10 g,苦杏仁10 g,葶苈子10 g,紫苏子10 g,莱菔子15 g,白芥子10 g,枳壳10 g,桔梗6 g,地龙20 g,僵蚕10 g,五味子6 g。中药饮片均购自苏州天灵中药饮片有限公司,由张家港市中医医院提供,均经药学部蒋志涛副主任药师鉴定符合2015年版《中华人民共和国药典》的相关标准,由制剂室制备成生药质量浓度为2 g/mL的浸膏,灌胃前用超纯水稀释。醋酸地塞米松片(上海上药信谊药厂有限公司生产,0.75 mg/片,批准文号:国药准字H31020793,生产批号:015170401),实验时以超纯水溶解成1 g/L溶液备用。
1.3 主要试剂卵清白蛋白(ovalbumin,OVA,美国Sigma公司,货号:A5253);磷酸盐缓冲液(PBS,北京中杉会桥生物技术有限公司,批号:A190711);大鼠TGF-β1酶联免疫吸附测定(ELISA)检测试剂盒(上海酶联生物科技有限公司,产品编号:ml002856);苏木素染液、伊红染液(珠海贝索生物技术有限公司,货号:BA-4041,BA-4024);马松(Masson)染液(北京索莱宝科技有限公司,货号:G1340);DAB显色剂(北京中杉金桥生物技术有限公司,货号:ZLI-9018);BCA蛋白检测试剂盒(美国Thermo公司);Anti-Smad3抗体(美国Abcam公司,货号:ab40854);Anti-Smad2抗体(美国Affinity Biosciences公司,货号:AF6449);Anti-TGF-β1抗体(北京博奥森生物技术有限公司,货号:bs-0086R)。
1.4 主要仪器402AI超声雾化器(江苏鱼跃医疗设备有限公司);RM2235型组织切片机,HI1210型漂片机(德国Leica公司);MDF-339型医用恒温冰箱(日本Panasonic公司);Tiss-24型组织研磨仪(上海净信实业有限公司);Mini-PROTEAN型凝胶电泳 仪,Trans-Blot Turbo型 转 膜 仪(美 国Bio-Rad公司);ImageQuant LAS 500生物分子成像仪(美国GE);BX43型光学显微镜、UC90型成像系统(日本Olympus公司)。
2 实验方法
2.1 造模与分组取30只大鼠,参照文献[12]的方法并作改进,进行致敏、激发,制备哮喘动物模型。实验第1天和第8天于大鼠双侧腹股沟各取1点,每点皮下注射0.5 mL含OVA 10 mg、氢氧化铝200 mg的溶液。另取6只大鼠作为正常组,相同位置皮下注射等体积生理盐水。实验第15天,将致敏大鼠采用随机字数表法分为模型组、地塞米松组和平喘汤低、中、高剂量组,每组6只。每日11∶00将致敏大鼠置于透明密闭容器中,用1%OVA溶液雾化30 min,正常组大鼠雾化吸入等体积生理盐水,每日1次,持续3周。
致敏阶段,致敏大鼠行为学未见明显改变;激发时,造模大鼠出现烦躁、抓耳挠腮、呛咳、呼吸急促等症状;激发1周后,造模大鼠上述症状明显加重,并出现精神萎靡、反应迟钝、进食减少、点头样喘息等症状。正常组大鼠行为学未见异常表现。上述现象说明造模成功。实验过程中,各组大鼠无死亡。
2.2 给药实验第15天(即雾化激发第1天)起,于每日上午8∶00至10∶00对各组大鼠分别灌胃给予相应药物或生理盐水。平喘汤临床常用生药量为117 g,以70 kg人和200 g大鼠按体表面积折算的等效剂量系数进行换算[13],得出平喘汤用于大鼠的成人等效剂量为10.6 g/kg。平喘汤低、中、高剂量组给药剂量分别为5.3 g/kg、10.6 g/kg、21.2 g/kg(以生药量计),地塞米松组给药剂量为0.001 g/kg,模型组和正常组分别予等体积生理盐水,各组大鼠均每日灌胃1次,连续3周。
2.3 标本采集末次雾化后24 h,各组分别取3只大鼠予腹腔麻醉,消毒后固定在手术板上,开胸充分暴露气管,注射4 mL生理盐水,轻轻按摩胸部30~60 s后,缓慢回抽支气管肺泡灌洗液(BALF),再次灌注3 mL生理盐水后回抽,将2次回收的BALF混合均匀,离心半径10 cm、3000 r/min离心5 min,取上清液,用于检测TGF-β1含量。取各组剩余的3只大鼠处死,取右肺组织置于4%多聚甲醛中浸泡固定,用于肺组织和气道的病理学观察和免疫组化染色法观察肺组织TGF-β1、Smad2和Smad3蛋白表达;取左肺组织用磷酸盐缓冲液(PBS)漂洗、吸干水分后置于-80 ℃冰箱冻存,用于蛋白免疫印迹法(Western blot法)检测肺组织TGF-β1、Smad2和Smad3蛋白表达。
2.4 指标检测
2.4.1 ELISA法检测BALF中TGF-β1含量取各组3只大鼠BALF,按照ELISA试剂盒说明书操作,检测各组大鼠BALF中TGF-β1含量。
2.4.2 苏木素-伊红(HE)和Masson染色观察大鼠肺组织形态学表现取各组3只大鼠右肺组织,脱水,石蜡包埋,切片(厚4 μm),分别进行HE和Masson染色,中性树胶封片,光学显微镜观察。HE染色后观察肺组织病理形态,Masson染色后观察气道胶原纤维病理形态。
2.4.3 免疫组化染色法检测肺组织TGF-β1、Smad2和Smad3蛋白表达取各组大鼠右肺组织石蜡切片,常规脱蜡至水,抗原修复,蒸馏水洗5 min,放入3%甲醇过氧化氢10 min(室温),蒸馏水洗5 min,PBS浸泡1 min,滴加一抗(TGF-β1、Smad2和Smad3,稀释比例分别为1∶60、1∶80、1∶80),4 ℃孵育过夜。第2天取出恢复至室温,用PBS缓冲液洗3次,每次5 min,滴加二抗(HRP标记的山羊抗兔IgG,1∶1000),37 ℃孵育30 min,PBS清洗3次,每次5 min。随后用DAB显色、苏木素复染、分化、反蓝,最后脱水、透明、封片。显微镜观察,采集图像。
2.4.4 Western blot法 检 测 大 鼠 肺 组 织TGF-β1、Smad2和Smad3蛋白表达取各组3只大鼠左肺组织,在液氮环境下研磨成粉末,加入裂解液置于冰上裂解30 min后,于4 ℃、离心半径10 cm、12 000 r/min离心5 min,取部分上清,按照BCA试剂盒的说明书测定总蛋白浓度。其余上清加入5×loading buffer,沸水中煮10 min,完成上样、电泳、转膜,5%脱脂奶粉室温下封闭1 h。添加配置好的一抗(TGF-β1、Smad2和Smad3,稀释 比 例 均 为1∶1000),4 ℃过夜,第2天用TBST洗膜3次,每次10 min,加入HRP标记的山羊抗兔IgG(1∶1000),室温孵育1 h,再用TBST洗 膜3次,每次10 min,等体积混合化学发光试剂A液和B液检测蛋白条带,使 用Image Pro Plus 6.0软件对各组目的蛋白的光密度值进行分析。
2.5 统计学方法采用SPSS 22.0统计软件进行统计学分析。本研究所有计量资料均符合正态分布,以(x-±s)表示,采用独立样本 t 检验进行两两比较,P<0.05表示差异有统计学意义。
3 实验结果
3.1 各组大鼠BALF中TGF-β1含量比较与正常组比较,模型组大鼠BALF中TGF-β1含量显著增加(P<0.001);与模型组比较,各给药组TGF-β1含量均显著降低(P<0.001);地塞米松组和平喘汤高剂量组TGF-β1含量显著低于平喘汤中、低剂量组(P<0.001),平喘汤中剂量组显著低于低剂量组(P<0.001),而地塞米松组和平喘汤高剂量组组间比较差异无统计学意义(P>0.05)。详见表1。
表1 各组大鼠BALF中TGF-β1含量比较(±s)
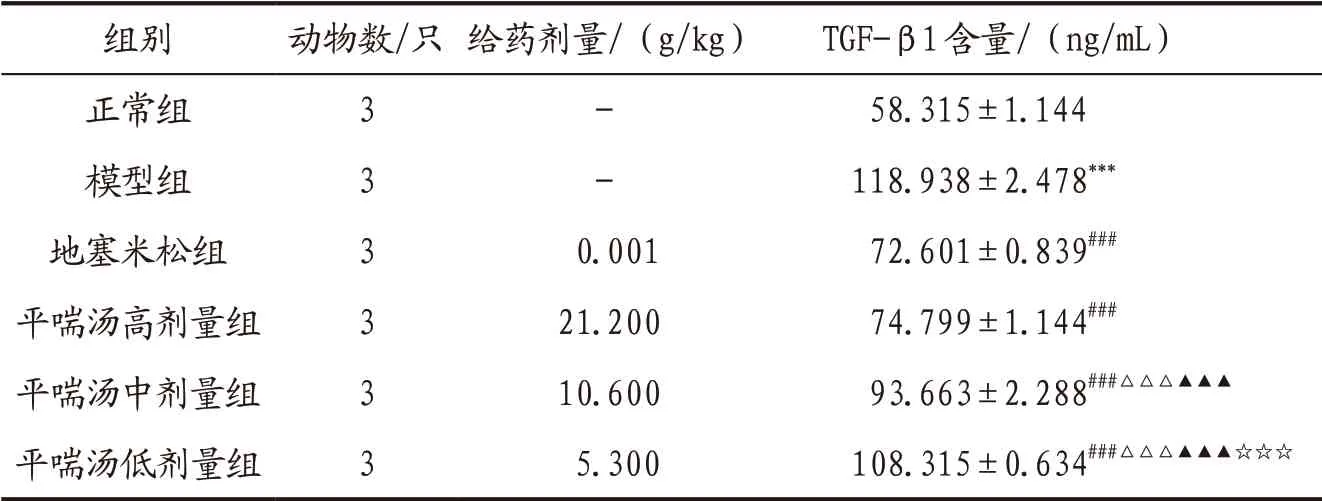
表1 各组大鼠BALF中TGF-β1含量比较(±s)
注: 与正常组比较,***P<0.001;与模型组比较,###P<0.001;与地塞米松组比较,△△△P<0.001;与平喘汤高剂量组比较,▲▲▲P<0.001;与平喘汤中剂量组比较,☆☆☆P<0.001。
3.2 各组大鼠肺组织形态学比较正常组大鼠肺组织结构规则,气道管壁薄,有少量炎性细胞浸润。模型组大鼠肺组织气道管壁增厚,黏膜皱襞增生,黏膜下明显充血、水肿,周围有大量炎性细胞浸润。与模型组比较,各给药组大鼠肺组织损伤、炎性细胞浸润情况均有不同程度的减轻,其中地塞米松组和平喘汤高剂量组改善最明显,炎性细胞浸润减少,黏膜下轻度水肿,管壁增厚较轻,平喘汤中剂量组次之。见图1。
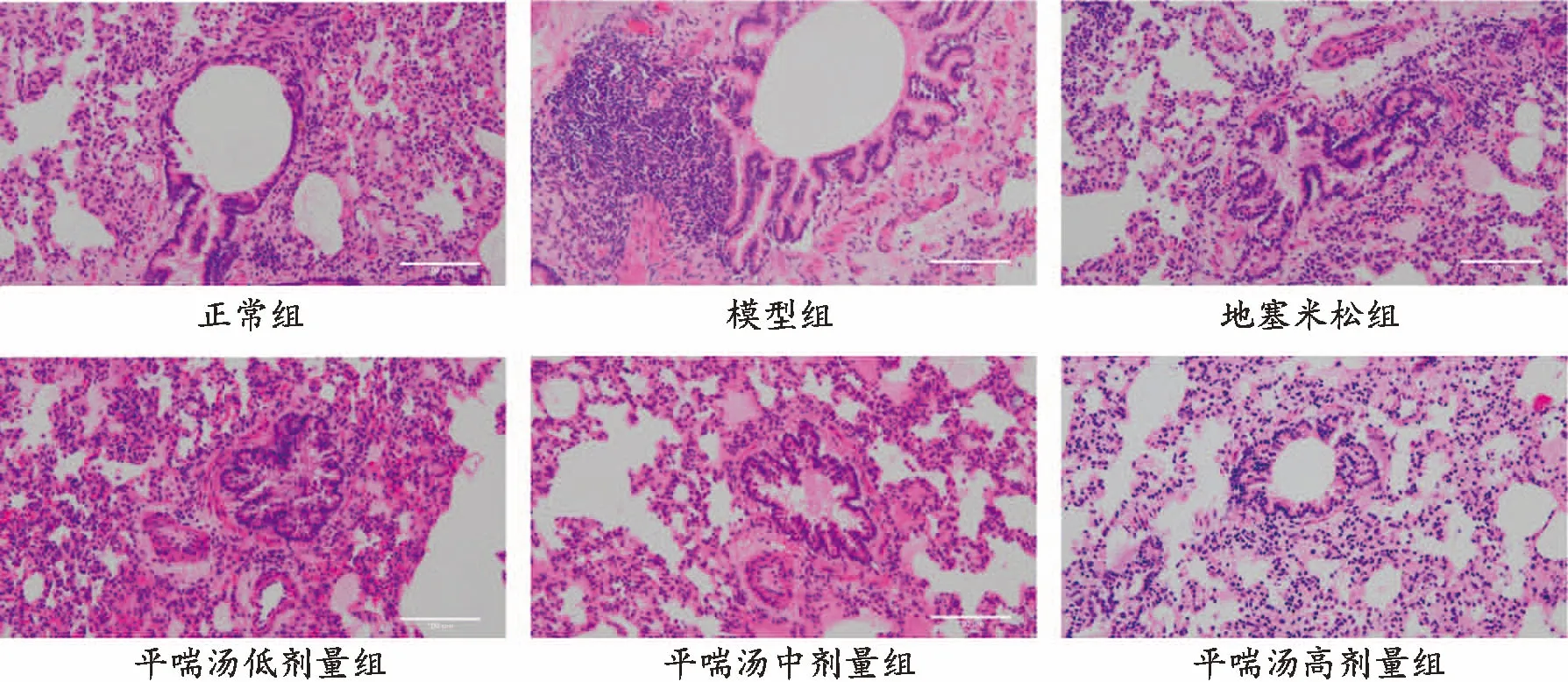
图1 各组大鼠肺组织形态学表现(HE,×200)
3.3 各组大鼠气道胶原纤维形态学比较Masson染色后大鼠气道上皮下胶原纤维呈蓝色,肌纤维、纤维素呈红色。与正常组比较,模型组胶原纤维广泛沉积;与模型组比较,各给药组胶原纤维沉积均有不同程度改善,其中地塞米松组、平喘汤高剂量组改善效果最佳。见图2。

图2 各组大鼠肺组织气道胶原纤维形态学表现(Masson,×200)
3.4 免疫组化染色法观察各组大鼠肺组织TGF-β1、Smad2和Smad3蛋白表达经免疫组化染色,各组大鼠气道黏膜上皮细胞、平滑肌和部分肺泡上皮均显示棕黄色TGF-β1、Smad2和Smad3蛋白表达颗粒。与正常组比较,模型组大鼠肺组织棕黄色颗粒显著增多;与模型组比较,各给药组大鼠肺组织棕黄色颗粒有不同程度的减少,平喘汤不同剂量呈现一定的剂量依赖性。见图3、图4、图5。

图3 各组大鼠肺组织TGF-β1蛋白表达(免疫组化染色,×200)

图4 各组大鼠肺组织Smad2蛋白表达(免疫组化染色,×200)
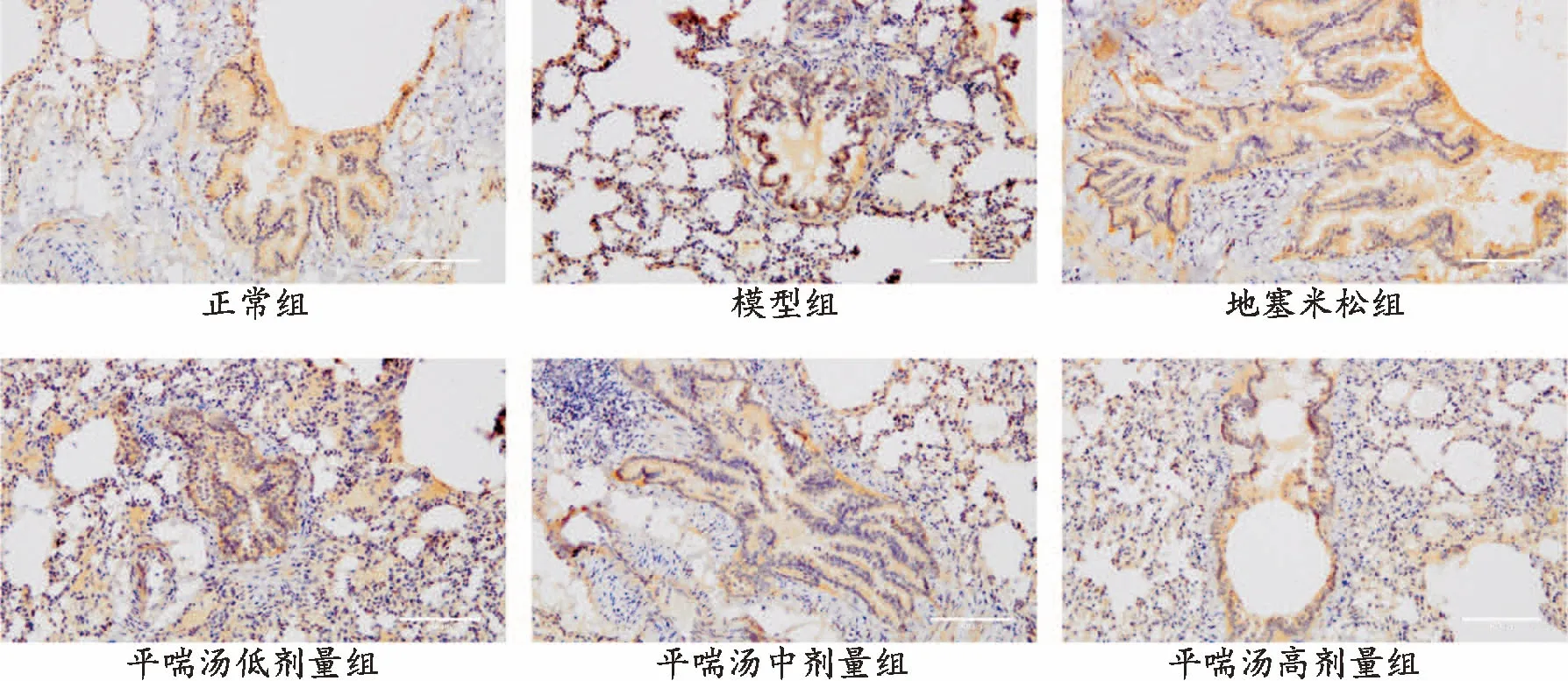
图5 各组大鼠肺组织Smad3蛋白表达(免疫组化染色,×200)
3.5 Western blot法检测各组大 鼠 肺 组 织TGF-β1、Smad2和Smad3蛋白表达与正常组比较,模型组大鼠肺组织TGF-β1、Smad2和Smad3蛋白表达显著升高(P<0.001);与模型组比较,平喘汤高、中剂量组以及地塞米松组大鼠肺组织TGF-β1、Smad2和Smad3蛋白表达显著降低(P<0.05,P<0.01,P<0.001);地塞米松组大鼠上述蛋白表达显著低于平喘汤各剂 量 组(P<0.05,P<0.01,P<0.001);平喘汤高、中、低剂量对大鼠上述蛋白表达的改善作用呈现明显的剂量依赖性(P<0.05,P<0.01,P<0.001)。见图6、表2。
表2 各组大鼠肺组织TGF-β1、Smad2、Smad3蛋白表达比较(±s)
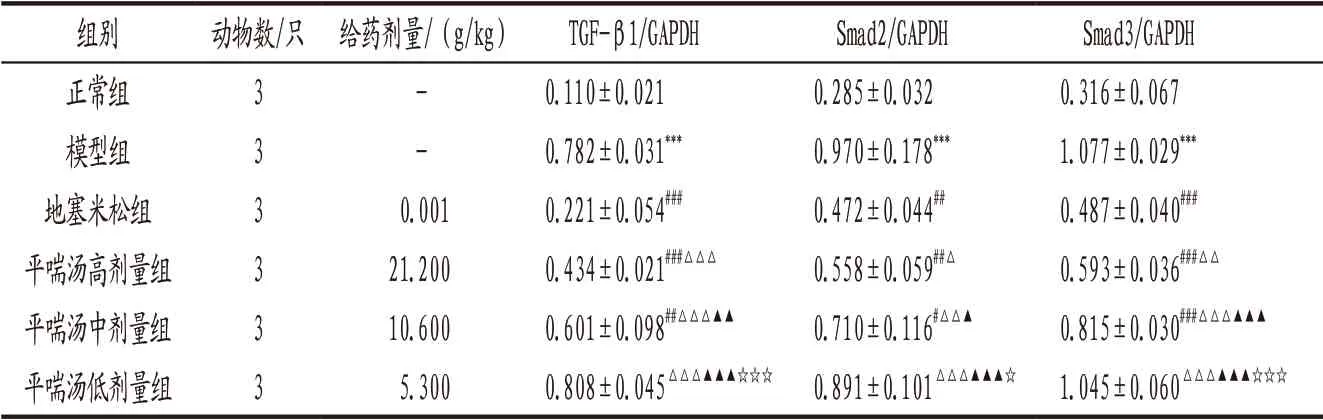
表2 各组大鼠肺组织TGF-β1、Smad2、Smad3蛋白表达比较(±s)
注: 与正常组比较,***P<0.001;与模型组比较,#P<0.05,##P<0.01,###P<0.001;与地塞米松组比较,△P<0.05,△△P<0.01,△△△P<0.001;与平喘汤高剂量组比较,▲P<0.05,▲▲P<0.01,▲▲▲P<0.001;与平喘汤中剂量组比较,☆P<0.05,☆☆☆P<0.001。

图6 各组大鼠肺组织TGF-β1、Smad2、Smad3蛋白表达
4 讨论
哮喘是一种常见的慢性肺部疾病,常伴有反复发作的胸闷、喘息、咳嗽、气急等症状,其发病机制复杂,气道重塑是其主要病理改变之一。哮喘的气道重塑由气道壁的多种结构变化组成,包括上皮损伤、上皮下纤维化、肌成纤维细胞增生、平滑肌纤维增加和血管增生等[14-15],造成管腔狭窄。而支气管管腔狭窄程度与不可逆气流阻塞及肺功能损害程度密切相关,影响哮喘患者的预后和恢复。因此,如何有效控制哮喘的气道重塑成为近年来的研究热点。
哮喘可归属于中医学“哮病”“喘证”等范畴,“喘有夙根,遇寒即发,或遇劳即发者,亦名哮喘”(《景岳全书·喘促》)。“夙根”即肺内的“伏痰”,是哮喘发病的主要病理因素。本病的基本病机可归纳为痰浊内停,外邪引动伏痰,痰阻气道,气机失调,故应以化痰平喘为治则。平喘汤方中麻黄主入肺经,可开皮毛之郁闭;苦杏仁味苦降泻,肃降兼宣发肺气。两药相配,升降相因而平喘。紫苏子、莱菔子、白芥子均为治痰之药,化痰降气而平喘。葶苈子专泄肺中水饮及痰火而平喘;枳壳联合桔梗主治痰滞胸痞。古人云“久病入络”“久病必瘀”,瘀阻肺络亦为哮喘的重要致病因素,故加入地龙、僵蚕以祛风解痉、化痰逐瘀。酌加五味子敛肺止咳、纳气平喘。全方具有宣肺化痰、止咳平喘、祛风逐瘀的功效。
本实验采用OVA和氢氧化铝复制哮喘大鼠模型,结果显示造模大鼠出现明显的呛咳、气急等哮喘症状,模型组大鼠肺组织炎性细胞浸润明显,胶原纤维广泛沉积,说明造模成功。本研究结果表明,平喘汤和地塞米松均可减轻哮喘模型大鼠肺组织炎性细胞浸润,抑制胶原沉积,其中平喘汤高剂量和地塞米松效果最为明显。
TGF-β1是公认的致纤维化因子[16],参与气道的多种病理生理过程,包括肺泡化、气道上皮和内皮屏障功能、免疫细胞趋化、细胞凋亡以及细胞分化和增殖等,这些生物学过程与支气管哮喘的发病机制有关。OJIAKU C A等[17]研究证实,TGF-β1可通过活化成纤维细胞,促进气道平滑肌增殖和细胞外基质沉积,最终导致气道结构改变。有研究发现,TGF-β1在哮喘患者的支气管肺泡灌洗液和支气管标本中过量产生[18],此外,TGF-β1基因表达水平与哮喘的严重程度相关[19]。本研究结果表明,模型组大鼠BALF中TGF-β1含量明显高于正常组,各给药组大鼠BALF中TGF-β1含量均较模型组显著下降,提示平喘汤和地塞米松可以抑制TGF-β1的表达,同时本研究发现平喘汤对哮喘模型大鼠BALF中TGF-β1含量的降低作用表现出明显的剂量依赖性。
TGF-β1诱导支气管哮喘结构改变的机制包括TGF-β1/Smad通路和TGF-β1诱导的上皮间质转化。本实验主要观察TGF-β1/Smad通路在气道重塑中的作用。Smad是位于TGF-β1下游的蛋白,介导细胞内信号转导[20],其中Smad2、Smad3可接收并在磷酸化后将信号从细胞膜传递到细胞核,调节靶基因的转录。本研究结果显示,与正常组比较,模型组哮喘大鼠肺组织TGF-β1、Smad2和Smad3蛋白表达水平明显上升,提示TGF-β1、Smad2及Smad3的过度表达。地塞米松组和平喘汤高、中剂量组大鼠肺组织TGF-β1、Smad2和Smad3蛋白表达水平均较模型组显著下降,表明平喘汤和地塞米松可通过调节哮喘模型大鼠肺组织中TGF-β1、Smad2及Smad3蛋白表达水平发挥治疗作用,同时本研究发现平喘汤对哮喘模型大鼠肺组织上述蛋白表达的降低作用表现出明显的剂量依赖性。平喘汤中苦杏仁苷可通过下调TGF-β/Smad通路中TGF-β1、Smad2、Smad3蛋白表达水平来减少胶原蛋白和纤维的形成[21],地龙则可能通过蚓激酶的活化纤溶酶和降解纤维蛋白的作用而对气道重构的TGF-β1/Smads信号途径产生干扰[22]。
综上所述,本研究通过建立哮喘大鼠模型,并给予平喘汤治疗,发现平喘汤可以减轻哮喘模型大鼠肺组织炎性反应及气道重塑,其机制与调控TGF-β1/Smad信号通路有关,且其调控作用表现出明显的剂量依赖性。中药复方具有多成分、多靶点的作用特点,课题组后续将进一步研究平喘汤的有效成分,以及是否存在对其他信号通路的调节作用,深入探讨平喘汤治疗哮喘的作用机制。
