烟草叶斑病病原菌Epicoccum latusicollum的鉴定、生物学特性及室内药剂筛选
2023-01-16安宣鲜桑维钧卢燕回王五权李昊熙杨江敏彭丽娟杨茂发
安宣鲜,桑维钧*,卢燕回,孔 菲,王五权*,李昊熙,杨江敏,彭丽娟,杨茂发
烟草叶斑病病原菌的鉴定、生物学特性及室内药剂筛选
安宣鲜1,桑维钧1*,卢燕回2,孔 菲2,王五权2*,李昊熙1,杨江敏1,彭丽娟1,杨茂发1
1. 贵州大学烟草学院/贵州省烟草品质重点实验室,贵州贵阳 550025;2. 中国烟草总公司广西壮族自治区公司科技处,广西南宁 530022
叶斑类病害是危害大田期烟草的主要病害之一,大多由真菌侵染所致,病害易暴发流行,对烟草的品质及产量造成重大影响。本研究采用组织分离法从广西‘K326’烟叶具有典型病斑的叶片上分离、纯化获得菌株,通过致病性测定结合形态学特征以及分子生物学手段对病原菌进行鉴定,同时采用菌丝生长速率法测定不同培养基、温度、pH、碳源、氮源、光照,致死温度处理以及10种常用化学药剂对病原菌菌丝生长的影响。该叶斑病的典型病症为:初期烟叶产生灰白色小圆斑,病害加重圆斑逐渐扩散成不规则状,病斑中心形成穿孔,颜色为灰白色,边缘棕褐色,伴随褪绿的黄色晕圈。通过分离纯化获得2个菌株,分别命名为HZFC36和HZZS76。致病性测定结果表明,2个菌株均可在叶片无伤条件下导致健康‘K326’烟叶部产生病斑。结合形态学特征和多基因位点(、、和)系统发育进化分析将引起广西烟草叶斑病的病原菌鉴定为。该病原菌在CMA培养基上生长最快,最适生长温度为28℃,最适pH为6,最佳碳源、氮源为蔗糖和牛肉浸粉,全光照条件更利于病原菌的生长,致死温度为47℃,水浴10 min。室内药剂初步筛选结果显示,50%啶酰菌胺和25%吡唑醚菌酯对病原菌的抑制效果最好,平均EC50值分别为4.752×10–2、4.989×10–2mg/L。本研究结果为引起烟草叶斑病的田间防控奠定了一定的理论基础。
叶斑病;病原菌鉴定;生物学特性;杀菌剂筛选
烟草作为我国重要的经济作物,是政府税收和农民收入的主要来源之一,目前国内种植面积已经超过200万hm2,种植区域主要分布在云南、广西、四川、贵州等南方省(区)[1-3]。在烟草生产过程中常见的病害可以大致分为根茎病害、叶斑类病害和病毒病[4-5]。其中,烟草叶斑病作为直接危害烟叶的病害,对产量和烤后质量造成重大影响,是烟草产业发展所面临的重要问题[6]。近年来,随着种烟年限的增长和种植面积的不断扩大,烟草栽培模式落后、植烟土壤肥力下降和品种退化等现象层出不穷,烟草叶斑病的种类也随之发生较大演变[7]。国内外常见的烟草真菌性叶斑病害有普通链格孢菌()、长柄链格孢菌()引起的烟草赤星病[8];山扁豆生棒孢()引起的烟草棒孢霉叶斑病[9];烟草尾孢菌()引起的烟草蛙眼病[10];立枯丝核菌()引起的烟草靶斑病[11]和炭疽病菌()引起的烟草炭疽病[12]等,其中以烟草赤星病危害最为严重。
隶属于子囊菌门(Ascomycota)、腔菌纲(Loculoascomycetes)、格孢腔菌目(Pleosporales)、亚隔孢壳科(Didymellaceae)、附球菌属()[13]。已有报道指出作为病原菌在多地引起多种植物病害,如2018年在广东省引起火龙果茎斑病[14];2019年在四川省引起山药黑斑病[15];2020年在贵州省引起烟草叶斑病[16]以及在云南省引起烟草烂根病[17]等。截至目前,在广西壮族自治区的研究比较匮乏。
前人对于的研究主要集中在鉴定方面,鲜有病原菌生物学特性及相关防治方面的研究报道。因此,本研究采用菌丝生长速率法测定广西烟草叶斑病菌的生物学特性,同时测定10种常用化学杀菌剂对其生长的抑制作用,明确的生长习性并筛选出高效低毒的化学杀菌剂,旨在为由引起的烟草叶斑病的有效防治提供一定的理论参考。
1 材料与方法
1.1 材料
1.1.1 样品采集 2021年7月,课题组在广西壮族自治区贺州市植烟区开展烟草病害调查,于富川瑶族自治县(111°16′27″E, 24°49′13″N)和钟山县(111°16′23″3, 24°29′23″N)采集具典型症状特征的烟草叶斑病叶片,带回实验室拍照,镜检,通过分离培养获得纯化菌株用于后续实验。
1.1.2 供试药剂 供试药剂名称及经初筛后确定的复筛浓度等信息见表1。
1.2 方法
1.2.1 病原菌的分离与纯化 通过组织分离法用无菌剪刀在镜检病斑的病健交界处剪取5 mm× 5 mm大小的叶片组织,分别经75%酒精浸泡30 s,1%次氯酸钠消毒3 min,无菌水漂洗3次,置于无菌滤纸干燥处理后接种在PDA培养基上,置于28℃恒温培养箱(型号:RXZ-380A,宁波江南仪器厂)中暗培养[18-19]。待接种点周围长出白色菌丝,用无菌接种针挑取边缘菌丝接种至PDA培养皿上进行纯化培养,纯化菌株以40%甘油冻存菌饼至–20℃冰箱中备用。
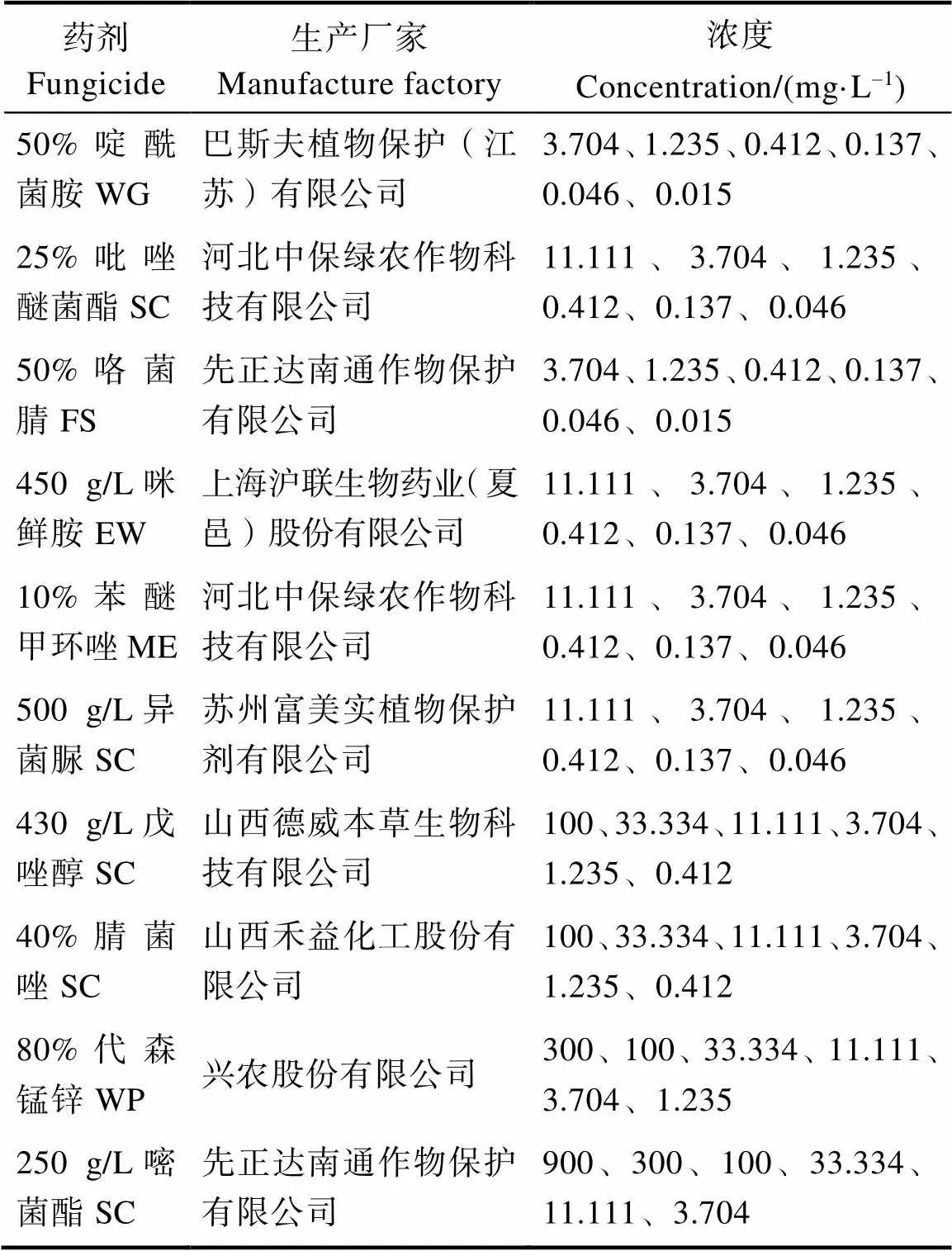
表1 供试药剂及处理浓度
1.2.2 病原菌的致病性测定 采用菌饼接种法对菌株的致病性进行测定[20]。菌株在PDA培养基上暗培养3 d后,用直径5 mm的灭菌打孔器打取菌饼。选取健康的‘K326’盆栽烟株,将菌饼接种于无伤烟株中部位置叶片的两侧,并在接种部位附近放置湿润的无菌棉球保湿,以接种纯PDA培养基饼为对照,每株接种3片叶。用自封袋对接种叶片进行套袋,烟株置于28℃,相对湿度75%,12 h光照、12 h黑暗周期的人工气候箱中培养,定期观察记录发病情况;对发病叶片进行病原菌的分离鉴定,并与原接种菌株进行比较,若菌株相同,则确定接种菌株为致病菌。
1.2.3 病原菌的形态学观察 将菌株分别接种在马铃薯琼脂培养基(PDA)、燕麦琼脂培养基(OA)和玉米粉琼脂培养基(CMA)上,28℃恒温暗培养7 d,对菌株的培养性状进行直观描述,并挑取菌丝体制作玻片在卡尔蔡司光学显微镜下分别观察产孢器、分生孢子大小[21]。
1.2.4 病原菌的分子鉴定 将病原菌接种于覆有半透膜的PDA培养皿中央暗培养3 d,用无菌手术刀轻轻刮取边缘菌丝采用Ezup柱式真菌基因组DNA抽提试剂盒[产品编号:B518259,生工生物工程(上海)股份有限公司]提取菌株的DNA。采用引物(表2)对菌株对应位点序列进行扩增,PCR反应程序参考对应文献,PCR产物用1.5%琼脂糖凝胶电泳检测后由生工生物工程(上海)股份有限公司代为测序。所得序列通过BLAST比对分析,从GenBank中收集用于比较的其他序列相关信息,通过MAFFT v. 7(https://mafft.cbrc. jp/alignment/software/)进行序列比对,使用TrimAl v. 1.3进行序列剪切,以MEGA 7软件将剪切后的序列进行拼接,应用IQ-TREE v.1.6.12的最大似然法(maximum likelihood, ML)构建系统发育树,bootstrap检验重复次数为1000次。
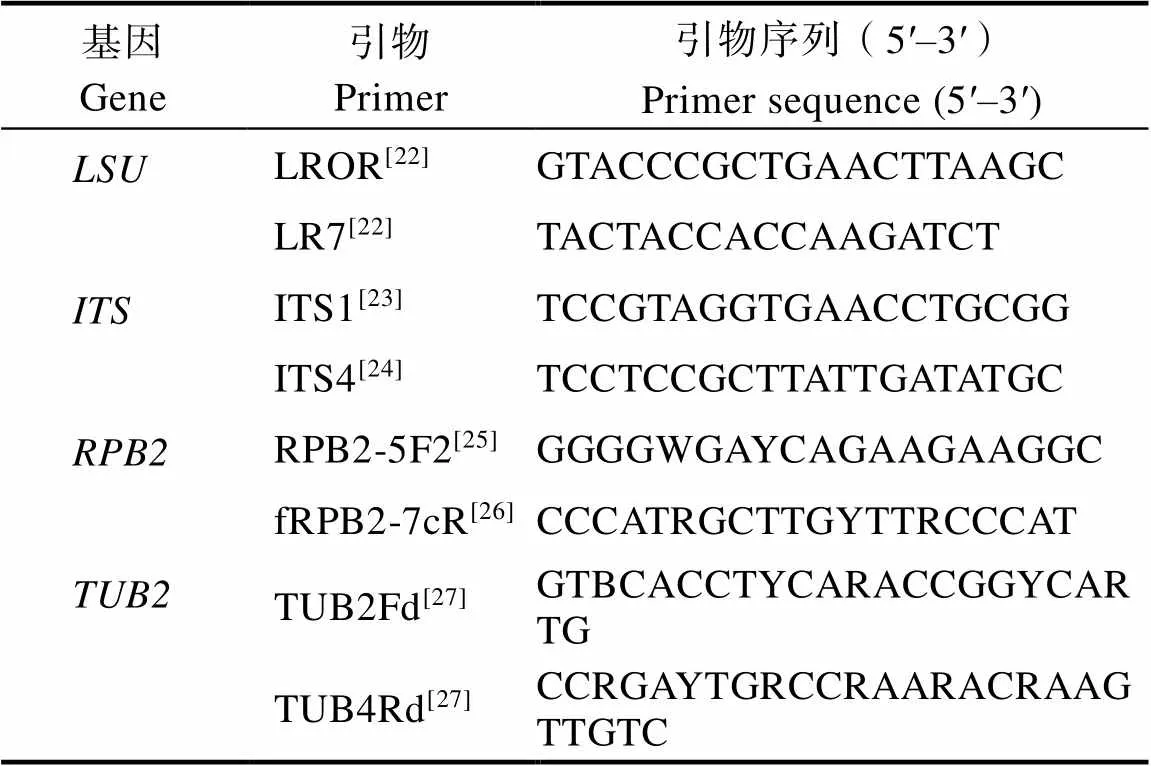
表2 病原菌鉴定所用的引物
1.2.5 病原菌的生物学特性测定 (1)不同温度处理。将直径为5 mm的菌饼菌丝面朝下接于PDA培养皿上,培养温度梯度设置为5、10、15、20、25、28、30、35℃,置于恒温培养箱中黑暗培养7 d,每个处理重复3次,采用十字交叉法测量菌落直径[28],下同。
(2)不同培养基处理。供试培养基分别为市售PDA培养基(青岛高科技工业园海博生物技术有限公司),CMA培养基(北京索莱宝科技有限公司),察氏培养基(CDA,北京索莱宝科技有限公司),OA培养基(北京索莱宝科技有限公司)和自配番茄汁琼脂培养基(TomA),山药汁琼脂培养基(YA),烟叶汁琼脂培养基(TobA)和水琼脂培养基(WA),各培养基配方源自《植病研究方法》[29]。将直径为5 mm的菌饼分别接种于上述8种培养基上,置于恒温培养箱中黑暗培养7 d,每个处理重复3次[30]。
(3)不同碳氮源处理。以查氏培养基(Czapek)[29]为基础培养基,将培养基中的碳源蔗糖分别用相同量的葡萄糖、乳糖、甘露醇、肌醇、山梨糖醇和可溶性淀粉替代;同理,分别以等量的蛋白胨、硝酸铵、牛肉浸粉、氯化铵,尿素、甘氨酸、丙氨酸代替培养基中的氮源硝酸钠,将直径为5 mm菌饼分别接于含不同碳氮源的培养皿上,置于恒温培养箱中黑暗培养7 d,每个处理重复3次[31]。
(4)不同pH处理。以PDA为基础培养基,在灭菌前用1%HCl和1%NaOH溶液把培养基的pH调为8个不同梯度(4、5、6、7、8、9、10、11),将直径为5 mm菌饼接于培养皿中央,置于恒温培养箱中黑暗培养7 d,每个处理重复3次[32]。
(5)不同光照处理。将恒温培养箱的光照条件设置为完全光照、完全黑暗和12 h明暗交替3种模式,将中央接有直径为5 mm菌饼的PDA培养皿分别放于3种光照模式的培养箱中,28℃恒温培养7 d,每处理3次重复。
1.2.6 病原菌的致死温度测定 将直径为5 mm菌饼分别置于装有1 mL无菌水的1.5 mL灭菌离心管中,调节水浴锅的温度为40、45、50、55、60、65℃。将载有离心管的浮板放入不同温度的水浴锅中持续处理10 min(预热1 min),计时结束时取出离心管置于常温纯净水中冷却。将处理后的菌饼接于PDA培养皿上,28℃恒温培养7 d,每处理3次重复,首先得到病原菌的致死温度范围,再以1℃为温度梯度,重复之前的步骤进一步确定病原菌的致死温度[33]。
1.2.7 室内药剂筛选 采用菌丝生长速率法测定供试药剂对分离菌株的抑制效果[34]。经初筛得出各药剂的实验终浓度(表1)。将不同浓度的药剂溶液加入PDA培养基中充分混匀,制作含药平板,以只添加相同体积无菌水的PDA平板作对照,每个处理设3次重复。用直径为5 mm的灭菌打孔器在培养5 d的菌落边缘打取菌饼接种于不同含药平板上,置于28℃培养箱中暗培养7 d,然后用十字交叉法测量各处理的菌落直径。计算各药剂对菌株菌丝生长的相对抑制率,以各药剂浓度的自然对数值作为自变量,以菌丝抑制百分率的Probit值作为因变量,计算药效回归方程和相关系数以及抑制有效中浓度EC50。
1.3 数据处理
利用Excel 2010软件计算试验数据的平均值、标准偏差以及构建柱形图,采用SPSS Statistics 26软件的Duncan’s新复极差法进行单因素ANOVA检验。
2 结果与分析
2.1 田间症状描述
2021年7月,在广西壮族自治区富川瑶族自治县和钟山县烟草种植区发现的叶部病害,发生于烟株的成熟期,烟草品种为‘K326’。发病初期,烟叶产生灰白色小圆斑,病害加重,圆斑逐渐扩散成不规则状,病斑中心形成穿孔,颜色为灰白色,边缘棕褐色,常伴随褪绿的黄色晕圈(图1A)。
2.2 病原菌的分离、纯化和致病性测定
经分离获得纯培养菌株2个,分别编号为HZFC36和HZZS76。致病性测定结果显示2个菌株均可引起健康烟株叶斑病,叶片无伤接种菌饼早期接种部位产生淡黄色病斑,7 d后变为灰褐色,并产生黄色晕圈(图1C),与田间症状(图1A)相似,甚至会出现穿孔现象(图1B),对照未表现出病症(图1D)。参照1.2.1的步骤对回接发病叶片进行病原菌的分离鉴定,得到的菌株与回接菌株一致。

A:田间典型危害症状;B:菌株HZFC36接种烟草品种‘K326’7 d后的症状表现;C:菌株HZZS76接种烟草品种‘K326’7 d后的症状表现;D:对照。
2.3 病原菌的形态特征观察
病原菌HZFC36和HZZS76的形态特征基本相同。菌株HZZS76在PDA培养基上(图2A)培养7 d后,菌落表面呈同心圆分布,中央浅褐色,向外浅红色,边缘白色较整齐。菌丝白色,致密,气生菌丝较发达;背面中央位置为淡红色,向外颜色加深至深红色,最外围为浅肤色,有红色的色素产生。在OA培养基上(图2B),培养7 d后菌落表面中央为灰褐色,向外为浅红色,最外为白色,白色气生菌丝茂盛;背面中央呈黑色,外围为浅红色。在CMA培养基上(图2C),培养7 d后菌落表面呈淡红色,菌丝较稀疏,白色菌丝聚集成结。分生孢子黑色,单腔呈椭圆形,具孔口,埋生或表生于培养基表面,平均大小为123.737~305.366 µm×132.500~418.649 µm(=10,图2D);分生孢子无色,呈长椭圆形,无隔,有1~2个油球,平均大小为7.01~7.21 µm×2.43~2.75 µm(=20,图2E);菌丝中间或末端着生膨大细胞,无色,呈梨状(图2F)。
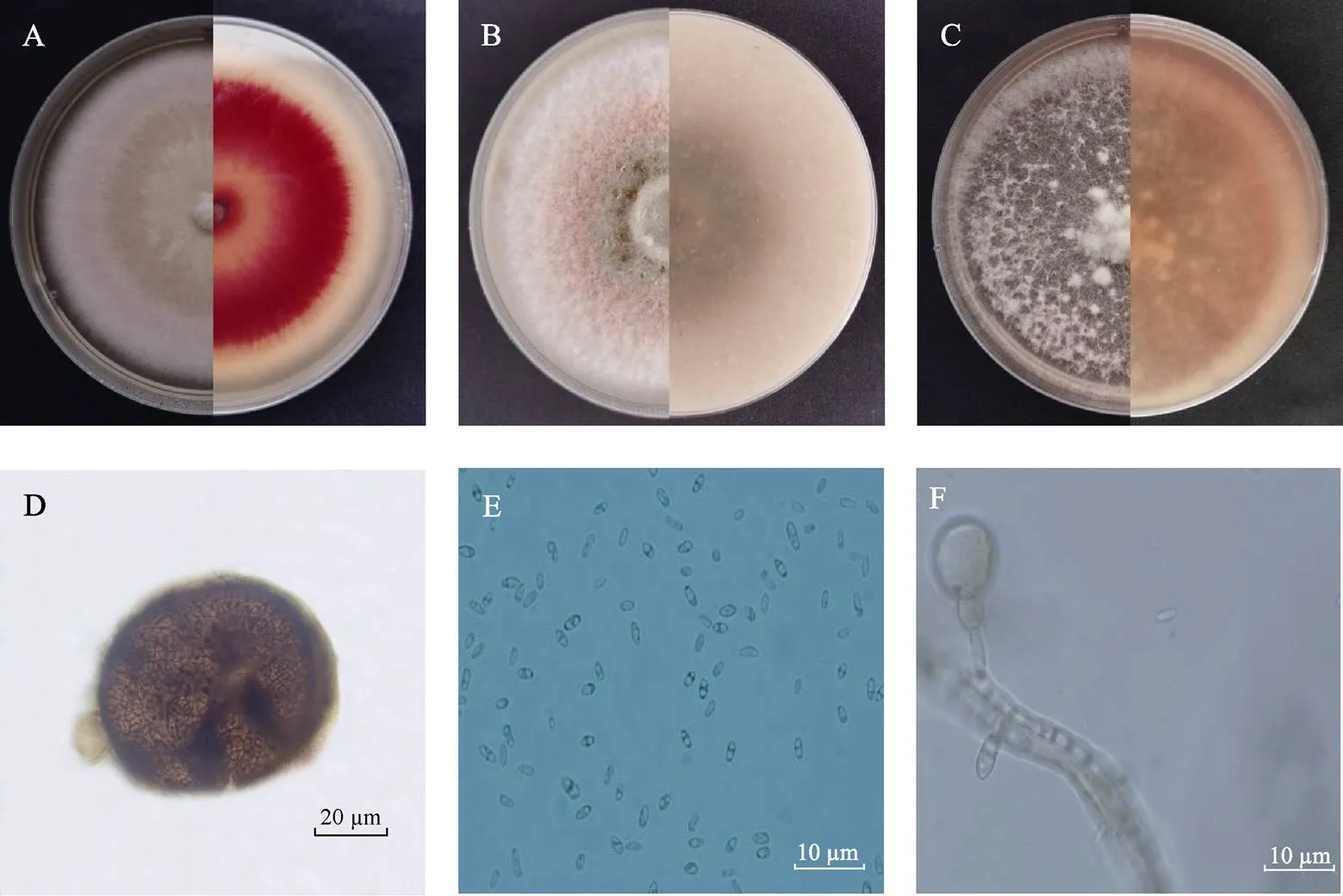
A:HZZS76菌株在PDA上培养7 d后的菌落形态(正、反面);B:HZZS76菌株在OA上培养7 d后的菌落形态(正、反面);C:HZZS76菌株在CMA上培养7 d后的菌落形态(正、反面);D:分生孢子器;E:分生孢子;F:膨大细胞。
2.4 分子生物学鉴定
将测序所获得的菌株HZFC36和HZZS76的、、和基因序列上传至GenBank,获取登录号分别为OK560049、OK559907、OK573447、OK573448、OK639091、OK639097、OL422486、OL422485。将8个序列在NCBI数据库中通过BLAST比对,比对结果显示,2个菌株与和均具有99%以上的同源性,暂不能鉴定至种。从Genbank数据库中下载与相关的23个菌株的、、、序列,通过最大似然法构建得到系统发育进化树(图3),结果表明,菌株HZFC36、HZZS76与LC:5158、LC:8153、LC:4859、T41以100%的支持率聚在一支,根据形态学特征与分子生物学分析,将菌株HZFC36和HZZS76鉴定为。
2.5 生物学特性测定
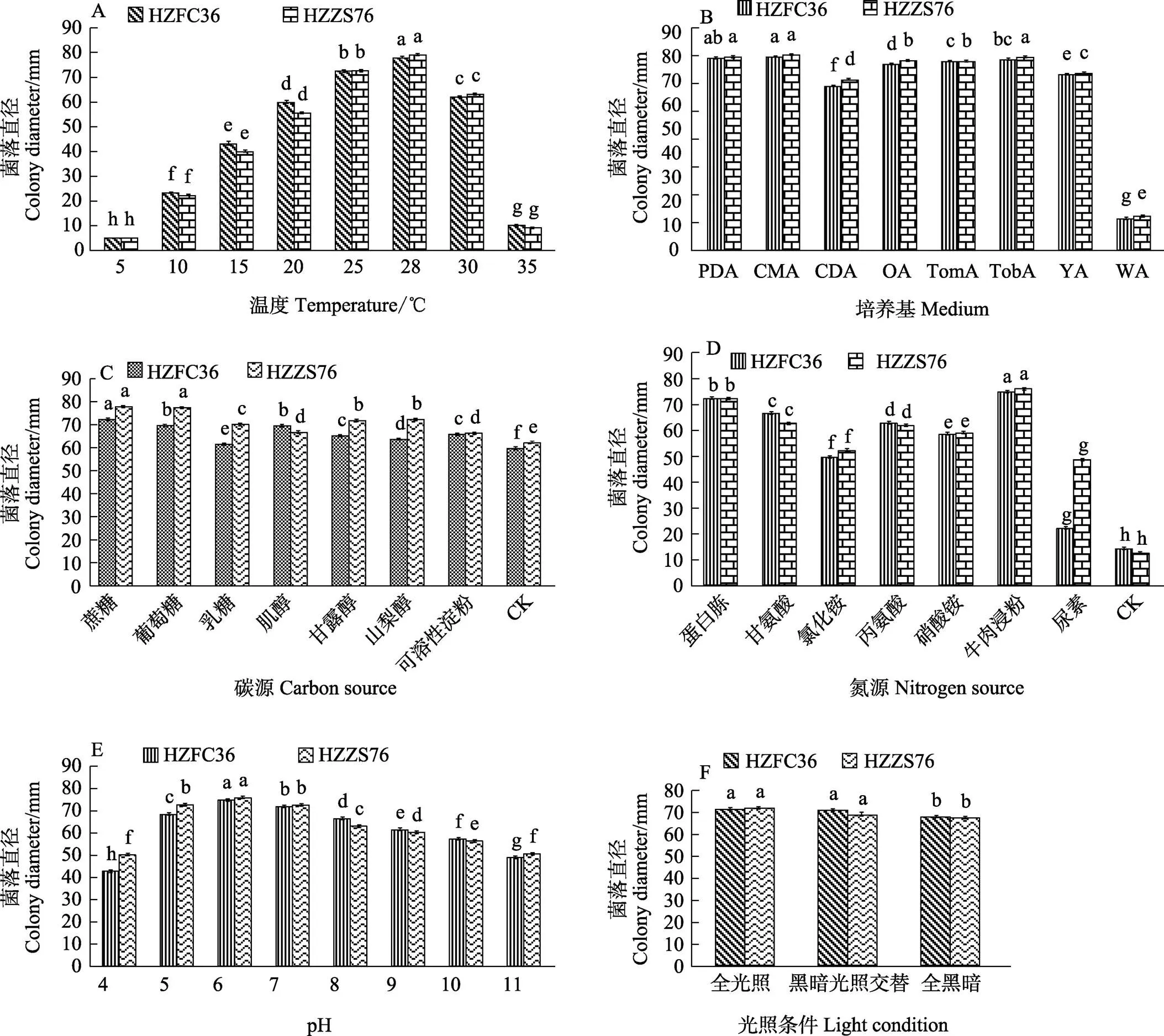
2.5.1 温度对病原菌菌丝生长的影响 菌株HZFC36和HZZS76在不同温度条件下的生长差异不显著,且在不同温度下菌丝的生长速度随处理温度的升高呈先上升后下降的趋势(图4A)。5℃时,菌株菌丝不生长,5~28℃范围内菌丝生长速度加快,28℃时菌落平均直径为78.58 mm,显著高于其他温度处理。28~35℃范围内,高温对菌丝生长的抑制作用尤为明显,菌丝生长速度缓慢。
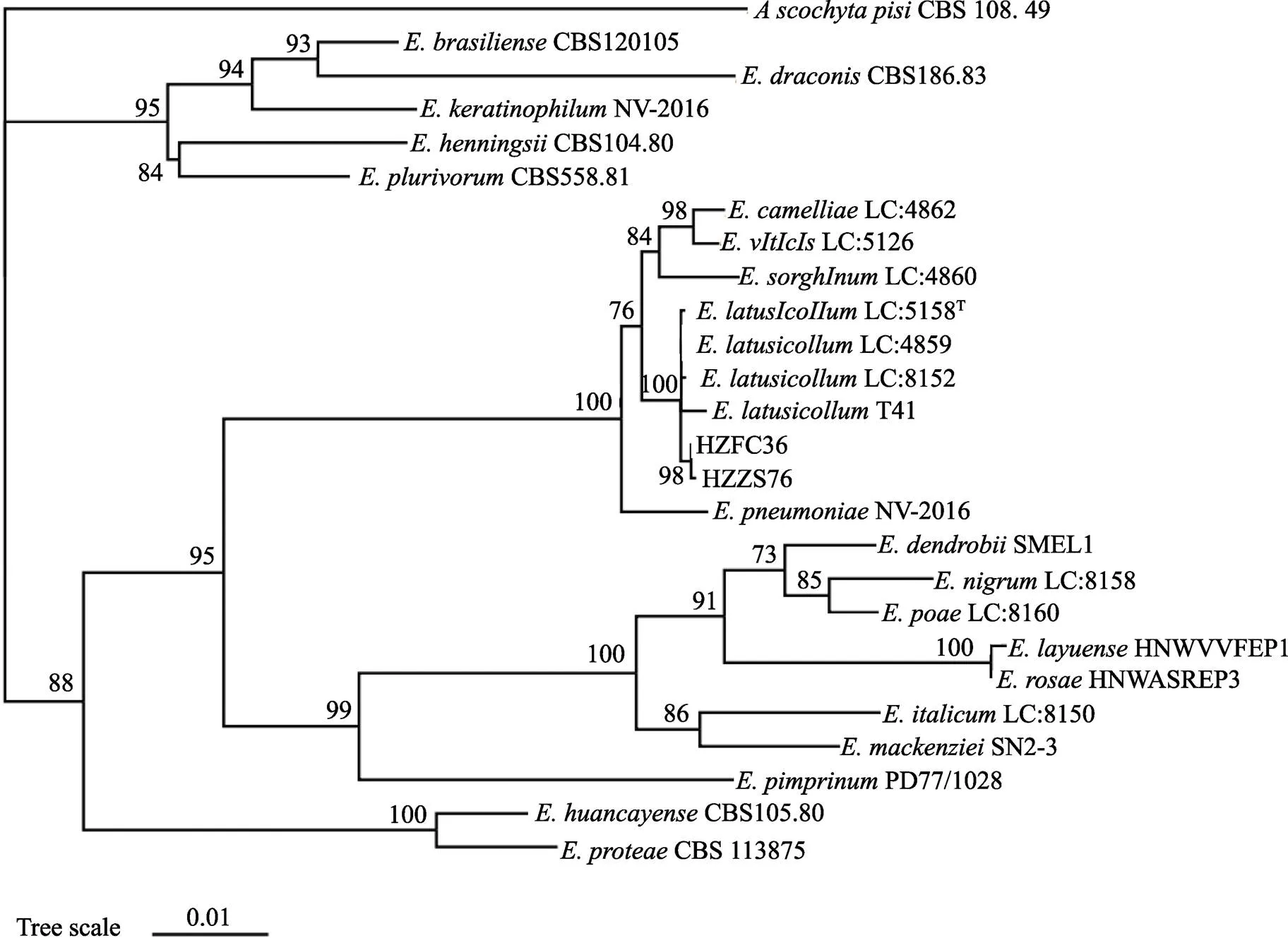
图3 基于LSU-ITS-RPB2-TUB2构建系统发育进化树
2.5.2 培养基对病原菌菌丝生长的影响 菌株HZFC36和HZZS76在8种培养基上的生长情况基本一致(图4B)。在CMA培养基上菌株菌丝生长速度最快,培养7 d后菌落平均直径达79.08 mm;其次是PDA培养基,这2种培养基无显著差异(<0.05);菌株在WA培养基上生长最慢,显著低于其余7种培养基,说明最适菌株菌丝生长的培养基为CMA培养基。
2.5.3 碳源对病原菌菌丝生长的影响 菌株HZFC36和HZZS76在7种供试碳源的培养基上均能生长,培养7 d后的菌落平均直径均显著大于对照,且菌株间生长差异不显著(图4C)。当以蔗糖为碳源时,菌株菌丝生长最快,菌落平均直径达到75.08 mm。
2.5.4 氮源对病原菌菌丝生长的影响 菌株HZFC36和HZZS76在不同氮源的培养基上菌丝生长速度存在差异,但均显著高于对照(图4D)。2个菌株菌丝生长的最适氮源为牛肉浸粉,菌落直径显著高于其他氮源处理,其次是蛋白胨。并且,菌株HZFC36与HZZS76在以尿素为唯一氮源的培养基上生长差异较大。
2.5.5 pH对病原菌菌丝生长的影响 菌株HZFC36和HZZS76在pH 4~11的范围内均可生长,且同一pH下菌株间生长差异不大,但不同pH间菌株的生长差异较为显著(图4E)。在pH 4~6范围内,菌丝生长速度随pH的升高而显著增加;在pH 6~11的范围内,菌丝生长速度又显著降低。pH为6时,培养7 d后菌株的菌落平均直径最大,为75.67 mm。由此可知,病原菌适宜在弱酸性条件下生长。
2.5.6 光照对病原菌菌丝生长的影响 菌株HZFC36和HZZS76在全光照、黑暗光照交替和全黑暗条件下菌丝均可以生长(图4F),且彼此间差异不显著。菌株菌丝在全光照条件下生长最快,培养7 d后的菌落平均直径为71.75 mm,说明光照充足的环境更利于病原菌生长。
2.5.7 病原菌菌丝的致死温度测定 将经供试温度水浴10 min处理后的菌饼接在PDA培养基上培养观察发现,菌株HZFC36和HZZS76在45℃处理后菌丝均能生长,在50℃处理下则未生长。再以45℃为起始温度,1℃为梯度进行逐渐升温水浴处理,结果显示,经温度≥47℃水浴10 min处理后,菌丝在培养基上不再生长,因此推断病原菌菌丝的致死温度为47℃水浴10 min。
不同小写字母表示差异显著(P<0.05)。
2.6 室内药剂筛选
10种化学药剂对烟草叶斑病病原菌的抑制效果有差异(表3)。50%啶酰菌胺、25%吡唑醚菌酯、50%咯菌腈、450 g/L咪鲜胺、10%苯醚甲环唑和500 g/L异菌脲6种药剂的抑制作用较为明显,EC50分别为4.752×10–2、4.989×10–2、1.406×10–1、2.063×10–1、3.090×10–1、8.703×10–1mg/L,这6种药剂均具有防治引起的烟草叶斑病的潜力,其中50%啶酰菌胺和25%吡唑醚菌酯的EC50最低,抑制效果最好。430 g/L戊唑醇、40%腈菌唑和80%代森锰锌对病原菌的抑制效果相对较差,EC50分别为1.745×100、2.227×100、1.477×101mg/L,但是对引起的烟草叶斑病的防治也具有一定的指导意义。
3 讨论
在广西壮族自治区调查发现的不同于常见烟草叶斑类病害的症状表现为:患病初期,叶片上出现灰白色的小圆斑,随着病情发展,圆斑逐渐扩散成不规则状,病斑中心形成穿孔,颜色为灰白色,边缘棕褐色,有褪绿的黄色晕圈。本研究通过科赫氏验证、形态特征和多基因序列(、、和)分析鉴定,将病原菌确定为,该病害特征与GUO等[16]报道的贵州省由导致的烟草叶斑病症状相似。
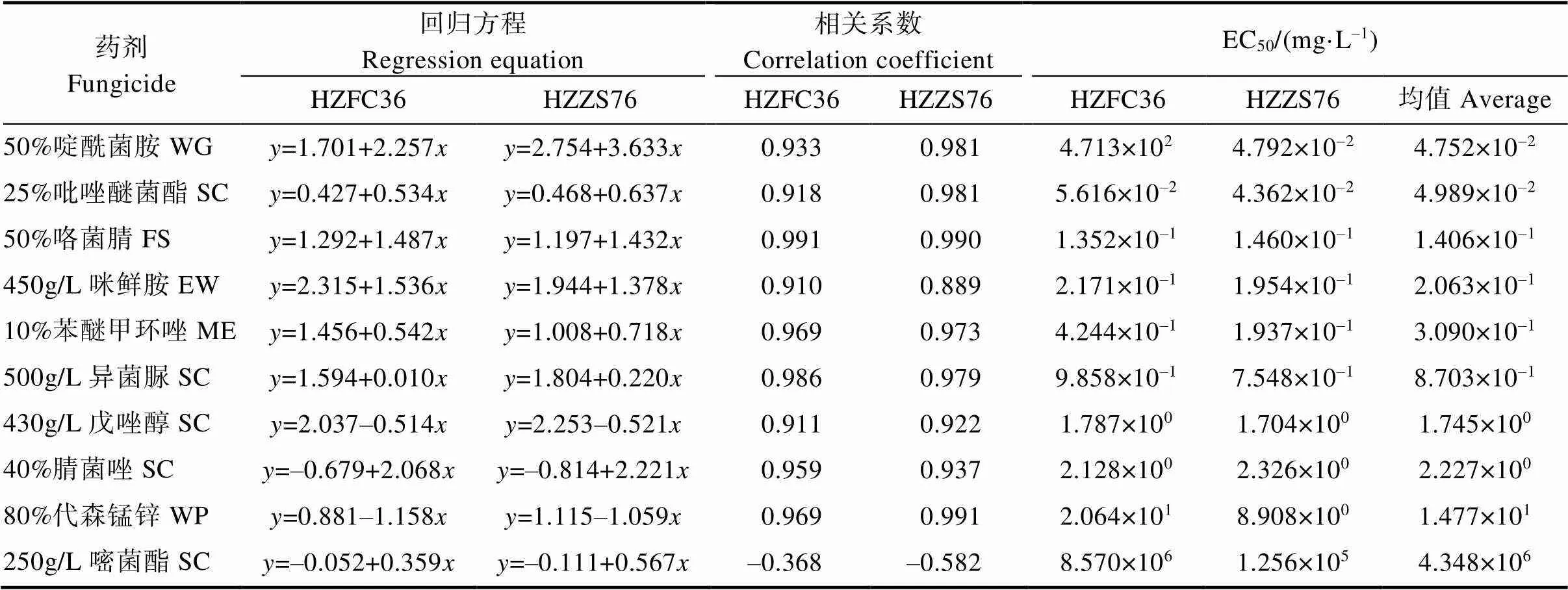
表3 不同杀菌剂对病原菌株的抑制效果
附球菌属()是由AVESKAMP等[35]通过利用4个基因(、、、)对亚隔孢壳科(Didymellaceae)进行多位点系统发育研究建立的新属,该属典型的特征为能够产生深色的葡萄串状的厚垣孢子。CHEN等[36-37]利用多序列(ITS、、、)对附球菌属进行了修订和补充,添加了5种不产生厚坦孢子的原茎点霉属()真菌和9个新种,其中包含。本研究中致病菌株HZFC36和HZZS76在PDA和OA培养基上均产生红色色素,但未见厚垣孢子,与CHEN等[36]报道的高粱叶斑病致病菌株LC 5158的形态学特征有一定差异,主要表现为菌株LC 5158在PDA和OA培养基上无色素产生;而菌株HZFC36、HZZS76与贵州省烟草叶斑病病原菌T41、火龙果茎斑病病原菌HJ2、黑龙江省玉米茎腐病病原菌JF3[37]、云南省烟草烂根病病原菌HH12在形态特征上基本一致。本研究对的生物学特性测定结果表明,病原菌菌丝生长最适温度为28℃,最适pH为6,与肖显梅等[14]报道的病原菌HJ12的最适生长温度为26℃和最适pH为6~7稍有差异,其原因可能与采集病原菌所处地理位置和不同寄主有关。
具有寄主多样性,可侵染烟草[16-17]、番茄[15]、辣椒[15]、花菜[15]、山药[15]、火龙果[14]、玉米[38]和胡颓子[39]等多种植物。在农业生产上及时采取有效措施对病害进行控制是防止病害暴发流行和减少经济损失的关键。目前,针对引起的植物病害的防治研究基本处于空白,本研究采用菌丝生长速率法测定了10种化学药剂对的抑制效果,结果表明50%啶酰菌胺、25%吡唑醚菌酯、50%咯菌腈、450 g/L咪鲜胺、10%苯醚甲环唑和500 g/L异菌脲6种杀菌剂对均有较好的抑制效果,EC50值均小于1 mg/L,其中以50%啶酰菌胺和25%吡唑醚菌酯为最佳,EC50值分别为4.752×10–2mg/L和4.989×10–2mg/L,相关结果为后续田间试验与示范奠定了基础。本研究为引起广西壮族自治区烟草叶斑病的田间识别和药剂防控提供了理论参考。
[1] 喻保华, 寇小杰, 孙亚楠. 中国烤烟生产技术进步贡献率实证分析[J]. 安徽农业科学, 2022, 50(1): 244-248.
YU B H, KOU X J, SUN Y N. Empirical analysis on contribution rate of tobacco production technology progress in China[J]. Journal of Anhui Agricultural Sciences, 2022, 50(1): 244-248. (in Chinese)
[2] 黄文清, 李明贤, 周冀衡. 中国烤烟种植区域布局变迁及其影响因素[J]. 湖南农业大学学报(自然科学版), 2015, 41(1): 35-41.
HUANG W Q, LI M X, ZHOU J H. Layout change of flue-cured tobacco planting regions in China and its impact factors[J]. Journal of Hunan Agricultural University (Natural Sciences), 2015, 41(1): 35-41. (in Chinese)
[3] 陈 晨, 牛莉莉, 程玉渊, 孙善兴, 胡燕芳, 贾晓果, 范志珂. 烟草种植移栽自动化应用研究[J]. 种子科技, 2021, 39(22): 135-136.
CHEN C, NIU L L, CHENG Y Y, SUN S X, HU Y F, JIA X G, FAN Z K. Study on automatic application of tobacco planting transplanting[J]. Seed Science & Technology, 2021, 39(22): 135-136. (in Chinese)
[4] 马俊红, 刘冬梅, 李永亮, 户艳霞, 卢灿华, 盖晓彤, 姜 宁, 莫笑晗, 麻莉娜, 王挥华, 王宇航, 夏振远. 烟草病虫药害智能识别基准数据集构建及三维注意力模型设计[J]. 中国烟草学报, 2021, 27(5): 52-60.
MA J H, LIU D M, LI Y L, HU Y X, LU C H, GAI X T, JIANG N, MO X H, MA L N, WANG H H, WANG Y H, XIA Z Y. Construction of benchmark data set for intelligent identifica-tion of tobacco pests, diseases, phytotoxicity and design of three dimensional attention model[J]. Acta Tabacaria Sinica, 2021, 27(5): 52-60. (in Chinese)
[5] 贺海滨. 烟草病虫害发生规律与绿色防控措施[J]. 世界热带农业信息, 2022(1): 35-36.
HE H B. Occurrence regularity of tobacco diseases and insect pests and green prevention and control measures[J]. World Tropical Agriculture Information, 2022(1): 35-36. (in Chinese)
[6] 谷纪涛, 丁 伟, 余永旭, 王振国, 肖 鹏, 罗建钦, 李承荣. 烟草野火病对烟叶产量产值及化学成分的影响[J]. 江苏农业科学, 2017, 45(4): 81-84.
GU J T, DING W, YU Y X, WANG Z G, XIAO P, LUO J Q, LI C R. Effects of tobacco wildfire disease on yield value and chemical composition of tobacco leaves[J]. Jiangsu Agricultural Sciences, 2017, 45(4): 81-84. (in Chinese)
[7] 朱贤朝. 中国烟草病害[M]. 北京: 中国农业出版社, 2002.
ZHU X C. Tobacco diseases in China[M]. Beijing: China Agriculture Press, 2002. (in Chinese)
[8] 彭希文, 刘光珍, 杨永柱, 杨佑斋, 邓先明. 云南省烟草赤星病(Tobacco brown spot)病原研究及其防治药剂的筛选[J]. 西南农业大学学报, 2000(2): 153-156.
PENG X W, LIU G Z, YANG Y Z, YANG Y Z, DENG X M. Identification of pathogens for brown spots on tobacco plants in Yunnan province and selection for effective fungicides for its control[J]. Journal of Southwest Agricultural University, 2000(2): 153-156. (in Chinese)
[9] 张中义, 李继新, 关国经, 梁贵林, 黄兴龙, 宫飞燕, 王英祥. 烤烟棒孢霉叶斑病病原菌鉴定[J]. 中国烟草学报, 2008, 14(6): 44-47.
ZHANG Z Y, LI J X, GUAN G J, LIANG G L, HUANG X L, GONG F Y, WANG Y X. Identification of fungal pathogen of corynespora leaf spot in fiue-cured tobacco[J]. Acta Tabacaria Sinica, 2008, 14(6): 44-47. (in Chinese)
[10] 王海蓉. 烟草真菌性病害的综合防治[J]. 四川农业科技, 2009(3): 52-53.
WANG H R. Comprehensive control of tobacco fungal diseases[J]. Sichuan Agricultural Science and Technology, 2009(3): 52-53. (in Chinese)
[11] 肖艳松, 钟 权, 吴文信, 李思军, 朱俊子, 钟 杰. 湖南烟草靶斑病的病原鉴定及分子检测[J]. 湖南农业大学学报(自然科学版), 2020, 46(6): 711-715.
XIAO Y S, ZHONG Q, WU W X, LI S J, ZHU J Z, ZHONG J. Pathogen identification and molecular detection of tobacco target spot in Hunan province[J]. Journal of Hunan Agricultural University (Natural Sciences), 2020, 46(6): 711-715. (in Chinese)
[12] 柴 欣, 徐业平, 姚 剑, 余晓峰, 宗 凯, 李云飞, 江 彤. 烟草炭疽菌的分子鉴定与检测[J]. 安徽农业大学学报, 2015, 42(5): 803-807.
CHAI X, XU Y P, YAO J, YU X F, ZONG K, LI Y F, JIANG T. Molecular identification and detection of tobacco anthracnose pathogen[J]. Journal of Anhui Agricultural University, 2015, 42(5): 803-807. (in Chinese)
[13] 袁 军. 中国西南地区亚隔孢壳科(Didymellaceae)植物病原真菌分子系统学研究[D]. 贵阳: 贵州大学, 2021.
YUAN J. Molecular systematics of plant pathogenic fungi in Didymellaceae in southwest China[D]. Guiyang: Guizhou university, 2021. (in Chinese)
[14] 肖显梅, 白成艳, 王 晗, 张 荣. 一种引起火龙果茎部病害病原菌的鉴定[J]. 中国南方果树, 2018, 47(2): 1-5.
XIAO X M, BAI C Y, WANG H, ZHANG R. Identification of the pathogen causing pitaya stem disease[J]. South China Fruits, 2018, 47(2): 1-5. (in Chinese)
[15] 韩 帅, 张河庆, 吴 婕, 李洪浩, 席亚东. 四川省山药黑斑病病原菌的鉴定[J]. 植物保护, 2019, 45(2): 68-74.
HAN S, ZHANG H Q, WU J, LI H H, XI Y D. Identification of the pathogen causing black rot of yam in Sichuan province[J]. Plant Protection, 2019, 45(2): 68-74. (in Chinese)
[16] GUO Z N, YU Z H, WANG H C, XIE H L. Leaf spot caused byon tobacco in China[J]. Plant Disease, 2021, 105(2): 501-501.
[17] GAI X T, JIANG N, LU C H, XIA Z Y, QIN X Y. First report ofcausing root rot onin China[J]. Journal of Plant Pathology, 2020, 102: 1291.
[18] 黄鈜琳, 尹桥秀, 江仕龙, 包兴涛, 武 娴, 王德炉, 陈 卓. 茶叶斑病病原菌高粱附球菌()的鉴定及生物学特性[J]. 热带作物学报, 2021, 42(11): 3269-3277.
HUANG H L, YI Q X, JIANG S L, BAO X T, WU X, WANG D L, CHEN Z. Identification and biological characteristics of, pathogen of tea leaf spot[J]. Chinese Journal of Tropical Crops, 2021, 42(11): 3269-3277. (in Chinese)
[19] 于广宇, 曹 尚, 张美琦, 台莲梅, 郭永霞, 左豫虎. 黑龙江省高粱靶斑病病原菌的鉴定及其生物学特性[J/OL]. 植物保护学报: 1-15[2022-10-20]. DOI:10.13802/j.cnki.zwb hxb.2021.2021069.
YU G Y, CAO S, ZHANG M Q, TAI L M, GUO Y X, ZUO Y H. Identification and biological characteristics of the pathogen causing sorghum target leaf spot disease in Heilongjiang province[J/OL]. Journal of Plant Protection: 1-15 [2022-10-20]. DOI:10.13802/j.cnki.zwbhxb. 2021. 2021069. (in Chinese)
[20] 刘自华, 张泽志, 苗玉焕, 朱成姗, 刘大会, 陈运中, 刘义梅. 虎杖叶斑病病原菌的鉴定、生物学特性及其有效杀菌剂研究[J]. 中国中药杂志, 2022, 47(12): 3185-3191.
LIU Z H, ZHANG Z Z, MIAO Y H, ZHU C S, LIU D H, CHEN Y Z, LIU Y M. Identification, biological characteristics, and screening of effective fungicides ofcausing leaf spot on[J]. China Journal of Chinese Materia Medica, 2022, 47(12): 3185-3191. (in Chinese)
[21] 王梦奇. 东北地区茎点霉属真菌研究[D]. 长春: 吉林农业大学, 2019.
WANG M Q. Studies of Phoma in Northeast China[D]. Changchun: Jilin Agricultural University, 2019. (in Chinese)
[22] REHNER S A, SAMUELS G J. Taxonomy and phylogeny ofanalysed from nuclear large subunit ribosomal DNA sequences[J]. Mycological Research, 1994, 98: 625-634.
[23] GARDES M, BRUNS T D. ITS primers with enhanced specificity for basidiomycetes - application to the identification of mycorrhizae and rusts[J]. Molecular Ecology, 1993, 2: 113-118.
[24] WHITE T J, BRUNS T, LEE S, TAYLOR J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]. PCR protocols: a guide to methods and applications, San Diego: Academic Press, 1990: 315-322.
[25] SUNG G H, SUNG J M, HYWEL-JONES N L, SPATAFORA J W. A multi-gene phylogeny of Clavicipitaceae (Ascomycota, Fungi): identification of localized incongruence using a combinational bootstrap approach[J]. Molecular Phylogenetics and Evolution, 2007, 44(3): 1204-1223.
[26] LIU Y J, WHELEN S, HALL B D. Phylogenetic relationships among ascomycetes: evidence from an RNA polymerse II subunit[J]. Molecular Biology and Evolution, 1999, 16(12): 1799-1808.
[27] WOUDENBERG J H C, AVESKAMP M M, GRUYTER J, SPIERS A G, CROUS P W. Multipleteleomorphs are linked to themorphotype[J]. Persoonia, 2009, 22(1): 56-62.
[28] 吴如慧, 李增平, 程乐乐, 张 宇. 台湾相思假芝根腐病病原菌的鉴定及其生物学特性测定[J]. 热带作物学报, 2019, 40(8): 1590-1597.
WU R H, LI Z P, CHENG L L, ZHANG Y. Identification and biological characteristics of acacia confuse root rot pathogen of[J]. Chinese Journal of Tropical Crops, 2019, 40(8): 1590-1597. (in Chinese)
[29] 方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998: 122-124.
FANG Z D. Plant disease research method[M]. 3rd edition. Beijing: China Agriculture Press, 1998: 122-124. (in Chinese)
[30] 仇 芳, 徐 刚, 谢昌平, 李 希, 郑妃庆. 油梨根腐病病原菌的鉴定、生物学特性及室内药剂筛选[J]. 热带作物学报, 2021, 42(5): 1424-1432.
QIU F, XU G, XIE C P, LI X, ZHENG F Q. Identification, biological characteristics and screening og fungicides of the pathogen causing root rot on avocado ()[J]. Chinese Journal of Tropical Crops, 2021, 42(5): 1424-1432. (in Chinese)
[31] 刘思睿, 宋莉莎, 任 静, 李 忠. 黄精褐斑病的病原生物学特性[J]. 菌物学报, 2019, 38(6): 768-777.
LIU S R, SONG L S, REN J, LI Z. Biological characteristics of pathogen causingbrown leaf spot[J]. Mycosystema, 2019, 38(6): 768-777. (in Chinese)
[32] 何 翔, 李 翱, 李 楚, 张 庆, 杨群辉, 朱红业, 陈齐斌, 杨佩文. 滇重楼稻曲拟盘多毛孢叶斑病病原鉴定及其生物学特性测定[J]. 植物保护, 2020, 46(6): 47-54, 64.
HE X, LI A, LI C, ZHANG Q, YANG Q H, ZHU H Y, CHEN Q B, YANG P W. Pathogen identification and biological characteristics ofvar.leaf spot disease caused by[J]. Plant Protection, 2020, 46(6): 47-54, 64. (in Chinese)
[33] 耿丽华, 王建设, 马 建, 杨 洋, 史 越, 宋顺华. 一种甜瓜新症状病害的病原鉴定及其生物学特性[J]. 中国瓜菜, 2021, 34(3): 15-20.
GENG L H, WANG J S, MA J, YANG Y, SHI Y, SONG S H. Identification and biological characteristics of the pathogen causing a new symptom disease of melon[J]. China Cucurbits and Vegetables, 2021, 34(3): 15-20. (in Chinese)
[34] 韦文添. 不同杀菌剂对辣椒炭疽病菌的室内毒力测定[J]. 江苏农业科学, 2013, 41(4): 117-119.
WEI W T. Laboratory toxicity test of different fungicides against anthrax in pepper[J]. Jiangsu Agricultural Sciences, 2013, 41(4): 117-119. (in Chinese)
[35] AVESKAMP M M, GRUYTER J DE, WOUDENBERG J H C, VERKLEY G J M, CROUS P W. Highlights of the Didymellaceae: a polyphasic approach to characteriseand related pleosporalean genera[J]. Studies in Mycology, 2010, 65: 1-60.
[36] CHEN Q, JIANG J R, ZHANG G Z, CAI L, CROUS P W. Resolving theenigma[J]. Studies in Mycology, 2015, 82(82): 137-217.
[37] CHEN Q, HOU L W, DUAN W J, CROUS P W, CAI L. Didymellaceae revisited[J]. Studies in Mycology, 2017, 87: 105-159.
[38] XU X, ZHANG L, YANG X L, LI J J, WANG X J, ZHAO J W, XIANG W S. First report of maize stalk rot caused byon maize (L.) in China[J]. Plant Disease, 2022, 106(8): 2255.
[39] QI X L, HE J, LI D W, HUANG L. First report of leaf spot oncaused byin China[J]. Forest Pathology, 2021, 51(5): e12716.
Identification, Biological Characteristics and Fungicide Screening of Tobacco Leaf Spot Disease Pathogen
AN Xuanxian1, SANG Weijun1*, LU Yanhui2, KONG Fei2, WANG Wuquan2*, LI Haoxi1, YANG Jiangmin1, PENG Lijuan1, YANG Maofa1
1. College of Tobacco Science, Guizhou University /Guizhou Provincial Key Laboratory for Tobacco Quality Research, Guiyang, Guizhou 550025, China; 2. Department of Science and Technology, Guangxi Zhuang Autonomous Region Company, China National Tobacco Corporation, Nanning, Guangxi 530022, China
Leaf spot disease is one of the main tobacco diseases in the field period, which is mainly caused by fungal infection. It is easy to happen and spread, and has a great impact on the quality and yield of tobacco. In this study, the strain was isolated and purified from the leaves with typical leaf spot diseases of tobacco variety ‘K326’ in Guangxi Zhuang Autonomous Region by tissue separation, and through pathogenicity determination combined with morphological characteristics and molecular biological methods to identify pathogens. The mycelium growth rate method was used to measure the mycelium growth of pathogens in different media, temperature, pH, carbon source, nitrogen source, light, lethal temperature treatment and 10 common chemical conditions. In the early period of tobacco leaf spot disease, the typical symptoms of the leaf spot disease are gray white small round spots. As the disease worsens, the round spot gradually diffuses into irregular shape, and the center of the spot forms a perforation, the color is gray white, the edge is brown, and accompanied by a yellow halo.We isolated and purified two strains and named them as HZFC36 and HZZS76. The pathogenicity test results showed that both strains could cause disease spots on the leaves of healthy ‘K326’ tobacco plant under the condition of no leaf injury.was identified as the pathogen causing tobacco leaf spot disease in Guangxi, based on morphological characteristics of pathogen and phylogenetic analysis of multiple loci (,,and). The mycelia of the pathogen grew the fastest on CMA medium, and the optimal growth temperature was 28℃, the optimal pH was 6, the optimal carbon was sucrose and nitrogen source was beef extract powder. 24 h continuous light is favorable to the growth of the mycelia, and the mycelia did not grow after being continuously treated in water bath at 47℃ for 10 min. Preliminary screening results of chemical fungicides in the laboratory showed that 50% boscalid and 25% pyraclostrobine had the best inhibitory effect on the pathogen with EC50value 4.752×10–2mg/L and 4.989×10–2mg/L respectively. The results of the study would provide a theoretical basis for the field control of tobacco leaf spot caused by.
leaf spot disease; identification of pathogenic bacteria; biological characteristics; fungicide screening
S435.72
A
10.3969/j.issn.1000-2561.2022.12.016
2022-05-10;
2022-06-14
中国烟草总公司广西壮族自治区公司项目(No. 202145000024006)。
安宣鲜(1997—),男,硕士研究生,研究方向:烟草病原真菌学。*通信作者(Corresponding author):桑维钧(SANG Weijun),E-mail:984139246@qq.com;王五权(WANG Wuquan),E-mail:redtea_lu@126.com。
