东北三省和浙江木耳稳定同位素特征与产地溯源
2023-01-16马延莉宋婷婷魏春雁徐丽红王树林李春霖聂晶袁玉伟
马延莉 宋婷婷 魏春雁 徐丽红 王树林 李春霖 聂晶 袁玉伟,*
(1浙江省农业科学院农产品质量安全与营养研究所,浙江杭州 310021;2青海大学农牧学院,青海西宁 810016;3浙江省农业科学院园艺研究所,浙江杭州310021;4吉林省农业科学院,吉林长春 130033)
黑木耳(Auricularia auricula)含有丰富的必需氨基酸、蛋白质、矿物质等,作为食用和药用资源一直备受消费者喜爱[1-2]。由于黑木耳品质会受到产地因素如气候、代料、水源等的影响[3],各地黑木耳具有不同的地理标志特色[4],如东北(黑龙江、吉林、辽宁)3种黑木耳属于国家地理标志产品[5],浙江省龙泉市黑木耳获得国家生态原产地产品保护[6],这些地域特征、品牌价值以及黑木耳对健康的益处[7-9]使消费者对黑木耳的需求不断增加[10],而市场假冒地理标志和产地产品案件时有发生。因此,进行黑木耳产地溯源对维护消费者权益、保障市场公平性和产业健康发展具有重要意义。
目前,黑木耳产地溯源判别方法主要有DNA条码检测、近红外光谱仪扫描、气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)、主成分分析(principal component analysis,PCA)等。如宋君等[11]利用DNA条码对黑木耳样品进行了产地溯源的分子检测研究;夏珍珍等[12]利用近红外光谱仪扫描不同主产地的香菇干样,利用偏最小二乘判别分析(partial least squares-discriminant analysis,PLS-DA)分别建立了不同省份栽培香菇的产地判别模型;杨根[13]利用GC-MS技术检测不同产地黑木耳,找出了不同产地间的差异;宋婷婷等[14]以8种不同基质配方栽培的双孢蘑菇为对象,测定4个稳定同位素的比例并结合PCA分析表明,可以将不同培养基质配方栽培的双孢蘑菇有效分为3类,3个主成分的贡献率为78.2%。以上研究证实,稳定同位素技术主要根据同位素分馏效应检测反应物同位素组成发生的改变,由此区分产物的地理来源[15-16]。目前,该技术是国际公认的有效溯源技术之一,已经在葡萄[17]、茶叶[18]、稻米[19]等植物源农产品产地判别应用中取得良好成效。因此,利用稳定同位素技术分析不同产地黑木耳样品δ13C、δ15N、δ2H、δ18O值并进行产地溯源具有可行性。
本研究在该类研究方法基础上,针对我国黑木耳原产地判定进行探索,采用元素分析-稳定同位素比率质谱仪测定了东北(黑龙江、吉林、辽宁)、浙江产地黑木耳中的稳定同位素δ13C、δ15N、δ2H、δ18O值,分析不同产地的分布特征,利用新疆黑木耳样品作为外部验证,结合PLS-DA分析构建黑木耳稳定同位素溯源模型,以期为黑木耳产地判定提供技术参考。
1 材料与方法
1.1 材料与试剂
本试验共采集85份黑木耳样品,其中东北(黑龙江、吉林、辽宁)40份、浙江34份,新疆11份,分别采自各产地代表性产区木耳种植基地、食用菌合作社等,其中新疆11份样品用于模型验证。样品产地信息见表1。
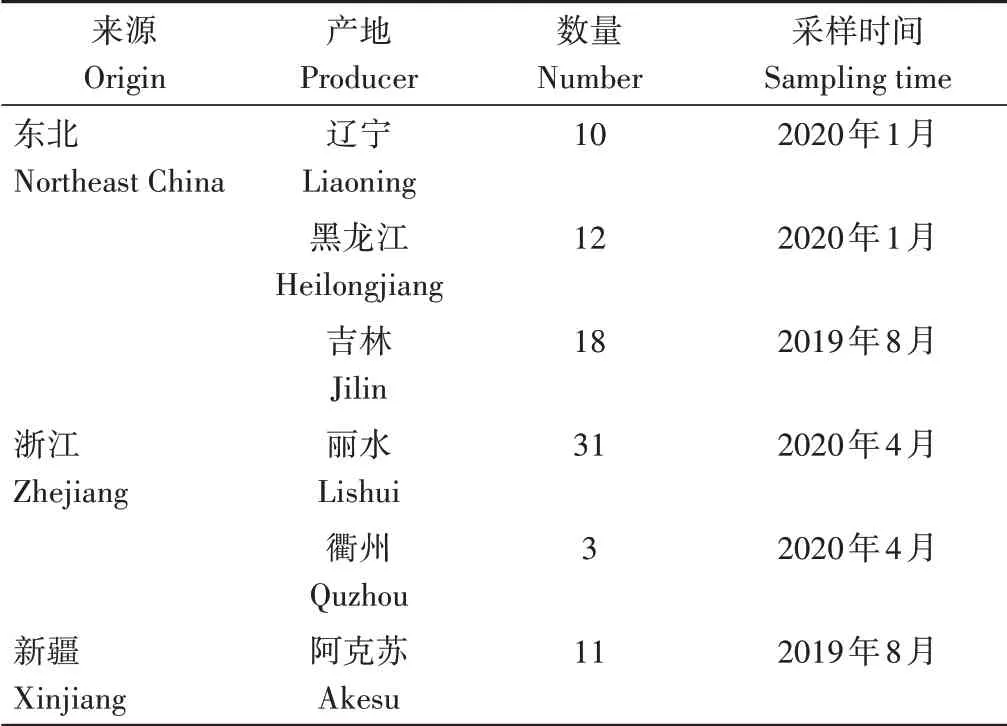
表1 黑木耳样品产地及数量Table 1 Origin and quantity of Auricularia auricula samples
稳定同位素δ13C标准物质:B2155(蛋白质,δ13CV-PDB=-26.98‰)、IAEA-CH-6(蔗 糖,δ13CV-PDB=-10.45‰),奥地利国际原子能机构;USGS64(甘氨酸,δ13CV-PDB=-40.81‰),美国地质勘探局。
稳定同位素δ15N标准物质:B2155(蛋白质,δ15Nair=5.94‰)、IAEA-N-2(硫酸铵,δ15Nair=20.30‰),奥地利国际原子能机构;USGS64(甘氨酸,δ15NairV-PDB=1.76‰),美国地质勘探局。
稳定同位素δ2H标准物质:USGS54(加拿大黑松木粉,δ2HV-SNOW=-150.4‰)、USGS56(南非红象牙木粉,δ2HV-SNOW=-44.00‰),美国地质勘探局。
稳定同位素δ18O标准物质:USGS54(加拿大黑松木粉,δ18OV-SNOW=17.79‰)、USGS56(南非红象牙木粉,δ18OV-SNOW=27.23‰),美国地质勘探局。
1.2 仪器与设备
XP6型天平,瑞士Mettler-Toledo公司;Vario PYRO cube型元素分析仪,德国Elementar公司;Isoprime 100型稳定同位素比率质谱仪,英国Isoprime公司;HR2864粉碎机,中国飞利浦电子公司;SCIENTZ-18N冷冻干燥机,宁波新芝生物科技股份有限公司。
1.3 试验方法
1.3.1 样品前处理样品采集后,去除残渣进行晾晒。用真空冷冻干燥机干燥后,再用粉碎机将黑木耳样品进行粉碎处理,过60目筛后装入样品袋,在常温25℃条件下贮存待测。
1.3.2 稳定性碳、氮同位素比率检测称取大约3~5 mg待测样,用锡箔杯包好后放置于元素分析仪样品盘中,碳元素和氮元素通过高温燃烧后经还原铜转化为纯净的CO2和N2,进入稳定同位素质谱仪检测。具体条件:元素分析仪氦气吹扫流量为230 mL·min-1;氧化炉和还原炉温度分别为1 020和650℃,进入质谱仪载气氦气流量为100 mL·min-1。在分析过程中,δ13C检测以B2155、IAEA-CH-6和USGS64为标样进行三点校正;δ15N以B2155、IAEA-N-2和USGS64为标样进行三点校正。
1.3.3 稳定性氢、氧同位素比率检测称取0.3~0.6 mg样品,用银杯包好后放至元素分析仪样品盘中,氢元素和氧元素经高温裂解后转化为纯净的H2和CO,进入稳定同位素质谱仪检测。具体条件:元素分析仪裂解炉温度为1 450℃,氦气流量为125 mL·min-1。在分析过程中,δ2H以USGS54、USGS56为标样进行二点校正;δ18O以USGS54、USGS56为标样进行二点校正。
稳定性同位素比率计算公式如下:

式中,R样品为所测样品中重同位素与轻同位素的丰度比,即13C/12C、15N/14N、18O/16O、2H/1H;R标准为国际标准样品中重同位素与轻同位素的丰度比,其中δ13C以维也纳美洲拟箭石为基准,δ15N以大气中氮气为基准,δ2H和δ18O以维也纳标准平均海洋水为基准。
1.4 模型建立
将东北(黑龙江、吉林、辽宁)40份黑木耳样品和非东北(浙江和新疆)45份黑木耳样品随机分为训练集(64个)和验证集(21个),将浙江34份黑木耳样品和非浙江51份黑木耳样品(黑龙江、吉林、辽宁、新疆)按数随机分为训练集(64个)和验证集(21个),并保证训练集和验证集中不同产地的样品数量比保持一致,将所有黑木耳样品的4个稳定同位素比值(δ)作为输入变量,利用XLSTAT 2019软件建立PLS-DA产地判别模型。
1.5 数据处理
采用单因素方差分析(one way-ANOVA)和PLS-DA对黑木耳原产地进行判别。数据分析前利用Excel 2019将原始数据进行标准化,然后采用SPSS 18.0软件对数据进行单因素方差分析。
2 结果与分析
2.1 东北(黑龙江、吉林、辽宁)、浙江两产地黑木耳δ13C和δ15N特征差异
由表2可知,东北(黑龙江、吉林、辽宁)黑木耳δ13C值的范围为-24.5‰~-22.7‰,平均值为-23.6‰,浙江黑木耳δ13C值的范围为-26.2‰~-24.5‰,平均值为-25.2‰,东北(黑龙江、吉林、辽宁)黑木耳δ13C值显著高于浙江(P<0.05);东北(黑龙江、吉林、辽宁)黑木耳δ15N值的范围为-0.9‰~3.1‰,平均值为0.7‰,浙江黑木耳δ15N值的范围为-0.9‰~1.2‰,平均值为0.4‰,两产地之间的差异不显著(P>0.05);浙江黑木耳δ2H值范围为-24.9‰~-9.0‰,平均值为-16.6‰,东北(黑龙江、吉林、辽宁)黑木耳δ2H值范围为-62.2‰~-34.6‰,平均值为-46.7‰,浙江黑木耳δ2H值显著高于东北(P<0.05);东北(黑龙江、吉林、辽宁)黑木耳δ18O值范围为15.9‰~19.4‰,平均值为17.5‰,浙江黑木耳δ18O值范围为19.9‰~22.2‰,平均值为21.4‰,浙江黑木耳δ18O值显著高于东北(P<0.05)。
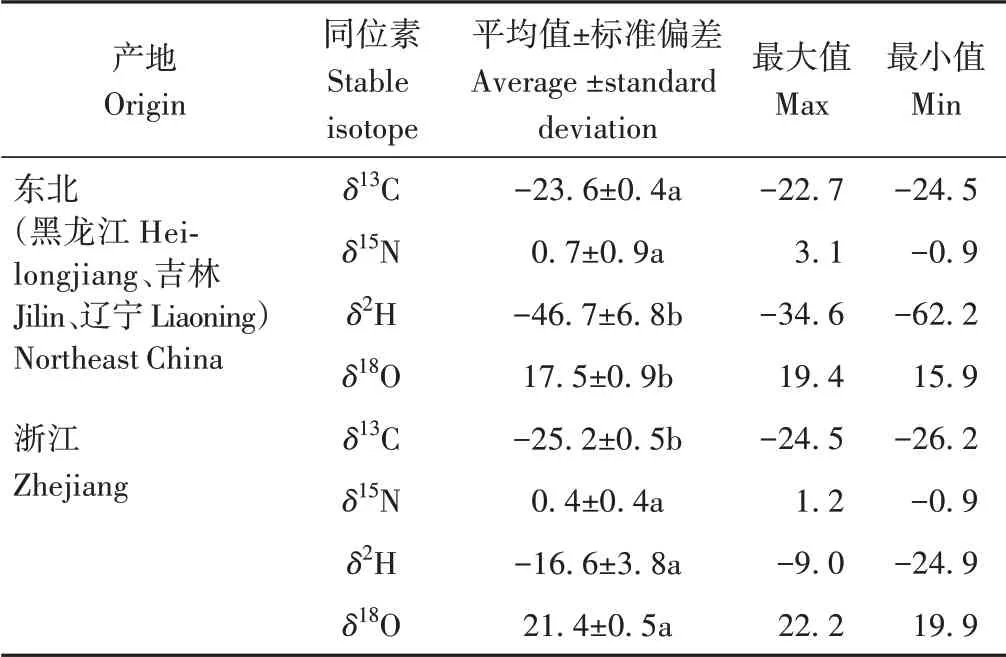
表2 黑木耳稳定同位素特征变化Table 2 Changes of stable isotope characteristics of Auricularia auricula /‰
东北(黑龙江、吉林、辽宁)、浙江两地共74份黑木耳δ13C值频率直方图和正态分布曲线如图1-A所示。在正态分布模型中,δ13C值的变化范围为-26.2‰~-22.7‰,其中东北(黑龙江、吉林、辽宁)黑木耳δ13C值为-24.5‰~-22.7‰,平均值为-23.6‰,浙江黑木耳δ13C值为-26.2‰~-24.5‰,平均值为-25.2‰,东北(黑龙江、吉林、辽宁)显著高于浙江(P<0.05)。东北、浙江两产地共74份黑木耳δ15N值频率直方图和正态分布曲线如图1-B所示,在正态分布模型中,δ15N值的变化范围为-0.9‰~3.1‰,其中东北(黑龙江、吉林、辽宁)黑木耳δ15N值为-0.9‰~3.1‰,平均值为0.7‰,浙江黑木耳δ15N值为-0.9‰~1.2‰,平均值为0.4‰,两产地之间的差异不显著(P>0.05)。说明δ13C值除了可能与地理经纬度和温度有关外,还与自然生长环境中的光照强度、代料基质有关[20],δ15N值除了可能与地域、基因型、年际有关外,还与代料基质中所用辅料如尿素等中氮的含量有关[21]。
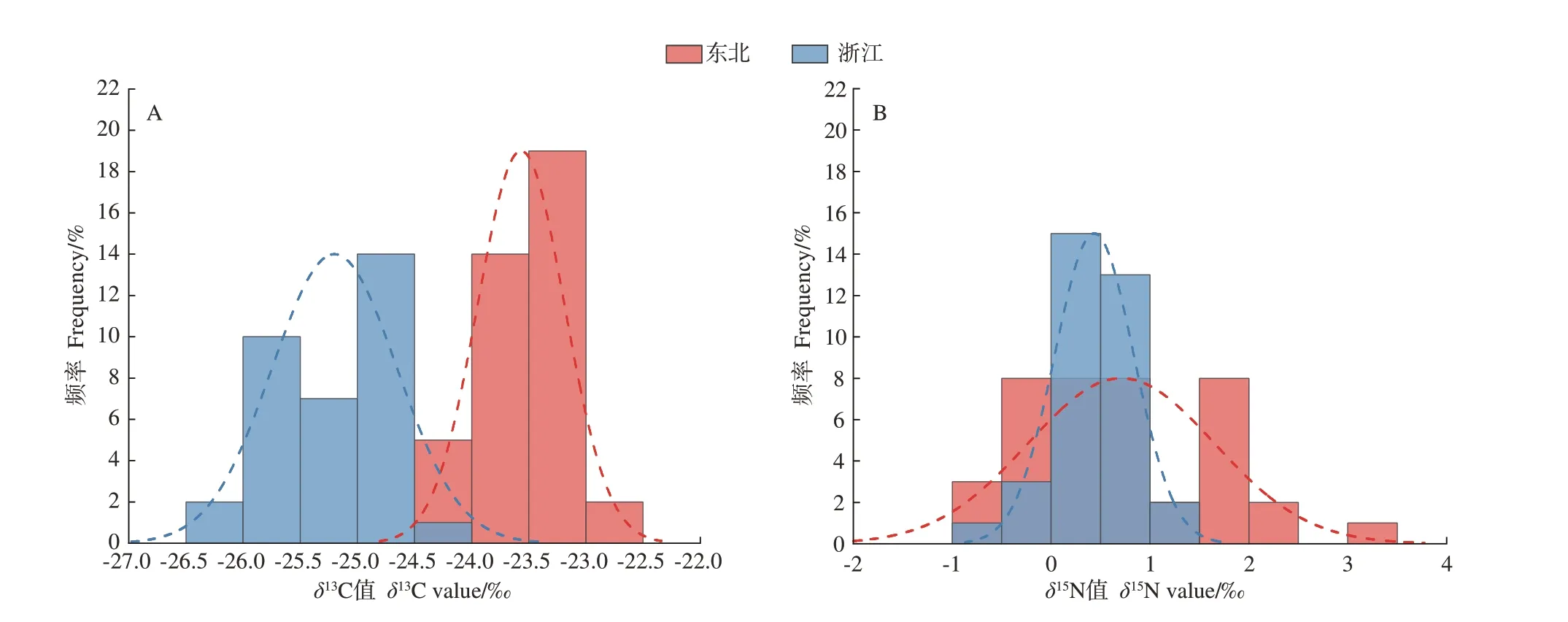
图1 东北(黑龙江、吉林、辽宁)、浙江黑木耳δ13C和δ15N分布图Fig.1 Distribution of δ13C and δ15N of Auricularia auricula in Northeast China and Zhejiang Province
2.2 东北(黑龙江、吉林、辽宁)、浙江两产地黑木耳δ2H和δ18O值特征差异
东北(黑龙江、吉林、辽宁)、浙江两地共74份黑木耳的δ2H值频率直方图和正态分布曲线如图2-A所示,在正态分布模型中,两产地黑木耳δ2H值的变化范围为-62.2‰~-9.0‰,其中浙江黑木耳δ2H值为-24.9‰~-9.0‰,平均值为-16.6‰,东北(黑龙江、吉林、辽宁)黑木耳δ2H值为-62.2‰~-34.6‰,平均值为-46.7‰,浙江显著高于东北(黑龙江、吉林、辽宁)(P<0.05)。东北(黑龙江、吉林、辽宁)、浙江两产地共74份黑木耳δ18O值频率直方图和正态分布曲线如图2-B所示,在正态分布模型中,δ18O值的变化范围为15.9‰~22.2‰,其中东北(黑龙江、吉林、辽宁)黑木耳δ18O值为15.9‰~19.4‰,平均值为17.5‰,浙江黑木耳δ18O值为19.9‰~22.2‰,平均值为21.4‰,浙江显著高于东北(黑龙江、吉林、辽宁)(P<0.05)。不同产地黑木耳中δ2H与δ18O值存在差异,这除了与产地气候有关外,还可能与南北两地水源δ2H、δ18O值和降雨量不同有关[22-23]。
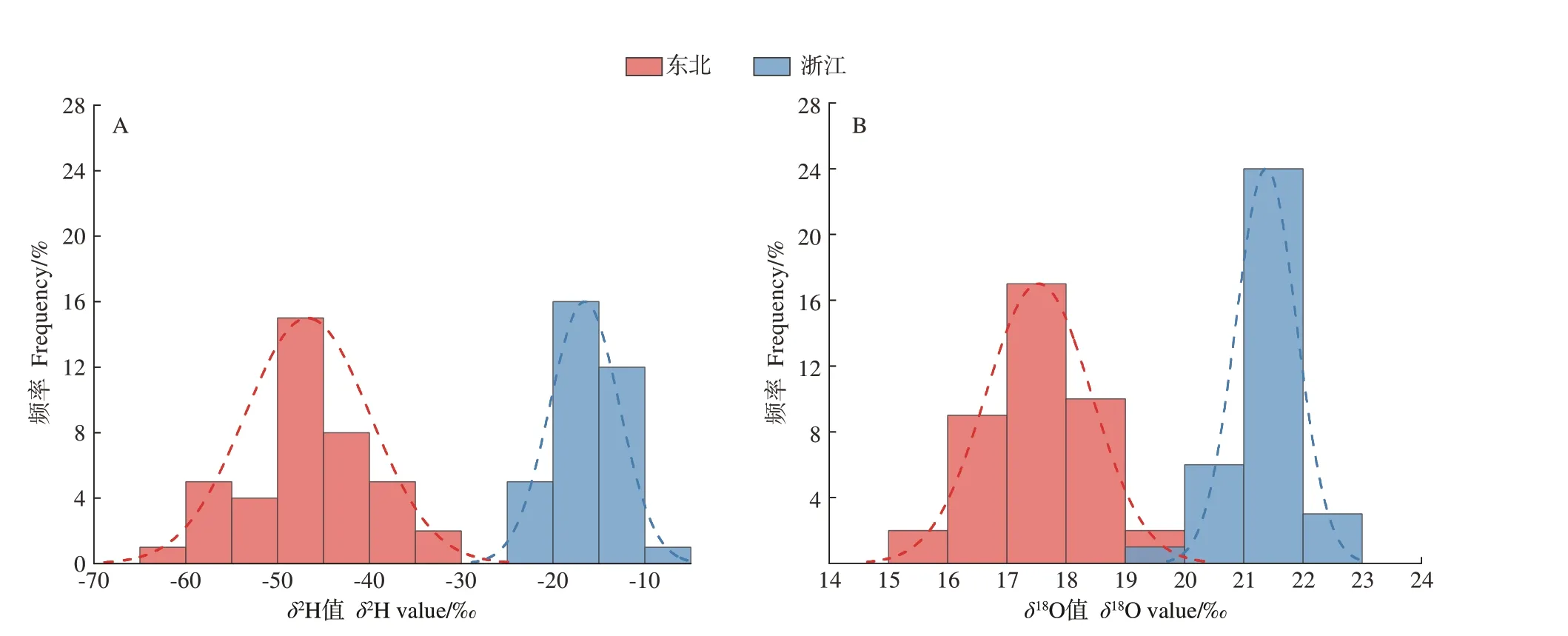
图2 东北、浙江黑木耳δ2H和δ18O分布图Fig.2 Distribution of δ2H and δ18O of Auricularia auricula in Northeast China and Zhejiang Province
2.3 模型构建与产地判别
由表3可知,通过PLS-DA建立的产地判别模型判别函数(F)如下:
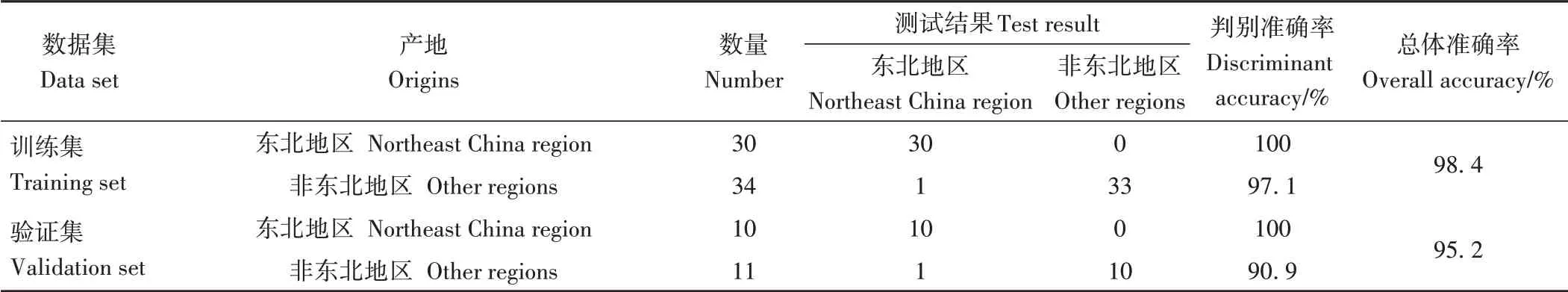
表3 东北黑木耳模型PLS-DA判别分析结果Table 3 Results of PLS-DA discriminant analysis of Northeast China Auricularia auricula model
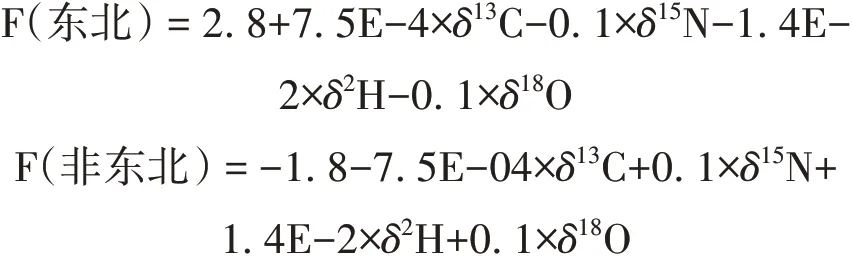
结果表明,训练集整体判别准确率达到98.4%,其中,东北(黑龙江、吉林、辽宁)黑木耳判别准确率达到100%,非东北(浙江和新疆)黑木耳判别准确率为97.1%,有1个样品被误判为东北(黑龙江、吉林、辽宁)。将测试集的21个样品作为外部验证的准确率为95.2%,其中东北(黑龙江、吉林、辽宁)黑木耳判别准确率达到100%,非东北(浙江和新疆)黑木耳判别正确率为90.9%,有1个样品被误判为东北(黑龙江、吉林、辽宁),综上所述,此模型可对东北(黑龙江、吉林、辽宁)和非东北(浙江和新疆)黑木耳进行有效的产地判别。
东北(黑龙江、吉林、辽宁)40份样品和非东北(浙江和新疆)45份样品PLS-DA模型的训练集和验证集样品得分结果如图3-A所示,训练集中R2X(cum)为0.885,R2Y(cum)为0.854。训练集样品的分类效果相对验证集样品较好,表现为东北(黑龙江、吉林、辽宁)训练集比较集中,非东北(浙江和新疆)训练集比较分散,并有个别交叉现象。东北(黑龙江、吉林、辽宁)的黑木耳样品集中在第一、第四象限,非东北(浙江和新疆)的黑木耳样品分布在第二、第三、第四象限,而且不同产地的黑木耳样品比较清晰地分布在各自的区域,能够很好地将两个产地黑木耳进行有效识别。东北(黑龙江、吉林、辽宁)黑木耳稳定同位素VIP贡献图如图3-B所示,各同位素的贡献度不同,其中δ18O值的贡献度最大,贡献度大于1的是δ18O和δ2H值,贡献度小于1的是δ13C和δ15N值。
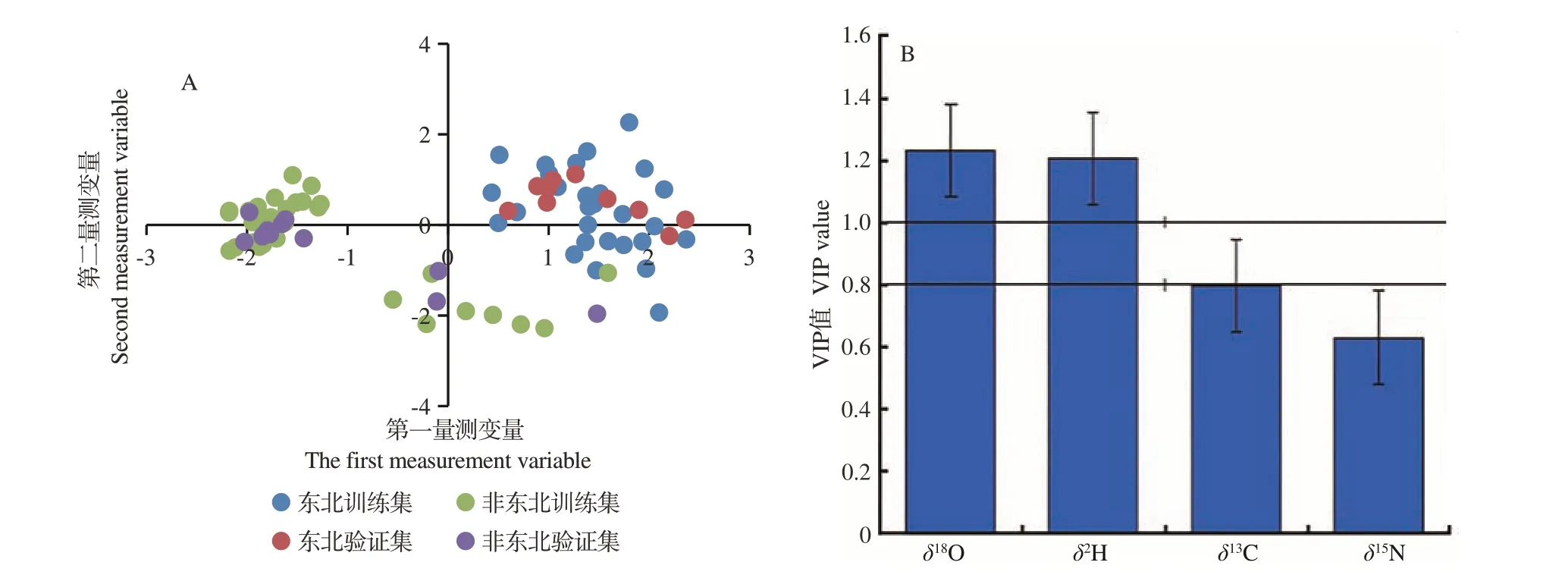
图3 东北黑木耳模型PLS-DA分析图(A)与VIP图(B)Fig.3 PLS-DA analysis diagram(A)and VIP diagram(B)of northeast Auricularia auricula model
由表4可知,通过PLS-DA建立的产地判别模型判别函数(F)如下:
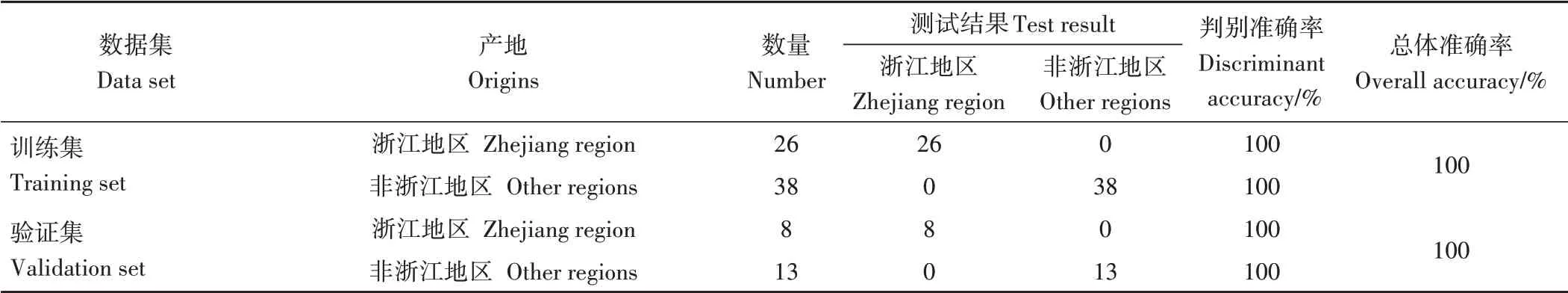
表4 浙江黑木耳模型PLS-DA判别分析结果Table 4 Results of PLS-DA discriminant analysis of Zhejiang Auricularia auricula model
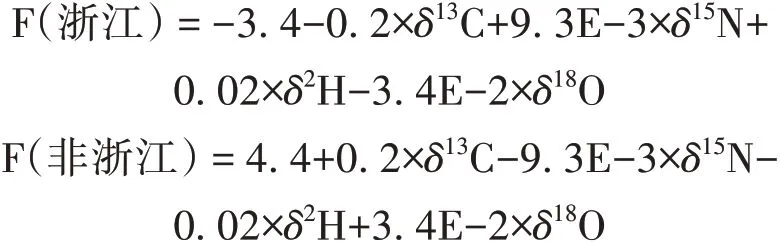
训练集64个样品整体判别准确率达到100%,其中,浙江和非浙江(黑龙江、吉林、辽宁、新疆)黑木耳判别准确率均达到100%。将测试集的21个样品作为外部验证的准确率为100%,浙江和非浙江(黑龙江、吉林、辽宁、新疆)黑木耳判别正确率均达到100%,没有黑木耳样品被误判。综上,此模型同样可对浙江和非浙江(黑龙江、吉林、辽宁、新疆)黑木耳进行非常有效的产地判别。
浙江34份样品和非浙江(黑龙江、吉林、辽宁、新疆)51份样品PLS-DA模型的训练集和验证集样品得分结果如图4-A所示,训练集中R2X(cum)为0.828,R2Y(cum)为0.922。训练集样品和验证集样品的分类效果相比:浙江训练集比较集中,非浙江(黑龙江、吉林、辽宁、新疆)训练集比较分散,并有个别交叉现象。浙江的黑木耳样品集中在第一、第四象限,非浙江(黑龙江、吉林、辽宁、新疆)的黑木耳样品分布在第二、第三象限,而且不同产地的黑木耳样品比较清晰地分布在各自的区域,能够很好地将两个产地黑木耳进行有效识别。浙江黑木耳稳定同位素VIP贡献图如图4-B所示,δ18O值的贡献度最大,δ2H值的贡献度与δ18O值相近,贡献度大于1的是δ18O、δ2H和δ13C值,贡献度小于1的是δ15N值。
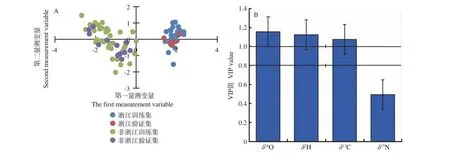
图4 浙江黑木耳模型PLS-DA分析图(A)与VIP图(B)Fig.4 PLS-DA analysis diagram(A)and VIP diagram(B)of Zhejiang Auricularia auricula model
3 讨论
本研究利用东北(黑龙江、吉林、辽宁)和浙江两地黑木耳样品分析稳定同位素比值分布及其变化情况,证实东北(黑龙江、吉林、辽宁)和浙江两地黑木耳δ13C、δ2H和δ18O值呈现显著差异,具有一定的地域特征。农产品δ13C值范围因光合途径不同而异,黑木耳不能进行光合作用,因此黑木耳中δ13C值的差异主要来源于不同栽培基质,如东北(黑龙江、吉林、辽宁)使用棉杆而浙江使用麦草等[14],此外黑木耳生长环境中的地理经纬度、光照强度、温度也能影响δ13C值;黑木耳栽培基质中尿素的含量、培养料堆置发酵中15N的富集致使δ15N值产生差异[14]。本试验与马奕颜等[24]利用稳定同位素对猕猴桃进行产地溯源以及刘宏艳等[25]利用元素分析仪-稳定同位素质谱仪(elementary analysis-isotope tatio mass spectrometers,EA-IRMS)和热电 离 质 谱 仪(thermal ionization mass spectrometers,TIMS)测定小麦籽粒中的稳定同位素组成比值的结论基本一致。δ2H和δ18O是具有地理指示性的稳定同位素,不同产地降雨中的δ2H和δ18O值不同,且随着纬度的增高而贫化,浙江降水充沛、黑木耳基质持水力较强、温湿度较高,浙江黑木耳δ2H和δ18O值显著高于东北(黑龙江、吉林、辽宁),符合赵汝婷等[23]和Federica等[26]关于外源水的添加以及气候和地理位置对δ2H、δ18O值影响较大的结论。不同产地农产品稳定同位素δ13C、δ15N、δ2H和δ18O值的差异性在大米[19]、葡萄[27]等农产品上也有体现。
虽然东北(黑龙江、吉林、辽宁)、浙江产地的黑木耳中个别同位素比值存在明显差异,但不能将两地黑木耳进行有效区分,需要再结合PLS-DA法建立两个产地判别模型,并且将新疆黑木耳作为外部验证。通过验证,所建立的判别模型对东北(黑龙江、吉林、辽宁)的产地判别准确率为98.44%,总体判别率达到95.24%,浙江的产地判别准确率为100%,总体判别率达100%。与Chung等[28]和Wang等[29]测定的双孢蘑菇(R2X=0.822,Q2=0.448)和野生食用菌(96.10%)的准确率相比有所提高。由此说明,此方法和模型可对不同产地的黑木耳产品进行有效判别。为了更好地区分黑木耳产地,还应考虑黑木耳的实际生产情况,如结合电感耦合等离子体质谱仪(inductively coupled plasma-mass spectrometry,ICP-MS)和高光谱成像仪(hyperspectral imaging spectrometers,HSI)等测试方法,对不同栽培方式、光照强度、代料配方以及不同季节、不同潮次的黑木耳进行判别,构建出更加有效和准确的产地判别模型。
4 结论
本研究结果表明,东北(黑龙江、吉林、辽宁)、浙江黑木耳中的δ15N值无显著差异,浙江黑木耳δ13C值低于东北(黑龙江、吉林、辽宁),δ2H、δ18O值则高于东北(黑龙江、吉林、辽宁),利用PLS-DA判别模型对东北(黑龙江、吉林、辽宁)、浙江黑木耳进行分析,所建立的判别模型对东北(黑龙江、吉林、辽宁)的训练集判别准确率为98.44%,验证集判别准确率达到95.24%;而浙江的判别准确率均为100%。结果证明,利用稳定同位素技术测定同位素比率并结合PLS-DA法建立的模型可以对东北(黑龙江、吉林、辽宁)和浙江的黑木耳进行有效的产地判别。同时,将稳定同位素技术与其他判别技术相结合,应用于黑木耳的产地判别,可进一步完善农产品产地追溯体系。
