人参Pg90B/724B基因异源转染突变体在干旱胁迫下的生理应答
2023-01-16许永华李美琪周新芳张建勋孙天尊
许永华,李美琪,周新芳,张建勋,孙天尊,赵 露
(吉林农业大学中药材学院,吉林 长春 130118)
1970年,Mitchell等首次从油菜花粉中筛选和分离出具有高生理活性的物质[1];1978年,Mandava从油菜花粉中分离纯化出芸薹素(brassin);1979年,Grove等对其分子立体构型进行了鉴定,确定其为多羟基类固醇化合物,命名为油菜素内酯(Brassinolide,BL),之后又分离出许多与BL分子结构相似的化合物,统称为油菜素甾醇类化合物(BR)[2-6].BR均具有4个环的5-α-胆甾烷,是继生长素、赤霉素、细胞分裂素、脱落酸、乙烯之后发现的植物激素.
BR能够调节营养器官生长,参与调节植物茎的伸长[3],调控植物侧根及根毛的生长[4]、维管束分化、种子萌发,还能够提高植物对干旱、冷害、盐胁迫等逆境胁迫的抗性.
BR生物合成经由鲨烯还原到油菜素内酯前体芸苔甾醇(campesterol,CR),以CR为起始,经过至少3条途径,即早期C-6氧化途径、晚期C-6氧化途径、早期C-22和C-23羟化途径合成油菜素甾酮(castasterone,CS)和油菜素内酯.其中,有些步骤存在可逆反应,但反应机制尚不明确,有待进一步研究[7-9].
拟南芥DWF4基因编码一个类固醇类C-22α-羟化酶,催化油菜素内酯的生物合成过程[10].该基因在植物活跃生长的组织中表达,如根与茎的顶端组织以及根与茎的接合部位,表达量受乙烯和茉莉酸甲酯的调控,参与植物的抗高温反应过程[11].
DWF4缺失突变体是从拟南芥突变体库中筛选矮小表型突变体时筛选到的[12],它的表型都是BR缺失的表型,即植株矮小、颜色深绿、叶柄缩短、莲座叶缩小变圆、角果及花丝缩短,成熟的花粉不能授粉到柱头上导致雄性不育[13].DWF4缺失表型不能被赤霉素和生长素恢复,只能被BR特异性恢复,所以认为它可能参与BR的合成.蛋白序列同源性比对分析显示,DWF4编码一个细胞色素P450蛋白,因此也被命名为CYP90B1,它与之前发现的CYP90A1(CPD)有43%的一致性[8].
对本实验室构建的人参转录组数据进行的分析发现,人参Pg90B/724B基因是拟南芥DWF4基因的同源基因,该基因编码一个C22-α-羟化酶,为芸苔素内酯生物合成途径中的一个限速酶,该蛋白是CYP90B基因家族中的成员.王若宸[14]对小麦BR生物合成基因TaDWF4进行的鉴定与功能研究发现,小麦中至少存在两个具有DWF4功能的基因;司建萍[15]对胡杨油菜素类固醇合成酶基因DWF4和CPD的功能研究发现,在调节植物生长发育方面,PeDWF4的作用与AtDWF4的作用可能存在差异;Jun Sakaguchi等[16]的研究表明,用光处理拟南芥地上组织可增强DWF4在根尖的积累;Yuya Yoshimitsu等[17]研究发现,生长素诱导的侧根伸长受到油菜素唑和DWF4突变的抑制,而这一结果最终导致油菜素内酯的表达被抑制,表明BRs在生长素控制下对根伸长有积极作用.DWF4转录除了在BR稳态中发挥作用,在与根伸长相关的BR-生长素串扰中也发挥新的作用.S.Choe等[18]研究发现,烟草DWF4过表达品系与对照组相比,花序增高、长角果数增加、种子数量增加,DWF4过表达导致内源性油菜素内酯增加.Tingsong等[19]研究发现,玉米幼苗中ZmDWF4在芽中的表达远高于根中,ZmDWF4在玉米中的表达受到外源油菜素内酯的影响显著下调;ZmDWF4的过表达可以使DWF4突变体的缺陷(如植株矮小、叶柄缩短和雄性不育)都恢复到正常水平.
Tanaka等[20]研究发现,高浓度外源BR处理拟南芥时,BR的关键合成基因DWF4,CPD,BR6ox1和ROT3表达下调.据Noguchi[21]研究报道,在BRI1突变体中,除DWF4表达下调外,其他BR的关键合成基因表达均无明显变化,表明BRs合成受到负反馈调节.张燕娣等[22]研究发现,单茎人参与多茎人参中油菜素内酯含量分别为0.24和0.85 ng/g,多茎人参中油菜素内酯含量显著高于单茎人参,而多茎人参中Pg90B/724B基因在转录组中表达为下调;此外,多茎人参中人参皂苷含量及矿质元素中大量元素的含量均高于单茎人参.
人参转录组数据显示的油菜素内酯生物合成途径中,90B/724B基因、734A基因均为关键基因,在多茎人参和单茎人参中的转录具有显著差异,90B/724B基因在多茎人参中下调转录,734A基因转录上调和转录下调同时存在.这些基因的转录和翻译表达对人参植株油菜素内酯的生物合成有重要影响,因此本文将人参90B/724B基因命名为Pg90B/724B.
本文对T1代拟南芥植株以及瞬时转染人参叶片进行干旱胁迫处理,测定了可溶性糖、可溶性蛋白、脯氨酸、丙二醛、叶绿素、超氧化物歧化酶(SOD)等逆境应答生理指标的变化情况,以探究Pg90B/724B基因过表达植株在干旱胁迫下的生理反应.
1 材料与方法
1.1 实验材料
拟南芥(Arabidopsisthaliana)种子采购自ABRC(拟南芥生物资源中心),4℃处理72 h后,在人工气候箱中种植.生长条件为16 h光照、8 h黑暗,22℃.培养基质V(草炭土)∶V(蛭石)=3∶1.
人参材料来自吉林农业大学人参育种温室,3年生植株.瞬时转染时,每株处理2枚叶片;生理指标测定时,每株人参取1~2枚叶片.用于生理指标测定的材料为瞬时转染的人参叶片和非转染的人参叶片.
主要试剂:克隆载体pMD19-T、植物转化载体pRI201-AN购自宝生物工程有限公司;乙酰丁香酮、牛肉浸膏、卡那霉素等购自上海生工.
引物:P1:ATATAAGGAAGTTCATTTCATTTGGAGAGAACACG;
P2:CATACCCTTTGTACCGAACATCTTTCACAGC.
1.2 实验方法
1.2.1Pg90B/724B基因克隆及表达载体构建
从本实验室构建的人参转录组数据库中筛选得到Pg90B/724B基因序列,用PCR法克隆该基因,构建pMD19-T-Pg90B/724B亚克隆载体.用限制性内切酶Nde I和Sal I对目的基因及pRI201表达载体同时进行双酶切,将目的片段与pRI201载体再连接,获得重组载体pRI201-AN-Pg90B/724B,电击法转化农杆菌LBA4404.
1.2.2 重组DNAPg90B/724B瞬时转染人参叶片及转染叶片鉴定
用叶片打孔法瞬时转染人参叶片.挑取根癌农杆菌LBA4404(Pg90B/724B+)单克隆摇菌,至菌液D(600)=2.0时终止培养.用注射器吸取菌液在人参叶片上打孔,48 h后采样.用qRT-PCR方法检查人参叶片Pg90B/724B基因相对表达量,18SrRNA为内参基因.
1.2.3 重组DNA pRI201-AN-Pg90B/724B异源转染拟南芥及突变体筛选
采用花粉管导入法转染拟南芥.用新鲜制备的农杆菌LBA4404(Pg90B/724B+)菌液充分浸没拟南芥花序,花序上的菌液保留24 h后用无菌超纯水洗去残余菌液;吸干表面水分后将植株移至人工气候箱中,在22℃,16 h光照、8 h黑暗条件下培养至种子成熟.将收获的拟南芥种子,4℃低温处理3 d后进行消毒,于筛选培养基(含卡那霉素)上播种,发芽7 d后根据幼苗颜色挑选抗性植株.将有抗性的绿色转基因植株(T1代)移栽到营养钵中,在22℃,16 h光照、8 h黑暗条件下培养4周后进行生理实验.
抗性植株鉴定:从获得的T1代植株中随机取10株拟南芥,PCR法鉴定是否为Pg90B/724B基因阳性植株.Pg90B/724B基因相对表达量测定采用qRT-PCR法,18SrRNA为内参基因.
1.2.4 干旱胁迫处理
干旱分为大气干旱、土壤干旱和生理干旱,本实验采用大气干旱胁迫方法.将瞬时转染的人参与未转染的人参连同营养钵移入植物培养箱中,30℃全光照处理2 h,培养箱内空气相对湿度低于20%.
将长势良好的野生型拟南芥和T1代转基因植株同样移入全光照培养箱中,30℃处理2 h,培养箱内空气相对湿度低于20%.
1.2.5 干旱胁迫下植株生理指标检测
可溶性蛋白含量采用考马斯亮蓝法测定;可溶性糖含量采用蒽酮比色法测定;脯氨酸含量采用茚三酮比色法测定;丙二醛含量采用硫代巴比妥酸比色法测定;超氧化物歧化酶(SOD)活性采用氮蓝四唑法测定;叶绿素含量采用乙醇提取比色法测定.
2 结果与分析
2.1 Pg90B/724B基因克隆及表达载体构建结果
从人参越冬芽中提取总RNA,变性琼脂糖凝胶电泳结果见图1a.特异引物RT-PCR扩增结果见图1b,显示目的片段长度约750 bp,与预期长度一致.将目的片段PCR产物与pMD19-T连接,得到重组载体,命名为pMD19-T-Pg90B/724B.转化大肠杆菌DH5α后提取质粒DNA,琼脂糖凝胶电泳结果见图1c,显示质粒DNA长度为3 500 bp左右,符合预期.

a.人参总RNA电泳图;b.PCR扩增产物电泳图;c.pMD19-T-Pg90B/724B重组质粒DNA电泳图;d.pRI201-AN-Pg90B/724B重组质粒DNA双酶切(PstⅠ和SacⅠ)产物电泳图;e.农杆菌LBA4404(pRI201-Pg90B/724B+)鉴定
将NdeI和SalI双酶切的pMD19-T-Pg90B/724B及pRI201载体连接,得到重组pRI201-Pg90B/724B表达载体.Pst I和Sac I双酶切重组DNA,得到10 300 bp和1 700 bp左右的片段,接近目的条带分子大小(见图1d),表明Pg90B/724B基因的植物表达载体构建完成.
将重组DNA pRI201-Pg90B/724B电击转化农杆菌LBA4404,随机挑取5个阳性克隆,摇菌并提取质粒DNA,目的片段PCR扩增结果见图1e,5个单克隆均获得750 bp左右的条带,表明农杆菌LBA4404转化成功.
2.2 重组DNA Pg90B/724B瞬时转染人参叶片及转染鉴定结果
瞬时转染处理2 d后,在不同人参植株上分别取转染处理的叶片共10枚,对转染叶片进行PCR鉴定,电泳结果见图2a,均检测出目的基因片段.转染处理的人参叶片,以18SrRNA为内参基因,qRT-PCR法检测基因相对表达量,结果见图2b.人参叶片瞬时转染7 d后,打孔处可见黄白色圆斑(见图2c).

a.瞬时转染人参叶片RT-PCR鉴定;b.Pg90B/724B基因在瞬时转染人参叶片中的相对表达;c.瞬时转染及转染7 d后的人参叶片
2.3 重组DNA Pg90B/724B异源转染拟南芥及阳性植株鉴定
对花粉管导入法得到的转基因拟南芥种子进行鉴定.在LB(Kan+)培养基上播种低温处理后的种子,每皿约2 000粒,22℃、16 h光照、8 h黑暗条件下培养4 d.如图3a所示,转基因阳性植株呈绿色,发育正常,可见2~4枚真叶;非转基因幼苗呈淡黄色、纤弱,生长停滞,仅有2枚子叶,真叶不发育.在播种的约170 000粒种子中共得到21株阳性转基因植株(T1),转化率约为0.12%.
从T1代拟南芥中随机选取10株,以35SF(P1)和90BR(P2)为引物进行目的片段扩增,对Pg90B/724B转基因植株进行分子鉴定.RT-PCR产物电泳结果见图3b,其中1道和6道、10道未检出目的片段,与抗性基因筛选结果不一致,需要进一步检测确认;2,3,4,5,7,8,9道有清晰条带,且分子大小与预期长度相符,表明这些植株为Pg90B/724B阳性植株,与抗性基因筛选结果一致,可以确认为Pg90B/724B基因阳性植株T1代.
以18SrRNA为内参基因,qRT-PCR法对转基因阳性植株进行Pg90B/724B基因相对表达量检测,结果见图3c.其中,1为野生型拟南芥(Col),2—6为转基因植株(Col),可见在Pg90B/724B过表达突变体中,Pg90B/724B基因mRNA转录水平不同程度增加,表明T1代突变体中Pg90B/724B基因整合基因组后未引起该基因沉默,基因可以表达并可能具有生理功能.

a.LB(Kan+)培养基筛选转基因阳性植株;b.T1代拟南芥Pg90B/724B+鉴定;c.Pg90B/724B基因在拟南芥T1植株中的相对表达
2.4 干旱胁迫下瞬时转染人参叶片的生理应答
植物在受到干旱胁迫时,一些蛋白质的合成会受到抑制,蛋白质含量或是蛋白质与氨基酸的比值会降低;而有些植物却与此相反,在受到逆境胁迫时会产生逆境蛋白,蛋白质含量表现为升高.Pg90B/724B基因瞬时转染的人参叶片可溶性蛋白质和脯氨酸含量较非转化叶片略有升高(见图4),但差异并不显著,提示Pg90B/724B基因过表达可促进渗透调节物质脯氨酸和相关逆境蛋白的合成,但应答干旱胁迫的生理活性可能仍然有限.而过表达Pg90B/724B基因的人参叶片,短时间内可溶性糖和超氧化物歧化酶(SOD)含量显著上升,提示该基因对可溶性糖及抗氧化酶合成的促进作用更显著.干旱胁迫对膜系统氧化损伤的修复则依赖于超氧化物歧化酶(SOD)等抗氧化酶的作用.由图4可见,过表达Pg90B/724B基因的人参叶片丙二醛含量显著升高,表明其膜系统被氧化损伤的更为严重,但与此同时抗氧化酶SOD的含量也显著升高,表明其去除活性氧损伤的修复活性显著提高.此外,干旱胁迫处理后过表达Pg90B/724B基因的人参叶片叶绿素含量略有降低(见图4).

Wt为未转染人参叶片,Pg90b/724b+为瞬时转染的人参叶片;Chla:叶绿素a,Chlb:叶绿素b,Chlt:总叶绿素.
2.5 拟南芥突变体(Pg90b/724b+,T1)对干旱胁迫的生理应答
对筛选出的T1代Pg90B/724B基因过表达突变体和野生型拟南芥进行干旱胁迫处理,测定在胁迫应答反应中两种类型植株的生理指标变化,探究Pg90B/724B基因在逆境胁迫时发挥的生理作用,结果见图5.由图5可见,在干旱胁迫条件下Pg90b/724b+过表达突变体(T1)的细胞渗透调节物质可溶性糖、游离脯氨酸以及逆境诱导蛋白——可溶性蛋白质含量显著升高,是野生型植株的2~3倍,提示过表达突变体可能具有较高的油菜素内酯水平,能更快速响应胁迫信号并调控细胞快速合成具有保水功能的小分子糖、氨基酸和蛋白质,增加细胞中束缚水比例,防止细胞因高温和干燥而过度蒸腾失水.此外,Pg90b/724b+过表达突变体(T1)也表现出很高的叶绿素水平,总叶绿素含量是野生型植株的4倍以上,叶绿素a和叶绿素b含量分别是野生型植株的4.5倍和4.6倍,推测干旱胁迫对过表达突变体的叶绿素合成影响较小或叶绿素降解较为缓慢,光合色素损伤程度有限.这或许是油菜素内酯增强植物抗逆性的一种表现.
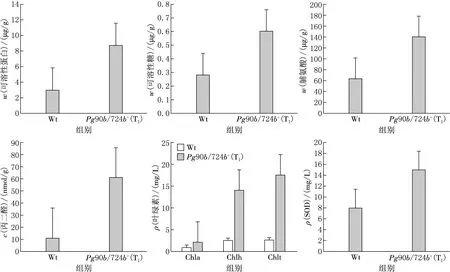
Wt为野生型拟南芥(Col),Pg90b/724b+(T1)为拟南芥T1突变体;Chla:叶绿素a,Chlb:叶绿素b,Chlt:总叶绿素.
在干旱胁迫条件下,Pg90b/724b+过表达突变体(T1)丙二醛含量显著上升,是野生型植株的4.7倍,表现出较强的细胞膜系统被氧化损伤的趋势.而超氧化物歧化酶(SOD)水平只有野生型植株的1.8倍左右,与丙二醛含量增长相比并不匹配.提示在过表达突变体中,超氧化物歧化酶含量升高有限,对活性氧清除能力有限,造成了膜系统损伤、丙二醛含量升高.这种表现可能与过表达突变体中油菜素内酯水平较高细胞生理活动及代谢处于活跃状态,在干旱胁迫时更容易受到损伤有关;另一种可能是目标基因的插入位置直接影响了超氧化物歧化酶的表达,使活性氧清除受到影响,造成细胞损伤.
3 结论与讨论
本文利用同源植物瞬时转染和异源植物稳定转染两种方法,对Pg90B/724B基因在干旱胁迫时的生理应答进行了研究.植物在干旱胁迫下,主要的调节机制为渗透调节,这些响应机制并非单一调节而是同时进行调节,其中之一就是植物会限制水分的消耗.可溶性蛋白作为植物渗透调节物质,能够保护细胞膜且有保水作用[23-24].在本实验中,转基因拟南芥及瞬时转染的人参叶片的可溶性蛋白含量均高于野生型拟南芥及未转染的人参叶片,说明在干旱胁迫过程中,Pg90B/724B基因可能通过参与油菜素内酯的合成调节、促进可溶性蛋白的产生、积累,从而使转基因植株对干旱胁迫具有更好的耐受能力和抗性.而脯氨酸作为参与植物渗透调节过程中最有效的渗透调节物之一,水和能力强,可与蛋白质结合防止蛋白质脱水变性,在植物抗逆境胁迫过程中起着至关重要的作用.转基因植株和瞬时转染的人参叶片中脯氨酸含量相比于未转染的野生型植株和人参叶片均有升高,说明T1代植株和瞬时转染的人参叶片在干旱胁迫中积累了更多的脯氨酸,能更好地对抗干旱胁迫.可溶性糖为植物代谢活动的主要参与者,含量升高有助于植物体内营养物质的运输和储存[25-26],同时作为渗透调节物质,在逆境胁迫时发挥作用[27].研究表明,T1代植株与瞬时转染的人参叶片中,可溶性糖的含量与未转染的人参叶片及野生型植株相比均有增加,证明转基因植株具有更强的保水能力,增加了植株对于干旱的耐受性.植物遭受干旱胁迫时的反应与低温胁迫一样,会产生大量活性氧(reactive oxygen species,ROS),造成膜的氧化损伤,而超氧化物歧化酶(SOD)与过氧化氢酶(CAT)、过氧化物酶(POD)可清除活性氧,降低活性氧的毒害作用,在植物抗逆过程中起着重要的作用.T1代植株与瞬时转染的人参叶片SOD含量均高于未转染的野生型植株和人参叶片,表明Pg90B/724B基因可能会增强植物的抗氧化能力.
丙二醛是细胞膜氧化产物,其含量高低可以表征细胞膜受损伤的程度,是逆境胁迫下考察植物受损伤程度的重要指标[28].在干旱胁迫过程中,细胞膜发生氧化分解,促使丙二醛大量积累.本文的研究发现,转基因拟南芥及瞬时转染的人参叶片丙二醛含量高于野生型拟南芥及非转染的人参叶片,造成这种现象的原因有待于在稳定转染的T3代纯合体植株中进行进一步的探究.
植物的叶绿素与植物的光合作用和营养状况有着密切的联系[29],叶绿素含量的高低直接影响着光合作用的强弱.当植物遭遇干旱胁迫时,由于失水导致叶绿素含量降低.本文的研究结果表明,瞬时转染的人参叶片和未转染的人参叶片叶绿素含量无显著差异,但T1代植株与野生型植株相比叶绿素含量存在极显著差异,叶绿素含量在转基因拟南芥中升高,表明T1代植株在干旱胁迫时仍保持一定的光合作用能力.
总之,通过对瞬时转染的人参叶片及稳定转染的拟南芥突变体进行的分析可知,人参Pg90B/724B基因可能参与了干旱胁迫条件下对渗透调节物质合成的调节,增强植物的保水性进而增强植物在干旱胁迫中的耐受性,一定程度上提高了植株的耐旱能力.
