DHEA 和EPEA 对小神经胶质细胞和星形胶质细胞的体外作用研究
2023-01-16张旭东刘浩昂王志浩刘碧波
张旭东,刘浩昂,兰 凯,廉 婷,王志浩,陈 蕊,刘碧波
(1.西安医学院临床医学院中尼友好拉吉姆医学实验室,陕西 西安 710021;2.西安医学院临床医学院陕西省呼吸病预防与诊治工程中心,陕西 西安 710021;3.西安医学院第一附属医院妇产科,陕西 西安 710077)
脊柱外伤(spine injury,SCI)是一种严重的损害,会造成运动和感觉降低及其他并发症[1]。目前治疗神经疼痛的药物包括普瑞巴林、加巴喷丁等[2,3]。由于中枢神经疼痛在不同阶段有不同的机制,且这些药物都存在严重的副作用。因此,亟须探寻新的治疗药物并了解其作用机制。二十二碳六烯酸单乙醇酰 胺(docosahexaenoyl ethanolamide,DHEA)、二十碳五烯酸单乙醇酰胺(eicosapentaenoyl ethanolamide,EPEA)是Ω-3 多不饱和脂肪酸DHA、EPA 的衍生物[4]。DHEA、EPEA 具有抗炎、抗肿瘤效果,然而其在中枢神经性疼痛的作用仍然未知[5]。研究表明[6],中枢神经疼痛与小神经胶质细胞和星形胶质细胞的状态有密切关系。本研究主要探究DHEA 和EPEA 在脊柱外伤后对小神经胶质细胞和星形胶质细胞的作用,旨在为中枢神经性疼痛治疗提供理论依据和实验基础。
1 材料与方法
1.1 材料 DMEM 高糖培养基、GlutaMAXTM、HEPEs、胎牛血清FBS、双抗(美国英杰生命技术有限公司),多聚赖氨酸PDL、脂多糖LPS、Hoechst(美国默克公司),细胞培养皿(广州杰特生物有限公司),DHEA、EPEA(美国开曼生物科技有限公司),山羊血清、绿色荧光二抗、iNOS、GFAP(美国生命科技有限公司)。
1.2 小神经胶质细胞和星形胶质原代细胞培养
1.2.1 小神经胶质细胞的获取方法 细胞混悬液4 ℃1500 r 离心10 min,弃去上清加入DMEM 重悬后,细胞计数。取用18 mm 盖玻片置于12 孔细胞盘,将稀释后的细胞混悬液分别铺于盖玻片上。最后将附着好的12 孔培养皿置于37 ℃,5%CO2,培养箱培养。
1.2.2 星形胶质细胞的获取 加入PBS 溶液冲洗3次,尽可能去除残留的小神经胶质细胞。之后加入Trypsin-EDTA 静置于培养箱5 min,用于分离附着于涂层的星形胶质细胞。4 ℃1500 r 离心5 min 去除上清液,用DMEM 重悬后进行细胞计数。最后将细胞混悬液加至放有18 mm 的盖玻片的12 孔细胞皿,37 ℃,5% CO2,培养箱培养。
1.3 小神经胶质细胞和星形胶质细胞给药处理
1.3.1 小神经胶质细胞和星形胶质细胞同时治疗 将铺好的小神经胶质细胞和星形胶质细胞分为4 组(control、100 ng/ml LPS、8 μmol/L DHEA 和8 μmol/L EPEA 组)。control 组加入无血清培养液,100 ng/ml LPS 组加入100 ng/ml LPS,DHEA 组加入8 μmol/L DHEA 及LPS,EPEA 组加入8 μmol/L EPEA、LPS。
1.3.2 小神经胶质细胞和星形胶质细胞延期治疗 与同时治疗一样,将两种细胞分为4 组(Delay control、Delay 100ng/ml LPS、Delay 8 μmol/L DHEA 和8 μmol/L EPEA 组)。Delay control 组加入无血清培养液,Delay LPS 组,Delay DHEA 组,Delay EPEA 组分别加入100 ng/ml LPS 进行激活,小神经胶质细胞激活16 h,星形胶质细胞激活24 h 后,加入无血清培养液到Delay LPS 组,分别加入8 μmol/L DHEA及8 μmol/L EPEA 到Delay DHEA 组和Delay EPEA 组。
1.4 免疫荧光 4%PFA 固定10 min,PBS 清洗细胞3 次,每次10 min。小神经胶质细胞染色:用PBS+0.1% sodium azide+0.2% triton 稀释后的10% goat serum 加入小神经胶质细胞中室温下培育1 h,加入第一次一抗(1∶1000)4 ℃过夜,之后加入第一次二抗(1∶400)室温下避光孵育2 h,PBS 洗3 次,加入第二次一抗,anti-iNOS(1∶200)4 ℃过夜,次日加入第二次二抗goat anti-mouse(1∶1000)室温避光培育2 h后PBS 清洗3 次。加入Hoechst(0.02 mg/ml PBS)孵育2 mins 后PBS 清洗3 次,自然风干后使用PBS-glycerol(1∶8)置于载玻片上固定。
1.5 数据分析 小神经胶质细胞激活态的定量分析,使用Adobe Photoshop CC 2017 合成iNOS 染色图片与iba-1 染色图片分析小神经胶质细胞的激活态。每个盖玻片选择5 个随机区域,采用Nikon 荧光显微镜拍照。DAPI 显示细胞核染色,GFP 可以观察到iba-1 染色,M-cherry 表示iNOS 表达情况。星形胶质细胞的定量分析采用ImageJ 1.52d 进行分析。
1.6 统计学方法 使用GraphPad Prism 5.0(GraphPad Software Inc)软件分析实验数据,计量资料采用(±s)表示,多组间比较采用One-way ANOVA 通过Tukey's test 多组间检验,P<0.05 表示差异有统计学意义,P<0.01 表示统计学意义显著,P<0.001 表示统计学意义极显著。
2 结果
2.1 小神经胶质细胞同时治疗结果
2.1.1 体外同时给药处理小神经胶质细胞形态变化与control 组相比,LPS 组细胞形态变化非常明显,细胞胞体变大,细胞突起缩短(图1A、1B);经DHEA和EPEA 处理后发现细胞形态趋向于control 组细胞(图1C、1D);小神经胶质细胞用iba-1 抗体染色标记(图1E),激活态的小神经胶质细胞用iNOS 染色标记(图1F);经DHEA 和EPEA 处理后可观察看到箭头所指出的激活态(图1G、1H)。

图1 体外同时给药处理小神经胶质细胞形态变化
2.1.2 同时给药处理能改变小神经胶质细胞的激活态 经同时给药处理后,LPS 组相比其他组别其细胞突起占比明显降低。control 组占比最高,其次为DHEA 和EPEA 组。此外,LPS 组中iNOS 表达远高于其他3 组,其次为EPEA 组,DHEA 组(P<0.001),见图2A;在同时给药处理后,DHEA 和EPEA 都能改变小神经胶质细胞形态,同时可以减少iNOS 在小神经胶质细胞内的表达,见图2B。

图2 体外同时给药处理能改变小神经胶质细胞的激活态
2.2 小神经胶质细胞延期治疗
2.2.1 延期给药处理能改变小神经胶质细胞的形态通过观察发现control 组大部分细胞都有细长的单突起或双突起(图3A),而LPS 处理组的细胞体变大、线状突起变粗变短(图3B);经8 μmol/L DHEA、8 μmol/L EPEA 处理后,发现大部分细胞有从LPS激活的形态变回对照组的形态趋势(图3C、3D);延期给药方案中control 组、LPS 组的结果与同时治疗结果相类似(图3E、3F),经DHEA、EPEA 处理后细胞形态也能恢复,同时iNOS 在小神经胶质细胞内的表达显著降低(图3G、3H)。

图3 小神经胶质细胞经延期给药处理后细胞形态变化
2.2.2 延期给药处理能改变小神经胶质细胞的激活态 经延期治疗后处理后,发现8 μmol/L DHEA 和8 μmol/L EPEA 组带有突出细胞的占比相近,但明显高于LPS 组(图4A)。同时LPS 组小神经胶质细胞的iNOS 表达明显是最高的,DHEA 组低于LPS组,然而却高于EPEA 组(图4B)。

图4 体外延期给药处理能改变小神经胶质细胞的激活态
2.3 星形胶质细胞同期治疗
2.3.1 同时给药处理能改变星形胶质细胞的形态 与LPS 处理组相比,control 组的星形胶质细胞有着更小的胞体和更长的突起(图5A、5B,5E、5F);经DHEA、EPEA 处理24 h 后,DHEA、EPEA 组与LPS组相比细胞体缩小,细胞突起加长(图5C、5D,5G、5H)。
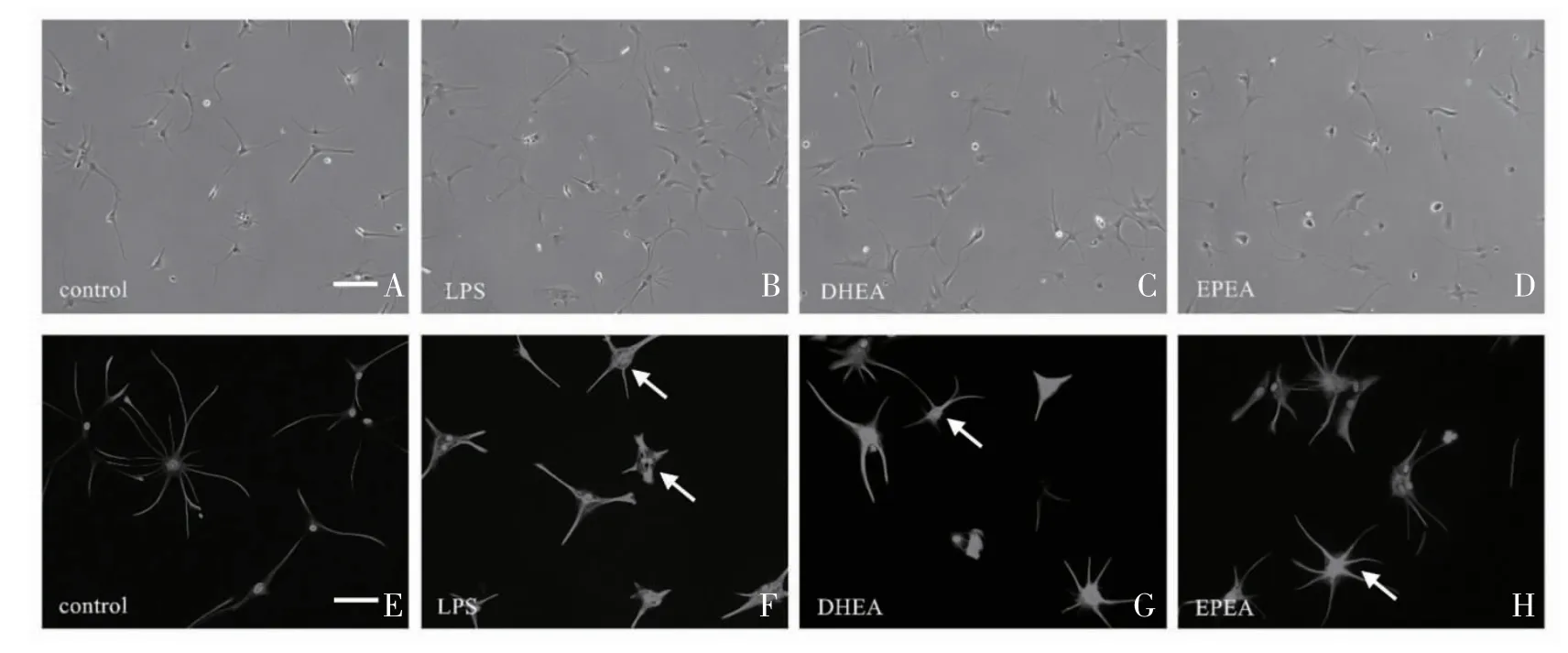
图5 体外同时给药处理能改变星形胶质细胞的形态
2.3.2 同时给药处理能改变星形胶质细胞GFAP 的表达 LPS 组中GFAP 的荧光强度最高,DHEA 组与EPEA 组GFAP 荧光强度接近且都低于LPS 组(图6)。

图6 星形胶质细胞同期治疗后GFAP 表达
2.4 星形胶质细胞延期治疗
2.4.1 延期给药处理能改变星形胶质细胞的形态 与LPS 组相比,control 组星形胶质细胞有着更小的胞体和更长的突起(图7A、7B,7E、7F)。同样经DHEA、EPEA 处理后,星形胶质细胞体更小,突起恢复更长(图7C、7D,7G、7H)。

图7 体外延期给药处理星形胶质细胞的状态改变
2.4.2 延期给药处理能改变星形胶质细胞GFAP 的表达 延期治疗中LPS 组GFAP 的强度明显高于其他组别,DHEA 组GFAP 的表达与对照组相接近,但是低于EPEA 组(图8)。
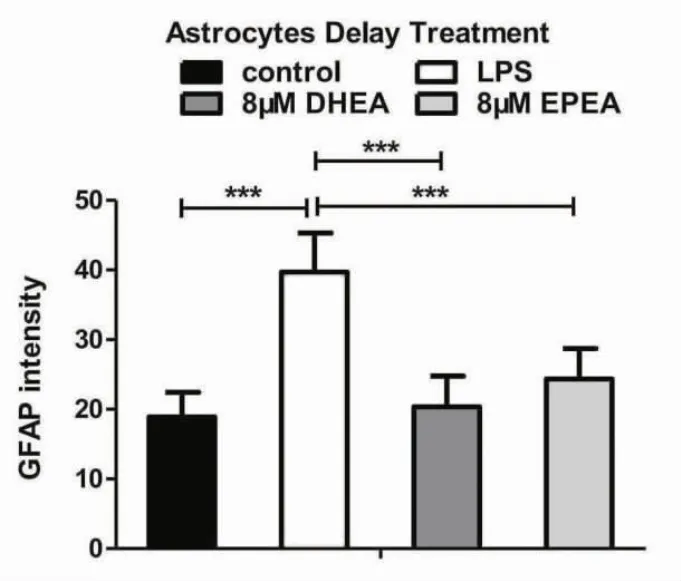
图8 星形胶质细胞延期治疗后GFAP 表达
3 讨论
DHA 是一种Ω-3 多不饱和脂肪酸(Ω-3PUFAs),在脊柱损伤模型中起保护作用[7-9],同时DHA和EPA 在神经系统中也具有保护神经和促进运动机能的作用[10]。一项利用成年大鼠脊柱外伤模型的研究发现EPA 能够促进神经细胞和少突胶质细胞存活[11]。此外,DHEA 与DHA 都有抗炎作用[12]。Ω-3PUFAs 的消耗可以导致EPEA 大量累积,而在脊柱外伤后Ω-3PUFAs 会影响大鼠中甘油酯类CB 受体的表达,并促进Ω-3PUFAs 的作用[13,14]。同时,DHA和EPA 乙醇酰胺衍生物DHEA 和EPEA 对小神经胶质细胞的细胞因子表达有很好的效果[15,16]。因此,探究DHEA 和EPEA 在中枢神经疼痛的作用机制就显得尤为重要。
生理状态下小神经胶质细胞为长分枝突起且胞体小,而星形胶质细胞在静息阶段是神经元样形态。经LPS 处理后小神经胶质细胞、星形胶质细胞都呈现出高的激活态状态,细胞胞体变大,但突起数量和长度却最低。经DHEA 和EPEA 两种给药处理后两种细胞的激活态降低,同时细胞突起显著增加,趋向于正常细胞形态。对比两种给药方案,发现同时给药处理在本研究中可以保持更多的细胞突起数量,而延期给药处理突起数量的占比相对较低,因此同期治疗方案对细胞形态的保护性更好。已有研究表明在神经病理性疼痛中,小神经胶质细胞活化发生在损伤24 h 后,星形胶质细胞的活化发生于受损72 h后,由此可见星形胶质细胞激活是慢性疼痛的主要原因,而小神经胶质细胞活化是急性疼痛的主要诱因[17]。本研究初步探究发现DHEA 和EPEA 同时给药处理对小神经胶质细胞效果更好,而延迟给药处理对星形胶质细胞的改变更佳,为合并用药提供了理论可能。脊柱外伤后疼痛受NF-κB 炎症因子调控[18,19]。此外,细胞因子可以增加神经性疼痛,因此对信号通路探究可以对未来治疗方案有更好地理解。通过减少或阻断细胞因子的接收或释放,以达到治疗效果[20,21]。
综上所述,DHEA 和EPEA 在同时、延期给药两种处理下均能改变激活态小神经胶质细胞和星形胶质细胞的形态和状态。接下来将进一步深入地研究DHEA、EPEA 对疼痛治疗的分子机制。
