水培条件下硒对花生幼苗生长和开花及抗氧化酶活性的影响
2023-01-15施和平张晓元
施和平,张晓元,许 晟
水培条件下硒对花生幼苗生长和开花及抗氧化酶活性的影响
施和平1,张晓元2,3*,许 晟1
1. 华南师范大学生命科学学院广东省植物发育生物工程重点实验室,广东广州 510631;2. 华南理工大学工业技术研究总院,广东广州 510641;3. 韶光市华工高新技术产业研究院,广东韶关 512027
硒(Se)是人和动物必需的微量元素,土壤环境缺硒可导致人、畜产生诸如白肌病和克山病等多种疾病;而通过施硒肥提高植物尤其是农作物的硒含量,是防治硒缺乏疾病的有效措施之一。花生()是中国乃至全球最重要的油料作物之一。为通过施硒肥来提高花生产量及其含硒量奠定实验基础和提供可能性,以花生幼苗为材料,采用水培法研究不同浓度硒(Se)对花生幼苗生长和开花及其抗氧化酶超氧化物歧化酶(SOD)和过氧化物酶(POD)活性及丙二醛(MDA)含量的影响。结果表明,硒浓度≤0.5 mg/L能促进花生幼苗的生长;其中以0.1 mg/L硒促进花生幼苗生长的效果最好;而硒浓度≤1.0 mg/L促进花生幼苗开花,以浓度为0.5 mg/L时花生幼苗开花数最多,达到27朵/株,约比对照提高90%;但硒浓度≥1 mg/L则抑制幼苗生长,且硒浓度愈高,对花生幼苗生长的抑制效果愈大,幼苗根变粗短,根尖褐化也愈严重,植株开花数显著减少,甚至不开花。与对照相比,低浓度(≤1.0 mg/L)硒可提高花生幼苗的SOD和POD活性,并降低其丙二醛(MDA)含量,但高浓度的硒(≥3 mg/L)则仅在培养初期提高花生幼苗的SOD和POD活性,但随着培养时间的延长,花生植株的POD和SOD活性则不断下降,但其MDA含量则逐渐升高。该结果为今后通过施硒肥来提高花生的含硒量和产量奠定了相关的实验和技术基础。
花生;硒;生长;开花;SOD;POD
硒(Se)是人体必需的微量元素之一。对于大多数的非蓄硒植物而言,硒是否为其生长发育的必需营养元素目前尚无定论;土壤环境缺硒可导致人、畜产生诸如白肌病和克山病等多种疾病[1]。中国大约有72%的县处于缺硒或严重缺硒状态[2]。在缺硒地区,通过施硒提高植物尤其是农作物的硒含量,是防治硒缺乏疾病的有效措施之一。某些非蓄硒植物的水培和田间实验结果表明,一定浓度的硒不仅可影响其生长和发育,还能影响其产量和品质,但高浓度的硒则对植物的生长有毒害作用[3-9]。而采用水培技术来研究硒对农作物生长发育的影响,则成为通过对农作物施硒来提高其含硒量的前提和试验基础。花生()是中国乃至全球最重要的油料作物之一;但截至目前,硒对花生生长发育的作用还不清楚。本研究以花生幼苗为材料,通过水培技术来研究微量元素硒对花生幼苗生长和开花及其抗氧化酶活性的影响,以期为今后农业生产上通过给油料作物花生施硒肥来提高花生产量及其含硒量奠定实验基础和提供可能性。
1 材料与方法
1.1 材料
花生()‘粤油5号’种子,购于广东省种子公司。
1.2 方法
1.2.1 硒对花生幼苗生长的影响 花生种子经萌发至3片真叶时,选取生长基本一致的幼苗,分别移植在盛有不加硒和添加不同浓度硒的荷格兰德(Hoagland)培养液的黑色塑料培养桶中,每培养桶栽植幼苗3株;10 d换一次培养液,以蒸馏水补足每天的失水量,在自然温度和自然光照下培养,并及时观察花生幼苗的生长及统计其开花情况;培养25 d后,取花生幼苗进行植株株高及生物量(干鲜重)的测量,每浓度设3次重复。实验重复2次,分别在2018年和2019年7—10月进行。
1.2.2 硒对花生幼苗超氧化物歧化酶(SOD)、过氧化物酶(POD)活性和MDA含量的影响 将与上述1.2.1相同的花生幼苗置于添加不同浓度硒的荷格兰德培养液的培养桶中培养,并分别在培养后5、10、15、20、25 d,取花生幼苗进行SOD和POD酶活性及MDA含量的测定。其中,花生幼苗的可溶性蛋白含量的测定参照BRADFORD[10]的方法;用考马斯亮蓝G-250进行染色,于岛津UV-1206型紫外分光光度仪595 nm处进行测定。花生幼苗的SOD活性按照BEAUCHAMP等[11]所建立的方法进行测定,以抑制氮蓝四唑(NBT)光化还原50%为一个酶活力单位,酶活性以U/mg表示。而花生幼苗的POD活性按照张志良等[12]的愈创木酚法,测定470 nm下值的变化,并以△470/(min·mg)蛋白表示酶活性的大小。MDA的含量测定参照许长成等[13]的方法。所有实验重复3次,取平均值。
2 结果与分析
2.1 硒对花生幼苗生长及开花的影响
当花生幼苗移植到分别加入不同浓度硒(以Na2SeO3形式加入)的荷格兰德培养液中培养一周后,发现3 mg/L和5 mg/L硒开始对花生幼苗的生长出现抑制,至培养20 d时,花生植株矮小,茎杆变细且呈紫红色,根系出现严重褐化,根变粗而短,并出现不同程度腐烂;表明该浓度硒已对花生幼苗生长产生严重的毒害症状(图1F~图1H)。由图1、图2可知,与对照相比,培养至25 d后,加0.05、0.1、0.5 mg/L硒培养的花生幼苗生长旺盛,根系发达,侧根较多,根白色,不变褐,其生物量(植株干重)分别比对照增加11.5%、41.0%和19.2%(图1A~图1D)。而与对照相比,培养至25 d后,添加1.0 mg/L硒培养的花生幼苗的地上部茎杆明显较对照略细,茎杆和主叶脉开始呈紫红色,但根比对照略长,可见小部分根尖变褐(图1E);同时发现,当花生幼苗液体溶养18 d后,开始产生花。与对照相比,当硒浓度≤1 mg/L时,花生植株所形成的花数目较多,其中以0.5 mg/L硒处理的效果最好,植株花朵数目最多,平均每植株所形成的花数达27朵,约比对照提高90%,具有显著差异(<0.05);而且用该浓度硒处理的花生植株第一朵花出现的时间比对照提早4 d。此外,还观察到,在液体培养条件下花生植株所产生的花能形成可逐渐伸长的果针,且各硒浓度培养的植株所形成的果针数也与花生植株所产生的花朵数目成正比(图1B~图1D)。与低浓度硒培养相比,当溶液中硒浓度超过1 mg/L时,随着硒浓度的增大,不仅花生幼苗生长被抑制,植株变矮,茎呈紫红色,部分幼叶变黄或呈浅黄绿色,而且会使花生植株所产生的花朵数目不断减少,5 mg/L硒培养的花生植株甚至不开花(图1E~图1H)。
2.2 硒对花生幼苗SOD活性的影响
植物体内的抗氧化酶SOD和POD是活性氧自由基清除系统中重要的保护酶之一,其活性的提高是使细胞免受毒害的调节反应。由图3可见,对照花生幼苗的SOD活性随着培养时间的延长而逐渐上升,但培养20 d后则逐渐下降。与对照相比,当培养液中硒浓度≤1 mg/L时,花生幼苗的SOD活性也随着培养时间的延长和硒浓度增加而逐渐提高,且均比对照高。而与对照和低浓度硒(≤1 mg/L)培养不同的是,添加高浓度3 mg/L硒培养的花生幼苗的SOD活性虽在培养5 d时比同时期的对照和低浓度硒培养的幼苗都高,但随着培养时间的延长,其SOD活性则逐渐下降,且不具有显著差异。可见,一定浓度的硒可提高花生幼苗的SOD活性,但以较高浓度的硒进行培养则反而会逐渐降低花生幼苗的SOD活性。

A:CK;B:0.05 mg/L硒;C:0.1 mg/L硒;D:0.5 mg/L硒;E:1.0 mg/L硒;F:3.0 mg/L 硒;G:5.0 mg/L 硒培养的根部;H:5.0 mg/L硒培养的地上部。
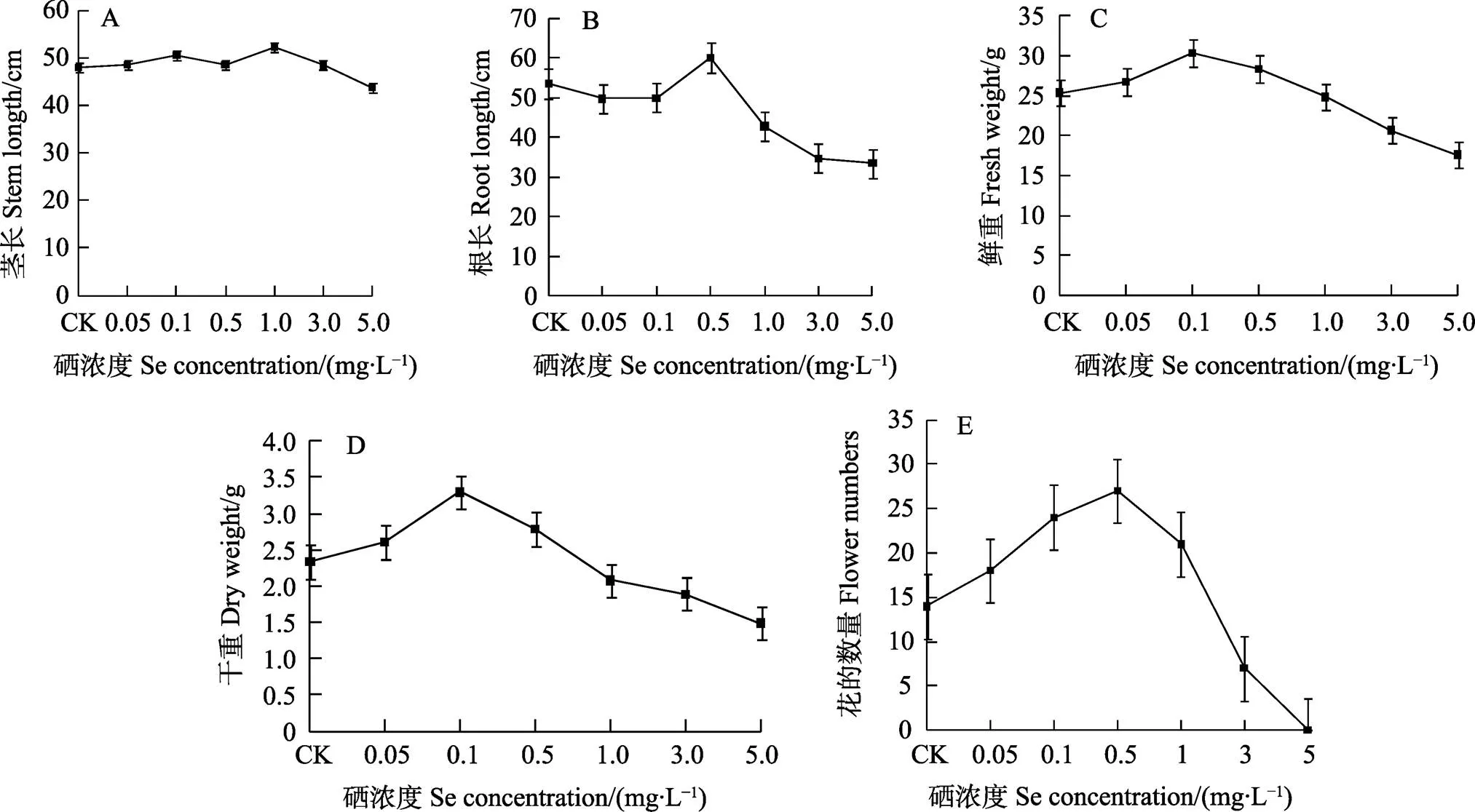
A:茎高;B:根长;C:植株鲜重;D:植株干重;E:平均每株开花数。
2.3 硒对花生幼苗POD活性的影响
由图4可见,在花生幼苗培养过程中,硒浓度≤1 mg/L培养的花生幼苗的POD活性均随着培养时间的延长而逐渐升高,并均在培养20 d时达到最大;之后,花生幼苗的POD活性则逐渐下降。与对照相比,硒浓度≤1 mg/L培养的花生幼苗POD活性均比对照不同程度提高(<0.05),具有显著差异。与对照和≤1 mg/L低浓度硒培养的花生幼苗相比,3 mg/L高浓度硒培养的花生幼苗的POD活性仅在培养5 d时最高,且比同期对照和低浓度硒培养的花生幼苗都高;但之后其POD活性则随着培养时间的延长而不断下降。
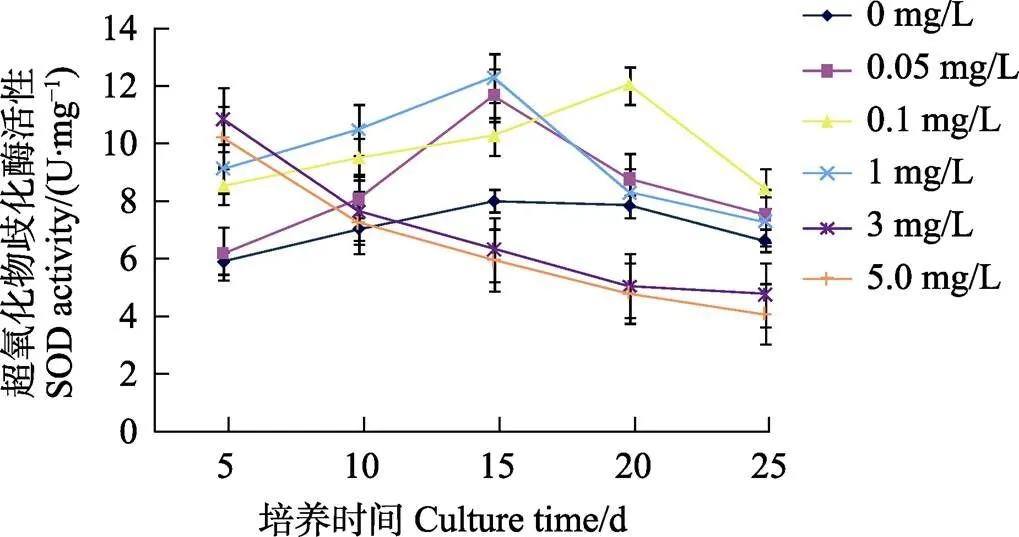
图3 不同硒浓度下花生幼苗的SOD活性
2.4 硒对花生幼苗MDA含量的影响
丙二醛(MDA)是细胞内膜脂过氧化的终末代谢产物,细胞内的氧自由基会严重地损伤细胞的生物膜,使膜的流动性降低;而MDA含量的变化则反映了细胞脂质过氧化程度并间接反映氧自由基含量。由图5可见,与对照相比,低浓度硒培养的花生幼苗植株的MDA含量均比对照低(<0.05),且具有显著差异;但当培养液中硒浓度大于1.0 mg/L时,随着硒浓度的增加,幼苗的MDA含量均比对照高,并与硒浓度呈正比。
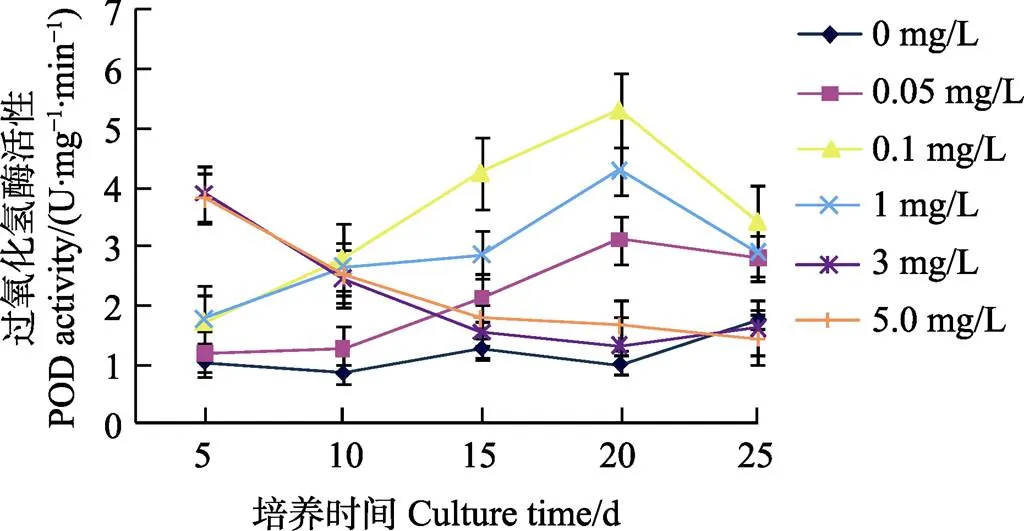
图4 不同硒浓度下花生幼苗的POD活性
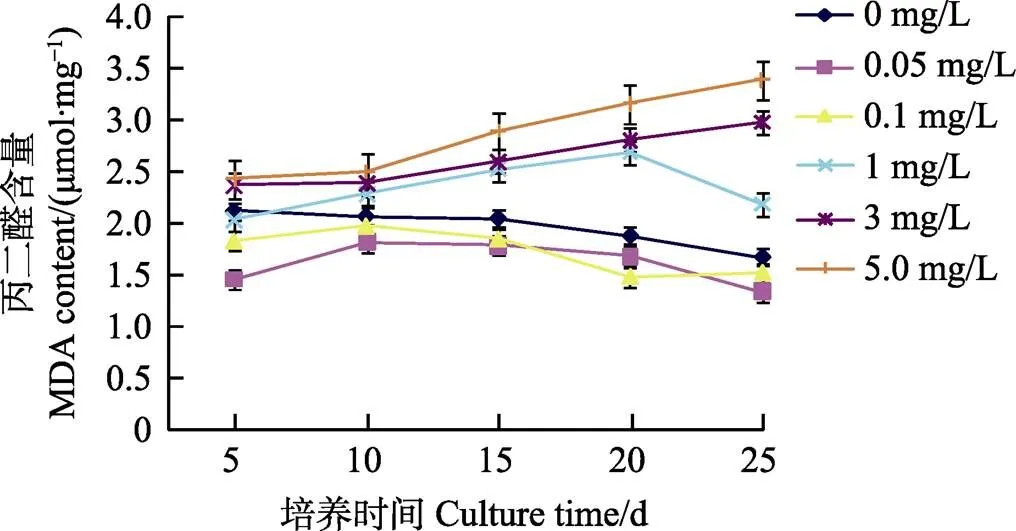
图5 不同硒浓度下花生幼苗的MDA含量
3 讨论
有关溶液培养条件下硒对植物生长发育的影响已有不少报道,如低浓度硒(≤0.1 mg/L)促进了菠菜(L.)的生长,而高浓度硒(1.0 mg/L)抑制生长[7];而李登超等[8]发现,低浓度硒(0.4 mg/L)可以促进水培生菜(L.)的生长;而营养液中加入低浓度硒(Se≤1.0 mg/L)时促进了小白菜(sspL.)的生长,增加了产量;但加高浓度硒(Se≥2.5 mg/L)时则抑制其生长[9],而在马铃薯盆栽实验中,适宜浓度(16~20 mg/kg)的硒可促进马铃薯根、芽的生长,但>20 mg/kg硒则对马铃薯植株有毒害作用[14]。这些与本研究的结果不完全一致。所不同的是,在本研究中,硒浓度≤0.5 mg/L时促进花生植株的生长,并以0.1 mg/L硒的效果最好;而硒浓度≥1 mg/L则抑制花生幼苗生长,且浓度愈高,抑制效果愈大,甚至产生毒害;同时还发现,合适浓度的硒不仅促进花生幼苗生长,还能促进花生幼苗开花。目前未见有关硒促进其他植物开花的报道。由于花生幼苗的开花数是影响花生果实数目和花生产量的决定因素。因此,本研究结果表明,硒对植物生长发育的影响可因植物种类或培养方式而异,而对花生施硒肥不仅可以促进其生长,还可能提高其产量。
抗氧化酶(SOD、POD等)是植物酶促防御系统中重要的保护酶,可以清除植物体内的活性氧自由基(ROS)并维持在较低水平。在正常情况下,其酶活性均处于较低水平,当植株受到伤害时,抗氧化酶活性会增强。在本研究中,培养基中添加低浓度的Se(0.05~1.0 mg/L)均可提高花生幼苗的SOD和POD活性,降低其MDA含量;但高浓度Se(3.0 mg/L)处理时,其SOD和POD活性仅在培养初期急剧升高,随着培养时间的延长,花生植株的SOD和POD活性均不断下降,但其MDA含量则逐渐升高。在水培菠菜时,低浓度硒可提高其抗氧化酶SOD、CAT(过氧化氢酶)及GSH-PX(谷胱甘肽过氧化物酶)活性,增强菠菜的抗氧化能力及增加产量[7],而这与本研究结果类似。这表明低浓度硒可能通过提高花生幼苗的抗氧化酶SOD和POD活性以及降低花生幼苗的膜脂过氧化程度及其MDA含量来影响花生幼苗的生长,但其影响受硒浓度及培养时间长短的影响;而高浓度硒则有可能通过加剧细胞膜脂的过氧化而对植株生长产生抑制或毒害。然而,在对盆栽花生植株叶面喷施不同浓度的亚硒酸钠来研究硒对花生抗氧化作用的影响时发现,10~60 mg/L Se处理可使其植株的POD活性高于对照,且随着硒浓度的增加而相应增加;而MDA含量则随着硒用量的增加而下降;而在Se浓度达到90 mg/L时,花生植株的叶绿素含量、POD活性则呈下降趋势,但其MDA含量则升高。与对照相比,在硒浓度为10~90 mg/L时,花生植株的CAT和SOD活性低于对照,并随着硒浓度的增加而下降,但在高浓度硒时其CAT和SOD活性则逐渐上升[15]。而这明显与本研究溶液培养花生幼苗的结果不一致。产生这种差异的原因可能与供试植物花生植株的培养方式、硒处理方式和植株吸收硒的效率等有关。
硒至少以2种方式参与蛋白质的代谢:一种是无机硒进入植物体后很快转化为Se-Cys(硒胱氨酸)、Se-Met(硒蛋氨酸)等多种氨基酸,以原料形式直接参与蛋白质的合成;另一种是作为tRNA的组成成分,转运氨基酸以合成蛋白质[16]。如杜振宇等[17]研究发现,土壤施硒后,茄子(L.)的含硒量随施硒量的增加而显著增加;显著提高了茄子粗蛋白蛋氨酸、胱氨酸和丝氨酸的含量,但谷氨酸和脯氨酸的含量显著降低。据SATHE等[16]的研究表明,大豆(L.)中89%的硒存在于蛋白质中,其主要化学形式是Se-Met。KONZE等[18-19]先后发现,硒代氨基酸如硒蛋氨酸和硒胱氨酸都可作为乙烯合成的更有效的前体,促进植物组织乙烯的释放。也有研究表明,乙烯可促进植物幼苗开花[20-21]。但目前未见有关硒促进植物开花以及其与乙烯释放关系的报道。而本研究中,发现合适浓度的硒除可促进花生幼苗生长外,还可显著促进花生幼苗开花,大大增加花生植株的花数。而硒对花生植株生长和开花的影响是否是由于含硒氨基酸通过促进乙烯产生、硒促进花生开花是否与硒蛋白或硒酶的活动有关,以及有关硒影响花生植株生长及其开花的分子机理方面,则有待进一步研究。由于花生植株的开花数目多少与花生的产量呈正比,因此,本研究结果为今后对重要经济作物花生合理施硒肥来提高花生的产量和含硒量奠定了一定的实验和技术基础。
[1] 李继云, 任尚学, 陈代中. 陕西省环境中的硒与大骨节病关系的研究[J]. 环境科学学报, 1982, 2(2): 91-101.
LI J Y, REN S X, CHEN D Z. A study of Kaschi-beck disease associated with environmental selenium in Shanxi area[J]. Acta Scientiae Circumstantiae, 1982, 2(2): 91-101. (in Chinese)
[2] 郑达贤, 李日邦, 王五一. 初论世界低硒带[J]. 环境科学学报, 1982, 2(3): 241-249.
ZHENG D X, LI R B, WANG W Y. A preliminary exposition on low-selenium zone in the world[J]. Acta Scientiae Circumstantiae, 1982, 2(3): 241-249. (in Chinese)
[3] 施和平, 张英聚, 刘振声. 番茄对硒的吸收、分布和转化[J]. 植物学报, 1993, 35(7): 541-546.
SHI H P, ZHANG Y J, LIU Z S. Absorption, distribution and transformation of selenium in the tomato plants[J]. Acta Botanica Sinica, 1993, 35(7): 541-546. (in Chinese)
[4] 王永勤, 曹家树, 李建华, 赵 孟, 赵翠芳. 施硒对大蒜产量和含硒量的影响[J]. 园艺学报, 2001, 28 (5): 425-429.
WANG Y Q, CAO J S, LI J H, ZHAO M, ZHAO C F. Effect of selenium application on the yield of garlic and its selenium content[J]. Acta Horticulturae Sinica, 2001, 28(5): 425-429. (in Chinese)
[5] 王晋民, 赵之重, 李国荣. 硒对胡萝卜含硒量、产量及品质的影响[J]. 植物营养与肥料学报, 2006, 12(2): 240-244.
WANG J M, ZHAO Z Z, LI G R. Effect of selenium application on the selenium content, yield and qualities of carrot[J]. Journal of Plant Nutrition and Fertilizer Science, 2006, 12(2): 240-244. (in Chinese)
[6] 侯 松, 田 侠, 刘 庆.叶面喷施硒对紫甘薯硒吸收、分配及品质的影响[J]. 作物学报, 2018, 44(3): 423-430.
HOU S, TIAN X, LIU Q. Effects of foliage spray of Se on absorption characteristics of Se and quality of purple sweet potato[J]. Acta Agronomica Sinica, 2018, 44(3): 423-430. (in Chinese)
[7] 尚庆茂, 高丽红, 李式军. 硒素营养对水培生菜品质的影响[J]. 中国农业大学学报, 1998, 3(3): 67-71.
SHANG Q M, GAO L H, LI S J. Effect of selenium on quality of hydroponica lettuce[J]. Journal of China Agricultural University, 1998, 3(3): 67-71. (in Chinese)
[8] 李登超, 朱祝军, 徐志豪,钱琼秋. 硒对小白菜生长和养分吸收的影响[J]. 植物营养与肥料学报, 2003, 9(3): 353-358.
LI D C, ZHU Z J, XU Z H, QIAN Q Q. Effects of selenium on the growth and nutrient absorption of pakchoi[J]. Journal of Plant Nutrition and Fertilizer Sciences, 2003, 9(3): 353-358. (in Chinese).
[9] 李登超. 朱祝军. 韩秋敏. 徐志豪. 硒对菠菜、小白菜生长及抗氧化活性的研究[J]. 上海交通大学学报(农业科学版), 2003, 21(1): 5-8.
LI D C, ZHU Z J, HAN Q M, XU Z H. Effects of selenium on the growth and antioxidative activity in spinach and pakchoi[J]. Journal of Shanghai Jiaotong University (Agricultural Science), 2003, 21(1): 5-8. (in Chinese)
[10] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1-2): 248-254.
[11] BEAUCHAMP C, FRIDOVICH I. Superoxide dismutase, Improved assays and an assay applicable to acrylamide gels[J]. Analytical Biochemistry, 1971, 44(1): 276-287.
[12] 张志良, 翟伟菁. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2003: 123-129.
ZHANG Z L, ZHAI W J. Experimental guidance of plant Physiology[M]. Beijing: Higher Education Press, 2003: 123-129. (in Chinese)
[13] 许长成, 邹 琦, 程炳肖. 硫代巴比妥酸(TBA)法检测脂质过氧化水平的探讨[J]. 植物生理学通讯, 1989(6): 58-60.
XU C C, ZOU Q, CHENG B X. Study on thiobarbiburic acid (TBA) method for determination of lipid peroxidations[J]. Plant Physiology Communications, 1989(6): 58-60. (in Chinese)
[14] 何 雪, 邓承佳, 李 威, 陆引罡, 刘 克. 硒、镉处理对马铃薯植株生长及硒镉吸收的影响[J]. 作物研究, 2021, 35(4): 311-317.
HE X, DENG C J, LI W, LU Y G, LIU K. Effects of selenium and cadmium treatment on plant growth and selenium and cadmium absorption of potato[J]. Crop Research, 2021, 35(4): 311-317. (in Chinese)
[15] 翟红强, 赵会杰. 硒对花生抗氧化作用的初步研究[J]. 中国油料作物学报, 2007, 29(1): 58-62.
ZHAI H Q, ZHAO H J. Preliminary study on antioxidation of peanut as affected by selenium[J]. Chinese Journal of Oil Crop Sciences, 2007, 29(1): 58-62. (in Chinese)
[16] SATHE S K, MASON A C, RODIBAUGH R, WEAVER C M. Chemical form of selenium in soybean (L.) lectin[J]. Journal of Agricultural and Food Chemistry 1992, 40(11): 2084-2091.
[17] 杜振宇, 史衍玺, 王清华. 施硒对茄子吸收转化硒和品质的影响[J]. 植物营养与肥料学报, 2004, 10(3): 298-301.
DU Z Y, SHI Y X, WANG Q H. Effects of selenium application on the selenium absorption and transformations of eggplant and its qualities[J]. Journal of Plant Nutrition and Fertilizer Science,2004, 10(3): 298-301. (in Chinese)
[18] KONZE J R, SCHILLING N, KENDE H. Enhancement of ethylene formation by selenoamino acids[J]. Plant Physiology, 1978, 62(3): 397-401.
[19] KONZE J R. Interactions of methionine and selenomethioine with methionine of adenosyltransferase and ethylene-generation system[J]. Plant Physiology, 1979, 63(3): 507-510.
[20] RUDICH J, HALEVY A H, KEDAR N. Ethylene evolution from cucumber plants as related to sex expression[J]. Plant Physiology, 1972, 49(6): 998-999.
[21] TAKAHASHI H, SUGE H. Sex expression and ethylene production in cucumber plants as affected by 1-aminocyclopropane 1-carboxylic acid[J]. Journal of the Japanese Society for Horticultural Science, 1982, 51(1): 51-55.
Effect of Selenium on Growth, Flowering and Activities of Antioxidant Enzymes ofSeedlings under Hydroponic Conditions
SHI Heping1, ZHANG Xiaoyuan2,3*, XU Sheng1
1. Guangdong Key Lab of Biotechnology for Plant Development, School of Life Science, South China Normal University / College of Life Science, South China Normal University, Guangzhou, Guangdong 510631, China; 2. General Institute of Industrial Technology, South China University of Technology, Guangzhou, Guangdong 510641, China; 3. Research Institute of Shaoguan Huagong High-tech Industry, Shaoguan, Guangdong 512027, China
Selenium (Se) is an essential trace element for human and animals. Selenium deficiency in soil environment can lead to many diseases in the animals such as white muscle disease and Keshan disease. Increasing the selenium content of plants, especially crops, by applying selenium fertilizer is regarded as one of the effective measures to prevent selenium deficiency diseases.is one of the most important oil crops in China and even in the world. In order to lay an experimental foundation and provide the possibility for improving peanut yield and its selenium content by applying selenium fertilizer to oil cropin agricultural production in the future, the effects of different concentrations of selenium (Se) on growth and flowering and activities of antioxidant enzymes superoxide dismutase (SOD) and peroxidase (POD) and MDA content inseedlings were investigated in hydroponic solution culture. The results showed that Se concentration less than or equal to 0.5 mg/L stimulated the growth of peanut seedlings, the best growth was obtained at 0.1 mg/L Se. Se concentration less than 1 mg/L was shown to enhance the flowering of peanut seedlings, the highest flowering frequency was 27 per plant, which was 90% higher than that of the control. When added more than 1 mg/L Se in the medium, the growth was gradually inhibited, the root was thicker and shorter, its tips became browner and the stems became shorter and redder and the number of flowers of seedlings was significantly decreased with the increasing Se concentration. No flower was even observed at 5.0 mg/L, the highest concentration of Se in the solution. Compared to the control, lower concentration of Se (≤1.0 mg/L) enhanced POD and SOD activities but decreased the MDA content of peanut seedlings; Higher concentrations above 3 mg/L Se could only enhance POD and SOD activities inseedlings at 5 days of culture, with prolonged time, the activities of SOD and POD inseedlings gradually decreased while its MDA content increased. This has would lay an experimental and technical foundation for enhancing Se content and yield of peanut through application of Se fertilizations.
; selenium; growth; flowering; SOD; POD
S565.2
A
10.3969/j.issn.1000-2561.2022.12.011
2022-01-20;
2022-04-24
广东省科技计划项目(No. 200729176271266,No. 2008B020200005)。
施和平(1964—),男,博士,教授,研究方向:植物生长发育与调控,E-mail:shihp@scnu.edu.cn。*同等贡献作者:张晓元(1964—),男,博士,高级工程师,研究方向:天然产物应用。
