白头翁皂苷B4和PD-L1 siRNA共递送cRGD修饰靶向脂质体的制备及体外细胞摄取研究 Δ
2023-01-14万安平张婧周雄冯育林刘骏何瑶李翔江西中医药大学中药固体制剂制造技术国家工程研究中心南昌330006江西中医药大学现代中药制剂教育部重点实验室南昌330004
万安平 ,张婧 ,周雄 ,冯育林 ,刘骏 ,何瑶 , ,李翔 (.江西中医药大学中药固体制剂制造技术国家工程研究中心,南昌 330006;.江西中医药大学现代中药制剂教育部重点实验室,南昌 330004)
白头翁始载于《神农本草经》,为毛茛科植物白头翁Pulsatilla chinensis(Bunge) Regel的干燥根[1]。白头翁皂苷B4(anemoside B4,AB4)是白头翁中的五环三萜皂苷成分之一,具有抗肿瘤、调节免疫等药理作用[2]。然而AB4为水溶性药物,在血浆中的半衰期短、代谢快,在肿瘤部位的富集量较少,这在一定程度上限制了其应用[3]。程序性死亡配体1(programmed cell death ligand 1,PD-L1)是一种在肿瘤表面大量表达的免疫抑制分子,阻断免疫检查点PD-L1/程序性死亡蛋白1(programmed death-1,PD-1)可以抑制癌细胞的激活,进而提高肿瘤免疫治疗的效应[4]。小干扰RNA(small interference RNA,siRNA)是一种长度为21~25 bp的双链RNA,其可通过RNA干扰作用沉默相关基因来达到治疗疾病的作用[5]。PD-L1 siRNA(简称为“siP”)可通过诱导内源性mRNA降解来下调肿瘤细胞中PD-L1的水平,从而激活T淋巴细胞的抗肿瘤免疫活性[6]。但是游离siP的稳定性差,难以穿透生物屏障,且靶向递送效率低[7]。因此,设计一种可实现靶向递送siP的有效载体具有重要意义。
脂质体是目前研究最多、应用最广的递送系统,可改善药物的稳定性[8]。将AB4和siP共同包载于脂质体囊泡中,有望延长其在体内的循环时间,从而提高其在肿瘤组织的分布。环精氨酰甘氨酸天冬氨酸序列[cyclo(Arg-Gly-Asp-D-Tyr-Cys),cRGD]是一种可与αβ整合素受体结合的环肽[9],而αvβ3整合素受体在非小细胞肺癌的肿瘤组织和肿瘤血管细胞表面高度表达[10]。因此,本研究首先将AB4和siP共装载于脂质体中,然后利用cRGD可与αvβ3整合素受体结合的优势,对脂质体进行修饰,制备AB4和siP共递送cRGD修饰靶向脂质体(AB4/siP-c-L),以提高脂质体的肿瘤主动靶向性,为其后续抗肿瘤研究奠定基础。
1 材料
1.1 主要仪器
本研究所用的主要仪器有Gallios型流式细胞仪(美国Beckman公司),JEM-2100型高分辨率透射电子显微镜(日本Jeol公司),Chemi Doc XRS型凝胶成像仪、Mini-Sub Cell GT Cell小型水平电泳槽(美国Bio-Rad公司),LSM-710型共聚焦激光扫描显微镜(德国Zeiss公司),ABI 7500型实时荧光定量聚合酶链式反应(PCR)仪(美国Applied Biosystems公司),LC-20AT型高效液相色谱仪(日本Shimadzu公司),HC-3018R型高速冷冻离心机(安徽中科中佳科学仪器有限公司),Nano ZS型粒度测定仪(英国Malvern公司)。
1.2 主要药品与试剂
AB4原料药(批号2018042505,纯度>98.0%)购自江西本草天工科技股份有限公司;荧光染料Alexa Fluor 647标记的siP(siP647)、荧光染料FAM标记的siP(siPFAM)、阴性对照siRNA均购自广州锐博生物技术有限公司;氢化大豆磷脂酰胆碱(HSPC)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇(DSPE-PEG 2000)均购自德国Lipoid GmbH公司;二硬脂酰基磷脂酰乙醇胺-聚乙二醇-cRGD(DSPE-PEG 2000-cRGD)购自西安瑞禧生物科技有限公司;(1,2-二油酰基-丙基)-三甲基铵-氯盐(DOTAP)及高纯度胆固醇均购自艾伟拓(上海)医药科技有限公司;4',6-二脒基-2-苯基吲哚(DAPI)购自武汉博士德生物工程有限公司;RPMI 1640培养基、胎牛血清(fetal bovine serum,FBS)、0.25%胰酶均购自德国Gibco公司;琼脂糖购自北京亚米生物科技有限公司;其余试剂均为分析纯。
1.3 细胞
小鼠Lewis肺癌细胞LLC购自美国菌种保藏中心。
2 方法和结果
2.1 脂质体的制备
(1)采用乙醇注入法制备cRGD修饰的AB4靶向脂质体(AB4-c-L)[11]。将AB4溶于乙醇中得到浓度为16 mmol/L的AB4乙醇溶液,将HSPC、DOTAP、胆固醇、DSPE-PEG 2000-cRGD、DSPE-PEG 2000(物质的量之比为8.3∶25∶7.2∶0.1∶0.9)溶于上述AB4乙醇溶液中,超声(60 ℃,50 kHz,5 min)使其完全溶解,然后缓慢注入到2 mL 5%葡萄糖溶液中,60 °C水化1 h,探头超声(300 W,10 min)。将所得纳米混悬液置于透析管中,在5%葡萄糖溶液中透析4 h,经0.45 μm滤膜过滤,收集滤液,即得AB4-c-L。(2)将DSPE-PEG 2000-cRGD替换为DSPE-PEG 2000,同法操作制备未经cRGD修饰的载AB4脂质体(AB4-L)。(3)将所得AB4-c-L与20 nmol/L的siP等体积混合,室温孵育30 min,通过静电吸附得到AB4/siP-c-L。(4)使用 siP647、siPFAM代替 siP,同法制备AB4/siP647-L、AB4/siP647-c-L和AB4/siPFAM-c-L。
2.2 AB4/siP-c-L的表征
2.2.1 粒径和Zeta电位测定 分别取AB4-L、AB4-c-L和AB4/siP-c-L混悬液各100 μL,用5%葡萄糖溶液稀释至2 mL,混匀,采用激光散射粒径测定仪测定其粒径及Zeta电位。每个样品平行测定3次。结果显示,AB4-L、AB4-c-L、AB4/siP-c-L的平均粒径分别为(180.6±0.3)、(190.7±1.2)、(187.4±3.1) nm,Zeta电位分别为(51.4±1.3)、(49.2±1.2)、(33.5±1.4) mV。
2.2.2 形态观察 将AB4/siP-c-L混悬液稀释适当倍数后,取适量滴加于铜网上,静置5 min,用2%磷钨酸染色10 min,晾干,置于透射电子显微镜下观察。结果显示,AB4/siP-c-L呈类球形,分散良好。结果见图1。

图1 AB4/siP-c-L的透射电镜图
2.2.3 AB4包封率和含量测定 采用高效液相色谱法测定AB4含量。色谱柱为Diamonsil C18(250 mm×4.6 mm,5 μm),流动相为乙腈-水(8∶17,V/V),柱温为25 ℃,检测波长为201 nm,流速为1.0 mL/min,进样量为10 μL。经方法学考察,结果符合2020年版《中国药典》(四部)通则要求[12]。
通过超滤离心法测定脂质体对AB4的包封率[13]。将400 μL AB4/siP-c-L混悬液置于Ultra-4超滤离心管(截留分子量为10 kDa)中,以10 000 r/min离心15 min,收集滤液;取滤液按上述色谱条件进样测定,得到脂质体中游离AB4的含量(Mfree)。取400 μL AB4/siP-c-L混悬液V脂质体,用甲醇稀释至2 mL,然后按上述色谱条件进样测定,得到脂质体中AB4的总量(Mtotal)。通过下列公式分别计算脂质体中AB4的包封率和药物含量:包封率(%)=(Mtotal-Mfree)/Mtotal×100%;药物含量=(Mtotal-Mfree)/V脂质体。结果显示,AB4在AB4/siP-c-L中的包封率为(95.2±0.4)%,含量为(1.0±0.2) mg/mL。
2.2.4 siP包裹能力考察 采用琼脂糖凝胶电泳法考察脂质体对siP的包裹能力。将AB4-c-L与20 nmol/L siP混合,使得AB4-c-L混悬液中DOTAP的氮(N)与siP中的磷(P)的物质的量之比为10∶1,室温孵育30 min,作为样品;以等量的游离siP(20 nmol/L)和AB4-c-L混悬液作为阴性对照样品,同法操作。将上述样品分别与上样缓冲液混合,依次上样进行琼脂糖凝胶电泳(电压75 mV,时间60 min),于凝胶成像系统中成像。结果显示,当AB4-c-L中N和P的物质的量之比为10∶1时,电泳条带消失,提示AB4-c-L可将siP完全包裹。结果见图2。

图2 AB4/siP-c-L对siP的包裹能力考察的电泳图
2.2.5 血清稳定性考察 将AB4/siP-c-L与FBS等体积混合,在37 ℃孵育,分别在0、1、2、4、8、12、24 h时取出24 μL的AB4/siP-c-L于离心管中,向离心管中加入6 μL上样缓冲液,涡旋混匀,作为待测样品;以等量的游离siP(20 nmol/L)作为阴性对照样品,同法操作。将上述样品分别上样至1.2%的琼脂糖凝胶各泳道中,设置电泳参数为电压75 mV、时间60 min,采用凝胶成像系统成像。结果显示,游离的siP在FBS中2 h后开始降解(条带颜色变浅),且时间越长,降解越完全;而AB4/siP-c-L在FBS中8 h后仍存在,表明AB4/siP-c-L能提高siP在血清中的稳定性。结果见图3。

图3 AB4/siP-c-L血清稳定性考察的电泳图
2.2.6 体外释放行为考察 采用透析袋扩散法考察AB4/siP-c-L的体外释放行为。分别取适量的AB4溶液和AB4/siP-c-L混悬液,置于截留分子量为10 kDa的透析袋中,然后将透析袋分别置于100 mL不同pH(pH7.4、6.0、5.0)的磷酸盐缓冲液(PBS)中,于37 ℃、150 r/min条件下考察AB4/siP-c-L中AB4在PBS中的释放行为。分别于 0.5、1、2、4、8、12、24、48 h时取样,同时补充相同温度和相同体积的释放介质,按“2.2.3”项下方法测定释放介质中AB4的含量。每个时间点平行测定3次。以释放时间为横坐标、AB4累积释放率为纵坐标绘制释放曲线,结果见图4。如图4所示,与AB4溶液相比,AB4/siP-c-L中AB4在不同pH条件下均未见明显突释,说明AB4/siP-c-L具有缓释作用。同时,AB4/siP-c-L的释放具有pH敏感性,随着pH的降低,AB4/siP-c-L中AB4的释放越快;在pH5.0条件下,AB4/siP-c-L中AB4的48 h累积释放率分别是pH6.0、pH7.4条件下的1.4、2.4倍。
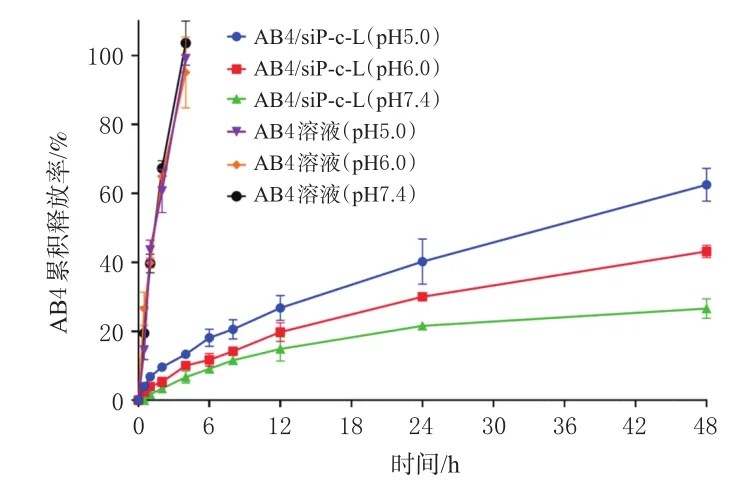
图4 AB4/siP-c-L中AB4在不同pH释放介质中的体外释放曲线(±s,n=3)
2.3 LLC细胞对脂质体的摄取考察
2.3.1 流式细胞术检测 采用流式细胞术考察LLC细胞对荧光标记制剂的摄取量。将LLC细胞按每孔1×106个接种于24孔板上,在37 ℃、5% CO2培养箱中孵育24 h至细胞贴壁。将细胞分为空白对照组、siP647组、AB4/siP647-L组、AB4/siP647-c-L组,每组设置3个复孔。空白对照组细胞给予常规培养基,给药组细胞分别加入siP647、AB4/siP647-L、AB4/siP647-c-L(siP647的浓度均为 20 nmol/L,AB4的浓度均为1.6 μmol/L)。将细胞置于培养箱中分别常规培养15、30、60 min后,用PBS清洗细胞3次,加入适量胰酶进行消化,收集细胞至流式管中。采用流式细胞仪检测孵育不同时间后细胞对荧光标记制剂的摄取量。采用Graphpad Prism 8软件对结果进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析,方差齐性时组间两两比较采用Tukey's检验,方差不齐时组间两两比较采用Dunnett'sT3检验。检验水准α=0.05。结果显示,在孵育15、30、60 min后,3个给药组细胞的荧光摄取量较空白对照组均显著升高(P<0.05),其中AB4/siP647-c-L组细胞的荧光摄取量又显著高于siP647组和AB4/siP647-L组(P<0.05),且随着孵育时间的延长AB4/siP647-L组、AB4/siP647-c-L组细胞的荧光摄取量均显著升高(P<0.05)。结果见表1。
表1 孵育不同时间后各组细胞对各制剂的摄取量测定结果(±s,n=3,%%)

表1 孵育不同时间后各组细胞对各制剂的摄取量测定结果(±s,n=3,%%)
a:与孵育相同时间的空白对照组比较,P<0.05;b:与孵育相同时间的siP647组比较,P<0.05;c:与相同制剂孵育15 min时比较,P<0.05;d:与相同制剂孵育30 min时比较,P<0.05;e:与孵育相同时间的AB4/siP647-L组比较,P<0.05
60 min 0.6±0.1 9.2±2.1a 96.1±1.7abcd 97.8±1.3abcde组别空白对照组siP647组AB4/siP647-L组AB4/siP647-c-L组15 min 0.3±0.1 1.1±1.1a 42.4±2.8ab 50.9±3.1abe 30 min 0.5±0.1 1.2±2.1a 71.8±2.5abc 90.4±1.8abce
2.3.2 共聚焦激光扫描显微镜观察 采用完全随机方案,利用共聚焦激光扫描显微镜考察荧光标记制剂在LLC细胞内的分布。将LLC细胞按每孔1×106个接种于Lab-Tek®腔室玻片上,置于37 ℃、5% CO2培养箱中孵育24 h至细胞贴壁。将细胞分为空白对照组、siPFAM组和AB4/siPFAM-c-L组,每组设置3个复孔。空白对照组细胞给予常规培养基,给药组细胞分别加入siPFAM、AB4/siPFAM-c-L(siPFAM的浓度均为 20 nmol/L,AB4的浓度均为1.6 μmol/L)。将细胞置于培养箱中分别常规培养1、4 h后,用PBS清洗细胞3次,DAPI染色10 min,再次用PBS清洗3次后,封片,于显微镜下观察细胞中的荧光分布。统计学分析方法同“2.3.1”项下。结果显示,孵育1、4 h后,药物主要分布于细胞质中,siPFAM组、AB4/siPFAM-c-L组细胞的荧光强度均显著高于空白对照组(P<0.05),AB4/siPFAM-c-L组细胞的荧光强度显著高于siPFAM组(P<0.05),且随着孵育时间的延长各给药组细胞的荧光强度均显著升高(P<0.05)。结果见图5、表2。

图5 孵育不同时间后各组细胞的共聚焦激光扫描显微图(×40)
表2 孵育不同时间后各组细胞胞浆中的荧光强度测定结果(±s,n=3)

表2 孵育不同时间后各组细胞胞浆中的荧光强度测定结果(±s,n=3)
a:与孵育相同时间的空白对照组比较,P<0.05;b:与相同制剂孵育1 h时比较,P<0.05;c:与孵育相同时间的siPFAM组比较,P<0.05
4 h 0 25.2±8.6ab 35.2±4.9abc组别空白对照组siPFAM组AB4/siPFAM-c-L组1 h 0 8.6±3.9a 18.4±4.4ac
3 讨论
本研究采用乙醇注入法制备了cRGD修饰的靶向脂质体,用于共递送水溶性药物AB4和基因药物siP。在制备过程中笔者发现,加入DSPE-PEG 2000-cRGD后可降低AB4-c-L和AB4/siP-c-L的电位。其可能原因在于,囊泡表面包裹的PEG可在一定程度上覆盖DOTAP的正电基团,从而导致脂质体的电位下降[14]。对于基因药物siP,由于体内存在大量的核酸酶,一旦游离siP进入体内,会迅速降解失效。但是经过脂质体包裹后,脂质体上PEG可保护siP不被核酸酶代谢,避免负电荷的蛋白或红细胞对siP的吸附,从而延长其在体内的循环时间[15]。通过细胞摄取实验结果可知,LLC细胞对AB4/siP-c-L的摄取能力比对游离siP更强,AB4/siP-c-L可在细胞质内大量富集。其具体的作用机制可能与靶向基团cRGD的肿瘤细胞穿膜作用相关[16]。
根据本课题组前期开展的药动学及组织分布实验得知,AB4/siP-c-L给药12 h后小鼠血液中AB4的浓度已非常低,AB4已基本分布到肿瘤部位。因此,为充分考察AB4/siP-c-L中AB4的释放行为,本研究选择48 h作为考察时间,未选择更长的72 h。在体外释放行为考察实验中,与AB4溶液相比,AB4/siP-c-L混悬液中AB4的缓释效果明显。其原因可能在于AB4包裹于脂质体的内水相,磷脂双分子膜发挥了延缓药物透过的作用。AB4/siP-c-L在接近内涵体酸性pH条件下(pH5.0~5.5)可更快释药,而在中性pH条件下(pH7.4)释药速率最慢。其原因可能是所使用的脂质材料DOTAP的极性基团三甲基铵在酸性条件下的极化程度增加,该极化的极性基团聚集使得磷脂双分子膜混乱程度增加,进而导致膜通透性增加,最终提高了AB4/siP-c-L中AB4在pH5.0~5.5环境中的跨膜释放速率。
综上所述,本研究制备的AB4/siP-c-L可有效实现AB4与基因药物siP的共载,并对LLC细胞具有一定的体外靶向性,可为后续AB4/siP-c-L的抗肿瘤研究提供基础。
