我国《临床急需境外新药名单》纳入品种及优化策略研究 Δ
2023-01-14蒋丰田侃南京中医药大学卫生经济管理学院南京1003南京中医药大学养老服务与管理学院南京1003
蒋丰 ,田侃 (1.南京中医药大学卫生经济管理学院,南京 1003;.南京中医药大学养老服务与管理学院,南京 1003)
临床急需境外新药指的是近十年在美国、欧盟或日本上市但未在我国境内上市的新药,包括用于治疗罕见病的药品、防治严重危及生命且尚无有效治疗或预防手段的药品和防治严重危及生命的疾病且具有明显临床优势的药品。《临床急需境外新药名单》是我国为了加快临床急需境外新药在境内上市而发布的药品名单,被纳入《临床急需境外新药名单》的品种可按照《临床急需境外新药审评审批工作程序》提交相关资料,直接提出上市申请,国家药品监督管理局药品审评中心(Center For Drug Evaluation,CDE)会建立专门的通道加快审评,进而更好地满足我国患者的用药需求[1]。自2018年11月CDE发布《第一批临床急需境外新药名单》起,到2022年5月已发布了3批《临床急需境外新药名单》,累计纳入73个品种。但是这73个品种在我国境内的上市情况如何,短缺监测是否到位,与各类药品目录的衔接是否密切,目前尚未有相关研究报道。本文首先回顾3批《临床急需境外新药名单》的发布过程,然后对纳入《临床急需境外新药名单》的药品进行品种特点分析,并从药品的境内上市情况、短缺监测、纳入医保和鼓励仿制等角度分析品种属性,为进一步建立健全临床急需境外新药的短缺监测制度、统筹医保支付、完善配套激励机制等提供参考。
1 我国《临床急需境外新药名单》的发布过程
回顾我国《临床急需境外新药名单》的发布过程,大致可分为3个阶段:一是孕育阶段。2018年4月召开的国务院常务会议通过了对进口抗癌药实施零关税并鼓励境外新药进口的决定。二是准备阶段。2018年4月,国家药品监督管理局发布了《关于进口化学药品通关检验有关事项的公告》[2],取消非首次进口化学原料药及制剂口岸检验;同年5月,国家药品监督管理局发布了《关于优化药品注册审评审批有关事宜的公告》[3],简化境外上市新药审评审批程序;同年10月,国家药品监督管理局又发布了《关于临床急需境外新药审评审批相关事宜的公告》[4],加快临床急需的境外上市新药在我国境内审评审批。三是实施阶段。2018年11月、2019年5月、2020年11月,国家药品监督管理局分别发布了3批《临床急需境外新药名单》。2022年3月,国家卫生健康委员会还发布了《临床急需药品临时进口工作方案》,以满足我国患者对于国内无注册上市、无企业生产或短时期内无法恢复生产的少量境外已上市的临床急需药品的用药需求。我国《临床急需境外新药名单》的发布过程见表1。
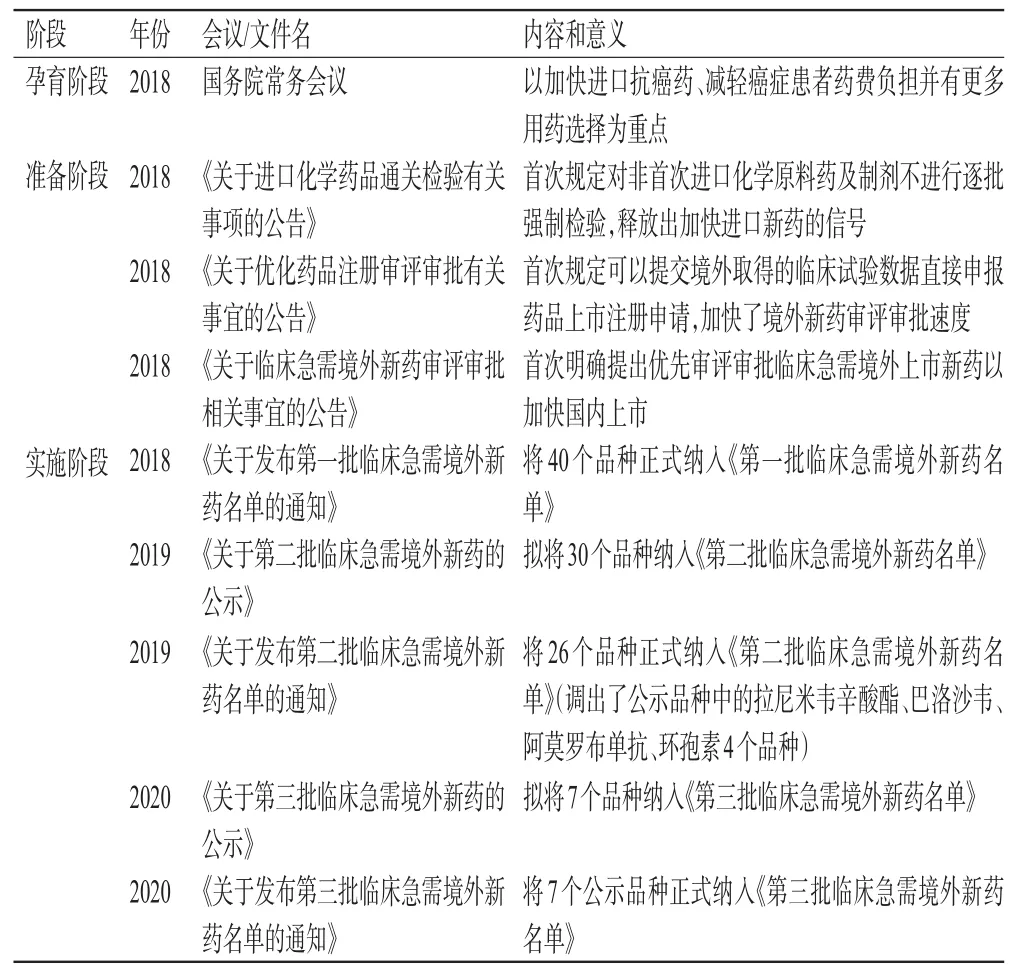
表1 我国《临床急需境外新药名单》的发布过程
2 临床急需境外新药的品种特点与属性
2.1 临床急需境外新药的品种特点
在治疗领域方面,3批临床急需境外新药的治疗领域相对集中于内分泌和代谢病、肿瘤、皮肤疾病,这3个治疗领域的品种占到了品种总量的45.21%(表2)。具体来看,第一批临床急需境外新药中治疗肿瘤的品种数量最多,有8种,包括地诺单抗、维莫德吉和地努妥昔单抗等;此外,治疗免疫系统疾病、内分泌和代谢病、皮肤疾病以及心脑血管疾病的品种也纳入较多,总共有20种。相比第一批临床急需境外新药品种数量多、类型丰富的特点,第二批临床急需境外新药的类型更为集中,有9个品种集中于治疗内分泌和代谢病,且均为孤儿药,如布罗索尤单抗、拉罗尼酶和美卡舍明等。第三批临床急需境外新药的品种数量较少,治疗领域相对集中于血液系统疾病,如卡拉西单抗、吉瑞替尼和依维替尼。在临床价值方面,有学者对3批临床急需境外新药中的孤儿药和抗肿瘤药进行了研究,发现3批临床急需境外新药中多数为孤儿药(孤儿药数量/总数分别为21/40、17/26、2/7),切实提高了我国罕见病患者用药的可及性;此外,《临床急需境外新药名单》的发布进一步加速了境外抗肿瘤新药在国内上市,我国逐步实现从“滞后进口”到“同步上市”的过渡[5—6]。在短缺监测方面,本文将3批临床急需境外新药与《国家短缺药品清单》和《临床必需易短缺药品重点监测清单》的纳入品种进行对照,发现3批临床急需境外新药均未被纳入到《国家短缺药品清单》和《临床必需易短缺药品重点监测清单》中,说明我国临床急需境外新药的短缺监测制度还有待建立健全。
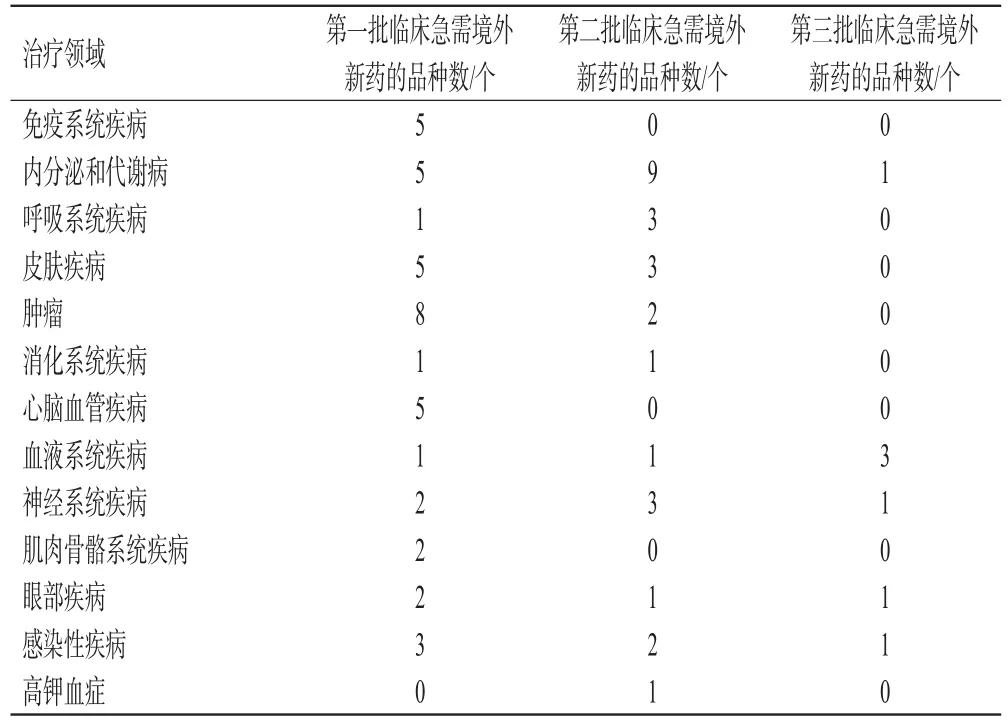
表2 3批临床急需境外新药的治疗领域及数量分布情况
2.2 临床急需境外新药的品种属性
2.2.1 境内上市情况分析 根据《临床急需境外新药审评审批工作程序》的规定,CDE会对临床急需境外新药建立专门的通道开展审评,对其中的罕见病治疗药品,CDE在受理后3个月内完成技术审评;对其他境外新药,CDE在受理后6个月内完成技术审评。这进一步加快了3批临床急需境外新药的上市速度[4]。截至2022年5月,纳入《临床急需境外新药名单》中的73个品种中有50个品种(占比68.49%)已上市,其中第一批临床急需境外新药有25个、第二批临床急需境外新药有20个、第三批临床急需境外新药有5个;8个品种(占比10.96%)正在申请上市,其中第一批临床急需境外新药有6个、第二批临床急需境外新药有2个;15个品种(占比20.55%)未开展申请,其中第一批临床急需境外新药有9个、第二批临床急需境外新药有4个、第三批临床急需境外新药有2个。3批临床急需境外新药在我国境内的上市情况见表3。

表3 3批临床急需境外新药在我国境内的上市情况
2.2.2 纳入医保情况分析 截至2022年5月,3批临床急需境外新药中有26个品种(占比35.62%)已经被纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2021年)》(以下简称《2021年医保目录》),分别涉及第一批、第二批、第三批临床急需境外新药的13、11、2个品种,3批临床急需境外新药的纳入医保情况见表4。由表4可见,目前3批临床急需境外新药已经有相当一部分被纳入了医保,切实降低了患者的用药负担。但值得注意的是,临床急需境外新药不再作为一类固定的药品被纳入《2021年国家医保药品目录调整工作方案》(以下简称《2021年工作方案》)和《2022年国家基本医疗保险、工伤保险和生育保险药品目录调整工作方案》(以下简称《2022年工作方案》)规定的医保药品调整范围,这可能是因为临床急需境外新药通常价格高昂,“保基本”的医保基金支付压力较大。
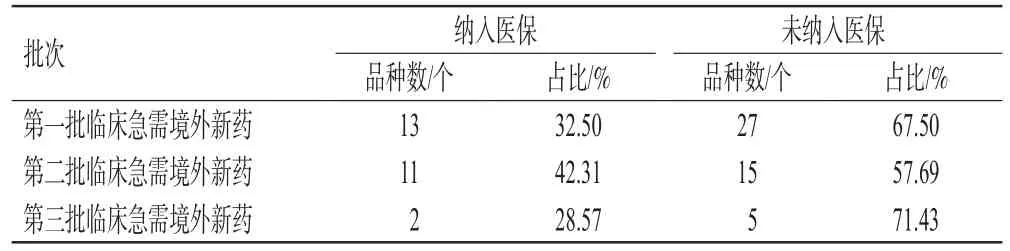
表4 3批临床急需境外新药的纳入医保情况
2.2.3 鼓励仿制情况分析 目前我国3批《临床急需境外新药名单》与2批《鼓励仿制药品目录》之间的匹配度不高,仅有治疗戈谢病的依利格鲁司他、治疗遗传性血管性水肿的艾替班特、治疗肺动脉高压的波生坦和治疗癫痫的氨己烯酸4个药品同时被纳入了《临床急需境外新药名单》和《鼓励仿制药品目录》中,并且这4个品种治疗的疾病均为《第一批罕见病目录》认定的罕见病,具有特殊临床价值。目前这4个药品中仅剩依利格鲁司他还未在我国境内上市,根据新3类仿制药“仿制境外已上市但境内未上市原研药品”的定义,依利格鲁司他仿制药属于新3类仿制药,适用《境外已上市境内未上市药品临床技术要求》关于“仿制药”的规定,该技术要求为我国仿制临床急需境外新药提供了更明确的临床试验和研究数据规定[7]。
3 《临床急需境外新药名单》落实过程中存在的问题
3.1 临床急需境外新药的短缺监测制度有待建立健全
根据《国家短缺药品清单管理办法(试行)》(以下简称《管理办法》)可知,临床必需易短缺药品是经我国药品监督管理部门批准上市,临床必需且不可替代或者不可完全替代,供应来源少,存在供给短缺风险的药品。临床急需境外新药在我国境内上市后显然属于临床必需易短缺药品,但是目前这3批临床急需境外新药尚未被很好地纳入到我国短缺药品监测体系中。《药品管理法》第九十四条和第九十五条明确提出,国家应建立药品供求监测体系,实行短缺药品清单管理制度。目前我国短缺药品监测会商联动机制主要包括原国家卫生计生委员会、国家发展和改革委员会、工业和信息化部、财政部、人力资源和社会保障部、商务部、国务院国有资产监督管理委员会、国家市场监督管理总局和国家药品监督管理局9大部门,部门间尚需协同与整合[8]。如国家药品监督管理局发布的3批临床急需境外新药均未被纳入到国家卫生健康委员会发布的《国家短缺药品清单》和《临床必需易短缺药品重点监测清单》中,这说明不同部门发布的药品清单可能存在衔接不畅的问题。除此之外,由于我国在药品短缺监测领域起步较晚,经验相对不足,因此药品短缺监测制度在实施过程中存在一些问题:在药品短缺信息收集方面,我国主要依靠各地医疗机构收集并逐级上报,但由于医疗机构上报者对“短缺”的理解不同,增加了药品短缺信息处理部门核查“短缺”信息真实性的难度,导致药品短缺信息收集存在一定的滞后性;在药品短缺信息公开方面,目前我国对于地方医疗机构上报药品短缺信息后是否需要进一步公开无统一规定,仅有部分省份会定期公开发布该省份的药品短缺清单,导致药企无法及时掌握我国药品短缺现状并及时调整产能[9]。在尚无可实现临床急需境外新药可及性的制度保障下,临床急需境外新药存在供应短缺、费用负担重、流通差等固有弊端[10]。国家对于临床急需境外新药短缺监测的缺位可能会使得患者断药后通过代购途径自行转向境外购买,这容易引发法律纠纷,导致出现“救命药困局”。因此,我国针对临床急需境外新药的短缺监测制度还有待进一步建立健全。
3.2 临床急需境外新药与医保的联动减弱
《2020年国家医保药品目录调整工作方案》(以下简称《2020年工作方案》)明确将获批上市的临床急需境外新药纳入调整范围,这使得前2批临床急需境外新药被纳入医保的品种数量较多,品种比例分别为32.50%和42.31%。《2021年工作方案》不再将临床急需境外新药作为一类固定的药品纳入调整范围,而是将在《鼓励仿制药品目录》内或在《鼓励研发申报儿童药品清单》内的已上市药品和已上市罕见病药品纳入调整范围。目前3批临床急需境外新药中有26个品种在《2022年工作方案》调整范围内,其中有13个品种还没有被纳入《2021年医保目录》。根据国家医疗保障局对于《2021年工作方案》和《2022年工作方案》的解读——“坚持保障基本,尽力而为、量力而行,把提高保障水平建立在经济和财力可持续增长的基础上”可知,为控制医保费用过快增长,国家医疗保障局在一定程度上限制了价格较高的临床急需境外新药被纳入医保,导致第三批临床急需境外新药被纳入医保的品种比例仅为28.57%。为应对利润急剧下降的“专利悬崖”现象,原研企业通常会在专利到期前通过“以量换价”的形式推动药品被纳入医保。如《第三批临床急需境外新药名单》中的玛巴洛沙韦片和环孢素滴眼液,被纳入医保后虽然其价格降幅分别达55.00%和72.47%,但是其医院端销售额增幅分别达180.32%和323.22%,市场份额得以巩固和扩大。因此,临床急需境外新药与医保联动的减弱实质上限制了原研企业通过“以价换量”达到市场推广的目的,不利于新药研发环境的改善。
3.3 鼓励仿制临床急需境外新药的力度不足
目前3批《临床急需境外新药名单》中有4个品种被纳入了《鼓励仿制药品目录》,并且这4个品种均为孤儿药。我国鼓励孤儿药的仿制力度较大主要有以下两个方面的原因:一方面是因为当前国内有关孤儿药研发的补偿激励机制以及政策法规尚不完善,我国的孤儿药供给现状与发达国家相比尚有差距,国内孤儿药短缺问题严重[11];另一方面是因为孤儿药市场需求较大、商业潜力十足、对临床研究的要求低、未来前景明朗,并且国外可借鉴的孤儿药政策相对成熟[12]。目前我国根据3个标准(满足其一即可)判断一个品种是否可以被纳入《鼓励仿制药品目录》:一是专利到期或专利即将到期,尚没有提出注册申请;二是临床供应短缺(竞争不充分);三是企业主动申报。查询美国FDA橙皮书(FDA Orange Book)数据库可知,依利格鲁司他、艾替班特、波生坦和氨己烯酸的专利均已到期或即将到期[13],结合这4个品种临床供应短缺(竞争不充分)的特点,已经可满足上述3个标准中的2个,因此被纳入《鼓励仿制药品目录》就顺理成章。但是3批《临床急需境外新药名单》中仅有4个品种被纳入《鼓励仿制药品目录》,数量偏少,且部分符合标准的品种也尚未纳入。如盐酸芬戈莫德的专利已于2019年到期,司来帕格、乌司奴单抗、阿达木单抗的专利也将于2023年到期,这些品种亦符合被纳入《鼓励仿制药品目录》的条件,但实际上却未被纳入。除此之外,鼓励仿制药的审评审批速度也需进一步加快,根据《药品上市许可优先审评审批工作程序(试行)》关于药品可以申请优先审评审批的规定,仿制药申请不在“适用范围”内。若临床急需境外新药的仿制药想要进入优先审评审批程序,只能通过 “适用范围”的第六条——“国家药品监督管理局规定其他优先审评审批的情形”单独“开政策口子”进行申报,效率较低且较为滞后。
4 优化完善《临床急需境外新药名单》的对策建议
4.1 加强临床急需境外新药短缺监测的部门协同联动
国家卫生健康委员会和国家药品监督管理局是临床急需境外新药短缺监测的主要主体。两部门虽然各司其职,但是在临床急需境外新药监管平台的建设维护、监测数据的处理、预警信息的公布、不同药品清单的联动和全环节短缺监测流程的构建等方面仍有协同联动的空间。国家卫生健康委员会和国家药品监督管理局可以牵头探索建立9大部门共享的药品短缺信息综合管理平台,引导《临床急需境外新药名单》涉及的不同利益相关者及时提供药品短缺信息,及时掌握临床急需境外新药短缺的紧急程度、短缺类型、危害程度、波及范围等,在各自职责范围内协商解决方案,如加快审评审批、鼓励研发仿制、申请临时进口、及时公开药品短缺信息等,以拓宽临床急需境外新药的“短缺预警”范围和“供应保障”渠道,推动《国家短缺药品清单》《临床必需易短缺药品重点监测清单》《临床急需境外新药名单》的协同联动,进一步提高我国临床急需境外新药的供应保障能力。
4.2 建立以临床价值为导向的医保支付体系
《2020年工作方案》明确将临床急需境外新药纳入医保调整范围,是少有的直接将药品清单纳入医保调整范围的规定,但该工作方案仅维持了1年,没有成为常态化举措。针对临床急需境外新药价格高昂和医保基金支付压力较大的问题,笔者认为应当建立以临床价值为导向的医保支付体系,在有限的医保基金内充分发挥临床急需境外新药的实际疗效:一是动态调整医保报销比例,按照临床急需境外新药的实际疗效动态调整医保报销比例,在医保支付能力范围内确定支付标准。二是建立阶梯价格谈判机制,对于全球新药和与现有最优治疗方案对照开展头对头试验,且试验结果为优效的药品可以参照国际上人均收入水平相近国家的同品种价格,按照合理比例确定价格并给予较长的价格保障期限[14]。三是引入先行谈判程序,对于具有较大临床价值的新药可以独立于常规医保谈判程序先行开展谈判,若先行谈判成功可直接纳入医保,若谈判失败可被授予二次机会继续参加常规医保谈判[15]。四是探索以医疗服务价值为基础的支付方式,目前全球的医疗费用支付者均开始利用疗效数据支付费用,医疗服务价值逐渐成为医保报销的主要标准[16]。
4.3 完善鼓励仿制临床急需境外新药的配套激励机制
针对我国鼓励仿制临床急需境外新药力度不足的问题,笔者提出以下完善鼓励仿制临床急需境外新药的配套激励机制建议:第一,应当加快鼓励仿制药的审评审批速度,赋予临床急需境外新药的仿制药优先审评审批资格,将其纳入《药品上市许可优先审评审批工作程序(试行)》优先审评审批的“适用范围”,作为一类固定的优先审评审批药品。第二,应当进一步完善“首仿市场独占期”制度。《药品专利纠纷早期解决机制实施办法(试行)》第十一条规定:“对首个挑战专利成功并首个获批上市的化学仿制药,给予市场独占期”。该要求对于我国仿制药来说条件较为苛刻,难以满足2个“首个”要求[17]。我国可以探索符合临床急需境外新药特点的“首仿市场独占期”制度,给予经认定的、企业申请的、市场竞争不足的临床急需境外新药的仿制药市场独占期,以加大对仿制临床急需境外新药的政策激励力度,也可以借鉴美国的简化新药申请(Abbreviated New Drug Application,ANDA)制度,允许仿制药通过比原研药耗时更短、成本更低的途径批准上市,并且允许仿制药企在原研药仍处于专利保护期时就开始研发仿制药[18]。第三,我国也应当注重“首仿市场独占期”制度下的反垄断审查。对此,可以借鉴美国 FDA实施的《药物竞争行动计划》[19],包括简化ANDA审查流程,加强复杂仿制药的开发和审查(如Pre-ANDA会议),减少延缓和阻碍仿制药批准的程序(如事先补漏机制),使临床急需境外新药的仿制药更有效地推向市场。
5 结语
《临床急需境外新药名单》的发布对于满足患者用药需求,提高全民健康水平,推进“健康中国”战略具有重要意义。但是《临床急需境外新药名单》在落实过程中还存在一些不足,如临床急需境外新药的短缺监测制度有待建立健全,与医保的联动减弱,鼓励仿制力度不足等。我国应进一步加强临床急需境外新药短缺监测的部门协同联动,建立以临床价值为导向的医保支付体系,完善鼓励仿制临床急需境外新药的配套激励机制,着力健全完善药品供应保障制度,不断提升药学服务能力和水平。
