体素内不相干运动扩散加权成像对I、II 型卵巢上皮性癌的鉴别诊断
2023-01-13岳福岭刘闯陈雯路凯李胜水许华薛秀荣张桂成
岳福岭,刘闯,陈雯,路凯,李胜水,许华,薛秀荣,张桂成*
1.河北省沧州中西医结合医院影像科,河北 沧州 061001;2.河北省沧州中西医结合医院病理科,河北 沧州 061001;3.河北省沧州中西医结合医院超声科,河北 沧州 061001;*通信作者 张桂成 czhzhangguicheng@163.com
卵巢上皮性癌(epithelial ovarian cancer,EOC)占卵巢癌的90%~95%,由于缺乏明显的初始症状和有效的筛查工具,患者病死率较高[1]。EOC分为较常见的侵袭性Ⅱ型癌和较少见的生长缓慢的Ⅰ型癌[2-3]。不同类型的EOC生物学行为及预后不同。Ⅰ型生物学行为通常表现为惰性,遗传型特征稳定,肿瘤生长缓慢,尽管对化疗有耐药性,但预后相对较好;Ⅱ型生物学行为高度不稳定,具有TP53基因突变,肿瘤进展迅速,早期即可发生转移,术后较Ⅰ型患者更易复发[4-5]。因此,选择合适的影像学方法评估EOC的分型对术前治疗的选择和预后评估具有重要的临床价值。
MRI是目前女性生殖系统疾病的最佳影像学检查方法。扩散加权成像(DWI)通过测量肿瘤和组织中的水的扩散系数获得组织的微结构信息,已常规用于诊断卵巢肿瘤[6-7]。体素内非相干运动(intravoxel incoherent motion,IVIM)反映了毛细血管灌注和水分子真实组织扩散率[8]。近年来,IVIM模型已用于多种器官及其相关疾病影像诊断、组织学分级预测、疗效监测及预后评估[9-11],但其在鉴别Ⅰ型和Ⅱ型EOC的研究相对较少。本研究拟比较DWI与IVIM相关扩散参数,以评估其对Ⅰ型和Ⅱ型EOC的鉴别诊断价值。
1 资料与方法
1.1 研究对象 回顾性分析2018年6月—2020年12月河北省沧州中西医结合医院卵巢肿瘤患者的临床、病理及影像学资料。纳入标准:经手术病理或穿刺活检证实为EOC;术前行常规MRI检查及DWI和IVIM序列。排除标准:①图像质量不佳或伪影较重影响疾病诊断及DWI和IVIM相关参数测量;②病理诊断示卵巢肿瘤含有混合成分不能进行分型;③有肿瘤治疗或复发史。最终纳入75例患者,根据Kurman等提出的标准,Ⅰ型为低级别浆液性癌[2],在大多数病例中,常含有浆液性交界性肿瘤成分,并逐渐发生癌变。Ⅱ型为高级别浆液性腺癌,细胞具有显著异形性。其中Ⅰ型EOC 27例,年龄32~71岁,低级别浆液性囊腺癌5例,黏液性囊腺癌7例,低级别子宫内膜样癌3例,透明细胞腺癌10例,恶性Brenner瘤2例;Ⅱ型EOC 48例,高级别浆液性癌35例,高级别子宫内膜样癌11例,未分化癌2例。本研究经医院伦理委员会批准,患者均签署知情同意书。
1.2 MRI检查 采用3.0T MRI扫描仪器(Magnetom Verio 3.0T及Magnetom Skyro 3.0T,Siemens)。使用盆腔相控阵成像线圈,数据采集时,患者仰卧,自由呼吸。扫描参数:常规横轴位自旋回波T1WI,TR 500 ms,TE 15 ms,视野350 mm,矩阵380×256,层厚5 mm,激励次数2;T2WI及脂肪抑制序列,TR 4 000 ms,TE 86 ms,层厚3 mm,视野350 mm,矩阵380×256,激励次数2。对比增强T1WI脂肪抑制成像,TR 3.96 ms,TE 1.41 ms,层厚4 mm,视野325 mm,矩阵384×256;激励次数2。以上参数应用于矢状位、冠状位和轴位扫描,增强扫描采用对比剂Gd-DTPA,剂量0.1~0.2 mmol/kg,注射速度2~3 ml/s,注射对比剂后采用双期T1WI扫描,早期(注射对比剂后30~60 s)扫描、延迟期(注射对比剂后120~180 s)扫描。DWI扫描参数:TR 4 400 ms,TE 64.7 ms,矩阵128×130,视野350 mm,层厚5 mm,b值取0、50、800 s/mm2。IVIM模型扫描参数:TR 4 043 ms,TE 75 ms,视野400 mm,层厚/层间隔5/1 mm,共24层,激励次数2,b值为0、20、40、60、120、240、480、1 000、1 500 s/mm2。
1.3 临床病理资料 记录患者的年龄、月经状况(是否绝经)、肿瘤指标(血清CA-125值)。根据病理Ki-67 表 达 分 为Ki-67<30%、30%≤Ki-67≤60% 和Ki-67>60%;当Ki-67>30%时,定义为Ki-67高表达。临床分期采用国际妇产科联合会(International Federation of Gynecology and Obstetrics,FIGO)2018临床病理分期法[12]。
1.4 MRI图像分析 由2位具有10年以上工作经验的放射科副主任医师采用盲法在图像存档与传输系统上评估MRI特征,包括肿瘤大小、形态、边缘、肿瘤信号、内部成分、纤维分割、壁结节及强化特征,存在分歧时通过协商解决。强化程度选择延迟期肿瘤增强是否低于子宫肌层强化分为轻度强化(低于子宫肌层强化)和中度-明显强化(等于-高于子宫肌层强化)。其他评价指标包括淋巴结肿大、邻近器官侵犯或转移、腹水。由另外2 名放射科医师在后处理软件(IMAge/enGINE,www.vusion.com.cn)测量DWI和IVIM相关参数。DWI定量参数为表观扩散系数(ADC),IVIM-DWI参数包括灌注分数(f)、假性扩散系数(D*)和真实扩散系数(D)。所有感兴趣区(ROI)均手动放置在任一原始b值图像的肿瘤部位,软件会自动覆盖其他b值图像相同的位置处,避开肿瘤内囊变、坏死及出血区域。
1.5 统计学分析 采用SPSS 24.0软件,计量资料以表示,两组比较采用独立样本t检验;计数资料采用例(%)表示,两组比较使用χ2检验;使用受试者工作特征(ROC)曲线评估诊断效能,采用Z检验比较曲线下面积(AUC)。P<0.05为差异有统计学意义。
2 结果
2.1 Ⅰ型和Ⅱ型EOC的临床基本情况及FIGO分期两组患者年龄、月经状况差异无统计学意义(P>0.05)。Ⅱ型EOC组肿瘤标志物CA125和CA199均明显高于Ⅰ型EOC组(P均<0.05)。Ⅱ型EOC组肿瘤Ki-67表达>30%占89.6%,Ⅰ型中48.2%的肿瘤Ki-67表达<30%,差异有统计学意义(P=0.001)。根据FIGO分期,Ⅰ型中I、Ⅱ期占81.48%(22例),Ⅱ型中Ⅲ、Ⅳ期占87.6%(42例),两组FIGO分期差异有统计学意义(P<0.001)(表1)。
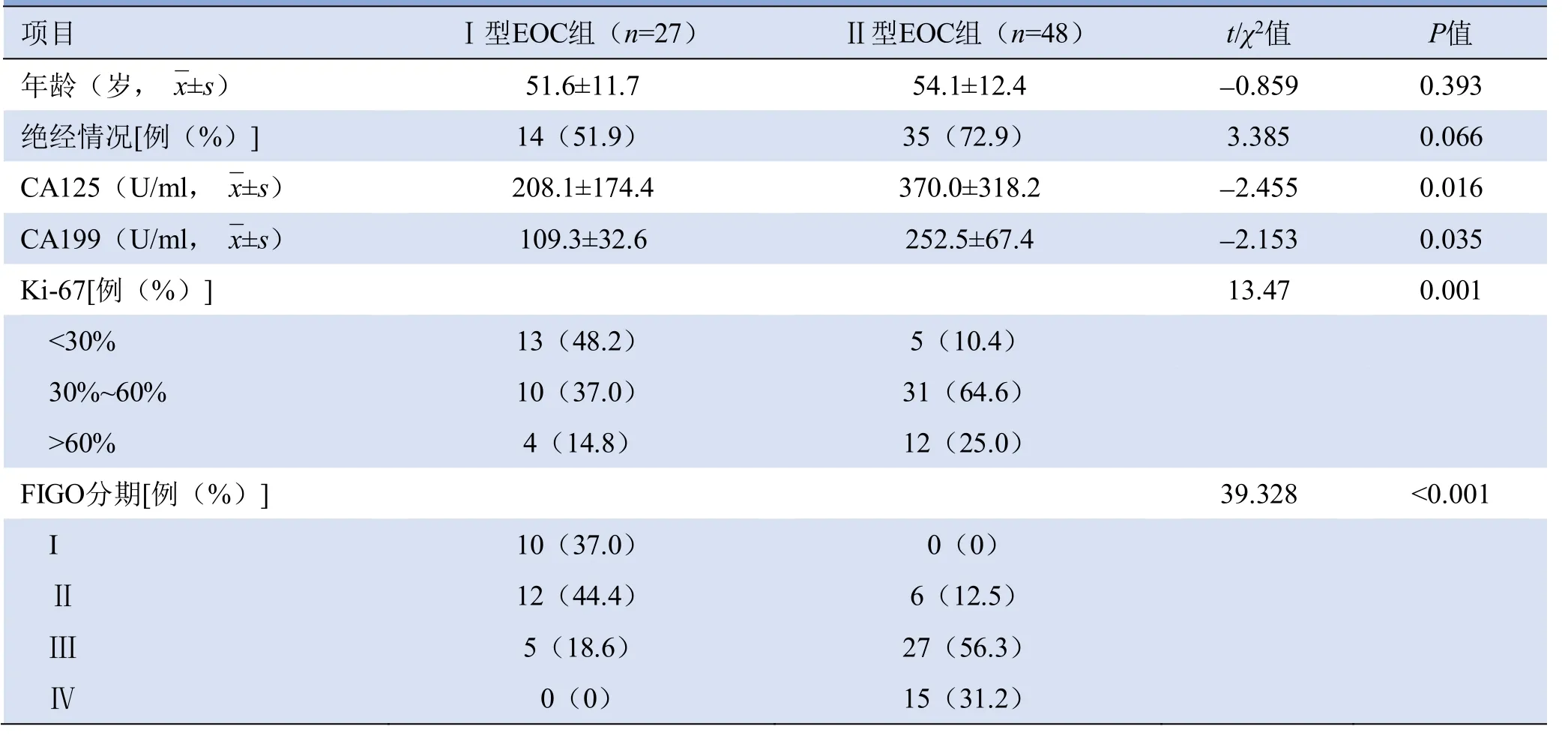
表1 I型和II型EOC患者临床基本情况及FIGO分期
2.2 Ⅰ型和Ⅱ型EOC的MRI表现 两组EOC在肿瘤成分、大小、分布、囊壁结节及淋巴结转移方面差异均有统计学意义(P均>0.05)。Ⅰ型EOC组肿瘤以囊性或囊性成分为主(占48.1%),Ⅱ型肿瘤以实性或实性成分为主(占47.9%,P=0.006)。Ⅱ型肿瘤直径大于Ⅰ型(P=0.043)。Ⅰ型EOC病灶以单侧分布为主(占81.5%),Ⅱ型EOC肿瘤发生在双侧比例为41.7%(P=0.041);Ⅰ型病灶囊壁结节的发生率明显高于Ⅱ型(P<0.001),淋巴结转移低于Ⅱ型(P=0.001)。Ⅰ型和Ⅱ型肿瘤内纤维间隔、腹水及强化程度差异均无统计学意义(P>0.05)(表2,图1、2)。

图1 女,66岁,卵巢透明细胞癌,EOC Ⅰ型,腹盆腔巨大囊实性占位。A.mDXION-water相显示病灶呈等低信号影,囊壁不均匀增厚,并见多发乳头状结节影,病灶中央见液性信号影;B.T2WI/SPAIR相显示病灶囊壁呈不均匀等高信号影;增强后囊壁呈明显不均匀强化及乳头状结节;C.囊腔液性成分未见强化;D.DWI显示囊壁呈环形高信号影;E.IVIM f图测量肿瘤囊壁平均灌注分数f值为0.225,高于囊腔内f值(0.196);F.IVIM D图测量肿瘤囊壁平均真性真实扩散系数D值为1.796×10-3 mm2/s、低于囊腔内D值(2.694×10-3 mm2/s)
2.3 IVIM与DWI在Ⅰ型和Ⅱ型EOC的诊断价值比较Ⅰ型EOC组ADC值和D值明显高于Ⅱ型,f值低于Ⅱ型(P均<0.05),两组D*值差异无统计学意义(P>0.05)(表2)。ROC曲线分析显示,75例EOC中D值的曲线 下 面 积(AUC=0.804 )明 显 高 于ADC 值(AUC=0.650;Z=2.672,P=0.008)和f值(AUC=0.675;Z=2.094,P=0.036),以D值=1.67×10-3mm2/s作为诊断阈值鉴别Ⅰ型与Ⅱ型EOC的敏感度为63%,特异度为83.3%(图3)。

图3 IVIM和DWI相关参数对EOC组织分型的诊断效能
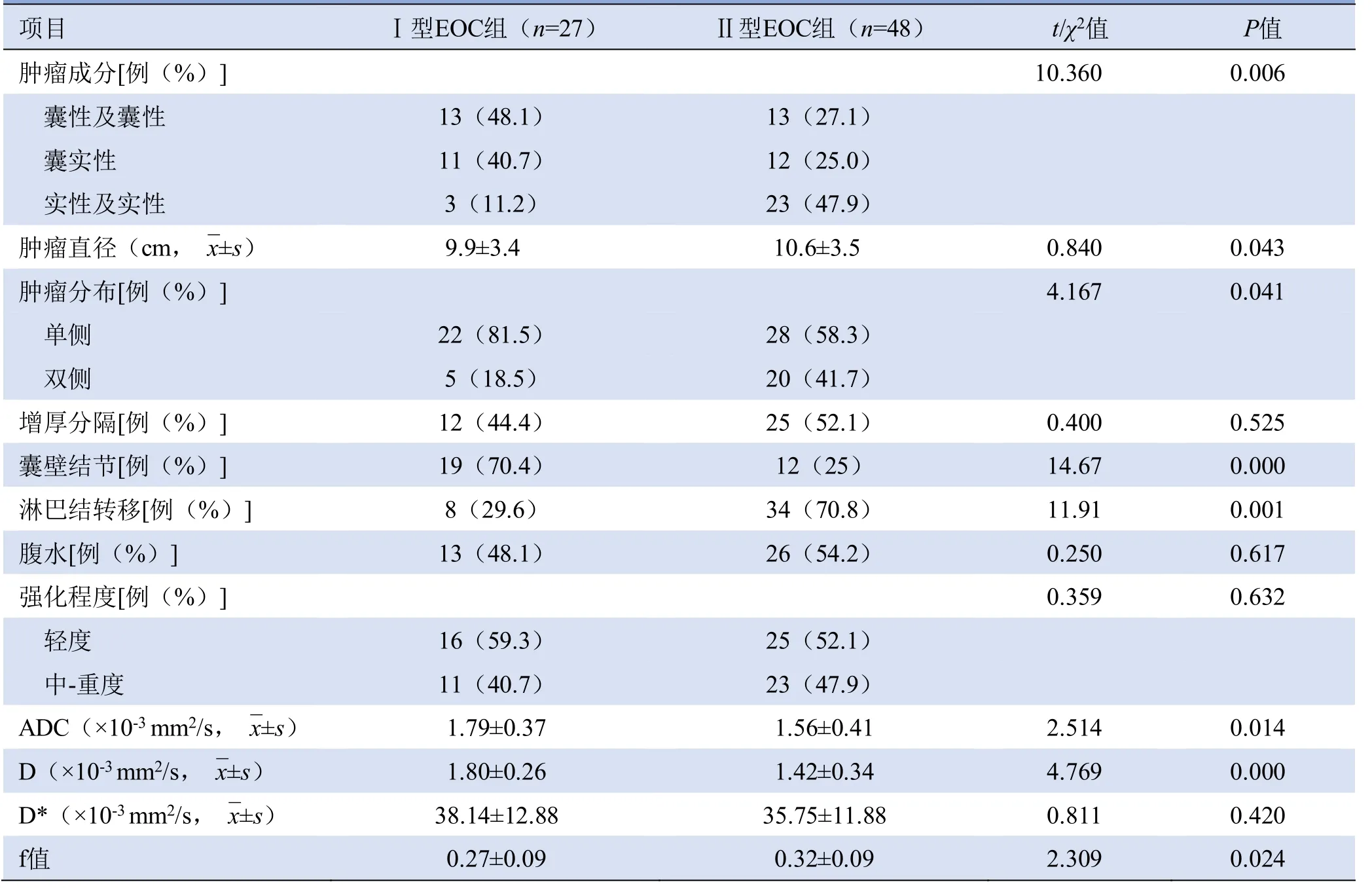
表2 两组EOC患者肿瘤及MRI特征比较
3 讨论
EOC是女性生殖系统中致死率最高的恶性肿瘤,不同类型EOC患者的治疗方式及预后存在较大的差异,目前临床上推荐的治疗方案是肿瘤减灭术联合辅助化疗[13]。其中Ⅰ型EOC肿瘤生长缓慢且常伴有特定的前驱病变,如交界性浆液性肿瘤、子宫内膜异位症等,而Ⅱ型EOC发展迅速、侵袭性较强,与Ⅰ型EOC患者相比,Ⅱ型患者死亡风险高、存活率低,需要更个性化的治疗[3]。因此,术前准确的评估EOC的病理类型对指导治疗方案的选择和改善患者预后具有重要的临床意义。
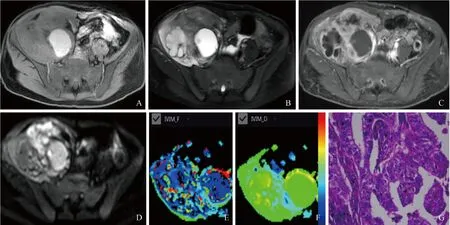
图2 女,54岁,高级别卵巢浆液性癌,EOC Ⅱ型,右侧盆壁区囊实性占位。A.mDXION-water相显示病灶呈等低信号影,其一囊腔内T1呈高信号影;B.T2WI/SPAIR相显示病灶内见多房囊性信号影,实性成分呈等信号影;C.增强后实性成分呈明显不均匀强化,并见多发分隔样强化;D.实性成分DWI呈不均匀高信号影。E.IVIM f图测量肿瘤实性成分平均灌注分数f值为0.252,高于囊腔内f值(0.184);F.IVIM D图测量肿瘤实性成分真性真实扩散系数D值为1.562×10-3 mm2/s、低于囊腔内D值(2.446×10-3 mm2/s);G.病理镜下可见不规则腺管样结构,细胞核大深染异型,可见核分裂象(HE,×400)
3.1 EOC的临床特点 相关研究表明,Ⅰ型与Ⅱ型EOC的临床资料和影像学表现存在一定的差异[3,14]。另外肿瘤指标CA125、CA199可单独或联合其他肿瘤标志物用于诊断EOC的复发及监测化疗效果[15]。在早期EOC患者中约47%的CA125水平升高,而在疾病晚期80%以上的出现CA125升高[16]。本研究中,Ⅰ型EOC的CA-125、CA199值低于Ⅱ型EOC,而且Ⅰ型EOC的Ki-67指标及FIGO分期均低于Ⅱ型,其原因为Ⅰ型的发生发展是一个缓慢的过程,从良性病变,经历特定的基因突变,演变为交界性肿瘤,然后发展为低级别上皮癌;而Ⅱ型的演变比较迅速,直接形成高级别上皮癌,所以这些指标反映了病变的恶性程度及恶变速度。
3.2 EOC的影像学特点 在影像表现上,Ⅱ型EOC瘤体直径通常比Ⅰ型瘤体小,表现为实性或偏实性肿瘤,而Ⅰ型更常表现为以囊性或囊性为主的肿瘤。Jang等[17]发现在高级别卵巢癌中,以实性或实性成分为主的比例高于低级别卵巢癌。在IVIM中的D值代表高b值时的水分子真实组织扩散率,可以减少毛细血管灌注的影响[8]。既往研究表明,D值有助于鉴别Ⅰ型和Ⅱ型EOC[1,18]。本研究结果显示,D值在区分Ⅰ型和Ⅱ型EOC的诊断效能显著高于ADC值和f值,其原因为Ⅱ型EOC肿瘤细胞增殖活跃,细胞间隙狭窄导致水分子活动受限。Ki-67是反映肿瘤增殖活性的特异性指标,本组病例中,Ⅰ型Ki-67高表达明显低于Ⅱ型。He等[1]的研究也证实D值和D*在恶性和交界性EOC中有很高的鉴别诊断价值,而D*值的诊断效能却不同于本研究的结果,本研究结果显示I型和Ⅱ型EOC中D*值无显著差异。D*值反映组织中血流灌注情况,虽然肿瘤内新生血管增加导致血液灌注分数增加,但同时微循环障碍也限制了血流速度,导致D*值增加的并不明显[19]。因此,D*值的诊断价值有限,与胶质瘤和乳腺肿瘤中的D*值一致,而Ⅱ型EOC的f值却显著高于Ⅰ型的f值,与Song等[20]研究结果存在一定差异。研究表明这些差异可能与不同的b值、信噪比和不同类型的肿瘤组织有关[10]。
3.3 本研究的局限性 首先,这是一项样本量相对较小的回顾性研究;其次,IVIM采集方案可能不够理想,应采用更多小的b值(<200 s/mm2)获得更稳定的扩散相关参数;第三,用于测量IVIM参数的ROI勾画未包括肿瘤全部层面,可能存在人为选择测量差异。
总之,Ⅰ型和Ⅱ型EOC的临床和影像特征存在一定的差异,与Ⅰ型EOC相比,Ⅱ型EOC更倾向于实性或以实性成分为主的肿块,Ki-67呈高表达,囊壁结节较少见,通过结合D值和f值,帮助临床医师术前准确鉴别Ⅰ型和Ⅱ型EOC,对患者预后和治疗方案的制订有重要意义。
