基于生物信息学的肝细胞癌预后模型的构建
2023-01-13李青玲李树德卫小娟黄映光李思熳
李青玲,李树德,卫小娟,2,黄映光,李思熳*
(1.昆明医科大学 基础医学院 生物化学与分子生物学系,云南 昆明 650500;2.中国科学院 昆明动物研究所,云南 昆明 650201;3.云南省第一人民医院 普外一科,云南 昆明 650034)
肝癌发病率高居世界第六,是癌症相关死亡第二大原因.肝细胞癌(Hepatocellular carcinoma,HCC)占原发性肝癌的75%~85%[1].由于HCC病情进展迅速,并发症多,大多数患者确诊时已达中晚期[2],且大量早期HCC患者在手术治疗后还会复发.目前对HCC的治疗决策多依赖于病理及影像学证据,缺乏分子学指标.而基于HCC特异性分子构建的预后预测模型则可进一步辅助临床医师进行HCC诊治[3].肿瘤突变负荷(tumor mutation burden,TMB)作为衡量免疫治疗效果的可靠指标,在HCC预后评估中至关重要.TMB表示外显子编码区每兆碱基中替换、基因插入或突变的总数[4],是预测免疫检查点抑制剂治疗多种肿瘤(如肺癌、子宫内膜癌、乳腺癌和结肠直肠癌)疗效的有效指标[5-9].多项研究[5-9]中已初步揭示TMB与免疫微环境之间的联系及TMB与HCC中的免疫治疗之间的联系,但由于其测序的复杂性和高成本,不太可能广泛应用于免疫治疗疗效的临床评价.Zhang等[10]基于2020年公共数据进行了HCC中TMB相关分析,然而,近2年the Cancer Genome Atlas(TCGA)数据库更新后鲜有相关研究报道.
本研究旨在基于(TCGA)数据库探索HCC中肿瘤突变概况,然后通过基因差异分析及预后分析筛选出TMB相关的预后基因,并基于筛选的预后基因构建HCC预后预测模型.
1 材料与方法
1.1 数据来源
从TCGA数据库(http:www.ncbi.nlm.nih. gov/geo)下载与HCC相关的基因组和临床病理数据,基因组数据格式为FPKM.由于数据丢失,部分样本被删除,最终选择357个肿瘤样本进行后续分析.同样,从TCGA数据库中获取HCC体细胞突变数据,并使用R软件中的“maftool”包进行分析[11].
1.2 TMB计算和分组
运用Perl脚本计算TMB.并通过X-tile结合患者总体生存率(overall survival,OS)找到TMB的最佳截断值,然后依据该值将患者分为TMB-H组和TMB-L组.
1.3 获取差异基因
使用R包“limma”处理数据,筛选出与TMB相关的差异表达基因(differentially expressed genes,DEGs).采用|log 2 FC|>1,false discovery rate(FDR)<0.05筛选出所有差异基因,并使用“pheatmap”包对差异基因进行分层聚类.
运用R包“org.Hs.eg.db”进行Gene Ontology(GO)富集分析和Kyoto Encyclopedia of Genes and Genomes(KEGG)通路分析,“clusterProfiler”和“ggplot2”包用于注释和绘图[12].采用P<0.05筛选出潜在通路.
1.4 TMB预后指数的构建
使用Gene Expression Profiling Interactive Analysis(GEPIA)数据库(http://gepia.cancer-pku.cn/)[13]分析差异基因的OS率.然后根据logrankP<0.05筛选出关键基因.然后根据风险评分(risk score,RS)将所有患者分为高危组和低危组.采用K-M曲线表示RS水平与OS之间的关系.最后,绘制受试者生存工作特征曲线(receiver operating characteristic curve,ROC),计算曲线下面积(caculate the area under the curve,AUC),以评估预后模型的价值.
1.5 统计分析
使用R Studio(https://www.rstudio.com)进行统计分析[14].OS采用K-M和log-rank检验方法计算.2组连续变量比较采用t检验或单因素方差分析.P值<0.05,表示差异有统计学意义.
2 结果
2.1 TMB在HCC中的研究概况
首先,通过评估每个HCC样本的突变情况发现:单核苷酸多态性(Single nucleotide polymorphism,SNP)、错义突变和C>T突变是HCC中最常见的变异类型.其中,C>T变异最高,达 15 420.HCC中突变前10位的基因为:TP53、TTN、CTNNB1、MUC16、PCLO和ALB、RYR2、ABCA13、MUC4频率均高于10(P<0.001)(图1).
2.2 突变基因的瀑布效应和相互关系
图2(a)描绘了HCC中前30个突变基因的瀑布图.我们进一步分析前20个突变基因表达相关度,结果发现:CTNNB1与TP53、AX1N1表达负相关(P<0.05),CTNNB1与SPTA1、OBSCN;MUC16与SPTA1、ABCA13、RYR2;PCLO与CACNA1E、HMCN1;RYR2与XIRP2;APOB与LRP1B;FLG与CSMD3、OBSCN;LRP1B与CACNA1E;HMCN1与SPTA1;TTN与LRP1B表达正相关(P<0.05)(图2(b)).
2.3 TMB与临床相关性
利用X-tile确定TMB=4.61为最佳截止值,并据此将357个样本分为TMB-H组和TMB-L组.TMB-H组和TMB-L组的平均值分别为8.19和2.79(图3(a)).生存分析结果显示TMB与HCC预后显著负相关(P<0.05).TMB高的患者预后较差[15](P<0.05)(图3(b)).图3(c)~(e)反映了TMB与临床病理特征的关系:在HCC患者中TMB与N分期(P<0.05)、年龄(P<0.05)、性别(P<0.05)相关.总的来说,老年(>65岁)无淋巴转移的男性TMB较高,但TMB水平与T/M分期、临床分期和分级无明显相关性(图3(f)~(i)).

(a)变异的分类 (b)变异类型 (c)单核苷酸多态性分类 (d)突变前10位的基因

(a)HCC中前30个突变基因的瀑布图
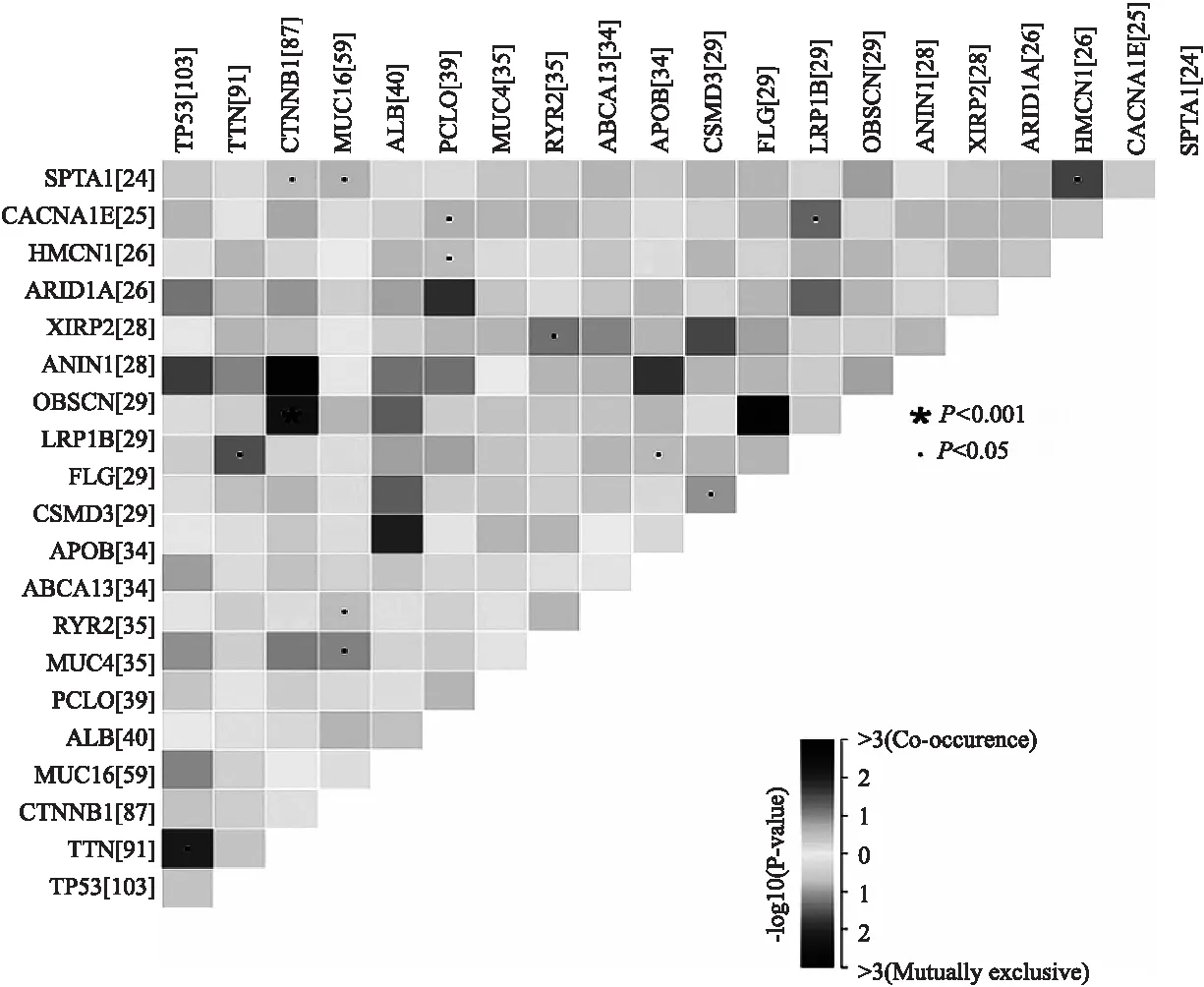
(b)HCC中前20个突变基因的相互关系

(a) TMB在各组间的分布 (b)TMB与HCC预后相关性 (c)TMB与年龄的关系

(d)TMB与性别的关系 (e)TMB与N期的关系 (f)TMB与T期的关系

(g)TMB与M期的关系 (h) TMB与临床分期的关系 (i) TMB与临床分级的关系
2.4 差异基因的富集分析
首先通过基因差异分析,筛选出39个与TMB相关的DEGs.图4(a)为DEGs的聚类热图.我们进一步通过GO功能富集分析研究DEGs相关的主要生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞成分(cellular component,CC) (图4(b)).KEGG通路分析显示,DEGs主要富集于细胞外基质组织、细胞外结构组织、硫化合物生物合成过程和硫化合物代谢过程(图4(c)).Gene set enrichment analysis(GSEA)分析结果显示,TMB-H组富集在RNA代谢过程,TMB-L组富集在其他途径包括调控超分子纤维组织、调控细胞器组织、正调控细胞器组织、肌动蛋白丝组织、调控细胞骨架组织、肌动蛋白聚合或解聚、调控肌动蛋白丝基过程、调控肌动蛋白丝组织(图4(d)).
2.5 COX回归分析
基于生存分析,可进一步发现:SFRP4、IL7R、FBLN2、COLEC10和CHGA的表达可能是影响HCC患者预后的独立因素(图5).由此,可利用COX回归分析建立预后预测模型,并利用ROC曲线验证模型的准确性.通过R包“merge”下载了357例HCC病例的转录组数据.根据多元COX回归模型,计算TMBPI为:
PI=(0.088 945 38×SFRP4-0.009 912 19×COLEC10-0.000 690 51×CHGA-0.024 612 34×FBLN2-0.165 479 22×IL7R).
每个个体的RS通过TMBPI得到,然后可根据风险评分的中位数将样本分为高风险组和低风险组(图6(a)).该模型1,3,5年生存率的AUC分别为0.64、0.67、0.59(图6(b)).结果显示高危组患者预后较差(P<0.001)(图6(c)).
(a)DEGs的聚类热图

(b)DEGs的GO功能富集分析 (c)DEGs的KEGG通路分析
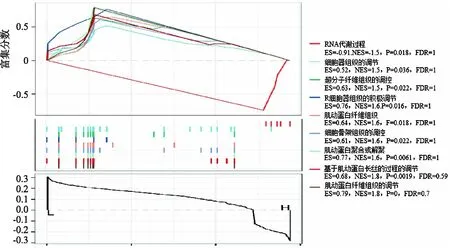
(d)TMB组间的GSEA分析

(a)SFRP4的表达与HCC患者预后相关 (b) IL7R的表达与HCC患者预后相关 (c) FBLN2的表达与HCC患者预后相关
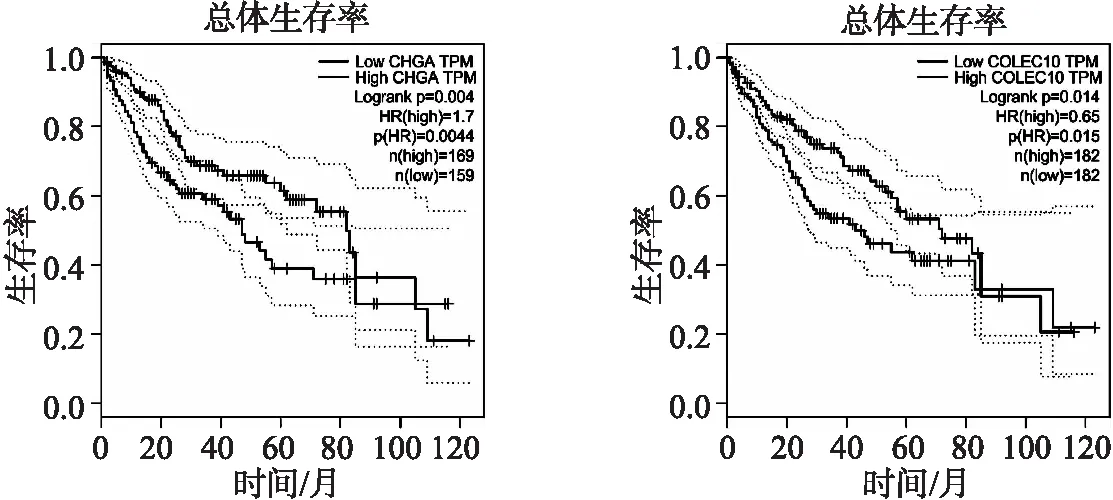
(d)CHGA的表达与HCC患者预后相关 (e) COLEC10的表达与HCC患者预后相关
3 讨论与结论
HCC侵袭性强,且具有高度异质性.多项研究[16-18]表明肝癌细胞内信号通路与正常肝细胞迥异.例如,PI3K/AKT和IKK/NF-κB通路在HCC中被激活,从而促进细胞增殖并诱导上皮-间质转化[19,20].此外,免疫系统在肿瘤的发展过程中起着至关重要的作用.Marina等[21]观察到MYC/CTNNB1通路的激活促进了免疫逃避和肝癌药物耐药性.TMB作为免疫系统识别和攻击肝癌细胞的关键因素,在很大程度上影响患者的预后.此外,在各种癌症中可观察到TMB与客观缓解率显著相关[22].在本研究中,我们发现错义突变是HCC中最常见的类型.研究表明TP53的错义突变可将HCC分化为不同的亚型,并可能促进疾病的进展[23].在HCC中SNP变异占绝大多数,在我们的研究中,C>T变异数量达到 15 420,这与HCC的发生密切相关[24,25].
功能分析结果表明,DEGs主要与细胞外基质组织和硫化合物代谢过程有关.细胞外基质是HCC免疫微环境的组成部分,靶向给药已取得一定成效[26].硫化合物代谢可能与HCC中的自噬密切相关[27].此外,我们发现RNA代谢过程的活性与TMB之间存在明显的负相关.越来越多的证据表明,不同的非编码RNA(non-coding RNAs,ncRNAs)参与多种肝脏疾病(包括乙肝、丙肝和非酒精性脂肪肝病)代谢状态调控,并最终导致HCC[28-30].这可能是TMB-H组总体预后不佳的最主要原因之一.
SFRP4、IL7R、FBLN2、COLEC10和CHGA在HCC发生发展中发挥重要作用.SFRP4位于染色体7p14.1上,含有一个富含半胱氨酸的结构域.该结构域可通过与Wnt直接结合来调节Wnt信号通路,从而形成沉默复合体并抑制HCC[31].IL-7R在T细胞分化和淋巴细胞发育中能发挥作用[32].IL-7R上调可激活细胞内通路,诱导相关分子表达,促进肝癌细胞增殖和迁移[33].COLEC10编码肝脏胶原凝集素1,是C凝集素家族的一员[34].研究表明[35],COLEC10受miR-452-5p的调控,促进肝癌细胞的增殖、侵袭和迁移.CHGA(或CGA)在HCC样本中高度表达,既往研究[36]表明它可以作为HCC的辅助诊断分子.本研究显示FBLN2高表达组与低表达组的预后差异有统计学意义.然而,FBLN2在肝癌中的作用及其应用价值尚未见报道,这可能是一个值得探索的靶点.
基于此,本文构建了多元COX回归模型,实现了对患者个体生存概率的预测和分析.在本研究中,该模型1、3、5年生存率的AUC分别为0.64、0.67、0.59,具有一定的准确度.该模型将为探索HCC新的预后因素提供了新的思路.此外,该模型无须识别患者的体细胞突变,而是通过直接检测TMB相关的5个基因,这使得基于关键基因的靶向测序技术更加常规.基于5个基因的预后预测模型可有效评估患者预后,这可能有助于指导肝癌患者的临床治疗.在常规临床实践中,临床医师多通过病理分期决定患者治疗手段.但HCC病理活检损伤大,多数患者依赖术前影像学(如CT、MRI)或常规生化指标(如AFP,CEA,CA199)等评估病情.本研究创新性地将TMB、DEGs与HCC临床数据相结合,通过COX回归模型预测患者预后,其可操作性强,侵入性更小.在精准医疗时代,利用分子分析结合病理分期的预后预测将比传统方法更准确.
该模型具有对HCC患者的实质性预测能力和价值,然而其局限性也应当被意识到.首先,目前研究缺乏患者的免疫治疗信息,这限制了我们对TMB介导的HCC免疫微环境变化的研究.其次,由于TCGA项目中只有一部分样本具有临床病理和TMB数据可用于分析,目前的样本量存在限制.最后,由于缺乏肝癌患者的全外显子测序信息,我们没有通过本中心临床数据来验证结论.因此,预测模型的有效性值得在未来使用独立队列进行更多的外部验证.
综上,本研究建立了一个新的基于5个基因的HCC患者预后预测模型.该模型可能是HCC预后风险分层的有效工具,并为肝癌的临床诊断结合病理和分子分析提供了新的思路.

