山楂果实提取物抗氧化能力
2023-01-12孙小晶李丹丹李莹修建华王金华
孙小晶,李丹丹 *,李莹,修建华,王金华
1.河北科技大学食品与生物学院(石家庄 050000);2.河北省山楂加工技术创新中心(承德 060000)
山楂是一种药食同源食品,可以预防结肠炎[1],也有保护心脏、作为抗氧化剂、抗炎和抗低血压作用[2],被认为有助于心血管系统的恢复[3]。因含有大量天然的具有治疗特性的生物活性化合物,山楂在内的药草是全球市场药物的丰富来源[4]。山楂中黄酮类化合物包括黄酮及其黄酮醇类[5],以及二氢黄酮和二氢黄酮醇类[6],这些物质是以芹菜素和木犀草素为基本单位构成山楂的基本功能成分。山楂中的多糖可用于调节人体肠道治疗疾病[7]。多糖研究表明,它是具有降脂、抗氧化、抗肿瘤和抗炎特性的活性成分[8]。维生素C又称抗坏血酸,是一种水溶性有机化合物,虽然没有游离羟基,但是其在碱性环境下很容易被氧化。人体中所需的维生素C大多数以水果和蔬菜提供,因此测定山楂中维生素C含量是营养分析的重要内容。关于山楂防治肿瘤、代用品,以及炮制、不良反应方面的研究已取得一定进展,尤其是山楂用于防老抗衰、防治肿瘤的研究方面。
试验采用不同提取方法提取山楂功能性成分,分别用DPPH法、羟自由基清除法、ABTS自由基清除法测定不同提取物的抗氧化能力,并对它们的清除自由基能力进行比较,以此评价其抗氧化能力,对于寻找新型高效的抗氧化剂及进一步开发利用山楂资源有一定意义。
1 材料与方法
1.1 材料与试剂
山楂(产自河北省兴隆县,铁金星品种,选择大小均匀、成熟度一致、无机械损伤、无病虫害的大果鲜果果实)。
偏磷酸[阿拉丁试剂(上海)有限公司];高岭土(天津市永大化学试剂开发中心);硫酸铵(天津市化学试剂一厂);交联葡聚糖凝胶(Sephadex G-25)、交联葡聚糖凝胶(Sephadex G-100)、1,1-二苯基-2-三硝基苯肼(DPPH),均来自上海宝曼生物科技有限公司;磷酸、浓硫酸、苯酚、硝酸铝(天津市永大化学试剂有限公司);乙二胺四乙酸(EDTA)、葡萄糖,均来自天津市百世化工有限公司;亚硝酸钠、抗坏血酸(天津市大茂化学试剂厂);氢氧化钠(廊坊市金海化工有限公司);无水乙醇(天津市富宇精细化工有限公司)。
1.2 仪器与设备
101-OAB型电热鼓风干燥箱、DK-98-1型电热恒温水浴锅(天津市泰斯特仪器有限公司);JYL-350料理机(山东九阳小家电有限公司);Adventurer分析电子天平(美国奥豪斯仪器有限公司);KQ5200DE型数控超声波清洗器(昆山市超声仪器);TGL-16G高速离心机(上海安亭科学仪器厂)。
1.3 方法
1.3.1 原料预处理方法
鲜山楂挑选→洗净→去核→切片→烘干(50 ℃,16 h)→粉碎→过筛(0.125 mm孔径,即120目)→山楂粉(装密封袋备用)
1.3.2 山楂中主要功能性成分的提取
1.3.2.1 黄酮类化合物的提取
黄酮样品的提取参考冯靖等[9]对黄酮的提取方法。
1.3.2.2 多糖的提取
多糖样品的提取用NY/T 1676—2008《食用菌中粗多糖含量的测定》[10]的方法。
1.3.2.3 维生素C的提取维生素C的提取采用GB 5009.86—2016《食品中抗坏血酸的测定》[11]中的方法。
1.3.3 山楂提取物含量测定
1.3.3.1 黄酮类化合物含量测定
黄酮含量测定采用NaNO2-Al(NO3)3-NaOH比色法[12]。以吸光度为纵坐标,以芦丁标品质量浓度为横坐标,绘制标准曲线,得标准曲线方程y=7.107 1x+0.044(R2=0.999 7)。
由山楂制备出的黄酮样液取出2 mL,置于25 mL的容量瓶中,其余步骤同标准曲线制备,测定黄酮样品吸光度。黄酮含量按式(1)计算。
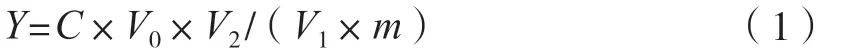
式中:Y为样品待测液中黄酮含量,mg/g;C为从标准曲线上查得被测液中黄酮的质量浓度,mg/mL;V0为测量时定容体积,mL;V1为检测时所取提取液体积,mL;V2为超声提取后样品定容体积,mL;m为提取黄酮时称量山楂样品质量,g。
1.3.3.2 多糖含量测定
多糖含量测定采用苯酚-硫酸法[13]。以葡萄糖质量浓度为横坐标,吸光度为纵坐标,绘出标准曲线,得标准曲线方程y=6.445 2x+0.150 6(R2=0.999 2)。
适当稀释样品,使吸光度在0.2~0.8之间。吸取1.00 mL稀释后的样品溶液于20 mL试管中,样品加量同上述标准曲线制备,测定多糖样品吸光度。多糖含量按式(2)计算。
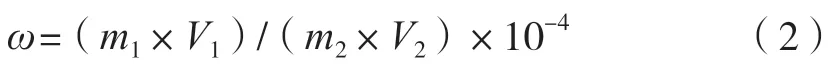
式中:ω为多糖含量,g/100 g;m1为葡萄糖标准曲线上查得的样品稀释液中含糖质量,μg;V1为样品定容体积,mL;m2为样品质量,g;V2为测吸光度时样品稀释液体积,mL。
1.3.3.3 维生素C含量测定
维生素C含量测定采用徐朝阳[14]的2,6-二氯靛酚滴定法。
2,6-二氯靛酚溶液标定步骤:用移液管精确移取1 mL 1 mg/mL抗坏血酸标准溶液,置入50 mL锥形瓶中,再加入10 mL 20 mg/mL偏磷酸溶液,摇匀后用2,6-二氯靛酚溶液滴定,直至滴入最后一滴液体时,锥形瓶内液体刚好出现粉红色并保持15 s不褪色。同时,另取10 mL偏磷酸溶液做空白试验,按式(3)计算滴定度。

式中:T为2,6-二氯靛酚溶液的滴定度,mg/mL;C为抗坏血酸标准溶液的质量浓度,mg/mL;V为测滴定度所吸取抗坏血酸标准溶液体积,mL;V1为滴定抗坏血酸标准溶液所消耗的2,6-二氯靛酚溶液体积,mL;V0为滴定空白所消耗2,6-二氯靛酚溶液体积,mL。
精确移取10 mL样品待测液于锥形瓶中,用标定过后的2,6-二氯靛酚溶液进行滴定,反应现象同滴定度测定试验,同时做空白试验。维生素C含量按式(4)计算。

式中:X为样品待测液中抗坏血酸含量,mg/100 g;V为滴定待测液所需2,6-二氯靛酚溶液体积,mL;V0为滴定空白所需2,6-二氯靛酚溶液体积,mL;T为2,6-二氯靛酚溶液的滴定度,mg/mL;A为稀释倍数;m为试样质量,g。
2 山楂各成分的抗氧化能力比较
2.1 DPPH自由基清除能力
使用DPPH方法对提取物的抗氧化活性进行体外评估[15]。测定步骤[16]:制得1.5×10-4mol/L的DPPH溶液,取2 mL该溶液,加入2 mL用无水乙醇溶解的试样,用涡旋振荡器振摇混合均匀,在25 ℃下避光放置,30 min后照紫外分光光度计,于517 nm测定吸光度,每个样品测定3次。DPPH自由基清除率按式(5)计算。

式中:A1为DPPH溶液和试样的吸光度;A2为乙醇溶解的试样溶液的吸光度;A0为DPPH无水乙醇溶液的吸光度。
2.2 羟自由基清除能力
样品均用95%乙醇溶液配制成质量浓度为0.11 g/mL溶液,向4 mL样品溶液中加入8.8 mmol/L H2O2溶液、9 mmol/L FeSO4溶液和9 mmol/L水杨酸溶液各0.5 mL,混匀,在37 ℃水浴加热30 min,在510 nm波长处测定样品吸光度(A1),将体系中的样品溶液改为加入4 mL蒸馏水,测得空白对照吸光度(A0),将加入0.5 mL 8.8 mmol/L H2O2溶液代替为0.5 mL蒸馏水,测得样品本底吸光度(A2),其中A1和A2每个质量样品浓度做3个平行,同按式(5)计算羟自由基清除率。
2.3 ABTS清除能力[17]
将过硫酸钾储备液(2.45 mmol/L)与ABTS储备液(7 mmol/L)按体积比1∶1制备ABTS+自由基储备溶液,并在黑暗中室温保持16 h。ABTS+自由基储备溶液用10 mmol/L磷酸盐缓冲盐水(pH 7.4)稀释,在734 nm处的吸光度为0.700±0.020。将样品与2.5 mL ABTS+自由基溶液混合并在室温下反应30 min,在734 nm处测定吸光度。同按式(5)计算ABTS清除率。
2.4 数据处理
所有试验均重复3次。试验结果表示为“平均值±标准偏差”,使用Origin 2018软件对数据进行统计分析并绘制图表,采用IBM SPSS Statistics 25数据分析软件对变化进行显著性分析,并进行Duncan’s差异显著性分析,P<0.05表示差异显著。
3 结果与分析
3.1 山楂中主要功能性成分含量
山楂中黄酮、多糖、维生素C含量见表1,黄酮、多糖、维生素C的含量有明显差异。

表1 山楂中主要功能性成分含量
3.2 山楂各提取物抗氧化能力的研究
3.2.1 DPPH自由基清除能力
山楂不同提取物清除DPPH的能力如图1所示。随着加样体积不断增加,3种提取物清除DPPH自由基能力均呈现上升趋势,不同样品对DPPH自由基清除率随体积升高而逐渐增强,在相同体积下,维生素C清除DPPH的能力最强。这是由于抗氧化剂的加入,配对了DPPH含有的孤对电子,DPPH溶液就由深紫红色自由基形式还原成黄色的非自由基形式,褪色程度可反映待测物质的抗氧化能力大小。在1.0 mL时,对DPPH自由基清除率为90.3%,高于其他2个样品。通过方差分析,P<0.05,有显著差异。
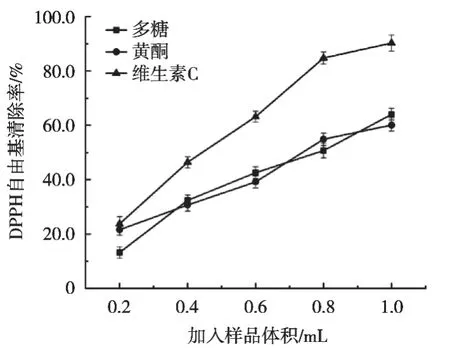
图1 山楂不同提取物对DPPH自由基的清除能力
山楂不同提取物对DPPH的IC50如表2所示。在清除率均为50%的情况下,维生素C浓度最小,多糖浓度最大。由此可得出,相比较山楂的其他提取物,维生素C清除DPPH自由基的能力最强,多糖最弱。赵二劳等[18]研究山楂提取物抗氧化能力,其研究结果:山楂提取物的抗氧化能力弱于维生素C,报道中山楂黄酮提取物清除 DPPH自由基的能力与试验结果相同,这可能与样品及研究方法不同有关。张全才等[19]研究山楂多糖的抗氧化活性研究,研究结果是:从整体来看维生素C的DPPH清除能力要强于山楂多糖,报道中山楂多糖清除DPPH自由基的能力与试验结果相同。
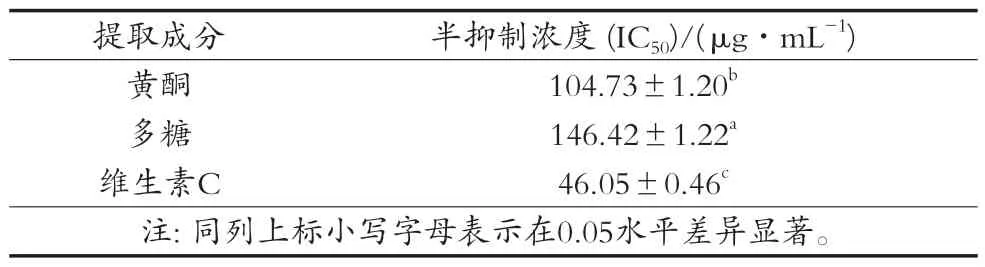
表2 不同提取成分对DPPH自由基的IC50
3.2.2 羟自由基清除能力
山楂不同提取物清除羟自由基的能力如图2所示。随着体积不断增加,3种提取物清除羟自由基的能力都呈现上升趋势,不同样品对羟基自由基的清除率均随体积升高而逐渐增强。且在相同体积下,维生素C清除羟自由基的能力最强。这是由于过氧化氢和亚铁离子反应生成·OH,水杨酸再与其反应生成能在510 nm处有最大吸收的二羟基苯甲酸,而抗氧化剂能够阻碍其生成,则反应体系在相同波长下的吸光度就会相应降低。在1.0 mL时,对羟基自由基的清除率为82.2%,高于其他2个样品,与维生素C对羟基自由基的清除率最接近。通过方差分析,P<0.05,有显著差异。赵岩岩等[19]研究结果是:多糖清除羟自由基的能力呈现逐渐升高的趋势,清除率最高可达81.6%,表明山楂多糖具有较好的清除羟基自由基的能力[20]。与试验结果不同,可能是试验方法与材料的不同。

图2 山楂不同提取物对羟自由基的清除能力
山楂不同提取物对羟自由基的IC50如表3所示。在清除率均为50%的情况下,维生素C浓度最小,多糖浓度最大。由此可得出,相比较山楂的其他提取物,维生素C清除羟自由基的能力最强,多糖最弱。

表3 不同提取成分对羟自由基的IC50
3.2.3 ABTS自由基清除能力
山楂不同提取物清除ABTS自由基的能力如图3所示。不同样品对DPPH自由基的清除率均随体积升高而逐渐增强。可以看出,随着加样体积不断增加,3种提取物清除自由基的能力都呈现上升趋势,且在相同体积下,维生素C的清除能力最强。这种评价抗氧化能力大小的原理是:ABTS易溶于水,是一种显色剂,经氧化反应生成阳离子自由基,该自由基在734 nm处有最大吸收峰,若加入抗氧化物质两者就会发生反应,则反应体系在相同波长下的吸光度就会相应降低。在1.0 mL时,维生素C对ABTS自由基的清除率为82.2%。通过方差分析,P<0.05,有显著差异。

图3 山楂不同提取物对ABTS自由基的清除能力
山楂不同提取物对ABTS自由基的IC50如表4所示。在清除率均为50%的情况下,维生素C的浓度最小,多糖浓度最大。由此可得出,相比较山楂的其他提取物,维生素C清除ABTS自由基的能力最强,多糖最弱。郑朋朋等[21]研究山楂多糖的提取及其抗氧化性作用,整体来看,维生素C对ABTS自由基清除能力要强于山楂多糖,与试验结果相同。

表4 不同提取成分对ABTS自由基的IC50
4 结论
试验采用最优条件分别提取出山楂中的黄酮、多糖、维生素C,并通过试验测定各提取物含量,计算得出:铁金星山楂中含33.69 mg/g黄酮、3.84 g/100 g多糖、36.64 mg/100 g维生素C,其含量大小依次为多糖>黄酮>维生素C。
通过4种抗氧化能力测定方法,评价山楂4种成分的抗氧化活性得出:黄酮对自由基的清除率最高值分别为64%(DPPH自由基清除率),63.5%(羟自由基清除率)和66.2%(ABTS自由基清除率);多糖对自由基的清除率最高值分别为60.1%(DPPH自由基清除率),51.3%(羟自由基清除率)和51.1%(ABTS自由基清除率);维生素C对自由基的清除率最高值分别为90.3%(DPPH自由基清除率),82.2%(羟自由基清除率)和82.2%(ABTS自由基清除率)。DPPH自由基清除能力:维生素C>黄酮>多糖。羟自由基清除能力:维生素C>黄酮>多糖。ABTS自由基清除能力:维生素C>黄酮>多糖。从抗氧化试验的测定结果可以发现,样品黄酮含量高则抗氧化性也高,抗氧化性和黄酮含量具有正相关性。山楂中含量最多的多糖,在抗氧化能力方面却最弱,而含量较少的维生素C和黄酮抗氧化能力相对较强。以上说明维生素C含量少却抗氧化能力强,说明其自身抗氧化能力就很强,而多糖含量多抗氧化能力还弱,说明其自身抗氧化能力就很弱。
综上所述,山楂中黄酮和维生素C抗氧化能力较强,今后可作为一个很好的抗氧化来源进行应用。
