蛋清溶菌酶与卵黏蛋白的相互作用及其结构表征
2023-01-11刘丽莉张孟军程伟伟杨晓盼徐宝成肖枫
刘丽莉,张孟军,程伟伟,杨晓盼,徐宝成,肖枫
蛋清溶菌酶与卵黏蛋白的相互作用及其结构表征
刘丽莉1,2,3,4,张孟军1,2,3,4,程伟伟1,2,3,4,杨晓盼1,2,3,4,徐宝成1,2,3,4,肖枫1,2,3,4
(1.河南科技大学食品与生物工程学院,河南 洛阳 471023;2.食品加工与安全国家级教学示范中心,河南 洛阳 471023;3.食品原料河南省工程技术研究中心,河南 洛阳 471023;4.功能食品资源研究与利用河南省教育厅科技创新团队,河南 洛阳 471023)
将溶菌酶与卵黏蛋白相互作用,以溶菌酶与卵黏蛋白为对照,研究溶菌酶与卵黏蛋白在不同反应时间(10、20、30、40、50、60 min),温度(5、15、25、35、45 ℃),pH(7.0、7.5、8.0、8.5、9.0),质量比(0.50∶1.00、0.75∶1.00、1.00∶1.00、1.00∶0.75、1.00∶0.50)下相互作用的浊度、表观黏度的变化;通过SDS–PAGE凝胶电泳、傅里叶红外光谱、低场核磁共振技术、扫描电镜对复合物的类型、作用力及结构等进行表征。结果表明:在反应时间为40 min、反应温度为25 ℃、pH为8.5、溶菌酶与卵黏蛋白的质量比为0.75∶1.00时,溶菌酶与卵黏蛋白相互作用最强;相较于卵黏蛋白和溶菌酶,复合物中α–螺旋和β–转角占比增加,β–折叠和无规则卷曲占比减少;互作后其结合水含量增加,自由水含量有所降低,疏水性高于溶菌酶,而低于卵黏蛋白;卵黏蛋白与溶菌酶互作包括氢键和二硫键结合及存在静电相互作用、表面疏水作用等分子间作用力;互作后微观结构发生变化,呈现出絮状结构。表明蛋白质间相互作用会导致其结构和聚集状态发生较大变化,产生不溶性复合物,可能与蛋清浓蛋白的黏弹性有关。
蛋清;溶菌酶;卵黏蛋白;相互作用;浊度;表观黏度;结构
蛋清是一种以水作为分散介质,以蛋白质作为分散相的非牛顿假塑性流体[1],在贮藏过程中会发生蛋清稀化现象,有学者认为这些可能与蛋清蛋白之间的相互作用有关[2–3]。关于蛋清稀化的机制至今未研究清楚。在国内,研究[4–5]发现蛋清稀化现象与禽蛋的贮藏条件、贮藏时间等密切相关。在蛋清稀化过程中,蛋清蛋白发生了明显的变化。在贮藏过程中,卵白蛋白、卵转铁蛋白、卵黏蛋白、溶菌酶等物质的浓度变化可能与蛋清的液化有关,尤其以卵黏蛋白、卵白蛋白和溶菌酶的变化最明显。卵黏蛋白属于浓蛋白,是维持蛋清凝胶结构的关键物质,而浓蛋白随着贮藏时间的延长逐渐转化为低黏度状态,卵白蛋白由–构型向–构型转化,卵黏蛋白–溶菌酶复合体逐渐解离,直至完全水化[6]。说明蛋白质的构象变化对蛋清稀化起着重要的作用[7]。
近年来,蛋白之间的作用机制已被不断发掘,如蛋白质会在热处理及pH等条件发生变化下产生不同程度的聚集,引起蛋白质的结构或功能基团发生变化等。WU等[8]研究了在高压脉冲电场下蛋清蛋白溶液的稳定性,发现热处理后的蛋白复合物有可溶性和不溶性2种,主要靠二硫键的作用,蛋清溶液经高压脉冲电场处理后仅有不溶性复合物,pH会影响溶液中不溶性复合物的形成。CHANG等[9]研究发现,蛋白质溶液经酸或酸热处理后,更多的疏水性氨基酸和带电基团暴露在分子表面,但蛋白二级结构变化不大。汪吴晶等[10]探究了蛋清中主要蛋白质间的相互作用及其物理性质和结构变化,发现加热处理后卵白蛋白、卵转铁蛋白、溶菌酶及卵黏蛋白间相互作用后的浊度及溶解度会发生明显变化,结构展开,疏水基团暴露。雷姝敏[11]研究发现,二硫键和巯基在乳液蛋白体系中发挥了重要作用,阻断巯基和二硫键形成会对肌原纤维蛋白、蛋清蛋白和大豆分离蛋白等3种蛋白乳化液产生影响,破坏蛋白质分子结构,使内部包埋的疏水基团暴露导致表面疏水性发生变化。这些对于蛋清蛋白相互作用的研究[12–13]大多侧重于乳蛋白、大豆蛋白与蛋清蛋白或蛋清的卵白蛋白、卵转铁蛋白及溶菌酶之间的相互作用,对于蛋清的溶菌酶与卵黏蛋白的相互作用研究较少。
为了解蛋清中的溶菌酶与卵黏蛋白的相互作用,采用浊度和表观黏度对蛋白质的物理性质进行分析,初步确定蛋白质发生相互作用的最佳条件;通过傅里叶中远红外光谱、低场核磁共振及扫描电镜等对溶菌酶与卵黏蛋白的相互作用的结构变化进行表征,通过SDS–PAGE凝胶电泳对蛋白质分子量进行表征,从而判断蛋白质相互作用对其结构的影响机理,以期为研究蛋清的劣变规律及控制鸡蛋品质变化提供依据。
1 材料与方法
1.1 材料与试剂
鸡蛋购自洛阳当地某超市;浓盐酸、乙酸、乙醇均为AR,购自洛阳昊华化学试剂有限公司;磷酸二氢钠、磷酸氢二钠、十二烷基硫酸钠均为AR,购自天津市德恩化学试剂有限公司。
1.2 仪器与设备
UH–5300型双光束紫外可见分光光度计和TM3030Plus型扫描电镜为日立产品;TDZ5–BP型高速冷冻离心机为长沙湘锐离心机有限公司产品;NMI20–015V–I型低场核磁共振成像分析仪为上海纽迈电子科技有限公司产品;ERTEX70型傅里叶变换中远红外光谱仪为BRUKER产品;Cary Eclipse型荧光分光光度计为安捷伦产品;DHR–2型流变仪为沃特斯产品。
1.3 方法
参照SHAN等[14]的方法,从鸡蛋中提取卵黏蛋白;参照周钦育等[15]的方法,从鸡蛋中提取溶菌酶。以磷酸缓冲液为溶剂,分别制备溶菌酶溶液和卵黏蛋白溶液,将适量的溶菌酶与卵黏蛋白溶液混合后振荡均匀,以互作时间(10、20、30、40、50、60 min),温度(5、15、25、35、45 ℃),pH(7.0、7.5、8.0、8.5、9.0),溶菌酶与卵黏蛋白的质量比(0.50∶1.00、0.75∶1.00、1.00∶1.00、1.00∶0.75、1.00∶0.50)为单因素,以浊度与表观黏度为测定指标,确定复合物制备的最佳工艺条件。参照JIANG等[16]的方法,测定溶菌酶与卵黏蛋白复合物浊度。参照常雪娇等[17]及GIRARD等[18]的方法并加以改进测定表观黏度,其中,静态流变剪切速率范围为0.01~1000/s。
将溶菌酶、卵黏蛋白及在最佳互作条件下互作后的溶液进行真空冷冻干燥制得溶菌酶、卵黏蛋白及复合物粉末,以备后续研究。将干燥后的粉末与溴化钾按照质量比为1∶100均匀混合,研细后置于压片机中于18 MPa下压片1 min,制成无裂纹的薄片,放置于傅里叶红外光谱仪样品槽中进行扫描,测定其结构变化,其中,分辨率为4/cm,扫描范围为4000~400/cm。称取30 mg冻干后的样品,置于核磁观察瓶中扫描,进行低场核磁共振分析,检测蛋白质凝胶中水的流动性和分布变化,其中,重复时间(TR)为2000 ms,回波时间(TE)为0.3 ms,图谱中21(0.01~1.00 ms)的峰代表结合水,22(1~10 ms)的峰代表弱结合水,23(10~1000 ms)的峰代表自由水。采用荧光光谱法测定溶菌酶与卵黏蛋白相互作用的疏水性变化,其中,激发波长为280 nm,扫描范围为300~450 nm。参照林伟静[19]的方法并加以改进,样品分别用0.6 mol/L NaCl溶液(溶液A)、0.6 mol/L NaCl+2% SDS溶液(溶液B)、0.6 mol/L NaCl+2% SDS+8 mol/L尿素溶液(溶液C)、0.6 mol/L NaCl+2% SDS+8 mol/L尿素+2% 2–巯基乙醇溶液(溶液D)溶解。溶液A可破坏静电相互作用;溶液B可破坏静电相互作用和疏水键;溶液C可破坏静电相互作用、疏水键和氢键;溶液D可破坏静电相互作用、氢键和二硫键。每种溶液与复合物充分混合后离心,取上清液进行还原态SDS–PAGE凝胶电泳分析相互作用后蛋白组分的变化,测定复合物的互作类型与作用力,其中,样品质量浓度为4 mg/mL,采用12%的分离胶及5%的浓缩胶,上样量为20 μL。参照陈珂等[20]的方法,通过扫描电镜观察卵黏蛋白、溶菌酶及复合物的微观结构。
1.4 数据处理
每组试验均重复3次。采用Origin 8.5及DPS 7.05对试验数据进行绘图与显著性分析。
2 结果与分析
2.1 溶菌酶与卵黏蛋白互作的浊度变化
溶菌酶与卵黏蛋白在不同条件下互作后产生肉眼可见的不溶性复合物,其浊度变化如图1所示。随反应时间的增加,复合物浊度先增大,在20 min时最大,随后急剧减小,30 min时浊度显著(<0.05) 降低,达到最小值,之后又增大,40 min后呈减小的趋势。随反应温度的升高,复合物的浊度先下降;当反应温度高于15 ℃时,浊度先增大,高于35 ℃后又减小,但整体较为平缓,这可能是由于蛋清发生了热聚集现象,蛋白发生互作后分子结构改变,分子之间趋于聚集,使蛋白质的颗粒变大,导致浊度随温度升高而增大。pH对蛋白质的相互作用影响也较大,在pH为7.5时,浊度显著(<0.05)降低,当pH大于7.5时,浊度随pH的增大而增大,在pH为8.5时浊度最大,随后呈减小的趋势。复合物浊度随溶菌酶与卵黏蛋白配比的增大而变化的趋势与其随时间变化的趋势类似,溶菌酶与卵黏蛋白的配比为0.75∶1.00时,其相互作用后的浊度最大。

图上不同字母示处理间的差异有统计学意义(P<0.05)。
2.2 溶菌酶与卵黏蛋白互作的表观黏度变化
从图2可知,溶菌酶与卵黏蛋白的互作溶液表观黏度随剪切速率增加而降低,有明显的剪切稀释现象,说明溶菌酶与卵黏蛋白的互作溶液属于非牛顿流体;在溶菌酶与卵黏蛋白的反应时间为40 min、反应温度为25 ℃、pH为8.5、溶菌酶与卵黏蛋白的配比为0.75∶1.00时,其相互作用后的表观黏度最大,可能是蛋白质互作后的复合物颗粒较大,影响了溶液的表观黏度,这与浊度的变化基本一致;反应时间少于40 min时,随反应时间延长,溶液的黏度逐渐增大,超过40 min后,随反应时间延长,溶液的黏度逐渐降低,可能是蛋白质发生聚集作用后,溶液不稳定,导致表观黏度发生变化;反应温度低于25 ℃时,黏度随温度升高逐渐增大,而高于25 ℃后,黏度随温度升高呈现降低趋势;pH 8.5时表观黏度最大,说明pH 8.5时溶菌酶与卵黏蛋白互作较好,此时互作产物较为均衡稳定。

图2 溶菌酶与卵黏蛋白在不同条件下互作的表观黏度
2.3 溶菌酶与卵黏蛋白互作的结构变化
由图3可知,溶菌酶与卵黏蛋白互作后在红外图谱的4000~400/cm内结构变化明显;酰胺Ⅰ带、酰胺Ⅱ带和酰胺Ⅲ带具有明显的吸收峰变化,说明溶菌酶与卵黏蛋白互作后结构发生了变化;酰胺Ⅰ带在1600~1700/cm处能反映蛋白二级结构中氢键的多少,波峰越低,氢键越少,溶菌酶与卵黏蛋白互作后氢键数量减少。对1615~1637/cm的β–折叠区、1637~1645/cm的无规则卷曲区、1646~ 1664/cm的α–螺旋区、1664~1681/cm的β–转角进行分析后发现,两者相互作用后α–螺旋和β–转角占比增加,β–折叠占比减少,无规则卷曲程度降低(表1)。β–折叠可能转化为α–螺旋和β–转角,可能与互作发生时蛋白质分子内部发生凝聚力被破坏有关,说明分子间和分子内的氢键减弱,β–转角与蛋白质的热聚集有关,其数量增加可能与溶菌酶与卵黏蛋白相互作用后发生不溶性聚集现象有关。

图3 溶菌酶与卵黏蛋白及其互作后的中远红外图谱
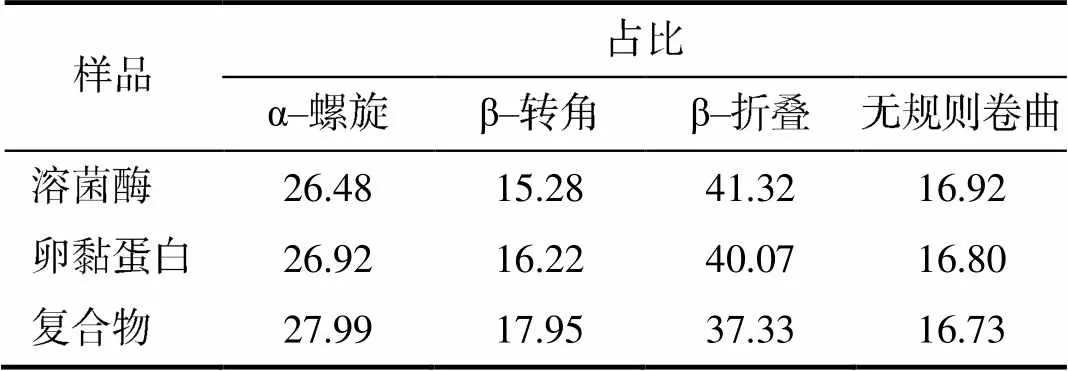
表1 溶菌酶与卵黏蛋白互作前后的酰胺Ⅰ带二级结构的组成比例
2.4 溶菌酶与卵黏蛋白互作的水分分布变化
由图4可知,溶菌酶与卵黏蛋白互作后,21弛豫时间发生明显左移,峰面积增加,说明互作后的结合水含量增加,可能与氢键数量变化有关,这与红外光谱分析结果一致;22和23峰值降低,面积减小,说明互作后的蛋白体系中弱结合水和自由水含量有所降低,可能与蛋白质互作后结构发生变化、疏水基团外露导致蛋白质的持水能力降低有关。
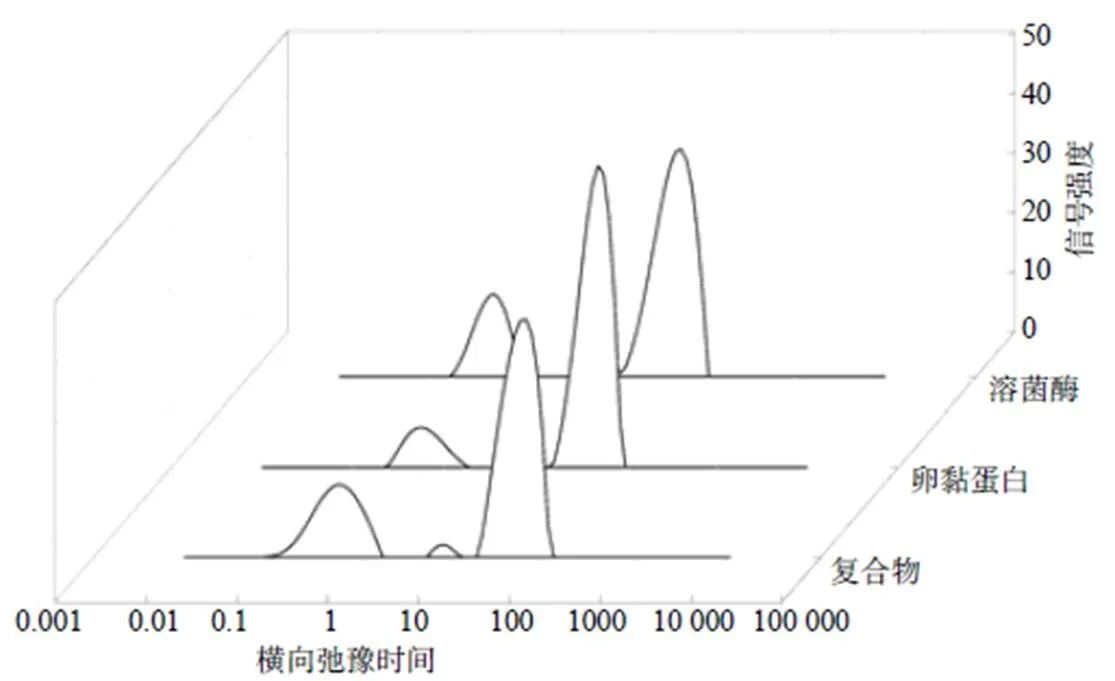
图4 溶菌酶与卵黏蛋白及其互作后的低场核磁图谱
2.5 溶菌酶与卵黏蛋白互作的疏水性变化
由图5可以看出,溶菌酶与卵黏蛋白相互作用后荧光强度发生明显的改变;复合物峰位及最大吸收峰值介于溶菌酶与卵黏蛋白之间,由此可看出溶菌酶与卵黏蛋白发生了相互作用,导致其结构发生改变,蛋白质的氨基酸残基的微环境发生了变化。这可能是由于其相互作用引起疏水基团暴露后又发生聚集作用引起的。
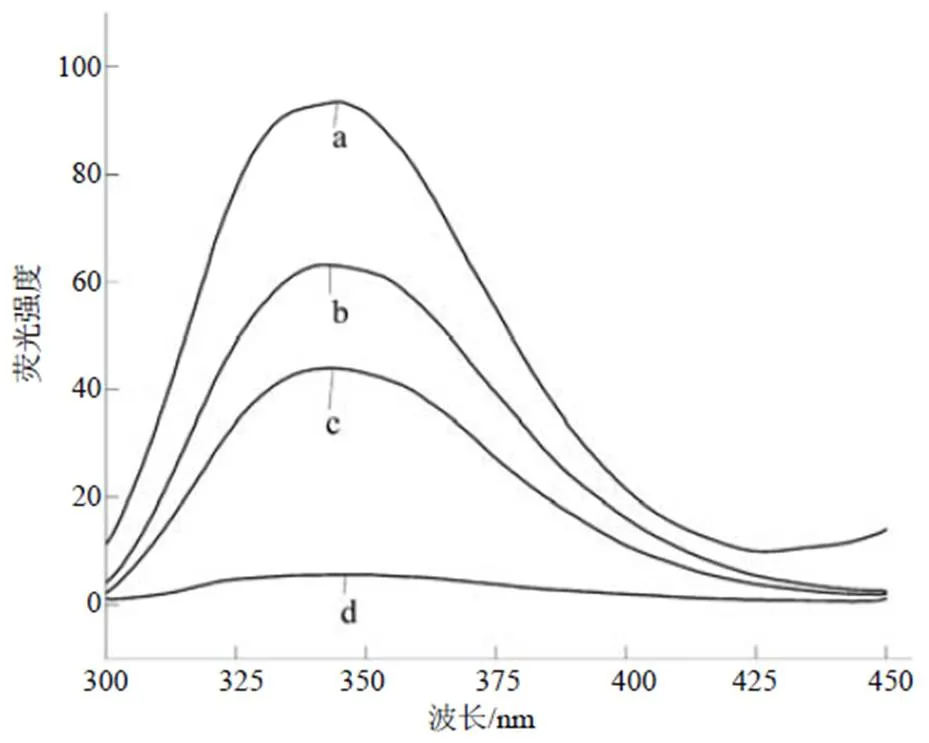
a 空白;b 溶菌酶;c 复合物;d 卵黏蛋白。
2.6 溶菌酶与卵黏蛋白的互作类型
从图6可知,不同溶液处理过的溶菌酶与卵黏蛋白互作复合物的相对分子质量发生了较大变化,处理后的溶液体系中均出现了大量溶菌酶及部分卵黏蛋白,说明两者互作主要为氢键和二硫键结合以及存在静电相互作用、表面疏水作用等分子间作用力。

泳道2~4分别示溶菌酶、卵黏蛋白、复合物的条带;5~8分别示溶液A、溶液B、溶液C、溶液D处理的复合物的条带。
2.7 溶菌酶与卵黏蛋白互作的外观结构变化
从图7可知,卵黏蛋白呈现出海绵状结构,含有大量孔隙;溶菌酶具有一定的球状结构;二者互作后其结构发生变化,呈现出一定的絮状结构。这可能是溶菌酶与卵黏蛋白互作后蛋白质的结构展开,然后通过氢键、二硫键等方式重新结合聚集,更利于蛋白质的疏水基团发生改变。

a 卵黏蛋白;b 溶菌酶;c 复合物。
3 结论与讨论
蛋白溶液的浊度变化在一定程度上可反映溶液中蛋白质颗粒的变化,浊度随蛋白颗粒和数量的增大而逐渐增大[21],与溶液中的蛋白聚集程度成正比,与溶解度成反比[22]。本研究中,在反应初期,天然蛋清蛋白较紧密的球状结构一定程度上阻碍了蛋清蛋白间的相互作用,而随着反应时间的变化,蛋白质因内部基团发生变化而逐渐发生互作,产物为肉眼可见的不溶性复合物,浊度增大;随着反应时间逐步进行,复合物沉降于底部,导致溶液中的浊度减小;在反应时间继续延长后,2种蛋白质之间发生互作,部分产物溶解后引起溶液的浊度逐渐增大。这与齐宝坤等[23]关于热处理对大豆11S球蛋白特性及结构的影响的研究结果相似。
反应溶液的浊度与蛋白的溶解度也有一定的关系,pH的变化可能会导致一些带电的功能基团发生沉降,从而影响浊度。本研究中,pH对蛋白质的相互作用影响也较大,在pH为7.5时,浊度显著(<0.05)降低;当pH大于7.5时,浊度随pH的增大而增大;在pH为8.5时浊度最大,随后呈减小的趋势。在pH更接近溶菌酶的pI时,非共价增强引起分子的随机聚集减少,溶菌酶溶解度降低,浊度升高。这与王晓翠等[24]的研究结果类似,溶菌酶与卵黏蛋白在pH为7时相互作用最大,随后其互作程度随pH升高而降低。溶菌酶比卵黏蛋白的溶解性更强,过量的卵黏蛋白能使二者更好的发生互作,溶菌酶与卵黏蛋白互作后的产物溶解性降低,溶液中不溶性颗粒增多,加剧了浊度的变化。
升温有助于蛋白质的溶解,使蛋白质间发生互作,聚集作用导致溶液变得黏稠;温度高出一定程度会导致蛋白质发生热聚集,使溶液中不溶性沉淀增多,导致溶液弹性恢复能力降低,从而引起黏度降低[25]。这与陈珂等[26]关于温度对蛋清蛋白流变特性影响的研究结果相似。溶菌酶溶解度高于卵黏蛋白,当溶液中的溶菌酶含量较高时,互作后产生聚集现象,但未有大量沉淀,其表观黏度相对较低;而当卵黏蛋白含量继续增大时,由于其分子量较大,导致蛋白颗粒增大,流动性降低,溶液表观黏度增大[27–28]。
荧光强度与表面疏水性呈正相关,复合物峰位及最大吸收峰值介于溶菌酶与卵黏蛋白之间,由此可知,互作后的疏水性高于溶菌酶,而低于卵黏蛋白,可能是在溶菌酶与卵黏蛋白互作过程中卵黏蛋白的内源性氨基酸随其结构展开而暴露在溶剂环境中,导致荧光强度发生改变;或溶菌酶与卵黏蛋白发生互作时,通过化学键相结合的方式使二者结构发生改变。王艺等[29]研究表明,不同条件处理蜂王浆蛋白,导致其内源荧光强度增加,可能与蛋白质的聚集有关。本研究结果与其相似。
综合试验结果可知,在反应时间为40 min、反应温度为25 ℃、pH为8.5、溶菌酶与卵黏蛋白的质量比为0.75∶1.00时,溶菌酶与卵黏蛋白互作程度较高;相较于卵黏蛋白与溶菌酶,复合物中二级结构的组成比例发生了变化,β–折叠可能转化为α–螺旋和β–转角,β–转角数量增加可能与溶菌酶与卵黏蛋白互作后发生聚集有关;聚集现象的产生导致互作后其疏水性发生改变,结合水含量增加,自由水含量降低;在溶菌酶与卵黏蛋白互作过程中有氢键和二硫键结合及存在静电互作、表面疏水作用等分子间作用力;两者互作后微观结构呈现出絮状结构。说明蛋白质间相互作用会导致其结构和聚集状态发生较大变化,产生不溶性复合物,可能与蛋清浓蛋白的黏弹性有关。
[1] 邹咪,郭全友,汤嘉慧,等.两种养殖模式下大黄鱼肌原纤维蛋白流变学特征研究[J].食品与发酵工业,2020,46(2):61–65.
[2] 王晶,马美湖.鸡蛋贮藏过程中蛋白质的变化机理及其研究方法[J].中国家禽,2013,35(3):46–48.
[3] DRABIK K,CHABROSZEWSKA P,VASIUKOV K,et al.Glycerin as a factor for moderating quality changes in table eggs during storage[J].Archives Animal Breeding,2018,61(3):285–292.
[4] NASRI H,VAN DEN BRAND H,NAJAR T,et al. Interactions between egg storage duration and breeder age on selected egg quality,hatching results,and chicken quality[J].Animals,2020,10(10):E1719.
[5] 李红,易建中,王家豪,等.鸡蛋储存时间对蛋清溶菌酶活性和蛋品质影响研究[J].上海畜牧兽医通讯,2016(3):2–4.
[6] 刘美玉,任发政,连昭慧,等.不同贮藏条件下鸡蛋清中主要蛋白质特性的变化[J].食品安全质量检测学报,2015,6(11):4468–4474.
[7] 王晓翠,武书庚,张海军,等.鸡蛋蛋清品质营养调控的研究进展[J].动物营养学报,2019,31(4):1491–1498.
[8] WU L,ZHAO W,YANG R J,et al.Aggregation of egg white proteins with pulsed electric fields and thermal processes[J].Journal of the Science of Food and Agricul- ture,2016,96(10):3334–3341.
[9] CHANG C H,NIU F G,SU Y J,et al.Characteristics and emulsifying properties of acid and acid-heat induced egg white protein[J].Food Hydrocolloids,2016,54:342–350.
[10] 汪吴晶,佟平,陈红兵,等.鸡蛋中卵白蛋白和溶菌酶相互作用对其结构和致敏性的影响[J].食品科学,2020,41(6):16–24.
[11] 雷姝敏.二硫键在不同蛋白乳化液和乳液蛋白复合凝胶中的作用研究[D].扬州:扬州大学,2017.
[12] 吴晓娟,王晓婵,张佳妮,等.pH值碱性偏移结合热处理对米糠蛋白结构和功能性质的影响[J].食品科学,2021,42(4):23–30.
[13] 杨晓盼,刘丽莉,黄正迪,等.常温贮藏期间鸡蛋清流变特性和蛋白质成分的变化[J].浙江农业学报,2021,33(3):526–533.
[14] SHAN Y Y,TANG D Y,WANG R,et al.Rheological and structural properties of ovomucin from chicken eggs with different interior quality[J].Food Hydrocolloids,2020,100:105393.
[15] 周钦育,黄燕燕,赵珊,等.蛋清溶菌酶的提取及其酶学性质探究[J].中国食品学报,2021,21(4):148–158.
[16] JIANG S S,DING J Z,ANDRADE J,et al.Modifying the physicochemical properties of pea protein by pH-shifting and ultrasound combined treatments[J]. Ultrasonics Sonochemistry,2017,38:835–842.
[17] 常雪娇,李坤,张英,等.晒干处理对花生过敏原蛋白潜在致敏性的影响[J].食品科学,2018,39(3):49–54.
[18] GIRARD A L,CASTELL-PEREZ M E,BEAN S R,et al.Effect of condensed tannin profile on wheat flour dough rheology[J].Journal of Agricultural and Food Chemistry,2016,64(39):7348–7356.
[19] 林伟静.糖基化改性对花生蛋白膜性能的影响及其作用机理研究[D].北京:中国农业科学院,2015.
[20] 陈珂,刘丽莉,孟圆圆,等.鸡蛋清蛋白喷雾干燥工艺优化及特性变化[J].食品与机械,2019,35(1):197–203.
[21] 刘丽莉,李玉,王焕,等.酶解–磷酸化协同改性对卵白蛋白特性与结构的影响[J].食品与机械,2017,33(6):17–20.
[22] 陈振家,王晓闻,荆旭,等.不同温度处理对红芸豆蛋白热稳定性及结构的影响[J].农业工程学报,2020,36(19):306–312.
[23] 齐宝坤,赵城彬,李杨,等.热处理对大豆11S球蛋白溶解性和二级结构的影响[J].食品科学,2018,39(22):39–44.
[24] 王晓翠,武书庚,岳洪源,等.卵黏蛋白:结构组成、理化性质、在浓蛋白液化中的作用及营养调控[J].动物营养学报,2015,27(2):327–333.
[25] LUAN D Y,WANG Z R,WANG H,et al.Determination method of the cavern boundary viscosity in a stirred tank with pseudoplastic fluid[J].AIChE Journal,2020,66(5):1–9.
[26] 陈珂,刘丽莉,郝威铭,等.喷雾干燥入口温度对蛋清蛋白流变和结构特性的影响[J].食品与发酵工业,2021,47(2):15–21.
[27] 曾琪,胡淼,王欢,等.pH值处理对黑豆分离蛋白结构、流变特性及乳化性能的影响[J].食品科学,2020,41(22):15–21.
[28] 孙红波,李杨,王立敏,等.大豆分离蛋白与花青素非共价及共价作用对蛋白构象变化的影响[J].食品科学,2018,39(12):33–39.
[29] 王艺,刘帆,臧梦璐,等.超声波处理对蜂王浆蛋白功能和结构的影响[J].食品工业科技,2019,40(10):50–56.
Interaction and structural characterization of lysozyme and ovomucin
LIU Lili1,2,3,4,ZHANG Mengjun1,2,3,4,CHENG Weiwei1,2,3,4,YANG Xiaopan1,2,3,4, XU Baocheng1,2,3,4,XIAO Feng1,2,3,4
(1.College of Food & Bioengineering, Henan University of Science and Technology, Luoyang, Henan 471023, China; 2.National Teaching Demonstration Center for Food Processing and Safety, Luoyang, Henan 471023, China; 3.Henan Engineering Technology Research Center for Food Raw Materials, Luoyang, Henan 471023, China; 4.Research and Utilization of Functional Food Resources Scientific and Technological Innovation Team of Henan Provincial Department of Education, Luoyang, Henan 471023, China)
This study aimed to investigate the interaction mechanism between lysozyme and ovomucin. With lysozyme and ovomucin as controls, the turbidity and apparent viscosity of the interaction between lysozyme and ovomucin were studied under six reaction time(10, 20, 30, 40, 50, 60 min), five temperatures(5, 15, 25, 35, 45 ℃), five pH(7.0, 7.5, 8.0, 8.5, 9.0), and five mixing ratios(0.50∶1.00, 0.75∶1.00, 1.00∶1.00, 1.00∶0.75, 1.00∶0.50). The acting force and structure of aggregates were characterized by SDS-PAGE gel electrophoresis, Fourier transform infrared spectroscopy, low-field nuclear magnetic resonance and scanning electron microscope. The results showed that the conditions of best interaction between lysozyme and ovomucin were incubation time of 40 min, reaction 25 ℃, pH of 8.5, with the ratio of 0.75∶1.00. Compared with ovomucin and lysozyme alone, the complex owned more α-helix and β-turn, and less β-pleated sheet and irregular coil. After interaction, the bound water content increased, and the free water decreased. The hydrophobicity of complex was higher than that of lysozyme, but lower than that of ovomucin. There were electrostatic interaction, hydrophobic interaction, hydrogen bond, disulfide bond and other intermolecular forces in the interaction between ovalbumin and lysozyme. After interaction, the microstructure changed and then flocculent structure was showed. It indicated that the protein-protein interactions would lead to great changes in their structure and aggregation state and produced insoluble complex, which might be related to the viscoelasticity of egg white protein.
egg white; lysozyme; ovomucin; interaction; turbidity; apparent viscosity; structure
TS253.1;S897.2
A
1007-1032(2022)06-0672-07
刘丽莉,张孟军,程伟伟,杨晓盼,徐宝成,肖枫.蛋清溶菌酶与卵黏蛋白的相互作用及其结构表征[J].湖南农业大学学报(自然科学版),2022,48(6):672–678.
LIU L L,ZHANG M J,CHENG W W,YANG X P,XU B C,XIAO F.Interaction and structural characterization of lysozyme and ovomucin[J].Journal of Hunan Agricultural University(Natural Sciences),2022,48(6):672–678.
http://xb.hunau.edu.cn

2021–06–02
2022–11–28
国家自然科学基金项目(U1704114);2021年洛阳市社会发展专项(2101021A)
刘丽莉(1974—),女,河南周口人,博士,教授,主要从事畜产品科学与食品生物技术研究,yangliuyilang@126.com
10.13331/j.cnki.jhau.2022.06.007
责任编辑:邹慧玲
英文编辑:柳正
