基于BOPPPS改进模型对“化学反应方向”的教学设计
2023-01-11李佳慧
李佳慧
(中国人民解放军陆军特种作战学院,广东广州 510030)
研究化学反应方向具有重要意义,可根据反应机理,改变反应温度、反应物的状态,从而使反应向我们需要的方向进行。例如,碳酸钙分解反应制得的氧化钙在化工生产中具有广泛应用,但是该反应常温下不自发,高温时才自发。学员通过本讲的学习不仅能明白为什么碳酸钙分解反应的条件是高温,还能计算出碳酸钙分解所需的最低温度,节约资源。再如,工业上用熔融氯化钾和钠单质混合制钾时,钾因为沸点低会变成气体跑出,此过程通过使反应的熵变大于零,从而使化学反应向希望的方向持续进行。
化学反应方向是热力学专题的第三次课,对判断反应发生的方向性问题具有重大意义,是学习热力学的重点。根据课程教学计划,本次课的教学目标如下:知识层面-能描述熵、吉布斯自由能的概念及其物理意义,能根据标准摩尔反应焓变、标准摩尔熵变、吉布斯-亥姆霍兹公式计算吉布斯自由能变;能力层面-能运用比较、归纳、概括等方法提升信息加工能力,能应用吉布斯自由能判据判断化学反应的方向;素质层面-在建立吉布斯自由能判据的过程中训练逻辑思维能力,体会事物的发展、变化常常受多种因素的制约,要全面分析问题。
教学对象分析:学员已在前一讲学习了化学反应中的能量关系,会用热力学数据计算标准摩尔反应焓变,通过类比标准摩尔反应焓变的计算能容易掌握用热力学数据计算标准摩尔熵变和标准摩尔吉布斯函数变的方法;学员有与反应自发性相关的生活经验,但是缺乏对经验的总结,在系统理解反应自发性、定量判断反应进行的方向存在困难;教学知识点和内容多,课堂上可自由调整的时间较少。
BOPPPS教学模型[1]包括6个教学环节:导入、学习目标、预评估、参与式学习、后评估和总结。考虑到BOPPPS教学模型的局限性,对其进行如下优化。
1)为更好的了解学员的知识能力基础,增加了预习导学环节;
2)为解决预评估和后评估可调整的教学时间短问题,将预评估调整到课前,后评估调整到课后;
3)为便于掌握课中学情,在参与式学习环节加入练习。
本文根据实际学情,结合BOPPPS改进模型[2]和实例教学,从学员已有知识及日常生活中的见闻出发,结合前一讲课后作业和本讲课前预评估反馈,建构化学反应方向的判据,学会运用比较、概括、归纳等方法对信息进行加工、构建新知识,系统理解化学反应方向。
1 预习
在上一讲课后布置明确的预习任务,使学员明白“学什么”,教员通过前测题了解学员相关知识的掌握情况,并通过反馈进行教学调整。
预习任务:预习《化学反应的方向》,找出熵、吉布斯自由能的定义;通过课本中吉布斯函数变的定义和例题,初步认识吉布斯自由能判据相关 内容。
2 导入
通过实例教学法和角色代入法[3],激发学员学习化学反应方向的兴趣和需要,明白“为什么学”。
导入:通过视频-俄乌冲突中克里米亚大桥被炸事件,感受弹药在军事中的重要性。介绍第一次世界大战期间,化学家发明了由空气、水和煤固氮并制取弹药的军事实例。引导学员代入角色,上级给你3种可能的固氮方案,请从热力学角度判断选择哪个反应最合适?
(1)N2(g)+O2(g)=2NO(g)
(2)N2(g)+2O2(g)=2NO2(g)
(3)N2(g)+3H2(g)=2NH3(g)
3 学习目标
从学员的角度出发,制定有层次的、精准可测的学习目标[4]。让学员初步建立学习预期,再次明确“学什么”,提升课堂质量。
强调学习的重难点,使学员心中有数。重点:理解熵、标准摩尔熵变与吉布斯自由能的概念。难点:应用吉布斯自由能判据判断化学反应进行的方向,应用吉布斯-亥姆霍兹公式计算任意温度下反应的吉布斯自由能变。
4 预评估
课前通过问卷星发布作业,了解学员“知晓什么”,教员再通过作业情况对课堂教学进行调节。前测题包含判断题(能否仅用焓变ΔH或熵变ΔS作为反应方向的判断依据)、选择题(吉布斯自由能的概念)、讨论题(如何判断反应的方向)。
5 参与式学习
此环节是本次课的核心部分,重点围绕“自发过程与熵”“吉布斯自由能”“化学反应的吉布斯自由能判据”“化学反应的非标准摩尔吉布斯函数变”这四个关键内容展开。此环节通过问题驱动,采用以学员为中心的问题导引式教学方法,在问题串的层递解决过程中由易到难建构主体内容,实现知识的融会贯通,训练逻辑思维能力。此外,为了方便掌握教学过程中学员的学习情况,增加了随堂练习。
5.1 自发反应进行的趋势
从焓和熵的角度,认识化学反应的“内因”,了解自发反应进行的趋势,自发过程与熵。
5.1.1 自发过程趋于从高能状态向低能状态转化
(1)结合真空时气体扩散的图示和生活中的常见现象(如水自高处流向低处、热从高温物体传给低温物体、不同溶液的相互混合),说明自发过程的定义并举例。
(2)学员通过例子归纳出自然界自发过程的特点:在没有外界能量的参与下,反应总是向放热(或焓减少)更多的方向自发进行。再次,自然引出汤姆森-贝赛洛判据(此处引入思政点:科研人员要坚持不懈地追求真理和坚定不移地坚持真理),并举例说明汤姆森-贝赛洛判据的局限性,如4℃时冰的自发融化过程吸热、氢氧化钡与氯化铵的自发反应过程吸热、碳酸铵分解反应向焓增加的方向自发进行。
(3)得出结论:仅用焓变ΔH不能作为反应方向的判断依据。
5.1.2 自发过程趋于从有序状态向无序状态转化
(1)结合自发过程物质无序程度的图示,介绍熵的起源历史和发展,学习熵的热力学定义,理解熵增原理。
(2)从熵的统计学定义,S=klnΩ(k为玻尔兹曼常数,Ω表示一个系统内微观粒子的微观状态总数),理解熵的物理意义,明白熵是热力学中描述系统混乱度的函数。在此基础上,通过例题讲解,框图归纳总结规律,体会熵的含义及熵值大小的比较方法。
(3)举出反例,发现并不是熵减的就是非自发反应,如氢气与氧气反应生成液态水。
(4)得出结论:仅用熵变ΔS不能作为反应方向的判断依据。
在理解自发过程和熵后,通过随堂测试,类比标准摩尔焓变ΔrHmθ的计算方法,用热力学数据计算标准摩尔熵变ΔrSmθ。最后组织学员讨论,比较、概括、归纳得出规律,体会熵的计算方法,并强调注意事项。
5.2 如何选择正确方法来判断化学反应进行的方向
吉布斯自由能:通过问题一的解决,学员已经明白孤立系统自发地向熵增加的方向进行。此外,通过上一讲“化学反应中的能量关系”的学习,知道在等温、等压条件下,系统自发地向系统内分子、原子的势能变化之和减少的方向进行。基于此,本次课从已有知识和生活经验出发,引导学员用孤立系统的推导方法和封闭系统推导方法来推导吉布斯函数(定义式ΔG=ΔH-TΔS)和吉布斯函数变判据[5]。
然后说明吉布斯判据与反应自发性的关系:ΔG<0为自发过程,ΔG=0为平衡态,ΔG>0为非自发过程。
通过合成氨这一典型实例进行巩固强化。在上级给的3种可能的固氮方案,通过化学反应的标准摩尔吉布斯函数变ΔrGmθ的计算,方案3:N2(g)+ 3H2(g)=2NH3(g)化学方程式中的ΔrGmθ=ΣvBΔfGmθ< 0,该反应更合适。
5.3 从热力力学角度分析以上三种固氮反应的条件(温度)
从复合判据的角度,预测在一定条件下某种物质可能发生的化学变化。
化学反应的吉布斯自由能判据:通过问题二的解决,学员已经知道吉布斯函数的定义式和吉布斯函数变判据。在此基础上,教员引导学员进行定性判断和定量计算,并用随堂练习进行巩固强化。
(1)定性判断:①熵增焓减,恒自发;②熵减焓增,恒不自发;③熵增焓增,高温自发,低温不自发;④熵减焓减,低温自发,高温不自发。
根据化学反应方向的复合判据ΔG=ΔH-TΔS中ΔH、ΔS与零的大小关系,定性判断化学反应能否自发进行及反应自发进行的条件。如图1所示,可用数轴的形式表示用自由能判断反应进行方向的规律,便于学员理解记忆温度对化学反应方向的影响。
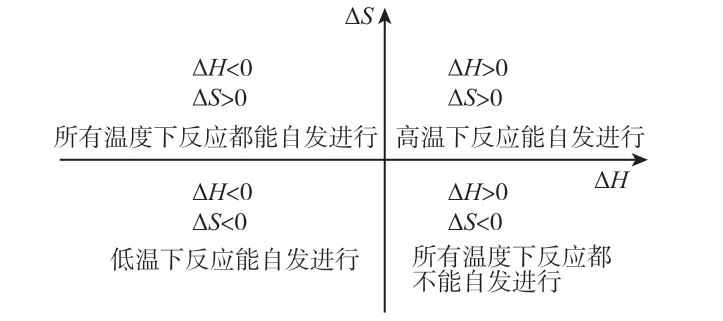
图1 自由能判断反应进行方向的规律
(2)定量计算:吉布斯-亥姆霍兹公式(Gibbs-Helmholtz equation)ΔrGmθ=ΔrHmθ-TΔrSmθ
定量计算标准摩尔吉布斯函数变可用公式①ΔrGmθ=ΣvBΔfGmθ或②ΔrGmθ=ΔrHmθ-TΔrSmθ。需注意的是:通过查课本后附表-某些物质的标准摩尔生成吉布斯函数(标准态压强Pθ=100kPa,25℃)可知ΔfGmθ,但该数据使用时对温度和压强有限制,因此公式①仅适用于100kPa、25℃时;因为ΔrGmθ、ΔrSmθ受温度影响小,公式 ΔrGmθ=ΔrHmθ(298.15K)-TΔrSmθ(298.15K)适用于任何温度,因此计算标准摩尔吉布斯函数变时优先选择公式②。
此外,不能直接用公式①计算所得ΔrGmθ与零的大小关系来判断化学反应的方向,因为该方法判断的只是标准大气压下、室温时化学反应的自发性。故我们常用ΔH、ΔS与零的大小关系来定性判断化学反应的自发性。
通过计算发现:①反应N2(g)+O2(g)=2NO(g),在标准状态下,温度高于7 287K时该反应可以自发进行。但由于温度过高,直接通过加热由N2和O2反应生成NO气体的反应实际操作性差。②反应 N2(g)+2O2(g)=2NO2(g) 的ΔrHmθ>0,ΔrSmθ<0,ΔrGmθ>0,该反应不能自发进行。③反应N2(g)+ 3H2(g)=2NH3(g)在标准态下,温度低于464.0K时该反应可自发进行。这一部分与导入环节相互呼应,解决问题。
5.4 非标准状态下,吉布斯函数变与标准摩尔吉布斯函数变的关系
通过问题三的解决,学员已经能定性判断化学反应的方向和定量计算标准摩尔吉布斯函数变。但是,一般反应不是在标准态下进行的,ΔG随系统中反应物和生成物的压强或浓度的变化而变化,由此问题过渡到非标准状态下的吉布斯函数变。再介绍由热力学推导出的范特霍夫等温方程(Van 't Hoff equation)。
范特霍夫等温方程:对于化学反应aA(aq)+dD(aq)=eE(aq)+fF(aq),在等温等压条件下,可用下式表示:
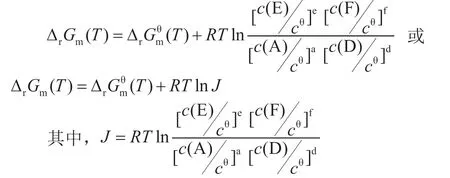
应用热力学数据和本次课学到的方法对工业上经常使用的金属材料是否能和大气中的氧气直接反应进行判断和估算。
6 总结
教员引导学员对本次课的要点进行回顾,并用思维导图进行归纳总结,再次明确学习目标。对学员的参与情况和学习情况进行总结与评价,肯定学员的学习成果,让学员感受到学习的成就感。通过本讲的学习,学员会计算标准状态下的吉布斯函数变,知道化学反应方向如何判断。提出新的问题:人们通过一氧化氮与一氧化碳反应生成氮气和二氧化碳来处理汽车尾气,通过本节课所学知识可知该反应可以自发进行,但汽车尾气中还是排放出大量的一氧化碳、一氧化氮,这与反应速率有关,让学员对下次课产生一定的学习预期。
7 后评估
由于在参与式环节中已通过部分测试题检验课中学习效果,并且每次课的课时是有限的,学员的消化吸收也需要一个过程,因此在课后设置后评估环节。后测题包含选择题(Smθ大小关系的比较、根据ΔrGmθ来判断标准状态下反应能否自发进行)、计算题(吉布斯函数变判据判断反应的自发性、反应温度的确定)、拓展阅读(熵的故事),最后布置下节课的预习任务。学员通过后测题复习理解所学内容,教员根据作业情况和预习反馈对下节课“化学反应速率”进行课堂教学设计。见图2。
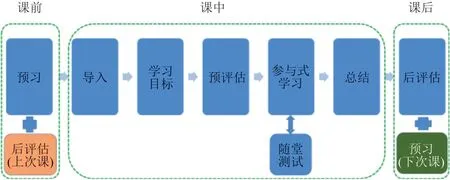
图2 基于BOPPPS改进模型的“化学反应方向”教学处理
以上是结合BOPPPS改进模型和实例教学的环节,7个环节环环相扣,层层递进,通过“评价-反馈-改进”建立闭环形成了持续改进机制,实现了教师对“课前-课中-课后”全过程的学情掌控。帮助学员运用对比、概括、归纳总结等方法对已知信息进行加工、建构化学反应方向的判据,提高应用吉布斯自由能判据判断化学反应方向的能力。
