UV和UV/过氧化物降解甲氧苄啶和恩诺沙星动力学
2023-01-10关英红陈丽君王盼盼杨松愉
关英红,陈丽君,王盼盼,杨松愉,陈 金
(1.东北农业大学 水利与土木工程学院,哈尔滨 150030;2.哈尔滨工业大学 环境学院,哈尔滨 150090)
磺胺类抗生素和喹诺酮类抗生素近年来被广泛使用,尤其是甲氧苄啶(TMP)和恩诺沙星(EFX),已被频繁报道检出于水体、土壤和农作物中[1]。在水环境中,即使抗生素的浓度很低,仍然可能会破坏本土微生物群体,促进耐药菌或病原体的生长,甚至可能导致人类畸形、诱发癌症等恶性影响发生[2-4]。生物法[5]由于成本低以及实用性强等优势成为去除水中抗生素的常用方法,但抗生素的去除主要是依靠活性污泥的吸附作用,后续的泥水混合液还需要进一步降解处理。化学氧化法基于氧化剂的直接氧化作用可以有效降解水中的抗生素,常用的氧化剂有次氯酸[6]、高锰酸钾[7]和高铁酸盐[8]等。这些氧化剂在其工艺的最优条件下都能够氧化去除甲氧苄啶和恩诺沙星,但是存在氧化剂利用率低、反应时间长等问题。
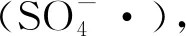
综上,对于不同的目标污染物或者在不同的反应条件下,UV/H2O2、UV/PMS和UV/PDS 3种氧化工艺的除污染效能对比顺序可能也不尽相同。基于此,以磺胺类抗生素甲氧苄啶(TMP)和喹诺酮类抗菌药物恩诺沙星(EFX)为目标物,研究单独紫外、紫外/过氧单硫酸盐(UV/PMS)、紫外/过氧二硫酸盐(UV/PDS)和紫外/过氧化氢(UV/H2O2)的除污染效率与降解速率随pH的变化规律;其次,计算在酸性(pH 3.0)、中性(pH 7.0)和碱性(pH 11.0)条件下TMP和EFX的光分解量子产率;最后,对比分析了UV/PMS、UV/PDS和UV/H2O2在自来水和地表水背景条件下对混合污染物中TMP和EFX的降解动力学。为应用UV和UV/过氧化物工艺降解水体中的磺胺类抗生素和喹诺酮类抗菌药物提供理论参考。
1 实 验
1.1 试剂与材料
过氧单硫酸钾(PMS)、过氧二硫酸钾(PDS)、磷酸氢二钠和磷酸二氢钠均为ACS试剂级,购自西格玛奥德里奇(上海)贸易有限公司。过氧化氢溶液(质量分数35%)购自阿法埃莎公司,液相色谱纯磷酸和甲醇分别购自天津迪马科技有限公司和赛默飞世尔科技公司,甲氧苄啶(TMP,98%)和恩诺沙星(EFX,98+%)购自北京伊诺凯有限公司。其他试剂均为分析纯,购自上海国药集团化学试剂有限公司。所有溶液均用Milli-QBiocel水系统生产的18.2 MΩ·cm Milli-Q水配制。自来水水体采自哈尔滨市居民供水管网。地表水水体采自哈尔滨市区内的松花江流段。
1.2 实验方法
所有的光化学实验在圆柱形硼硅酸盐玻璃容器中进行,反应容器体积为0.55 L,光程为2.63 cm。低压汞灯(Heraeus,GPH135t5l/4,6 W,λ=254 nm)的入射辐射强度(I0)为 0.905 J/s(1.92×10-6Einstein/s)[19]。纯水背景实验中,通过投加一定量的HClO4、磷酸氢二钠/磷酸二氢钠缓冲液、KOH调节加入氧化剂之后的反应液至pH(3.0±0.1)、pH(7.0±0.1)和pH(11.0±0.1)(后分别表达为pH 3.0、pH 7.0和pH 11.0)。开始实验前,将目标物和氧化剂依次加入超纯水或实际水体中,混合均匀。将上述反应液放置到反应装置内,取零号样,即刻开始计时。在预设的反应时间节点取样,用过量的盐酸羟胺和甲醇终止反应。反应温度为(25±1) ℃,所有实验均重复两次以上。图中的误差线代表实验数据的标准差。假一级速率常数基于污染物降解率≤90%的实验数据进行拟合所得。
1.3 分析方法
BA、TMP和EFX的浓度采用液相色谱(Waters Acquity UPLC H-Class)测定。色谱柱型号为Waters Acquity UPLC®BEH C18 column (2.1 mm×100 mm,1.7 μm颗粒),PDA检测器检测波长依次为226、270和270 nm,流动相采用乙腈和0.1%的甲酸水溶液,两者体积比为20∶80,流动速率为0.1 mL/min,柱温为25 ℃,进样体积为10 μL。溶液的pH使用上海雷磁精密酸度计(PHS-3C)pH计测定,溶液的温度使用水银温度计测量。PMS、PDS和H2O2的浓度分别采用酸性碘量法[20]、NaHCO3缓冲碘量法[21]和邻苯二甲酸氢钾缓冲碘量法[22]测定。
2 结果与讨论
2.1 TMP和EFX的紫外光分解速率与量子产率
图1为单独紫外光辐射下,TMP和EFX在酸性(pH 3.0)、中性(pH 7.0)和碱性(pH 11.0)条件下的降解规律。由图1(a)可知,在pH 3.0条件下,反应10 min时,单独紫外光辐射对TMP的降解率为6%;当反应时间为30 min时,TMP的降解率达25.9%。随着pH的增加,TMP的降解效率呈现增加的趋势,当pH增加到11.0时,单独紫外辐射30 min,TMP的降解率达33.7%。由图1(b)可知,当以EFX为目标污染物,在pH 3.0、反应10 min时,紫外辐射对EFX的降解率为20.9%。当pH增加至7.0和11.0时,EFX的降解效率显著增加,在反应5 min时,EFX的降解率分别达100%和94.3%。TMP和EFX的降解符合假一级反应动力学,通过式(1)拟合TMP和EFX的浓度随时间的变化曲线,可以得出TMP和EFX光分解的假一级速率常数(k0),见表1。在pH 3.0、7.0和11.0条件下,TMP光分解的k0分别为0.000 1、0.000 1和0.000 2 s-1;EFX光分解的k0分别为0.000 6、0.008 2和0.010 5 s-1。
c(TMP)=2 μmol/L,c(EFX)=2 μmol/L。
ln(c/c0)=-k0t
(1)
式中:c0为初始浓度,mol/L;c为剩余浓度,mol/L;k0为假一级速率常数,s-1;t为反应时间,s。
污染物直接光分解速率的计算公式如式(2)所示[23-24]。当溶液的吸光度A较小时,式(2)可以简化为式(3)。此时,污染物的直接光分解符合假一级动力学,如式(4)所示。根据表1中TMP和EFX光分解的k0和ε,可以计算出相应条件下的表观量子产率(φ),见表1。TMP和EFX在pH 3.0、7.0和11.0条件下直接光分解的φ分别为0.001 0、0.001 3、0.003 6和0.005 3、0.051 1、0.064 5。TMP和EFX的φ随pH发生显著变化,这可能是由于TMP和EFX在溶液中存在的型体随pH的变化发生了转变,而分子的质子化或者去质子化会影响其存在型体的共轭程度,从而影响电子跃迁的能级大小和量子产率。

表1 不同pH条件下TMP和EFX光分解的k0、ε和φ
(2)
(3)
(4)
式中:A为溶液的吸光度值;ε为摩尔吸光系数,L/(mol·cm);c为吸光物质的浓度,mol/L;I0为入射辐射强度,J/s;φ为量子产率;b为λ=254 nm处的能量换算系数,4.714 1×105J/Einstein。
TMP的酸解离常数分别是pKa,1=3.2和pKa,2=7.1[13],EFX的酸解离常数为pKa,1=6.2和pKa,2=7.9[25]。根据TMP和EFX的酸解离平衡常数,计算出TMP和EFX在不同pH条件下的型体分布系数,如图2。可以看出,当pH<10.0时,随着pH的降低,TMP发生质子化分别形成一价阳离子和二价阳离子形态。在pH 3.0时,TMP主要以一价阳离子和二价阳离子的型体存在,在pH 7.0时,TMP主要以一价阳离子和中性分子型体存在,在pH 11.0时,TMP以中性分子的型体存在。EFX在pH 3.0和pH 11.0条件下,分别发生质子化与去质子化,主要以其一价阳离子和负一价阴离子型体存在,而在pH 7.0时,大部分以两性离子型体存在。

图2 TMP和EFX的型体分布随pH的变化
由表1可以看出,TMP的ε随着pH的增加而降低,根据图2(a)所示的TMP在不同pH条件下的型体分布规律,可以计算出TMP的二价阳离子型体、一价阳离子型体和分子型体的ε分别为5 074、4 598和2 635 L/(mol·cm),依次降低,但其在λ=254 nm的直接光分解的φ依次增加(表1),这与Baeza和Knappe[10]报道的TMP在λ=254 nm处的ε和φ随pH的变化规律一致。虽然本研究与文献[10]中研究的pH条件不同,但是在中性pH条件下本研究计算得到的φ(φ=0.001 3,pH 7.0)与文献[10]报道的数值(φ=0.001 2,pH 7.9)接近。基于式(4)和图2(a)可以进一步计算出TMP的二价阳离子型体、一价阳离子型体和分子型体的φ依次为0.001 4、0.000 2和0.003 6。EFX的ε随着pH的增加而增加(表1)。基于图2(b)所示的EFX的型体分布随pH的变化,可以计算出EFX的阳离子型体、两性离子型体、阴离子型体的ε分别为5 343、7 938和7 709 L/(mol·cm),依次增加。进一步计算3种型体的φ为0.005 3、0.054 4和0.064 5,也依次增加。且EFX的两性离子型体、阴离子型体的φ显著大于阳离子型体,相差一个数量级,这一变化趋势与Wammer等[26]报道的在模拟太阳光(λ=296~450 nm)条件下EFX的φ随pH的变化规律相似,EFX的两性离子型体和阴离子型体的φ(φ=0.051 0和0.022 0)远远大于阳离子型体(φ=0.001 5)。
2.2 紫外/过氧化物体系对TMP和EFX的降解速率
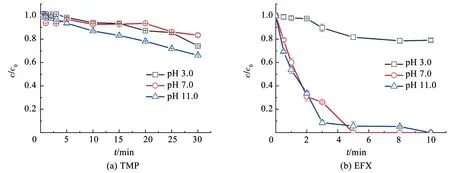
图3为紫外/过氧化物体系中,PMS、PDS和H2O2的初始浓度均为50 μmol/L时,TMP和EFX在酸性(pH 3.0)、中性(pH 7.0)和碱性(pH 11.0)条件下的降解规律。k0通过拟合TMP和EFX在不同紫外/过氧化物体系中的降解数据得出,见表2。由图3(a)可知,以TMP为目标物时,在pH 3.0条件下,UV/PMS、UV/PDS和UV/H2O2反应体系在2 min内的降解率分别达65.3%、100%和72%,TMP降解的k0依次为0.009 6、0.025 6和0.012 4 s-1;在pH 7.0条件下,3种氧化体系在2 min时的降解率分别达42.4%、82.7%和74.6%,k0依次为0.005 6、0.015 5和0.010 7 s-1;在pH 11.0条件下,反应1 min时,降解率分别达95.1%、47.7%和41.9%,k0依次为0.050 6、0.013 0和0.009 6 s-1。由图3(b)可知,以EFX为目标物时,在pH 3.0条件下,UV/PMS、UV/PDS和UV/H2O2反应体系在5 min内的降解率分别达84.9%、100%和83.8%,k0依次为0.006 5、0.018 9和0.005 6 s-1;在pH 7.0条件下反应3 min时,降解率分别达89.1%、100%和87.2%,k0依次为0.013 2、0.027 6和0.010 0 s-1;在pH 11.0条件下,反应2 min时,降解率分别达100%、88.7%和82.0%,k0依次为0.032 4、0.018 9和0.011 2 s-1。

c(TMP)=2 μmol/L, c(EFX)=2 μmol/L, c(PMS)=50 μmol/L,c(PDS)=50 μmol/L,c(H2O2)=50 μmol/L。

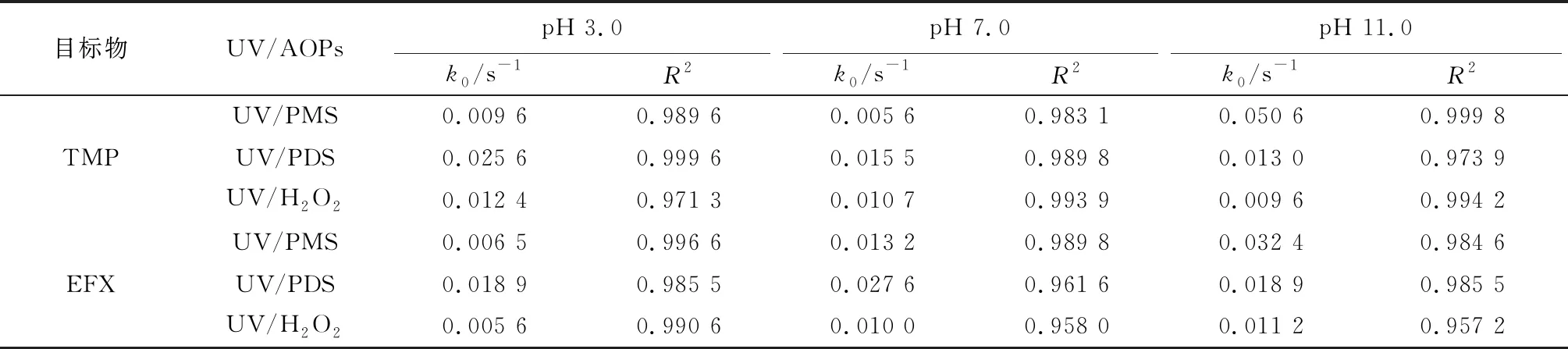
表2 不同pH条件下紫外/过氧化物对TMP和EFX降解的k0
2.3 实际水体背景对紫外/过氧化物体系降解TMP和EFX速率的影响
2.3.1 自来水水体背景的影响
图4为自来水水体背景条件下,紫外/过氧化物体系对混合污染物溶液中TMP、EFX和BA的降解规律。自来水的水质指标见表3。由图4可知,在反应30 min时,对于自身不发生光分解的BA,UV/PMS、UV/PDS和UV/H2O2对其的降解率分别为34.1%、36.3%和45.7%。3种氧化体系对TMP的降解率分别为>99%、>99%和74.4%。3种氧化体系对EFX的降解速率明显比TMP快,在反应2 min时,UV/PMS、UV/PDS和UV/H2O2对EFX的降解率分别为89.6%、100%和52.5%。采用假一级反应动力学模型拟合各体系中TMP、EFX和BA的降解,拟合所得k0见表4。UV/PMS、UV/PDS和UV/H2O2对参考目标物BA降解的k0依次为0.000 3、0.000 3和0.000 4 s-1,TMP降解的k0依次为0.001 4、0.001 3和0.000 8 s-1,EFX降解的k0依次为0.021 3、0.047 4和0.004 8 s-1。
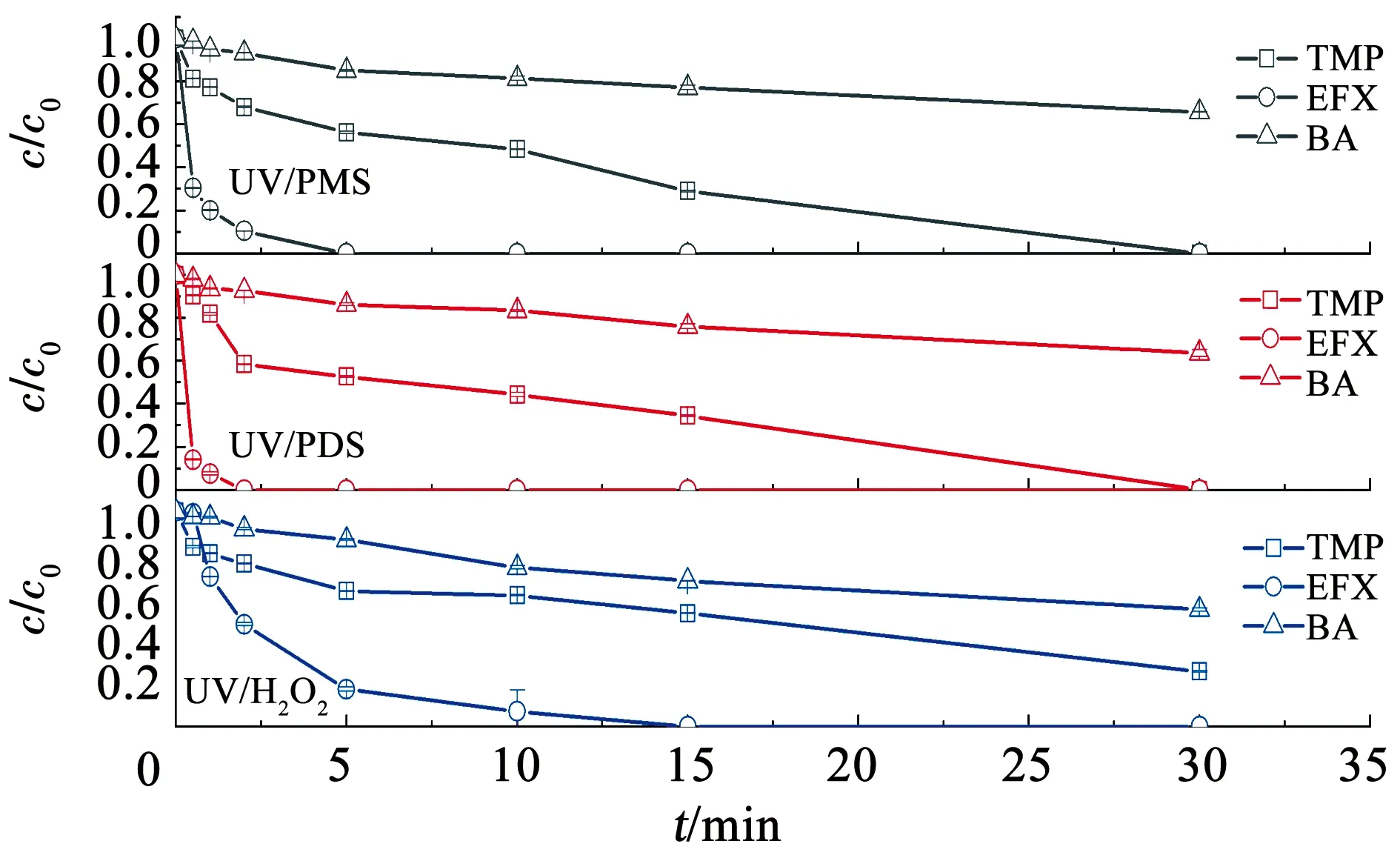
c(TMP)=2 μmol/L,c(EFX)=2 μmol/L,c(BA)=3.5 μmol/L,c(PMS)=200 μmol/L,c(PDS)=200 μmol/L,c(H2O2)=200 μmol/L。
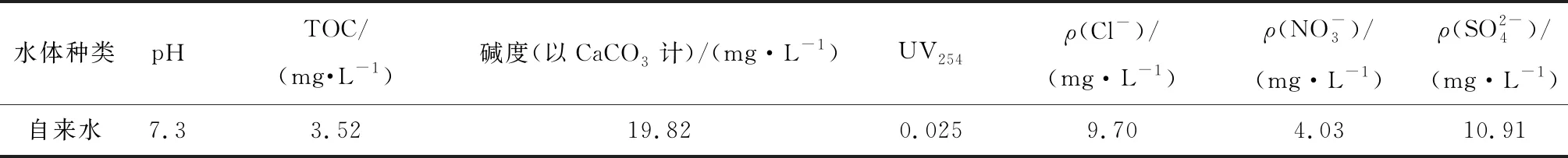
表3 自来水水质参数
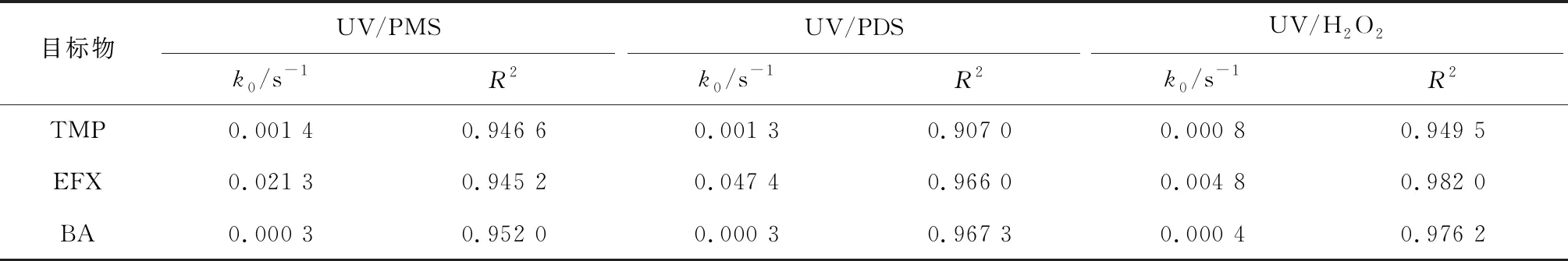
表4 自来水水体背景下不同紫外/过氧化物体系中TMP和EFX降解的k0

2.3.2 地表水水体背景的影响
图5为地表水水体背景条件下,紫外/过氧化物体系对混合污染物溶液中TMP、EFX和BA降解规律。地表水水质指标见表5。由图5可知,反应30 min时,UV/PMS、UV/PDS和UV/H2O2对BA的降解率分别为29.4%、24.4%和46.7%,对TMP的降解率分别为90.0%、>99%和99%。反应2 min时,UV/PMS、UV/PDS和UV/H2O2对EFX的降解率分别为84.3%、91.4%和48.9%。地表水水体背景条件下,TMP、EFX和BA的降解k0见表6。UV/PMS、UV/PDS和UV/H2O2对BA降解的k0分别为0.000 2、0.000 2和0.000 4 s-1,TMP降解的k0依次为0.001 4、0.002 0和0.002 4 s-1,EFX降解的k0依次为0.019 4、0.023 1和0.003 2 s-1。

表5 地表水水质参数

表6 地表水体背景下不同紫外/过氧化物体系中TMP和EFX降解的k0
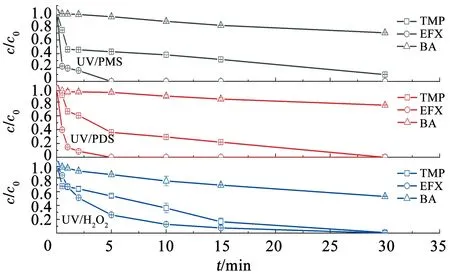
c(TMP)=2 μmol/L,c(EFX)=2 μmol/L,c(BA)=3.5 μmol/L,c(PMS)=200 μmol/L,c(PDS)=200 μmol/L,c(H2O2)=200 μmol/L。
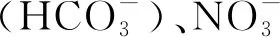
2.3.3 实际水体背景下过氧化物的分解速率
自来水和地表水背景条件下的过氧化物分解规律如图6所示。在反应30 min时,自来水中的PMS、PDS和H2O2的消耗率分别为36%、33%和11%,地表水中的各过氧化物的消耗率分别为31%、26%和15%。

c(TMP)=2 μmol/L,c(EFX)=2 μmol/L,c(BA)=3.5 μmol/L,c(PMS)=200 μmol/L,c(PDS)=200 μmol/L,c(H2O2)=200 μmol/L。
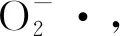
3 结 论
1)单独紫外辐射时,在pH 3.0、7.0和11.0条件下,TMP和EFX光分解的k0分别为0.000 1、0.000 1、0.000 2 s-1和0.000 6、0.008 2、0.010 5 s-1。TMP和EFX光分解的k0随pH增加而增加,并且在相同的pH条件下,EFX的光分解速率明显比TMP快。在pH 3.0、7.0和11.0条件下,TMP和EFX光分解的φ(λ=254 nm)分别为0.001 0、0.001 3、0.003 6和0.005 3、0.051 1、0.064 5。
2)超纯水背景条件下,在pH 3.0和7.0时,UV/PDS对TMP和EFX降解的k0最大,而在pH 11.0时,UV/PMS体系的k0最大。以TMP为目标污染物时,UV/PDS和UV/H2O2体系的k0随着pH的增加呈现下降的趋势;而以EFX为目标污染物时,UV/PDS和UV/H2O2体系在pH 7.0和11.0条件下的k0显著大于pH 3.0时。这主要是由于EFX的直接光分解速率远大于TMP,EFX的光分解速率对其在UV/过氧化物体系中的分解速率贡献显著,从而EFX的直接光解速率随pH的变化规律,主导了UV/PDS和UV/H2O2体系中EFX的降解速率随pH的变化。
3)自来水背景条件下,对于混合污染物溶液中TMP的降解,UV/PMS和UV/PDS的降解速率相近,大于UV/H2O2;对于EFX的降解,UV/PDS效果最好。地表水背景条件下,UV/PMS、UV/PDS和UV/H2O2对TMP降解效率相差不大,UV/H2O2去除最佳;而UV/PMS和UV/PDS对EFX的降解速率明显大于UV/H2O2,UV/PDS降解速率最快。
