响应面法优化纳豆激酶发酵培养基
2023-01-07潘冬梅张心青杨传伦王红霞杨丹丹田杰伟王秀芝高保军马春峰于帅帅牟文杰
潘冬梅,张心青,杨传伦,王红霞,杨丹丹,田杰伟,王秀芝,高保军,马春峰,于帅帅,牟文杰
(1.黄河三角洲京博化工研究院有限公司,山东 滨州 256500;2.京博农化科技有限公司,山东 滨州 256500)
血栓性疾病是指血液有形成分在血管内形成栓子,造成血管部分或完全堵塞,或是血栓脱落,在随血流移动的过程中部分或全部堵塞某些血管,造成相应部位血液供应障碍的一种疾病。血栓性疾病严重威胁人类的生命健康,其发病率高居各种疾病之首,且近年来还有渐增之势[1],是当代医学研究的重点和热点之一。
纳豆激酶(nattokinase,NK)是由纳豆芽孢杆菌发酵产生的一种丝氨酸蛋白酶[2],具有溶解血栓作用,同时还具有多种作用,KAMIYA S等[3]研究发现纳豆激酶通过延长雌性大鼠血管堵塞时间,达到机体不易形成血栓而预防血栓的作用[4-5];HSIA C H等[6]研究发现纳豆激酶可降低心血管疾病且无副作用;吴杰忱等[7]研究发现纳豆激酶可治疗高血压、预防肢体水肿和深静脉血栓疾病的发生;JI H R等[8]研究发现纳豆激酶可预防和治疗糖尿病及骨质疏松疾病;FUJITA M等[9]研究发现纳豆激酶具有避免大脑局部缺血的作用;KIM W等[10]研究发现纳豆激酶具有抗菌活性;HSU R L等[11]研究发现纳豆激酶具有治疗阿尔茨海默病的潜在医学作用;除此之外,纳豆激酶在工业上的应用也有很多研究,WANG S L等[12]纳豆激酶可以用于工业垃圾的处理;WANG S L等[13-15]研究发现纳豆激酶可以作为工业添加剂;NGUYEN T T等[16]显示纳豆激酶作为洗涤剂有显著效果。目前科学家研究最多的还是纳豆激酶的溶栓特性。
纳豆激酶已经显示出巨大的应用前景,但是纳豆激酶目前的发酵水平不高,造成以纳豆激酶为主要成分的产品价格昂贵,限制了其应用。发酵培养基的优化对提高纳豆激酶产量、降低发酵生产成本发挥着重要作用,高泽鑫[17]采用高酶活菌株GUJN05固态发酵36 h后的纳豆激酶活力达到(141.97±0.64)FU/g,相比KIM J Y等[18]报道的20~80岁高血压患者口服纳豆激酶胶囊(2 000 FU/d)8周后,舒张压和收缩压均较对照组(服用安慰剂)明显降低,成品制备所需纳豆激酶活力还有一定差距。因此,提高纳豆激酶的发酵水平是当前纳豆激酶研究领域中亟待解决的问题。
本研究在单因素试验优化纳豆激酶培养基的基础上,以发酵液纳豆激酶活力为响应值,利用响应面法对其培养基成分进行优化,以期提高酶活,为实现纳豆激酶的大规模生产及应用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌种
纳豆芽孢杆菌(Bacillus natto):由本实验室筛选保藏。
1.1.2 试剂
胰蛋白胨、牛肉膏、氯化钠、甘油、无水氯化钙、七水硫酸镁、十二水磷酸氢二钠、无水磷酸二氢钾、L-甲硫氨酸:国药集团化学试剂有限公司。实验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
种子培养基:胰蛋白胨10.00 g/L,牛肉膏3.00 g/L,氯化钠5.00 g/L。
发酵基础培养基:蔗糖20.00 g/L,胰蛋白胨20.00 g/L,无水氯化钙0.10 g/L,七水硫酸镁0.60 g/L,十二水磷酸氢二钠4.00 g/L,无水磷酸二氢钾1.00 g/L。
以上培养基均于121 ℃高压蒸汽灭菌15 min。
1.2 仪器与设备
LDZX-50KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;722型可见分光光度计:上海舜宇恒平科学仪器有限公司;PHS-3C精密pH计:上海雷磁仪器厂;HC-2518R高速冷冻离心机:科大创新有限公司中佳分公司;SW-CJ-1FB超净工作台:苏州净化设备有限公司。
1.3 方法
1.3.1 种子液制备
挑取1环纳豆芽孢杆菌菌株的新鲜斜面接种于装有100 mL种子培养基的500 mL锥形瓶中,37 ℃,180 r/min条件下振荡培养24 h(OD600nm值=1.5~1.6)。
1.3.2 发酵方法
将种子液按5%接种于装有100 mL发酵培养基的500 mL锥形瓶中,37 ℃,180 r/min条件下振荡培养96 h后,发酵液10 000 r/min离心10 min后,取上清液用于纳豆激酶活力的测定。
1.3.3 纳豆激酶活力的测定
采用紫外分光光度法测定纳豆激酶活力[17],向试管中加入1.4 mL Tris-HCl(50 mmol/L,pH 7.8)缓冲液和0.4 mL纤维蛋白原溶液(7.2 mg/mL),37 ℃温育5 min后加入0.1 mL凝血酶(20 U/mL),再37 ℃温育10 min形成人工血栓,加入0.1 mL的待测样品,37 ℃温育60 min,加入2 mL三氯乙酸(0.2 mol/L)溶液静置20 min终止反应,13 000 r/min离心10 min,取上清液于275 nm 波长处测定吸光度值。酶活定义:每分钟波长275 nm处吸光度值增加0.01所需要的酶量定义为1个单位(FU)的纤维蛋白降解酶活力。
1.3.4 培养基配方优化试验设计
(1)单因素试验
碳源对纳豆激酶活力的影响:在发酵培养基基础上,分别以20.00 g/L的蔗糖、葡萄糖、麦芽糖、乳糖、甘油为唯一碳源,种子液按5%接种,37 ℃、180 r/min条件下振荡培养96h后测定纳豆激酶活力,并改变筛选碳源添加量(10.00g/L、20.00 g/L、30.00 g/L、40.00 g/L、50.00 g/L、60.00 g/L)继续培养,以确定发酵培养基中碳源种类及最佳添加量。
氮源对纳豆激酶活力的影响:在最优碳源的基础上,在发酵培养基基础上,分别以20.00 g/L的胰蛋白胨、豆粕粉、酵母粉、鱼粉、玉米浆干粉为唯一氮源,种子液按5%接种,37 ℃、180 r/min条件下振荡培养96 h后测定纳豆激酶活力,并改变筛选氮源添加量(10.00 g/L、20.00 g/L、30.00 g/L、40.00 g/L、50.00 g/L)继续培养,以确定发酵培养基中氮源种类及最佳添加量。
无机盐对纳豆激酶活力的影响:以不加无机盐为对照,在发酵培养基基础上,分别添加0.10 g/L的无水氯化钙、七水硫酸镁、七水硫酸锌、七水硫酸亚铁、五水硫酸铜、十二水磷酸氢二钠、无水磷酸二氢钾,种子液按5%接种,37 ℃、180 r/min条件下振荡培养96 h后测定纳豆激酶活力,并改变筛选无机盐添加量继续培养,以确定发酵培养基中无机盐种类及最佳添加量。
氨基酸对纳豆激酶活力的影响:以不加氨基酸为对照,在发酵培养基基础上,分别添加0.10 g/L的酪氨酸、半胱氨酸、L-甲硫氨酸、谷氨酸、色氨酸,种子液按5%接种,37 ℃,180 r/min条件下振荡培养96 h后测定纳豆激酶活力,并改变筛选氨基酸添加量(0.10 g/L、0.20 g/L、0.30 g/L、0.40 g/L、0.50 g/L)继续培养,以确定发酵培养基中氨基酸种类及最佳添加量。
(2)Plackett-Burman试验[19]
将初始发酵培养基中的7个组分作为影响因素进行全面考察,选择11个因子及试验次数N=12的试验设计,实际变量包括A(甘油)、B(豆粕粉)、C(无水氯化钙)、D(十二水磷酸氢二钠)、E(无水磷酸二氢钾)、F(七水硫酸镁)、G(L-甲硫氨酸),H、J、K、L作为4个虚拟变量以估计试验误差,每个因素取高低2个水平(表1),每组试验3个重复取平均值。

表1 培养基配方优化Plackett-Burman试验设计因素与水平Table 1 Factors and levels of Plackett-Burman experimental design for medium formula optimziation
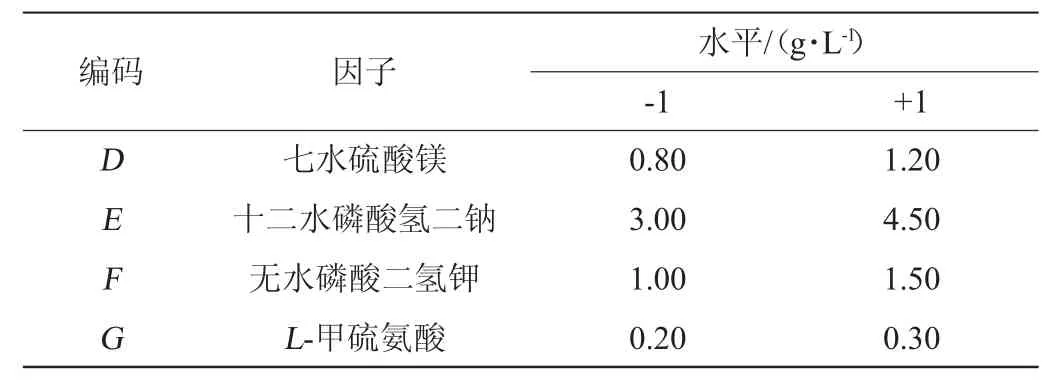
续表
(3)最陡爬坡试验
最陡爬坡法以试验值变化的梯度方向为爬坡方向,根据各因素效应值的大小确定步长长短,能快速、经济地逼近最佳值区域[20]。根据(2)Plackett-Burman筛选的显著性影响因素,进行最陡爬坡试验。
(4)响应面试验
响应面分析法确定最佳培养基配方:以爬坡试验结果确定因素取值进行Box-Behnken中心组合设计(表2),用软件Design-Expert 8.0.6对试验进行回归分析[21],得出响应面分析结果,进而确定最佳培养组分含量,最后依据回归方程绘制响应面分析图。
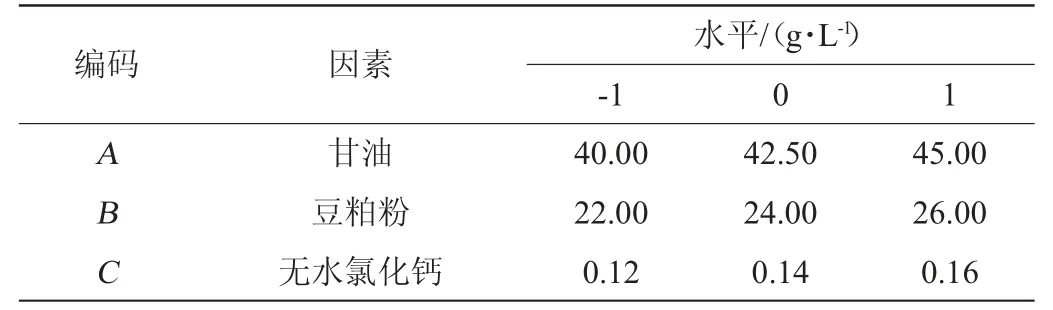
表2 培养基配方优化Box-Behnken试验设计因素及水平Table 2 Factors and levels of Box-Behnken experimental design for medium formula optimziation
1.3.5 数据处理与分析
采用Design-Expert 8.0.6进行数据处理与分析,采用Excel 2016进行绘图。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 碳源对纳豆激酶活力的影响
碳源对纳豆激酶活力的影响见图1。
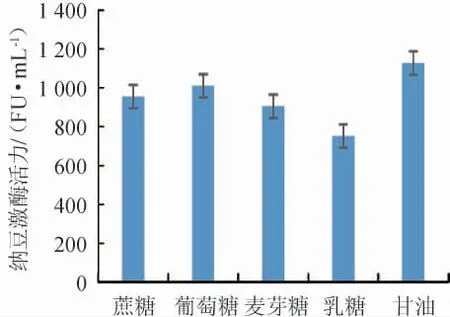
图1 碳源对纳豆激酶活力的影响Fig.1 Effects of carbon sources on nattokinase activity
由图1可知,不同碳源对纳豆激酶活力的影响为甘油>葡萄糖>蔗糖>麦芽糖>乳糖,以甘油为发酵培养基唯一碳源时纳豆激酶活力最高为1 127 FU/mL,所以发酵培养基碳源选择甘油。不同甘油添加量对纳豆激酶活力的影响见图2。
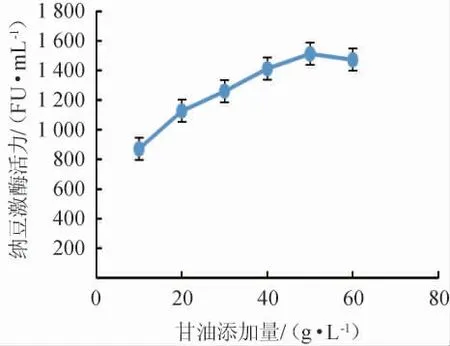
图2 甘油添加量对纳豆激酶活力的影响Fig.2 Effects of glycerol addition on nattokinase activity
由图2可知,纳豆激酶活力随着甘油添加量的增加而先上升后下降,甘油添加量为50.00 g/L时纳豆激酶活力最高,为1 512 FU/mL,故选择发酵培养基碳源为50.00 g/L的甘油。
2.1.2 氮源对纳豆激酶活力的影响
不同氮源对纳豆激酶活力的影响见图3。
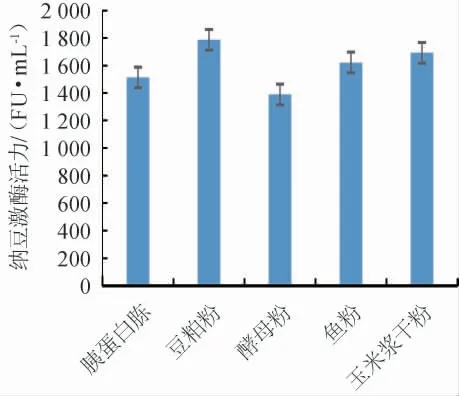
图3 氮源对纳豆激酶活力的影响Fig.3 Effects of nitrogen sources on nattokinase activity
由图3可知,不同氮源对纳豆激酶活力的影响为豆粕粉>玉米浆干粉>鱼粉>胰蛋白胨>酵母粉,豆粕粉为发酵培养基唯一氮源时,纳豆激酶活力最高1 786 FU/mL,所以选择发酵培养基的氮源为豆粕粉;考察不同豆粕粉添加量对纳豆激酶活力的影响见图4。
由图4可知,纳豆激酶活力随着豆粕粉添加量的增加呈先上升后下降的趋势,添加量为30.00 g/L时纳豆激酶活力最高,为1 885 FU/mL,故选择发酵培养基氮源为30.00 g/L的豆粕粉。
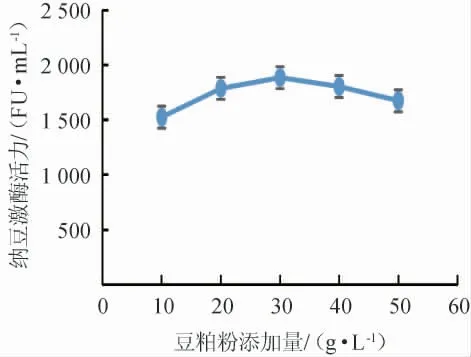
图4 豆粕粉添加量对纳豆激酶活力的影响Fig.4 Effects of soybean meal addition on nattokinase activity
2.1.3 无机盐对纳豆激酶活力的影响
不同无机盐对纳豆激酶活力的影响见图5。由图5可知,不同无机盐对纳豆激酶活力的影响为无水氯化钙、七水硫酸镁、十二水磷酸氢二钠、无水磷酸二氢钾促进了纳豆激酶活力,七水硫酸锌、七水硫酸亚铁、五水硫酸铜抑制了纳豆激酶活力。
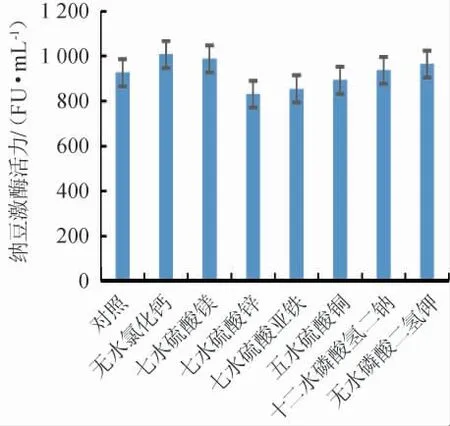
图5 无机盐对纳豆激酶活力的影响Fig.5 Effects of inorganic salts on nattokinase activity
选择对纳豆激酶活力有促进作用的无机盐:无水氯化钙、七水硫酸镁、十二水磷酸氢二钠、无水磷酸二氢钾逐个进行添加量试验,结果见图6。
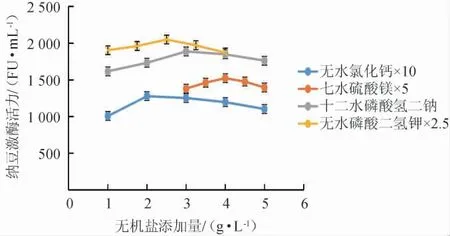
图6 不同无机盐添加量对纳豆激酶活力的影响Fig.6 Effects of inorganic salt addition on nattokinase activity
由图6可知,选择发酵培养基中各无机盐的质量浓度为无水氯化钙0.20 g/L、七水硫酸镁0.80 g/L、十二水磷酸氢二钠3.00 g/L、无水磷酸二氢钾1.00 g/L。
2.1.4 氨基酸对纳豆激酶活力的影响
不同氨基酸对纳豆激酶活力的影响见图7。由图7可知,L-甲硫氨酸、谷氨酸促进了纳豆激酶活力,酪氨酸、半胱氨酸、色氨酸抑制了纳豆激酶活力,发酵培养基氨基酸选择促进纳豆激酶活力力度最大的L-甲硫氨酸,纳豆激酶活力最高2 101 FU/mL。
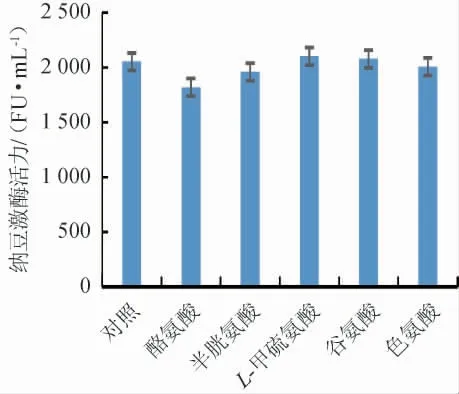
图7 氨基酸对纳豆激酶活力的影响Fig.7 Effects of amino acids on nattokinase activity
不同添加量的L-甲硫氨酸对纳豆激酶活力的影响见图8。由图8可知,随着L-甲硫氨酸添加量的增加,纳豆激酶活力呈现先升高后降低的趋势,添加量为0.2 g/L时,纳豆激酶活力最高为2 165 FU/mL,故选择发酵培养基的氨基酸为0.2 g/L的L-甲硫氨酸。
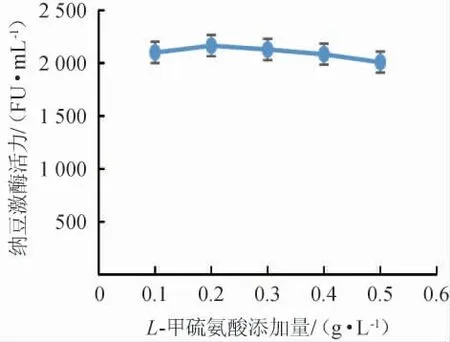
图8 L-甲硫氨酸添加量对纳豆激酶活力的影响Fig.8 Effects of L-methionine addition on nattokinase activity
通过单因素优化试验,得到的纳豆激酶发酵培养基为甘油50.00 g/L、豆粕粉30.00 g/L、无水氯化钙0.20 g/L、七水硫酸镁0.80 g/L、十二水磷酸氢二钠3.00 g/L、无水磷酸二氢钾1.00 g/L、L-甲硫氨酸0.20 g/L。
2.2 Plackett-Burman试验设计结果与分析
Plackett-Burman试验设计及响应值(纳豆激酶活力R1)见表3,方差分析结果见表4,根据试验结果得到回归方程(1)。
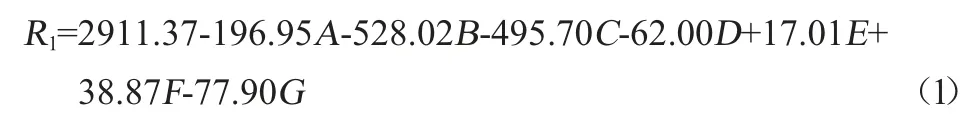
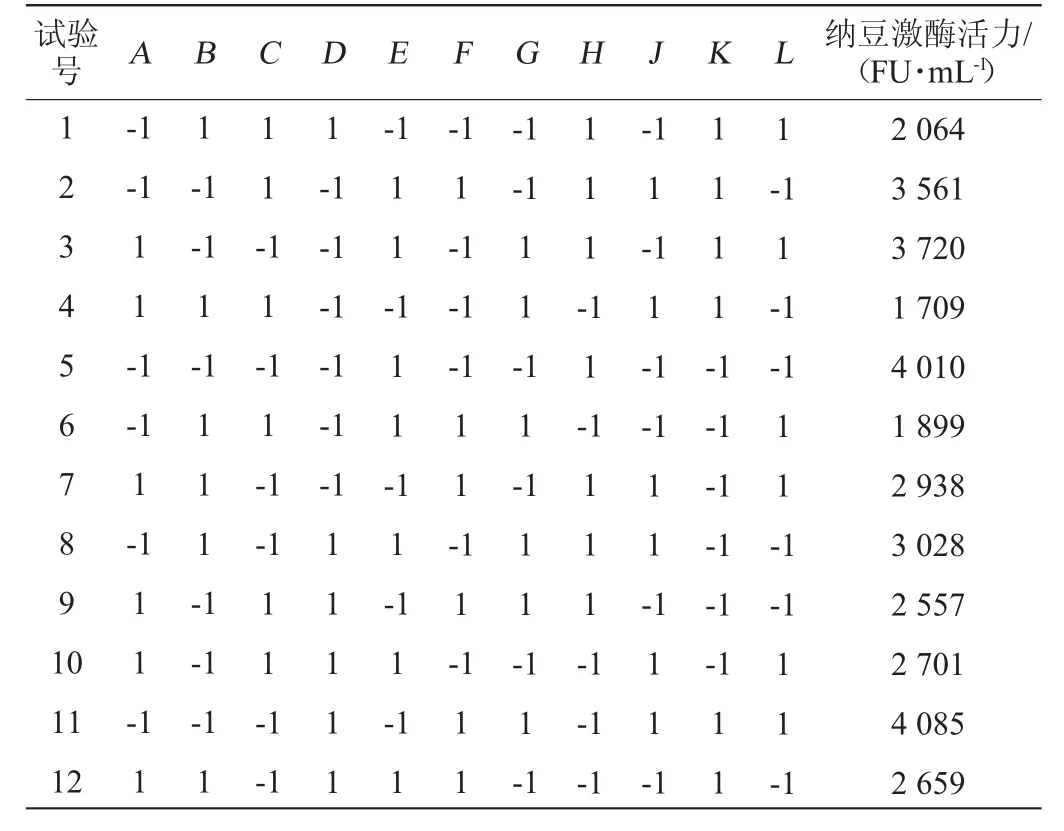
表3 Plackett-Burman试验设计及结果Table 3 Design and results of Plackett-Burman experiments
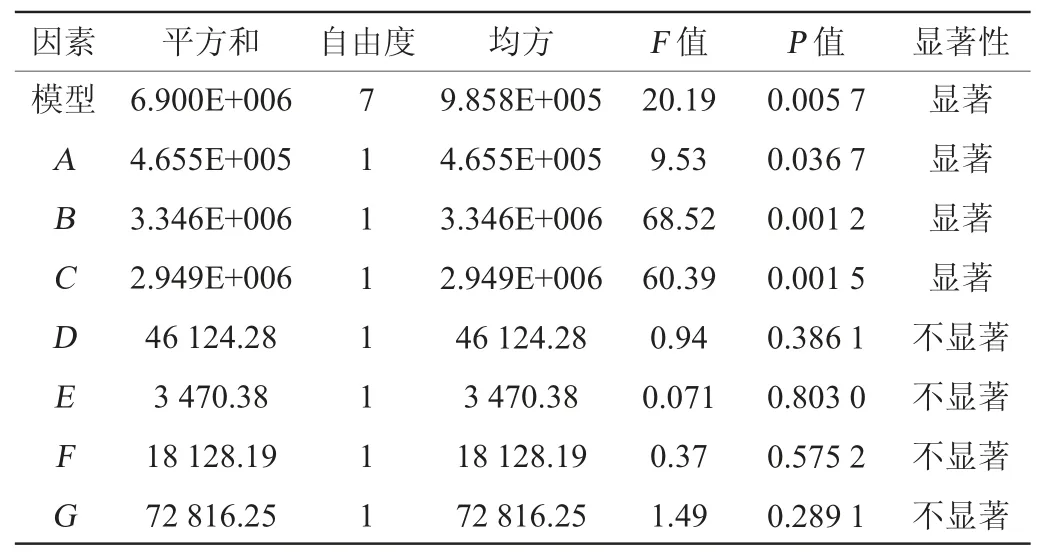
表4 Plackett-Burman试验结果方差分析Table 4 Variance analysis results of Plackett-Burman experiments
模型决定系数R2=0.972 5,模型P值为0.005 7,所得回归模型极显著,说明模型拟合性良好[22]。表4中P<0.05为显著影响因子,发酵培养基组分对纳豆激酶活力具有显著影响的因子依次是B>C>A,即豆粕粉>无水氯化钙>甘油,且3个因素都表现为负效应,浓度可适当降低,将豆粕粉、无水氯化钙、甘油作为发酵培养基优化的主要因素进行爬坡试验,其余因素结果可参考单因素试验结果。
2.3 最陡爬坡试验
根据回归方程(1)中A、B、C因素估计系数的效应,依次减小甘油、豆粕粉、无水氯化钙的浓度,设计最陡爬坡试验[23],试验结果见表5。
由表5可知,随着甘油、豆粕粉、无水氯化钙浓度逐渐减少,纳豆激酶活力呈现先增大后减小的趋势。当发酵培养基中甘油为42.50 g/L、豆粕粉为24.00 g/L、无水氯化钙为0.14 g/L时,纳豆激酶活力达到最高,为A、B、C因素的最大响应值区域。以表5中试验号4的因素水平为中心值进行Box-Behnken中心组合试验。
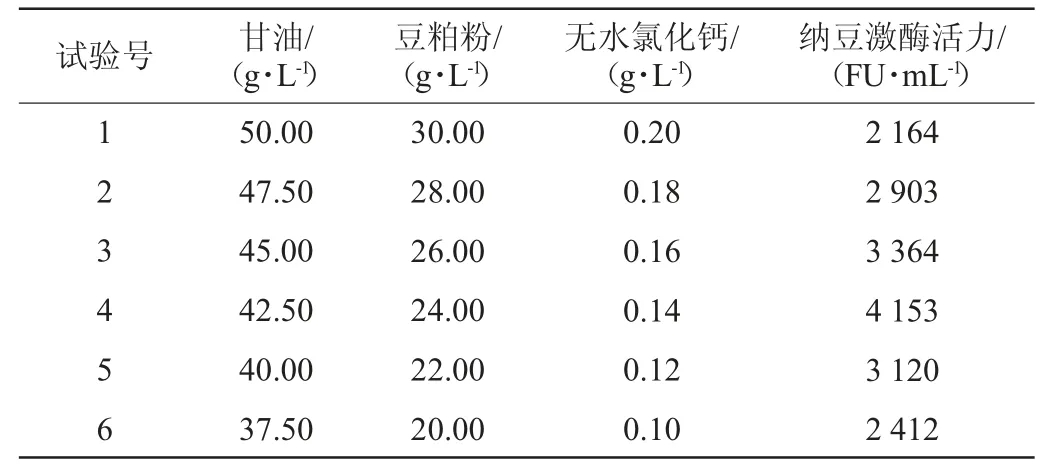
表5 最陡爬坡试验设计及结果Table 5 Design and results of the steepest climb experiments
2.4 Box-Behnken中心组合试验结果与分析
2.4.1 Box-Behnken中心组合试验结果
根据最陡爬坡试验结果,选择试验号4各因素水平作为Box-Behnken中心组合试验的中心点进行响应面试验,利用Design-Expert 8.0.6软件设计3因素3水平的Box-Behnken中心组合试验,试验点共包括12个析因点和5个零点重复,Box-Behnken设计及结果分析见表6和表7。
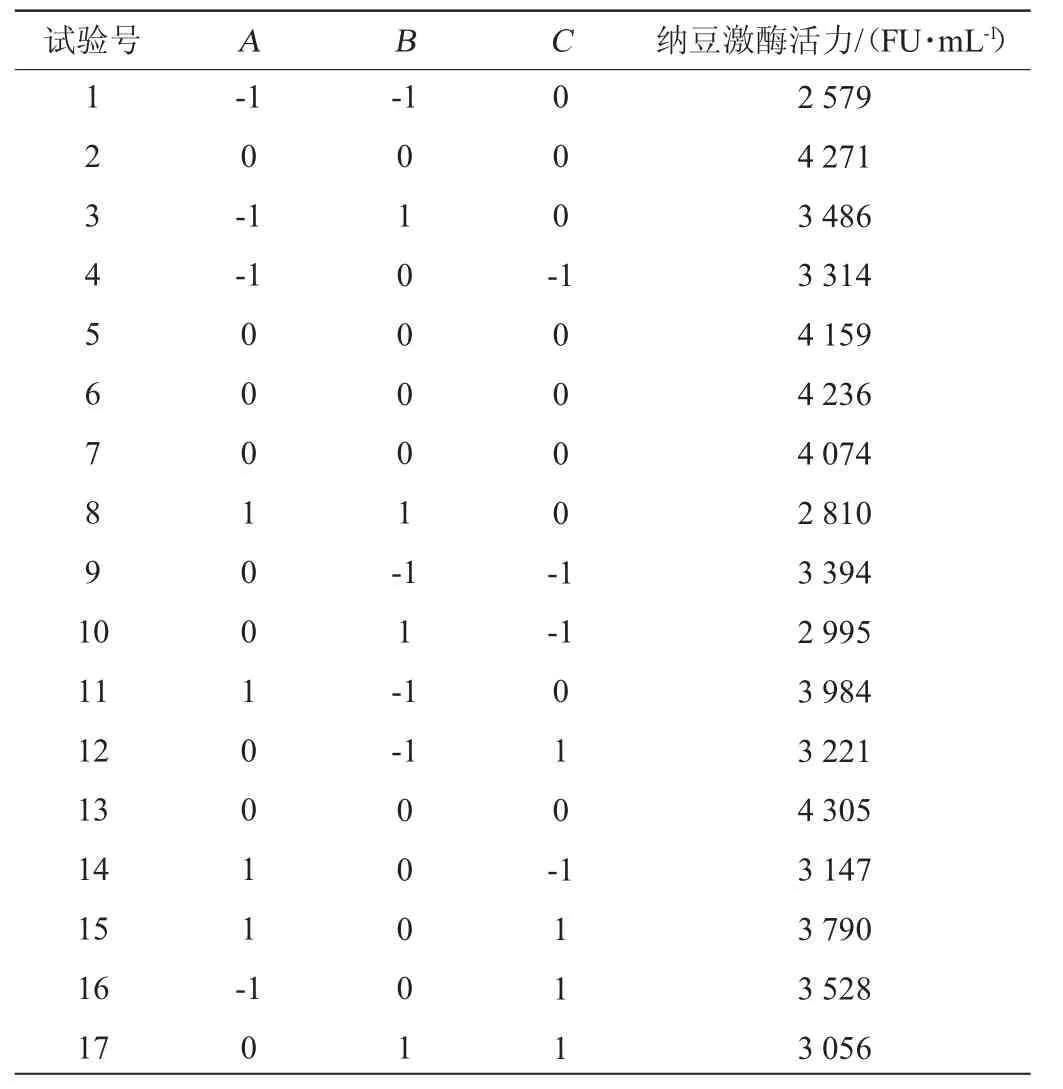
表6 Box-Behnken试验设计及结果Table 6 Design and results of Box-Behnken experiments
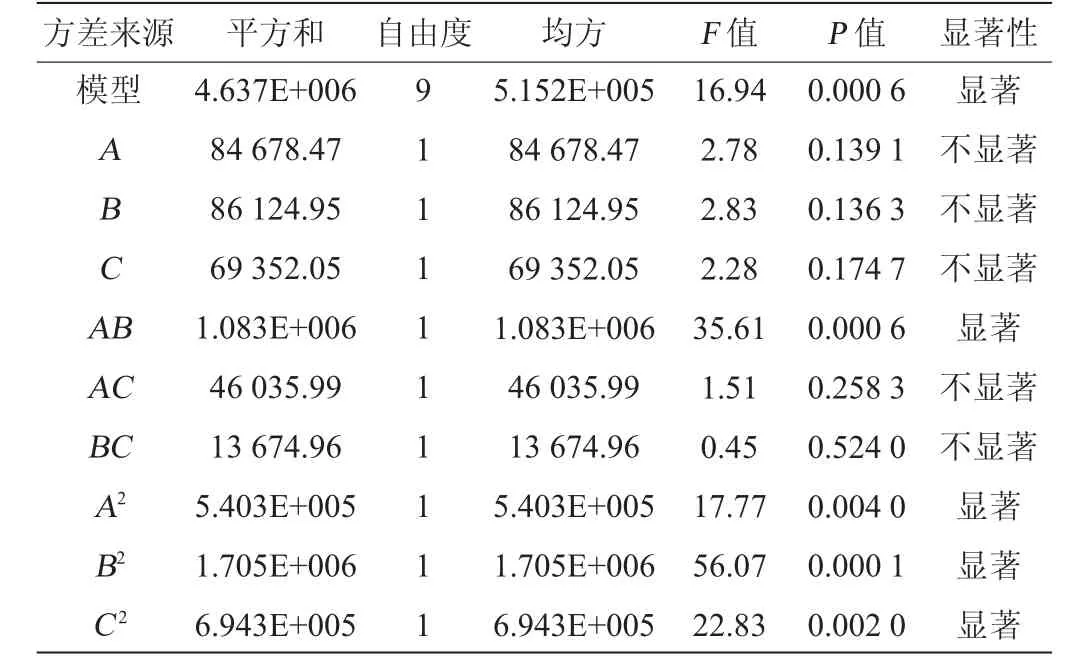
表7 Box-Behnken试验回归分析结果Table 7 Regression analysis results of Box-Behnken experiments
利用Design-Expert 8.0.6软件对中心组合试验结果进行响应面分析,得到纳豆激酶活力(R2)对甘油(A)、豆粕粉(B)、无水氯化钙(C)的多元二次回归方程(2):

模型决定系数R2=0.956 1,调整决定系数R2Adj=0.899 7,模型P值为0.000 6,表明模型显著(P<0.05),模型可以很好的预测试验结果[24]。由表7可知,因素A、B、C对纳豆激酶活力的线性效应均不显著;因素A2、B2、C2对纳豆激酶活力的线性效应均显著(P<0.05);因素A、B之间对纳豆激酶活力的交互影响显著(P<0.05),因素A、C和B、C之间对纳豆激酶活力的交互影响不显著(P>0.05)。
2.4.2 Box-Behnken中心组合试验分析
利用Design-Expert 8.0 软件根据多元二次回归方程绘制了相应的三维响应曲面图(见图9)。甘油和豆粕粉对纳豆激酶活力的影响,等高线接近椭圆说明两者交互作用显著(P<0.05),甘油和无水氯化钙对纳豆激酶活力的影响,等高线接近圆形说明两者交互作用不显著(P>0.05),豆粕粉和无水氯化钙对纳豆激酶活力的影响,等高线接近圆形说明两者交互作用不显著(P>0.05),用该图对影响纳豆激酶活力的任何两种因素之间的交互效应进行分析,进而确定因素最佳水平[25]。
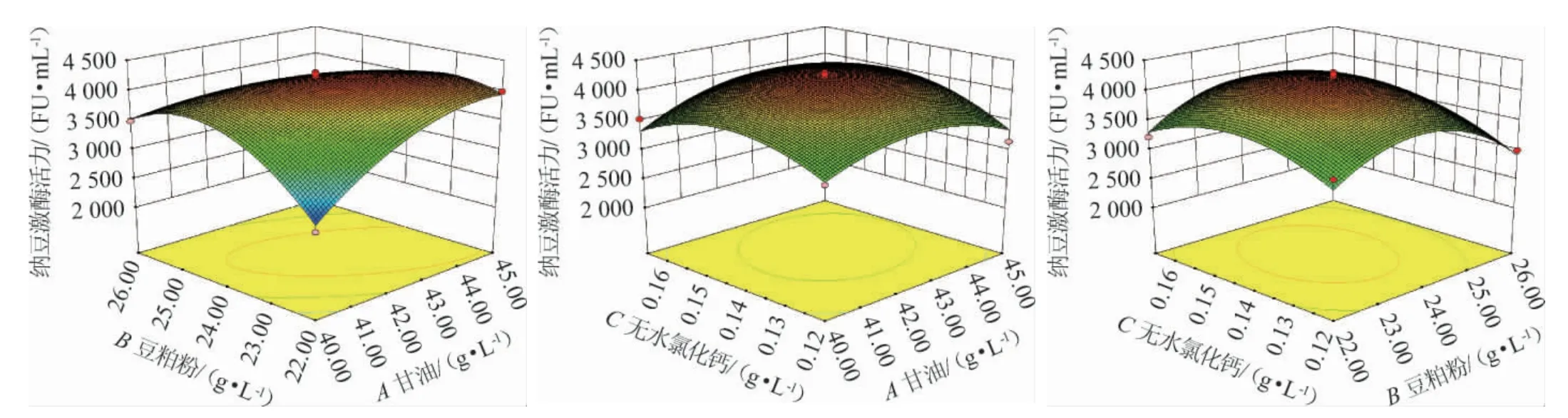
图9 各因素间交互作用对纳豆激酶活力影响的响应面及等高线Fig.9 Response surface plots and contour lines of effects of interaction between each factor on nattokinase activity
2.5 模型验证
回归方程(2)对纳豆激酶活力Box-Behnken 响应面试验拟合良好,采用Design-Expert 8.0.6软件分析,当培养基甘油添加量43.28 g/L,豆粕粉添加量23.60 g/L,无水氯化钙添加量0.14g/L时,发酵纳豆激酶活力预测值为4 242 FU/mL。为了验证纳豆激酶活力模型的有效性,同时为了实际操作可控,设置甘油添加量为43 g/L,豆粕粉添加量为24 g/L,无水氯化钙添加量为0.14 g/L。在该优化条件下进行摇瓶试验,试验重复3次,纳豆激酶活力实际值为(4 281±103)FU/mL与预测值基本一致。利用最优发酵培养基发酵纳豆激酶活力是优化前(2 164 FU/mL)的1.97倍。
3 结论
本研究通过Plackett-Burman设计,快速有效地从7个影响纳豆激酶含量的因素中筛选出3个显著性影响因素:甘油、豆粕粉、无水氯化钙,然后利用最陡爬坡试验得到最大响应值区间并用Box-Behnken设计得出最佳培养基为:甘油43 g/L,豆粕粉24 g/L,无水氯化钙0.14 g/L,七水硫酸镁0.80 g/L,十二水磷酸氢二钠3.00 g/L,无水磷酸二氢钾1.00 g/L,L-甲硫氨酸0.20 g/L。在最佳培养基组合下,发酵纳豆激酶活力含量达到(4 281±103)FU/mL,是优化前的1.97倍。
