气相色谱-三重四级杆串联质谱法测定土壤中多环芳烃
2023-01-07贾晓菲张益文邹学仁叶少媚谭淑铧
贾晓菲,张益文,邹学仁,叶少媚,谭淑铧
(中山市农产品质量安全检验所,广东 中山 528437)
多环芳烃(PAHs)是一类在环境中存在的典型持久性有机污染物,具有高毒、难降解、残留时间长、生物累积、分布广和易迁移等特性,它可以通过废水排放、大气沉降、农业施肥等途径进入土壤中,并在土壤中积累。虽然在全球范围内禁用多年,但由于其化学性质稳定、难降解,在土壤或沉积物中仍能检测到[1-4]。土壤是环境中PAHs最重要的赋存介质,PAHs进入土壤后可通过食物链传递和富集,经饮食摄入等途径进入生物体内而产生毒害作用。PAHs的存在不仅污染环境,还会影响植物的生长,甚至会对人体健康造成伤害。因此,建立快速、准确的检测土壤中PAHs的方法,对于保护环境和农产品安全具有重要意义。
目前,针对PAHs检测方法研究较多的为气相色谱-ECD法[5-6]与气相色谱-质谱法[7-9]。气相色谱法在早期研究中应用较多,但是只能根据保留时间定性,定性和定量极易受到样品基质的干扰。气相色谱-质谱法虽然在选择离子模式的情况下可以提高抗干扰能力,但是在分析土壤这种复杂基质的样品时还是会受到影响而使灵敏度降低。本文利用气相色谱-三重四级杆串联质谱法测定土壤中的PAHs,运用多重反应监测(MRM)技术,有效降低了背景干扰,灵敏度更高[10-11],定性、定量更准确。
1 材料与方法
1.1 仪器与试剂
Agilent 7890A/7000C气相色谱-三重串联四级杆质谱联用仪,美国Agilent;SB25-12DTD超声波清洗器,波新芝生物科技股份有限公司;水浴氮吹仪,Biotage;MS 3 digital涡旋振荡器,IKA;3-18ks冷冻离心机,SIGMA;电子天平,sartorius。
丙酮,色谱纯,德国默克;正己烷,色谱纯,德国默克;超纯水,屈臣氏;无水硫酸镁,广州试剂;Florisil固相萃取小柱,1 000 mg,6 mL,美国Agilent;有机滤膜,津腾。
16种PAHs混合标准溶液,包括苊、苊烯、蒽、芴、菲、萘、芘、荧蒽、苯并[a]蒽、、苯并[b]荧蒽、苯并[k]荧蒽、苯并[ghi]苝、茚并[1,2,3-cd]芘、二苯并[A,H]蒽、苯并[a]芘,浓度100 mg/L(BePure)。
1.2 试验方法
1.2.1 样品采集与制备
采集纵向深度为0~15 cm的表层土壤,去除石块、草等杂物,在通风干燥阴凉处自然风干,干燥后研碎,依次过60目筛、100目筛,充分混匀后装进样品瓶,放入干燥器保存,待处理。
1.2.2 样品前处理
称取5.0 g土壤样品于50 mL离心管中,加入1.0 mL水,涡旋振荡混匀,让水充分浸润土壤样品,加入10 mL丙酮-正己烷(1∶1)、2 g无水硫酸镁和1粒陶瓷均质子,涡旋混匀后放入超声波提取仪中超声萃取20 min,萃取过程中要不时地取出振摇2~3次,7 000 r/min离心5 min,吸取2 mL上清液至试管中,氮吹至近干,2 mL正己烷复溶,涡旋振荡混匀,待净化。
净化:依次用6 mL丙酮∶正己烷(1∶9)、6 mL正己烷活化Florisil固相萃取净化小柱,当溶剂液面到达吸附层表面时,立即倒入上述待净化溶液,用试管收集洗脱液,用5 mL丙酮∶正己烷(1∶9)冲洗待净化液试管后淋洗Florisil柱,并重复一次。将盛有淋洗液的试管置于水浴氮吹仪中,40℃水浴氮吹至近干,用1 mL正己烷定容,过0.22 μm有机滤膜,待测。
1.2.3 标准溶液配制
分别将浓度为100 mg/L的16种PAHs混合标准溶液用正己烷配制成10 mg/L的储备液,放入-18℃冰箱保存备用。使用前,取出放至室温后,用正己烷逐级稀释为0.01 mg/L、0.05 mg/L、0.1 mg/L、0.2 mg/L、0.5 mg/L的混合标准工作溶液。
1.2.4 仪器条件
色谱条件:色谱柱为HP-5ms UI(30 m×250 μm×0.25 μm);进样口温度280℃,不分流进样,进样体积1.0 μL,载气为高纯氦气(99.999%),恒流模式,流速1.2 mL/min。升温程序:初始温度80℃,保持1 min,以20℃/min升至180℃,保持1 min,以10℃/min升温至240℃,保持2 min,以10℃/min升至300℃,保持4 min。
质谱条件:电子轰击离子源(EI),电离能量70 eV;离子源温度280℃;传输线温度280℃;四级杆温度150℃;选择扫描模式MRM,溶剂延迟5 min。
2 结果与分析
2.1 GC-MS/MS条件优化
将浓度为2.0 mg/L的PAHs混合标准溶液进行GCMS/MS全扫描,全扫描范围80~450 m/z,扫描时间25 min,获得全扫描质谱图,16种PAHs的分离度都较好,见图1。确定每个组分的保留时间,选择质荷比大、丰度高的离子作为母离子。对选择的特征母离子再进行产物离子扫描,并优化碰撞能量,选择响应较高的子离子对作为样品的定量离子对和定性离子对,建立MRM方法。16种PAHs的定性和定量特征参数见表1。

图1 PAHs的总离子流图Fig.1 Total ion current chromatogram of PAHs
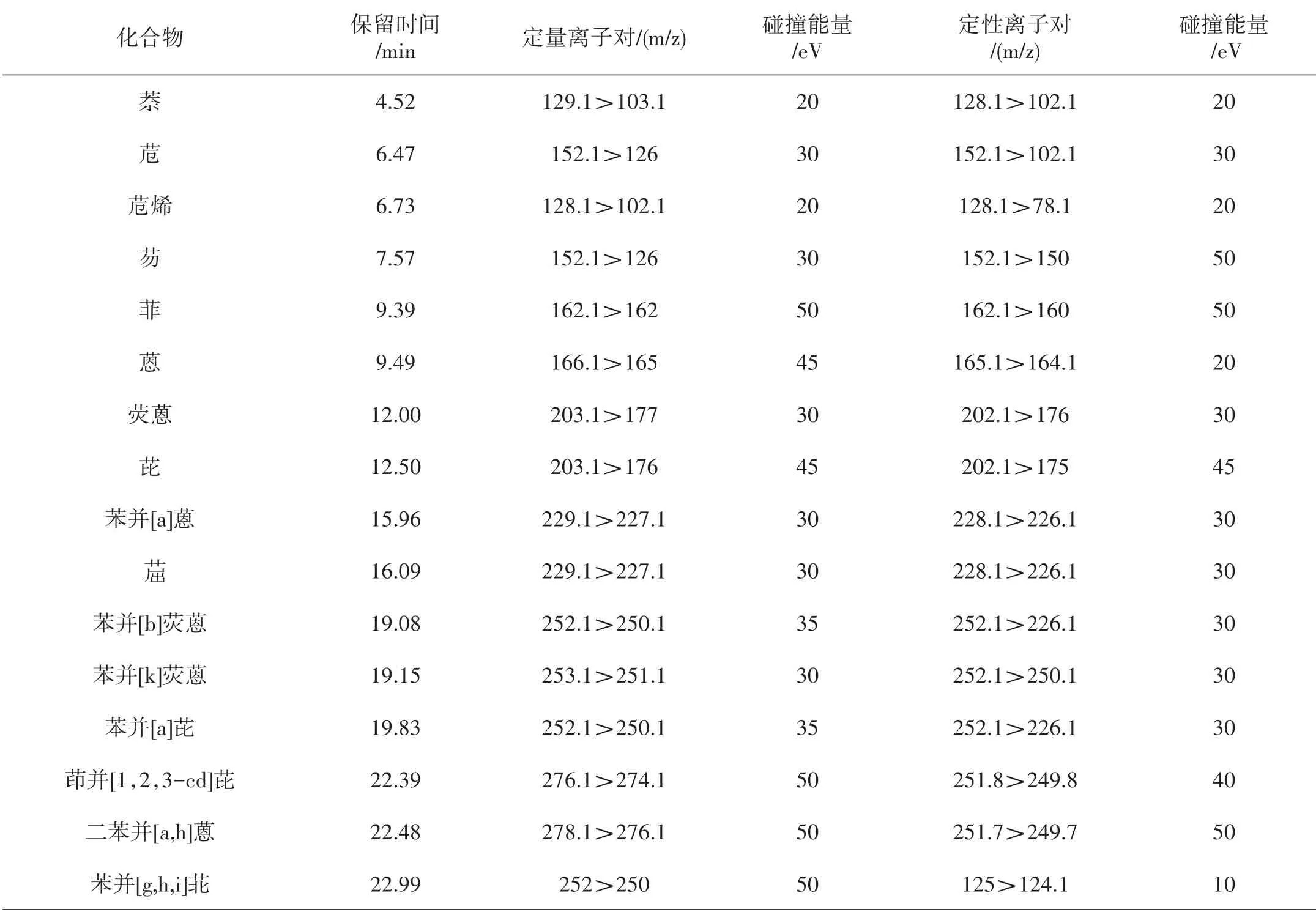
表1 16种PAHs的特征参数Table 1 Characteristic parameters of 16 PAHs
2.2 标准曲线和检出限
将配制浓度为0.01 mg/L、0.05 mg/L、0.1 mg/L、0.2 mg/L、0.5 mg/L的混合标准工作液进行测定,用外标法做标准曲线,以各PAHs定量离子的峰面积y对其浓度x绘制标准曲线,回归方程及相关系数见表2。结果显示,16种PAHs在0.01~0.5 mg/L范围内线性关系良好,相关系数不低于0.995。以色谱峰的3倍信噪比(S/N)计算方法检出限,均在0.30~1.00 μg/kg之间。
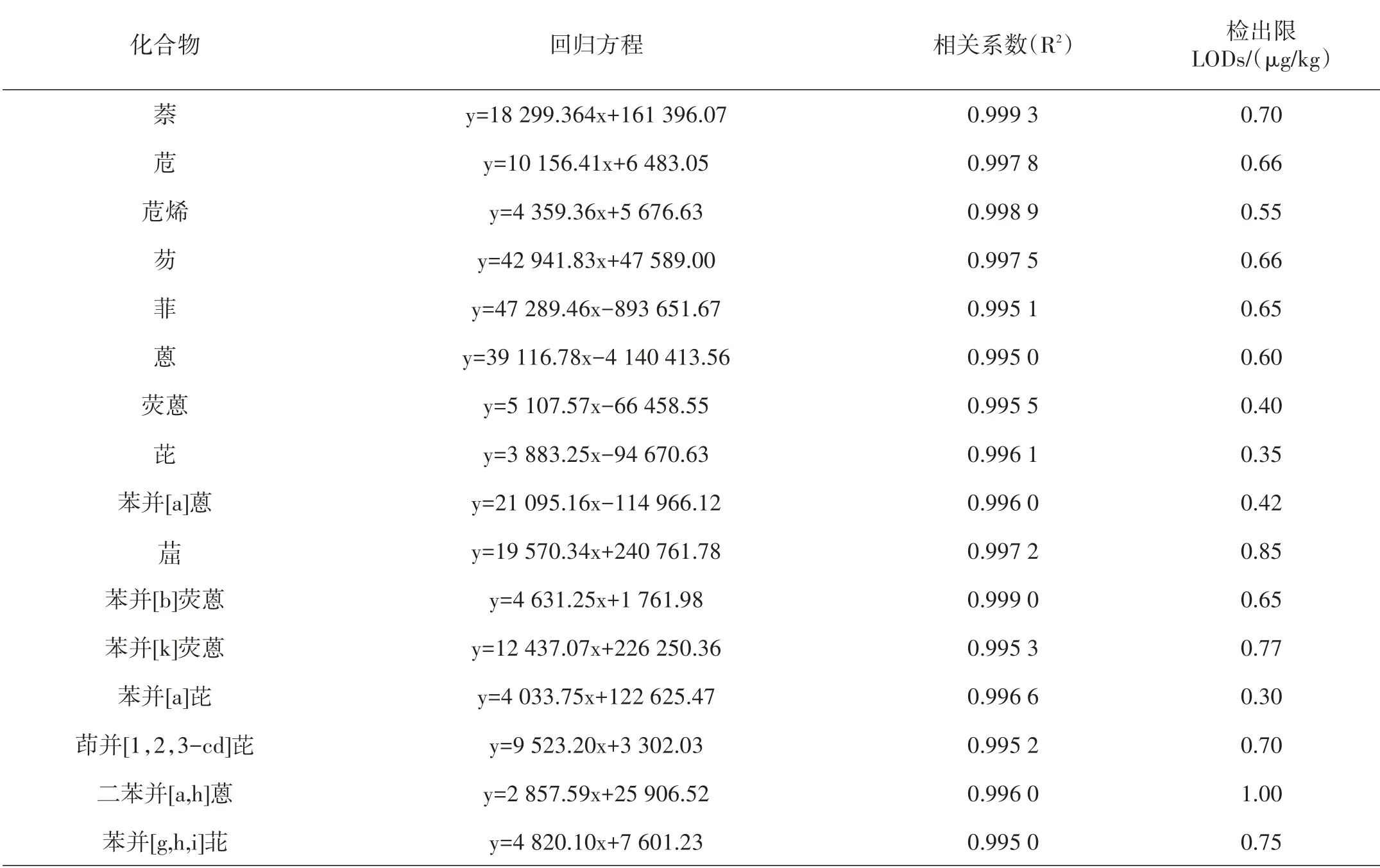
表2 16种PAHs的回归方程、相关系数及检出限Table 2 Regression equations,correlation coefficients and limits of detection(LODs)of 16 PAHs
2.3 回收率及精密度
用不含该16种PAHs的土壤作为空白样品进行加标回收实验,添加3个浓度水平,分别为20 μg/kg、40 μg/kg、100 μg/kg,每个浓度水平做5个平行样,并做2个空白对照。运用本文的方法进行前处理和测定,计算加标回收率和相对标准偏差RSD,见表3。结果表明,在3个添加浓度下,16种PAHs的平均回收率在70%~115%,相对标准偏差2.0%~9.5%,回收率和精密度都较好,方法稳定、准确。
3 结论
本文利用气相色谱-三重四级杆串联质谱仪建立了测定土壤中16种PAHs的方法,土壤中有较多的干扰物质,基质复杂,本文首先在前处理中将样品经丙酮-正己烷(1∶1)超声提取,再过Florisil净化小柱,净化效果较好且回收率较高,在选择仪器上采用了气相色谱-三重四级杆串联质谱仪,采用MRM扫描模式,大大减少了土壤基质中杂质离子的干扰,提高了选择性和准确度。该方法能够精确定性和定量土壤中的PAHs,提高了土壤监测效率,为开展土壤中PAHs的检测分析提供了有效方法。
