二维铅(Ⅱ)配位聚合物的合成、结构表征及其与BSA作用
2023-01-07童倩倩徐晨薇陈驰王逸飞王峥
童倩倩,徐晨薇,陈驰,王逸飞,王峥
(有机化工新材料湖北省协同创新中心,有机功能分子合成与应用教育部重点实验室,湖北大学化学化工学院,湖北 武汉 430062)
配位聚合物(CPs)是由金属离子或金属簇与含有多个位点的有机配体构成的一类无机-有机杂化材料,具有丰富的建筑单元和拓扑结构,应用于催化、气体吸附、非线性光学、磁性材料、医药等领域[1-3]。选择相应的金属离子和含有合适配位位点的有机配体是建构具有预期结构和功能性质的配位聚合物的必要条件。
铅(Ⅱ)离子半径较大,具有特殊的电子构型,配位数可从2到10,表现出丰富的立体化学活性,配位结构多样,其化合物在邮电、冶金、化工、石油等领域有广泛的应用[4-5]。由于铅元素是一种有毒的重金属元素,铅(Ⅱ)化合物的广泛应用,会造成环境污染和生物重金属中毒,危害人类健康,人们通常通过化学或物理方法来解决铅的污染问题[6-7],例如,D-青霉胺(D-penicillamine)是一种含有巯基、氨基和羧基的配体,可作为重金属中毒的赋形剂与重金属配位,为铅(Ⅱ)离子赋形剂的设计合成提供了思路[8]。除了提供多位点配位,结构也是选择配体的考虑因素之一。吡啶羧酸类化合物兼具吡啶基团和羧基的结构特点和性能优势:第一,氮、氧原子可提供多个位点与金属离子配位;第二,羧基氧原子具有多样的配位模式,可与金属离子单齿、双齿或多齿配位;第三,吡啶基团具有刚性结构,有利于形成具有规则拓扑结构、性能稳定的配位聚合物。用吡啶羧酸类配体去捕获铅(Ⅱ)离子,可能为铅造成的重金属中毒问题提供一个有效的解决方案。
人血清白蛋白是一种球状的水溶性血清蛋白,是血液中数量最多的一种蛋白。血清蛋白有维持多种生理功能的作用,如维持渗透压等,与此同时还担任药物、脂肪酸等药物小分子及离子的储存和运输功能[9]。研究铅(Ⅱ)配合物与血清白蛋白之间的作用,有利于认识铅(Ⅱ)配合物在人体内的行为,对了解铅(Ⅱ)配合物与血清白蛋白的作用机理有一定的指导意义。牛血清白蛋白(BSA)由一条包含583个氨基酸残基的单链多肽组成,分子量为66.8 KDa,其结构与人血清白蛋白(HSA)相似,且价格低廉,较容易大量制得,因而,常被用来替代HSA研究与药物分子的相互作用[10-11]。
吡啶-2,6-二甲酸是一种生物活性物质,吡啶环和两个羧基之间存在120°的刚性角,可以提供多种配位模式,形成离散或连续的金属配合物[12]。铅(Ⅱ)离子与吡啶-2,6-二甲酸存在多种配位方式,相关研究主要集中在配合物结构的解析及光学性质的探讨[13-14],较少有铅(Ⅱ)吡啶二甲酸与BSA相互作用的研究报道。本文以吡啶-2,6-二甲酸为配体,铅(Ⅱ)为中心离子,构建吡啶-2,6-二甲酸铅(Ⅱ)配位聚合物,确定其结构,利用荧光技术研究配位聚合物与BSA之间的作用,希望为解决铅的环境污染和铅中毒问题提供一定的参考。
1 实验部分
1.1 试剂与仪器
吡啶-2,6-二甲酸、BSA,分析纯,阿拉丁化学试剂有限公司。
iS10型傅里叶变换红外光谱仪,美国Nicolet公司;D8 Advance型X射线衍射仪,德国Bruker公司;X’-ta-LAB Synergy型X射线单晶衍射仪,荷兰;JSM6510LV型扫描电子显微镜,日本Jeol公司;STA 2500型热重分析仪,德国Netzsch公司;LS-55型荧光分光光度计,美国PerkinElmer公司;Lambda 35型紫外分光光度计,美国PerkinElmer公司;Optima 8000型电感耦合等离子体原子发射光谱仪,美国PerkinElmer公司。
1.2 配合物[(C7H3NO4Pb)n]的合成
将10 mL Pb(NO3)2(0.1 mmol,0.033 1 g)水溶液逐滴加到5 mL吡啶-2,6-二甲酸(0.1 mmol,0.016 7 g)的乙醇溶液中,溶液出现浑浊,室温下持续搅拌数小时后,抽滤并用少量乙醇洗涤,干燥得到白色粉末。ICP测定值:Pb,55.63%(计算值:55.66%)。
为了确定上述配合物的结构,制备了单晶,制备方法如下:称取0.016 7 g吡啶-2,6-二甲酸(0.1 mmol)和0.033 1 g Pb(NO3)2(0.1 mmol)溶于10 mL H2O,室温下搅拌30 min,一并转入25 mL反应釜,140℃反应72 h,缓慢降至室温,过滤得到无色柱状晶体。晶体用蒸馏水洗涤并在空气中干燥,产率为79%(按Pb(NO3)2用量计算)。
1.3 紫外和荧光光谱测试方法
在pH=7.4的0.1 mol·L-1Na2H PO4-
Na H2P
O4缓冲溶液中配制BSA溶液,浓度为6.0×10-6mol·L-1。
往2 mL BSA溶液中,依次加入0 μL、5 μL、10 μL、20 μL、30 μL、50 μL、70 μL、90 μL、100 μL浓度为4.0×10-4mol·L-1的配合物水溶液,分别在298 K和308 K下保温30 min后,测定荧光光谱。
298 K下,往2 mL BSA溶液中依次加入0 μL、5 μL、10 μL、20 μL、30 μL、50 μL、70 μL、90 μL、100 μL浓度为4.0×10-4mol·L-1的配合物水溶液,测定紫外光谱。
2 结果与讨论
2.1 红外图谱分析
配合物的单晶和粉末的红外光谱如图1所示,吸收峰的峰位和相对强度基本一致。配合物的单晶和粉末在1 700 cm-1左右均未出现吡啶-2,6-二甲酸-COOH的特征峰,说明配体中的羧基脱质子并参与了配位[15],此结果与X射线单晶结构解析一致。出现在1 610 cm-1、1 579 cm-1、1 379 cm-1、1 353 cm-1处的特征峰,分别对应于脱质子羧基(-COO-)的反对称和对称伸缩振动。1 422 cm-1处的吸收峰归属于吡啶环的骨架振动。

图1 配合物的红外光谱图Fig.1 The IR spectrums of complexes
2.2 结构分析
2.2.1 X射线粉末衍射分析
由图2可知,配合物粉末的XRD图谱强度较高,无杂峰,说明配合物粉末纯度高且具有良好的晶相。单晶衍射数据模拟的XRD图与配合物粉末XRD图基本一致,配合物的三强峰分别出现在2θ=9.84°、19.05°、24.96°,表明配合物粉末和单晶结构一致。

图2 配合物的XRD衍射图Fig.2 XRD pattern of the complexes
2.2.2 X射线单晶衍射分析
吡啶-2,6-二甲酸铅的单晶结构已在CCDC注册,CCDC号为2095564,晶体学数据列于表1,主要键长键角列于表2。配合物属于单斜晶系,P21/n空间群,晶胞参数为a=9.739 5(4)Å,b=5.538 6(2)Å,c=14.175 5(6)Å,α=90°,β=104.501(4)°,γ=90°,V=740.31(5)Å3,

表1 配合物的晶体学数据和结构参数Tab.1 Crystal data and structure refinement for the complex
Z=4,Dc=3.340 g/cm3。图3是Pb(Ⅱ)离子的配位环境图,配体吡啶-2,6-二甲酸被去质子化,羧基O9和O13原子及吡啶环上的N2原子以三齿螯合模式与中心Pb(Ⅱ)离子配位,形成两个五元环。两个配位单元通过羧基氧O13桥连,形成双核结构,如图4所示。双核单元通过羧基O13的桥连作用,形成一维无限的Pb-O-Pb链状结构。一维链通过链间O10和O12桥连作用,形成二维网状结构(图5)。

图3 Pb(II)的配位环境图Fig.3 Coordination environment of Pb(II)ion

图4 单晶的一维侧视图Fig.4 1D side view of the monocrystal

图5 单晶的二维面图Fig.5 A 2D layer of monocrystal
2.3 热稳定性
由图6可知,配合物表现为一步失重,温度超过400℃时开始分解,在400℃到575℃区间,失重率为44.37%(计算值:44.34%),归因于配合物骨架坍塌,有机配体分解。温度升至600℃时,不再失重,说明配位聚合物具有较好的热稳定性。
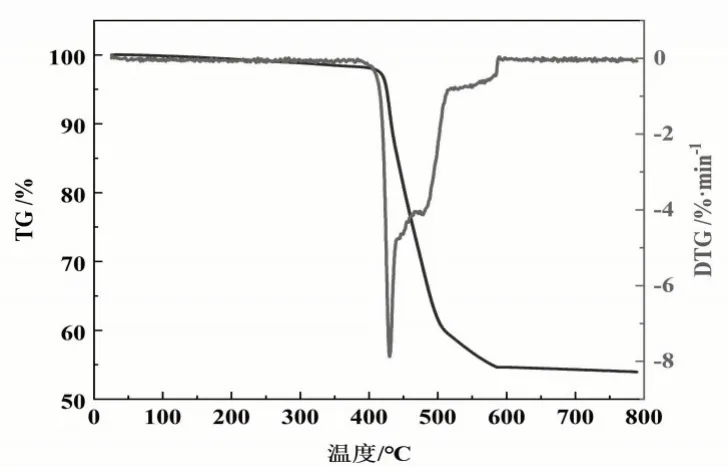
图6 配合物的TG-DTG图Fig.6 TG-DTG analyses of complex
2.4 配合物与BSA的作用
2.4.1 配合物对BSA的荧光猝灭光谱
图7为配合物与BSA在298 K时的荧光猝灭光谱图。随着配位聚合物浓度的增加,BSA的荧光强度逐渐减弱,荧光猝灭,表明配位聚合物和BSA之间存在相互作用。308 K时,配合物对BSA荧光的猝灭与298 K时相似,最大荧光峰的位置没有改变(图8)。

图7 298 K时,BSA与配合物相互作用的荧光光谱图Fig.7 Fluorescence spectra of BSA with various concentrations of complex at 298 K

图8 308 K时BSA与配合物相互作用的荧光光谱图Fig.8 Fluorescence spectra of BSA with various concentrations of complex at 308 K
Pb(1)-O(13)1Pb(1)-O(13)Pb(1)-O(12)1Pb(1)-O(10)Pb(1)-O(9)Pb(1)-N(2)O(10)-C(8)O(13)-C(11)O(12)-C(11)
O(13)1-Pb(1)O-(13)O(13)-Pb(1)-O(12)1O(13)1-Pb(1)-O(12)1O(9)-Pb(1)-O(13)O(9)-Pb(1)-O(13)1O(9)-Pb(1)-O(12)1O(9)-Pb(1)-N(2)
N(2)-Pb(1)-O(13)1N(2)-Pb(1)-O(13)N(2)-Pb(1)-O(12)1Pb(1)2-O(13)-Pb(1)C(11)-O(13)-Pb(1)C(11)-O(13)-Pb(1)2C(11)-O(12)-Pb(1)2C(8)-O(9)-Pb(1)
C(6)-C(7)-C(11)
N(2)-C(7)-C(6)
2.498(4 )2.636(5)2.684(4)2.806(5)2.396(4)2.478(5)1.244(6)1.277(7)1.240(8)77.33(7)115.47(14)50.65(14)129.12(13)79.88(13)81.19(13)66.54(15)72.76(14)63.44(15)118.87(14)142.90(16)119.5(4)96.1(4)88.3(3)122.8(4)122.3(6)121.4(6)C(7)-C(6)C(7)-N(2)C(7)-C(11)C(4)-C(5)C(4)-C(3)C(5)-C(6)C(8)-C(3)N(2)-C(3)O(9)-C(8)
N(2)-C(7)-C(11)C(5)-C(4)-C(3)C(6)-C(5)-C(4)O(10)-C(8)-C(9)O(10)-C(8)-C(3)O(9)-C(8)-C(3)C(5)-C(6)-C(7)C(7)-N(2)-Pb(1)C(3)-N(2)-Pb(1)C(3)-N(2)-C(7)O(13)-C(11)-C(7)O(12)-C(11)-O(13)O(12)-C(11)-C(7)C(4)-C(3)-C(8)N(2)-C(3)-C(4)N(2)-C(3)-C(8)1.393(8)1.348(8)1.507(8)1.381(10)1.390(8)1.370(9)1.509(9)1.335(7)1.271(7)116.3(5)119.3(6)119.7(6)125.4(7)118.0(6)116.6(5)118.6(6)122.8(4)117.4(4)119.8(5)117.3(6)124.0(6)118.6(5)122.6(5)121.0(6)116.4(5)
2.4.2 配合物对BSA的荧光猝灭机理
猝灭过程实际上是与发光过程竞争以缩短发光分子的激发态寿命。荧光猝灭分为动态猝灭和静态猝灭。动态猝灭是猝灭剂与荧光团激发态分子之间的相互作用,而静态猝灭是猝灭剂与荧光物质的基态分子之间的相互作用[16]。在分析中用Stern-Volmer方程来确定配合物与BSA之间的相互作用:
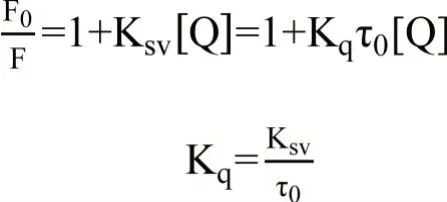
式中,F0为加入猝灭剂前BSA的荧光强度,F为加入猝灭剂后BSA的荧光强度,Ksv为Stern-Volmer猝灭常数,[Q]为猝灭剂浓度,Kq为猝灭速率常数,0为无猝灭剂时荧光体的荧光平均寿命,约10-8s[17]。以F0/F为纵坐标,[Q]为横坐标作图,图9为配合物对BSA的Stern-Volmer荧光猝灭曲线。

图9 不同温度下配合物对BSA的Stern-Volmer荧光猝灭曲线Fig.9 Stern-Volmer plots of BSA quenched by complex at different temperatures
由图9可以看出,Stern-Volmer曲线在配位聚合物测量的浓度范围内具有线性关系,表3显示了根据线性关系计算出的Ksv和Kq值。

表3 不同温度下配合物对BSA的猝灭常数Tab.3 Quenching constants of complex with BSA at different temperatures
由表3可得,在不同温度下,Ksv值随温度的升高而减小,猝灭速率常数Kq值远大于最大扩散碰撞猝灭常数2.0×1010L·mol-1·s-1[18],表明此时BSA荧光猝灭为静态猝灭,在配合物与BSA作用过程中,配合物与BSA的氨基酸残基相互作用形成复合物。
此外,从UV-Vis光谱(图10)来看,加入配合物后,BSA在278 nm处的峰强度逐渐增大,说明配合物与BSA形成了复合物,这也进一步证明了配合物对BSA的静态猝灭机制。

图10 配合物与BSA相互作用的紫外光谱图(298K)Fig.10 UV spectra of BSA with various concentrations of complex at 298 K
2.4.3 配合物与BSA的结合常数和结合位点
为了进一步研究配合物与BSA的结合常数、结合位点,用Scatchard公式进行计算:

式中:F0为加入猝灭剂前BSA的荧光强度,F为加入猝灭剂后BSA的荧光强度,n为结合位点,[Q]为猝灭剂的浓度,Ka为结合常数,以log[Q]为横坐标,log[(F0-F)/F]为纵坐标作双对数曲线(图11),根据双对数曲线的斜率、截距计算得到结合位点n和结合常数Ka,计算结果见表4。298 K时,配合物与BSA的结合位点数为0.838,308 K时,配合物与BSA的结合位点数和结合常数Ka显著降低,表明随着温度的升高配合物与BSA结合的能力减弱,复合物的稳定性降低[19]。
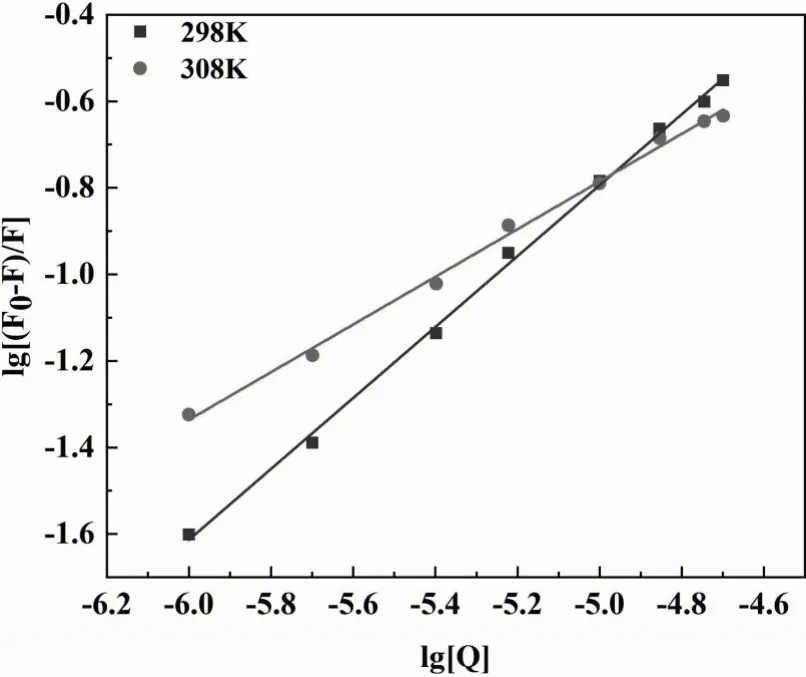
图11 不同温度下配合物对BSA荧光猝灭的双对数曲线Fig.11 Double-log plots of BSA quenched by complex at different temperatures
小分子化合物与BSA等生物聚合物之间的键合力主要包括疏水作用、静电作用、范德华力和分子间氢键。不同的猝灭剂与BSA的结合能力不同,猝灭剂与BSA及其他生物聚合物相互作用的能力可根据热力学参数确定[20]。当ΔH<0,ΔS<0时,猝灭剂与BSA主要通过分子间氢键和范德华力键合;当ΔH<0,ΔS>0时,猝灭剂与BSA主要通过静电作用键合;当ΔH>0,ΔS>0时,猝灭剂与BSA主要通过疏水作用键合。为了阐明本文中配合物与BSA的结合力类型,相关热力学参数由以下公式计算。如果温差不是很大,焓变ΔH、熵变ΔS可看作常数[21]。计算结果见表4。
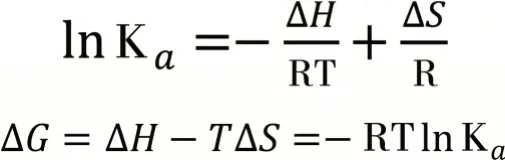
由表4可知,热力学常数ΔH<0,ΔS<0,说明配合物与BSA间主要通过分子间氢键和范德华力键合。在298 K和308 K下,ΔG都小于0,说明是一个自发进行的过程。

表4 不同温度下配合物与BSA的结合常数、结合位点及热力学参数Tab.4 Binding constants,binding sites and thermodynamic parameters of the complex with BSA at different temperatures
2.4.4 配合物与BSA间的能量转移
按照Förster非辐射能量转移理论,如果供能体可以发出荧光,其荧光发射光谱与受能体的UV-Vis光谱有一定的重叠,供能体与受能体间最大间隔在7 nm以下,会产生非辐射能量转移现象,并发生荧光猝灭[22]。两者间能量转移效率E,结合距离r及能量转移距离R0有如下关系:

在方程中,R0是50%能量转移效率下的临界距离;K2是偶极空间取向因子,取2/3;ϕ为供能体的荧光量子产率,取色氨酸量子产率为0.118[23];N为介质的折射率,取1.336;J为供能体的荧光发射光谱与受能体的UV-Vis光谱重叠积分。图12为配合物的UV-Vis光谱与BSA的荧光发射光谱部分重叠图。分别求得J=1.312 5×10-17cm3/(mol·L),E=0.13,R0=2.57 nm,r=3.52 nm。r<7 nm,表明配合物与BSA分子间发生了非辐射能量转移[24]。
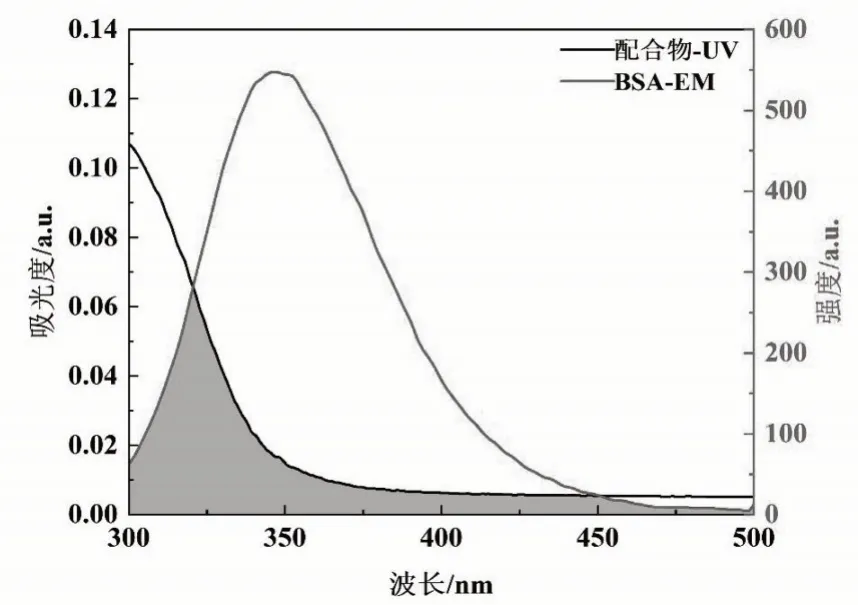
图12 配合物的紫外吸收光谱和BSA的荧光发射光谱重叠图Fig.12 Spectral overlap between absorption spectrum of complex and fluorescence emission spectrum of BSA
3 结论
本研究以吡啶-2,6-二甲酸为配体,室温合成得到吡啶-2,6-二甲酸铅(Ⅱ)配位聚合物,通过水热法培养得到吡啶-2,6-二甲酸铅(Ⅱ)配位聚合物的单晶。通过红外、X射线粉末衍射和X射线单晶衍射等方法进行了表征,结果表明,室温合成和水热法培养得到的吡啶-2,6-二甲酸铅的配位聚合物结构一致。吡啶-2,6-二甲酸铅晶体属于单斜晶系,P21/n空间群,Pb(Ⅱ)为中心,两个中心Pb(Ⅱ)离子通过两个脱质子配体中的羧基氧桥联,形成双核结构。双核分子通过配体中另一个羧基氧相连,形成一维链状结构。一维链通过羧基氧O12和O10与Pb(Ⅱ)进一步桥连,形成二维结构。二维组装模式使配位聚合物表现出良好的热稳定性。采用紫外光谱和荧光光谱研究了配位聚合物与BSA之间的相互作用,结果表明,配位聚合物与BSA的猝灭机制是静态猝灭,配位聚合物与BSA可自发形成复合物,氢键和范德华力在自发结合过程中起重要作用。铅(Ⅱ)与吡啶-2,6-二甲酸形成的配合物与BSA结合作用不强,且随着温度的升高(从298 K至308 K),配位聚合物与BSA的结合位点数和结合常数减小明显,说明以吡啶-2,6-二甲酸为配体捕捉铅(Ⅱ),构建的吡啶-2,6-二甲酸铅(Ⅱ)配位聚合物能减弱铅(Ⅱ)与蛋白质分子的作用,且可通过控温进一步调控配位聚合物与BSA的作用力,有望为有效解决铅的环境污染和铅中毒问题提供一定的参考。
