GPR160信号通路对高糖环境下雪旺氏细胞的保护作用研究
2023-01-07王晨菲张春雪高静
王晨菲,张春雪,高静
(1.新疆医科大学第五附属医院 内分泌科,新疆 乌鲁木齐 830000; 2.新疆医科大学第五附属医院 体检科,新疆 乌鲁木齐 830000)
糖尿病周围神经病变(diabetic peripheral neuropathy, DPN)是糖尿病的主要并发症,具体的发病机制复杂[1]。高血糖诱导的雪旺氏细胞(Schwann cells, SCs)凋亡参与DPN的发病机制,SCs作为外周髓鞘形成细胞,在维持外周神经结构和功能方面发挥着重要作用[2]。高血糖诱导的SCs凋亡是降低神经传导速度和增加热感知阈值、轴突萎缩及DPN脱髓鞘的关键因素[3]。最近的研究[4]表明,内质网(endoplasmic reticulum,ER)应激诱导的细胞凋亡参与了DPN的发病机制。ER应激是由ER中未折叠蛋白或错误折叠蛋白的积累引起的,可以激活未折叠蛋白元件(unfolded protein response, UPR)以恢复ER的稳态。但持续的ER应激也可诱导细胞凋亡,因此,本研究探讨ER应激诱导SCs凋亡的机制,为进一步研究DPN的发病机制提供新的思路。
G蛋白偶联受体(G-protein-coupled receptors, GPCRs)是目前研究最深入的药物靶点,其中关键原因是GPCRs在人类病理生理学和药理学上的可操作性优势。GPCRs调节剂相关的主要疾病指向糖尿病、肥胖和阿尔茨海默病等[4]。其中GPCRs成员G蛋白偶联受体160(G-protein coupled receptor 160, GPR160)的配体可卡因和安非他明调节的转录肽(cocaine-and amphetamine-regulated transcript peptide, CARTp)与神经性疼痛和糖尿病嗜食症密切相关,因此GPR160信号通路是一个有吸引力的DPN治疗靶点。GPR160-CARTp已被确定为神经性疼痛的潜在治疗靶点[5]。以上研究表明,CARTp和GPR160极有可能参与调控DPN的髓鞘病变。然而,目前并不清楚GPR160信号通路对DPN的具体调节作用。本研究旨在探讨GPR160信号通路是否参与高糖诱导的SCs凋亡和ER应激损伤。
1 材料和方法
1.1 试剂耗材
兔抗GPR160的一抗购于瑞典Atlas Antibodies公司(HPA006970);兔抗CARTp的一抗购于美国Santa Cruz生物技术有限公司(sc-293241);兔抗C/EBP-同源蛋白(C/EBP-homologous protein, CHOP)相关的生长阻滞和DNA损伤诱导蛋白34(growth arrest and DNA damage inducing protein 34, GADD34)(ab9869)、兔抗ER氧化还原酶1α(endoplasmic reticulum oxidoreductase1α, Ero1α)(ab223646)、兔抗CHOP上游的蛋白需肌醇酶1(inositol-requiring enzyme-1α, IRE1α)(ab235171)、兔抗X-框结合蛋白1(X-frame binding protein, XBP-1)(ab37152)、兔抗β-肌动蛋白(β-Actin)(ab8227)的一抗以及相应的二抗均购于美国Abcam公司。GPR160的小干扰RNA重组质粒(small interfering RNA recombinant plasmid of GPR160, siGPR160)和小干扰RNA阴性对照(small interfering RNA negative control, siNC)的设计与合成由上海吉玛公司完成。大鼠SCs细胞系RSC96(XY-XB-1191)购于美国典型培养物保藏中心(American Type Culture Collection, ATCC);10%胎牛血清(B7446)购于美国Gibco/英杰公司;Fluo-3(0.5 μmol·L-1)(S1056)购于上海Beyotime公司;聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜(ISEQ00010)和电化学发光(electrochemiluminescence, ECL)(PE0010)试剂购于美国Millipore公司。Annexin V-FITC/PI细胞凋亡检测试剂盒(C1062M)、TRIzol试剂盒(R0016)、逆转录酶试剂盒(D7180M)、M-MLV platinum qPCR试剂盒(D7188L)购于上海碧云天公司。
1.2 细胞培养和分组
RSC96在DMEM培养基中培养,培养基含10%胎牛血清,培养环境为37 ℃及5% CO2。Control组培养于DMEM培养基。150 mmol·L-1葡萄糖(GLU)组将DMEM培养基中的GLU浓度换为150 mmol·L-1,其余处理与Control组一致。siGPR160组和siNC组分别将siGPR160或siNC转染150 mmol·L-1GLU组的RSC96,其余处理与siGPR160组一致。
1.3 蛋白质印迹试验
RSC96以3×105个·孔-1接种在6孔板中,按1.2所述进行处理之后,将细胞在RIPA裂解缓冲液中裂解15 min。使用BCA试剂盒测定蛋白浓度。将20 μg 蛋白在10%SDS-PAGE凝胶中电泳分离,并经湿转法转入PVDF膜上。室温下将PVDF膜用5%脱脂奶粉封闭2 h,随后与一抗在4 ℃下孵育12 h,与二抗室温下孵育1 h,之后在ECL试剂中孵育。β-Actin是内参蛋白,使用ImageJ软件对蛋白进行定量分析。
1.4 RNA提取和实时荧光定量PCR(qRT-PCR)
根据制造商的指南,使用TRIzol试剂盒从组织或细胞中分离和纯化总RNA。使用NanoDrop 1000对RNA的质量和数量进行评估。根据制造商的指南,使用逆转录酶试剂盒合成第1链cDNA。在LightCycler480系统上,用M-MLV platinum qRT-PCR试剂盒进行qRT-PCR。qRT-PCR重复3次,并通过相对定量(2-ΔΔCt)方法计算倍数变化。
1.5 细胞活力的检测
将1.2所述各组RSC96以4×103个·孔-1的浓度接种于96孔板培养48 h,加入100 μl四甲基偶氮唑蓝(MTT)(5 mg·ml-1,Sigma)溶液,37 ℃孵育4 h,随后除去MTT溶液并加入DMSO(150 μl·孔-1)室温孵育10 min,使用SpectraMax Plus384酶标仪(Molecular Devices, Sunnyvale, CA, USA)在490 nm处检测细胞活力。结果以GLU细胞吸光度的百分比表示。
1.6 Ca2+水平的检测
RSC96(4×105个·孔-1,24 h;3×105个·孔-1,48 h)接种在6孔板中,使其贴壁过夜,随后按1.2所述方法进行处理后RSC96用不含EDTA的0.25%胰蛋白酶裂解并收集,用0.5 μmol·L-1Fluo-3在37 ℃ 下孵育30 min。用BD LSRFortessaTM流式细胞仪(BD Biosciences, San Jose, CA, USA)分析Ca2+水平。
1.7 流式细胞术检测细胞凋亡
用Annexin V-FITC/PI细胞凋亡检测试剂盒检测细胞凋亡。将细胞用冷的细胞染色缓冲液洗涤2次,以1.0×106个·ml-1的浓度重悬于Annexin V结合的缓冲液中。随后将细胞涡旋,在黑暗中于25 ℃温育15 min。之后向每个试管中加入400 μl结合缓冲液,通过流式细胞仪分析细胞的凋亡。
1.8 ER超微结构观察
RSC96以合适的浓度(3×105个·孔-1,48 h)接种在6孔板中,使其贴壁过夜,用1.4所述方法处理后,RSC96用0.25%胰蛋白酶(不含EDTA)裂解并以2 000 r·min-1离心5 min,随后用2.5%戊二醛固定3 h,储存在磷酸盐缓冲液中送往透射电子显微镜中心进行超微结构观察。
1.9 统计学处理
应用SPSS 7.0统计软件进行统计学分析,两组之间比较使用t检验,3组及以上比较采用单因素方差分析,两两比较采用LSD-t进行分析。结果以均数±标准差表示,P<0.05为差异有统计学意义。
2 结 果
2.1 GPR160信号通路在高糖诱导的RSC96中的表达
高糖孵育24、48 h后,150 mmol·L-1GLU组中GPR160蛋白和配体CARTp的表达量均明显上调,差异均有统计学意义(均P<0.05)。见图1。
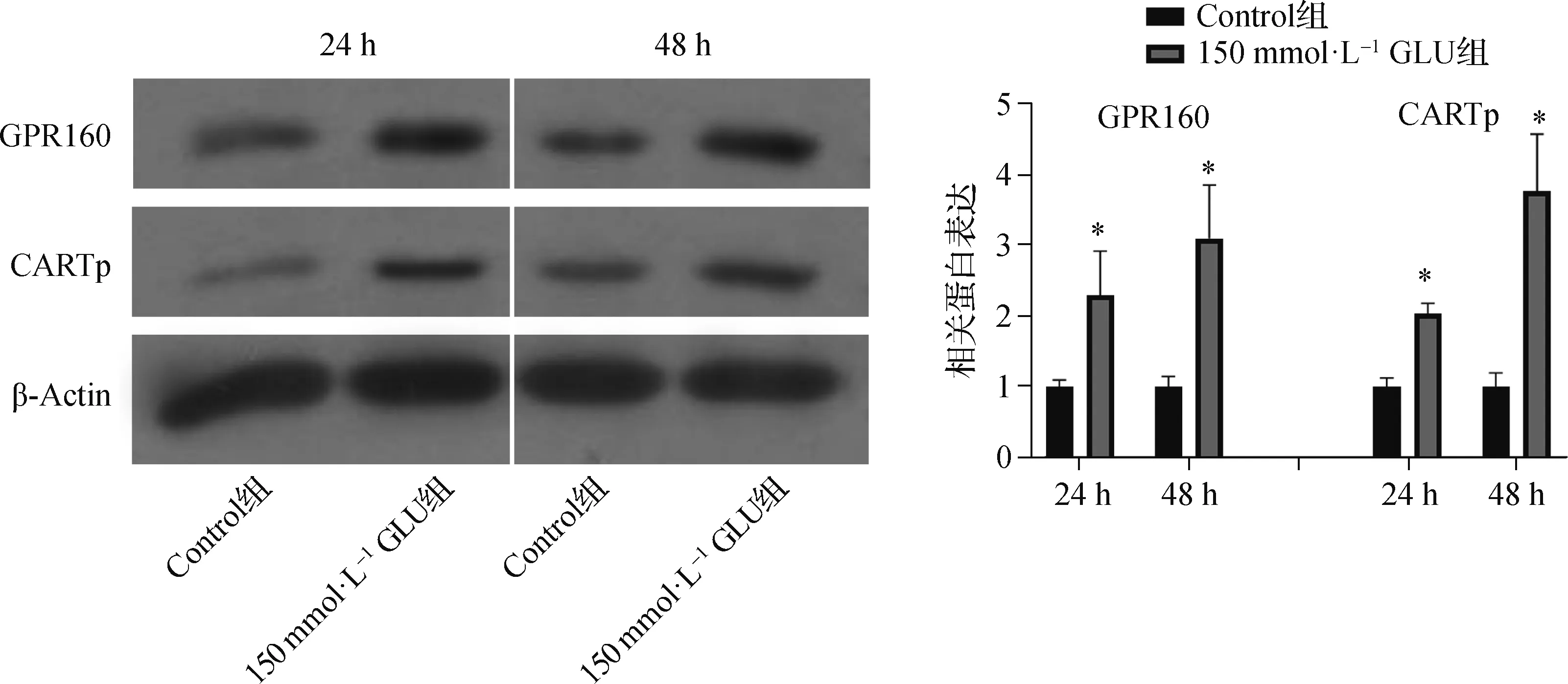
* 与Control组比,P<0.05图1 高糖诱导RSC96中GPR160信号通路蛋白高表达(n=3)
2.2 siGPR160抑制GPR160信号通路改善高糖诱导的细胞毒性
通过MTT法进行细胞活力测试,结果显示siGPR160可以抑制GPR160蛋白和配体CARTp的表达量(P<0.05)。另外,高糖孵育24、48 h后,150 mmol·L-1GLU组细胞活力明显降低(P<0.05);而siGPR160可以增加高糖环境下RSC96的细胞活力(P<0.05)。见图2。

* 与Control组比,P<0.05;# 与150 mmol·L-1 GLU+siNC组比,P<0.05A.qRT-PCR法检测GPR160和CARTp的mRNA水平;B.MTT法检测RSC96细胞的增殖活性图2 GPR160信号通路被siGPR60抑制后改善高糖诱导的RSC96的细胞毒性(n=3)
2.3 siGPR160降低高糖诱导的RSC96细胞凋亡和Ca2+水平
流式细胞仪检测结果显示,150 mmol·L-1GLU组细胞凋亡率较Control组明显升高(P<0.05),而siGPR160导致凋亡率明显降低(P<0.05)。另外,150 mmol·L-1GLU组Ca2+水平较Control组明显升高(P<0.05),siGPR160导致Ca2+水平明显降低(P<0.05)。见图3。

* 与Control组比,P<0.05;# 与150 mmol·L-1 GLU+siNC组比,P<0.05A.通过流式细胞仪检测RSC96的细胞凋亡和统计结果;B.通过流式细胞仪检测RSC96中Ca2+水平的图像和统计结果(n=3)图3 siGPR160降低高糖诱导的RSC96的细胞凋亡率和Ca2+水平
2.4 siGPR160保护高糖环境下ER形态的完整性
如图4所示,48 h Control组ER膜结构清晰完整,而150 mmol·L-1GLU组ER膜形态部分膨润且不均匀,并出现ER的碎片形态。在150 mmol·L-1GLU+siGPR160组中,ER的形态趋于结构完整。

图4 GPR160信号通路在高糖环境下保护ER形态的完整性48 h ER的超微结构(×8 000)
2.5 GPR160信号通路调控ER应激相关蛋白的表达
进一步检测CHOP相关蛋白GADD34和Ero1α的表达发现,150 mmol·L-1GLU组GADD34和Ero1α的表达较Control组明显增加(P<0.05);与150 mmol·L-1GLU+siNC组相比,150 mmol·L-1GLU+siGPR160组GADD34和和Ero1α的表达降低。继续检测CHOP上游蛋白IRE1α和XBP-1的表达发现,与Control组相比,150 mmol·L-1GLU组中IRE1α和XBP-1的表达明显增加(P<0.05),而且与150 mmol·L-1GLU+siNC组相比,150 mmol·L-1GLU+siGPR160组IRE1α和XBP-1的表达明显降低(P<0.05)。见图5。

* 与Control组比,P<0.05;# 与150 mmol·L-1 GLU+siNC组比,P<0.05图5 siGPR160降低高糖诱导的RSC96细胞中GADD34和Ero1α以及CHOP上游蛋白IRE1α和XBP-1的表达(n=3)
3 讨 论
全球糖尿病的发病率一直在上升,每年新增约100万例[6]。由于DPN患者可用药物的副作用,导致不得不停止使用[6]。高糖引起ER应激与DPN的发病机制有关[7],例如在高糖状态下活性氧(reactive oxygen species, ROS)的产生增加[7],长时间接触会耗尽内源性抗氧化防御机制并导致细胞功能障碍和(或)死亡[8]。另外,DPN病理特征是轴突周围的髓鞘出现肿胀、变性、结构异常,又称脱髓鞘性病变。SCs作为外周神经系统中主要的髓鞘形成细胞,在周围神经损伤后修复再生过程中起着关键作用[2]。因此改善高糖引起的SCs损伤有望成为治疗DPN的理想策略。
最新研究表明,GPCR的调制药物主要针对糖尿病、肥胖和阿尔茨海默病[5,9]。CARTp是一种GPCR的配体,研究表明广泛表达于大脑区域的CARTp可参与人体食欲调控,在糖尿病型肥胖大鼠中CARTp的表达明显高于非糖尿病肥胖大鼠,说明CARTp可能具有糖尿病治疗方面的临床应用潜力,但由于CARTp肽受体的缺失,基于CARTp的合适疗法的发展一直处于停滞状态[10-11]。最新研究将GPR160鉴定为CARTp的同源受体,并证明其在疼痛调节中的重要性[12],但有关GPR160和其配体CARTp在DPN中的调节作用还不清楚。本研究通过体外建立高糖诱导SCs模型,我们观察到GPR160和配体CARTp的表达在高糖诱导的SCs中表达明显上调,我们进一步深入探讨了GPR160对高糖诱导的SCs凋亡和ER应激损伤的调节机制。
SCs细胞凋亡是DPN的主要发病机制之一,而之前的研究已经证明GPR160信号通路参与诱导前列腺癌细胞的凋亡并且与细胞周期的阻滞有关[13]。另外,ER是钙的主要储存细胞器,细胞内Ca2+对于ER的发育是必不可少的。钙过载被确定为细胞凋亡的一个因素[14],并参与ER应激[15]。本研究中150 mmol·L-1GLU组Ca2+水平较Control组明显升高,这表明细胞内环境稳态被破坏并导致细胞凋亡,而当使用siGPR160沉默GPR160表达后可以明显降低Ca2+水平。我们利用Annexin V/PI染色的研究同样得到类似结果,提示GPR160信号通路可以抑制高糖诱导的细胞凋亡。
CHOP是ER应激的标志信号,CHOP的上调可以诱导Ero1α和GADD34的表达,Ero1α甚至可以直接引发细胞凋亡,而GADD34导致ER中错误折叠蛋白的合成,因此GADD34/Ero1α激活或高表达可以直接或间接诱导ER应激和细胞凋亡[16-18]。因为GPR160信号通路被siGPR160抑制后降低了高糖诱导的GADD34和Ero1α表达,我们假设这是由于下调CHOP上游蛋白的表达所致。IRE1α是3种未折叠蛋白反应跨膜蛋白之一,可以通过诱导XBP-1的表达来诱导CHOP蛋白的表达,当ER应激发生时,游离IRE1α被二聚化和磷酸化激活,并通过转录因子XBP-1 mRNA的裂解诱导下游XBP-1表达,最终激活下游凋亡蛋白CHOP[19-21]。因此,我们进一步检测了IRE1α和XBP-1的表达,结果表明抑制GPR160信号通路能显著下调高糖SCs模型中的IRE1α和XBP-1的表达。
当ER应激持续时间较长时,ER稳态不能及时恢复;ER凋亡机制被激活。为了探讨GPR160对ER应激损伤的影响,我们利用电子显微镜分析了亚细胞超微结构,观察ER的形态发现150 mmol·L-1GLU组的ER形态部分肿胀甚至破碎,表明ER中蛋白过度积累和细胞内环境稳态被破坏,进而诱发ER应激,然而150 mmol·L-1GLU+siGPR160组中ER形态趋于结构完整,说明抑制GPR160信号通路可以保持ER形态的完整性。
综上所述,沉默GPR160抑制GPR160信号通路降低了高糖诱导的SCs Ca2+水平和细胞凋亡,并且与抑制ER应激细胞凋亡通路中CHOP相关通路有关。本研究表明高糖环境下抑制GPR160信号通路对SCs具有保护作用,GPR160信号通路是DPN中SCs凋亡的潜在治疗靶点。
