红树植物老鼠簕的光合特性及光响应曲线模型
2023-01-07林明伟陈荣强吴志华
林明伟,陈荣强,吴志华*
红树植物老鼠簕的光合特性及光响应曲线模型
林明伟1,陈荣强2,吴志华2*
(1.广东湛江红树林国家级自然保护区管理局,广东 湛江 524094;2.中国林业科学研究院速生树木研究所,广东 湛江 524022)
光响应曲线反映了植物对光能利用的特性。本研究采用6种光合响应模型对红树植物老鼠簕嫩叶和成熟叶进行光合曲线拟合并对其光合特性进行评估。结果发现所有的模型决定系数均在0.9以上,均能很好地解释光响应。不同叶龄叶片对模型拟合影响显著,而模型之间在决定系数2、差异程度较小。非直角双曲线模型适合拟合老鼠簕光合-光响应曲线的模型,利用此模型可有效地对老鼠簕利用效率进行评价。老鼠簕嫩叶和成熟叶光响应曲线模型以及光合特性方面均存在差别,在非直角双曲线模型中,其成熟叶的最大光合速率6.191 μmol·m‒2·s‒1显著高于嫩叶最大光合速率为3.247 μmol·m‒2·s‒1,成熟叶相对嫩叶来说更具有强的光环境适应能力。相关分析表明:光照强度(PAR)与光合速率(Pr)、水气压差(VpdL)和水分利用效率(WUE)具有强的相关性,光合速率(Pr)与胞间CO2浓度(Ci)呈显著负相关,而与蒸腾速率(Tr)、气孔导度(Cond)呈显著正相关(<0.01),气孔导度是限制光合速率的重要因子。
老鼠簕;光合特征;光合响应曲线模型;最大光合速率
光合作用是植物和其他生物体将光能转化为化学能的过程。植物的光合作用由生物物理过程的光反应(光的吸收和能量转移到水反应中心)和生物化学的暗反应(如ATP和NADPH的形成)组成,由于这两个过程易受环境因素(如光、CO2浓度和温度)影响,因此增加了预测环境因子对光合作用影响的复杂性。分析对光合作用影响的各种因素并计算光合作用的特征参数,对预测环境变化对叶片光合产量和净光合作用的影响具有重要意义[1]。
不同光合作用模型用于预测光合作用,以加强对植物光合过程和途径的理解[2]。光响应曲线模型是光合作用对环境因子响应模拟系统的关键核心,构建理想的光响应模型可更客观准确地反映光反应过程[3]。目前植物的光合作用开发了如直角双曲线模型[4]、非直角双曲线模型[5]和直角双曲线修正模型[6]等光响应曲线模型,但这些模型多基于光合作用对CO2反应的Farquhar等生化模型[7],或其他改进型模型[1],它将关键的动力学变量参数化[8],如RuBP羧化酶/加氧酶羧化的最大速率,电子运输的最大速率(Jmax)以及三糖-磷酸的利用(VTPU)。这种生化模型可以量化生化物质的分配与气孔对光合作用中二氧化碳反应的限制[9-10]。不同植物的光响应曲线模型不同,而同一植物的不同的光响应曲线模型在拟合效果以及获得的光响应特征参数亦有所不同。因此,选择合适的光响应曲线模型才能全面地反映植株的光合特性。
红树植物老鼠簕(),为生长于潮间带的非胎生红树林植物真红树,是红树林植物宜生滩涂的先锋植物和重要的建群树种,在我国福建、广东、广西、海南、台湾、香港和澳门7省(区)沿海均有分布[11],在红树林的群落生态演变过程起着重要的作用。老鼠簕为直立灌木,同时叶、根及全株均可入药,为红树林重要的药用植物之一[12]。老鼠簕光合特性是其快速适应滨海环境的重要性状,研究老鼠簕的光响应特性,可为培育老鼠簕高光合效率、速生、生态或经济价值优良的种质提供科学依据。
1 材料与方法
1.1 试验材料
老鼠簕苗龄约1.5年生苗木,苗高约10 ~ 50 cm,2021年4月初采集于广东省雷州市附城镇。
1.2 试验方法
1.2.1 光合指标的测定
在自然光照(10:00—12:00)条件下,使用便携式光合仪(LI-6400XT)测定老鼠簕叶片的光合指标,包括光合速率Pr(Photosynthetic rate, µmol·m‒2·s‒1)、气孔导度Cond(Stomatal conductance,mol H2O m‒2·s‒1)、胞间CO2浓度Ci(Intercellular CO2concentration,μl·L‒1)、蒸腾速率Tr(transpiration rate, mmol·m‒2·s‒1),叶温下水气压差VpdL(mg·L‒1),叶片水分利用效率WUE(=Pr/Tr)。通过将光照强度(PAR)设置为1 200 µmol·m‒2·s‒1,流速设置为500 µmol·s‒1,在当前大气CO2浓度下的CO2浓度[(400±20) µmol·mol‒1,维持环境的稳定性,叶片温度为25±1 °C。在每个枝条的不同部位分别测量,选择不同株的同个部位同个朝向生长一致的健康无病害的3片嫩叶和成熟叶,每个分枝前1 ~ 5片展开叶定义为嫩叶,6 ~ 10片定义为成熟叶,分别测量1 ~ 3个叶片,每次测量3株以上。
1.2.2 光响应曲线的测量
利用LI-6400 XT便携式光合仪(LI-COR,USA),在10:00—12:00之间测定了老鼠簕叶片的光响应曲线。实验装置设置为开放式回路,将CO2保持在400 µmol·mol‒1,气体流速为500 µmol·s‒1,其他参数设置为默认值。使用LED红光和蓝光光源设置了12个光合有效辐射(PAR, µmol·m‒2·s‒1),包括1 600、1 200、800、600、400、200、100、80、50、20、10、0 µmol·m‒2·s‒1。测定不同光照强度下叶片的净光合速率。在测定光合速率之前,在1 200 µmol·m‒2·s‒1的光照强度下诱导2 min,每个光照强度点的等待时间为120 ~ 200 s。
1.2.3 光合拟合模型
光合作用对光响应模型分别如下,根据模型拟合效果选择最优。
1)直角双曲线模型(Model 1)
直角双曲线模型[13]的数学表达式为:

(1)式中为净光合速率,为光强,为光响应曲线的初始斜率,为最大净光合速率,为暗呼吸速率。
2)非直角双曲线模型(Model 2)
非直角双曲线模型[14]的表达式为:

(2)式中为净光合速率,为光强,为曲线的曲率,为植物光合作用对光响应曲线在=0时的斜率,即光响应曲线的初始斜率,也称为初始量子效率,为最大净光合速率,为暗呼吸速率。
3)直角双曲线的修正模型(Model 3)
直角双曲线的修正模型表达式如下[15]:

(3)式中是光响应曲线的初始斜率,和为系数,为光合有效辐射,为暗呼吸。饱和光强用为:

最大净光合速率用为:

4)指数方程
参照文献[16],建立指数方程光响应模型(Model 4):
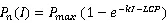
(6)式中为系数,为光补偿点 (µmol·m‒2·s‒1),P(I)、、和的定义与前述相同。
由BASSMAN等[17]的植物光合作用对光响应的指数方程模型(Model 5)的表达式则为:

(7)式中P(I)、、、和的定义与前述相同。
5)Logistic参数方程(Model 6)
以Logistic的四参数方程如下:

(8)式中为系数,拐点处曲线斜率,、分别与、相关的常数,为渐近线估值,指为P(I)为特定处(曲线拐点)的值,P(I)、和的定义与前述相同。
全部模型拟合采用Originlab2021(Corporation)的拟合工具包,Logistic的四参数方程求解采用高斯牛顿迭代法,迭代次数1 000次。
2 结果与分析
2.1 不同光响应曲线模型的差异
光响应曲线可以反映植物利用光照的能力,这也是确定光合作用能力与环境因素之间关系的一个关键工具[18]。R-squared,即决定系数2,表示模型的变异解释量,越趋向1,表明方程的变量对y的解释能力越强,表明模型拟合效果好。残差平方和(, Residual Sum of squares)表示预测值和样本值之间的差异程度。选择6种不同模型的光响应曲线对老鼠簕成熟叶进行拟合,决定系数2均达到0.9以上(图1),其中最小为嫩叶中的Model 4,最大的为成熟叶Model 2和Model 3,可达到1.0,在同一叶型中,各模型在2上无太大的差别。嫩叶总体来说显著低于成熟叶(<0.05),表明成熟叶模型的拟合效果优于嫩叶。由结果可知,同一叶型中决定系数2较大的同时具有相对较小的值,特别是成熟叶的Model 2和Model 3,其很小,表示这些模型均能很好地解释变异数据。
2.2 光响应模型选择
用6种模型进行数据拟合,得到光响应曲线和相应方程及参数(图2 ~ 3)。在嫩叶中Model 1 ~ Model 3均有不错的拟合效果,而在成熟叶中同样有高的2和低值。因此,选择成熟叶中决定系数最大、但在嫩叶决定系数排第二的非直角双曲线模型(Model 2),进一步提取了老鼠簕光响应模型的主要特征参数。
2.3 老鼠簕嫩叶和成熟叶的光合作用特性
由图2 ~ 3可知,在光合有效辐射较低的情况下,嫩叶和成熟叶的净光合速率呈直线快速增加,在1 200 µmol·m‒2·s‒1光合有效辐射时,净光合速率逐渐趋于稳定水平;到达光强1 600 µmol·m‒2·s‒1后,嫩叶和成熟叶均随光合有效辐射的升高还有增加,
说明老鼠簕无论嫩叶和成熟叶光合速率均能适应光强的增加。成熟叶相对嫩叶而言更具有强的光环境适应能力。由图2 C、D拟合结果可知,嫩叶最大光合速率为 3.247 mol·m‒2·s‒1,显著低于成熟叶的光饱和点6.191 mol·m‒2·s‒1。老鼠簕成熟叶暗呼吸Rd为1.164 µmol·m‒2·s‒1,略大于嫩叶1.000 µmol·m‒2·s‒1。嫩叶光响应曲线的初始斜率α为0.125,略大于成熟叶的0.096。总体而言,老鼠簕的嫩叶和成熟叶的光合作用均强,表明老鼠簕能适应强光的滨海环境。
由图4可知,光照强度PAR与光合速率(Pr)、水气压差(VpdL)和水分利用效率(WUE)相关性极显著(<0.01)。光合速率Pr与胞间CO2浓度(Ci)呈显著负相关,相关系数为‒0.97,而与蒸腾速率(Tr)、气孔导度(Cond)呈显著正相关,相关系数分别为0.62、0.53。气孔导度(Cond)与蒸腾速率(Tr)呈正相关,显然气孔的开放程度不但影响胞间CO2浓度,也影响叶片水气压差(VpdL)以及蒸腾代谢,同时也是限制光合速率的重要因子。

图1 老鼠簕几种光响应曲线模型参数

图2 不同模型的老鼠簕嫩叶和成熟叶的光响应曲线
注:A和B为直角双曲线模型Model 1;C和D为非直角双曲线模型Model 2;E和F为直角双曲线的修正模型Model 3。

图3 3种模型的老鼠簕嫩叶和成熟叶的光响应曲线
注:G和H为指数方程Model 4;I和J为指数方程Model 5;K和L为Logistic参数方程Model 6。

图4 老鼠簕光响应下参数相关系数图
3 讨论与结论
光合作用是一个复杂的生理过程[19],经常受到外界条件和内在因素的影响而不断变化。光合作用速率与叶龄密切相关,并且随着叶龄的变化而变化[20]。从叶片萌芽到叶片枯萎过程中,光合速率呈单峰曲线变化[21]。本研究的红树植物老鼠簕成熟叶片的光合速率高于嫩叶,这与赤桉()的研究结果一致[22],其原因可能与嫩叶的叶绿素对强光的敏感性有关。光响应曲线反映了植物光合速率随光照强度而变化情况[23],能很好地对植物光合速率、光饱和点、光补偿点以及植物的其他重要生态和生理参数的进行量化评估[24]。本研究采用6种常见的光响应曲线模型分析了老鼠簕嫩叶和成熟叶的光响应曲线,结果发现所有的模型均能有效解释光响应。经综合对比,不同叶龄类型对模型拟合影响最大,而模型之间差异程度相对较小。一般情况下,模型的参量越多,所获得拟合的效果比较理想。但过多且不确定的参数会使模型变得复杂,也易导致模型容易受到变量过多导致对因子解析的不确定性增加。本研究所使用的模型最多有4个参数,而获得模型最高项次数为二次,模型拟合效果在两种叶片中均有良好的拟合效果,因此模型的适用性较强。不同评估软件在算法上的差异导致所获得的模型参数差异也大。如本研究均采用OriginLab软件拟合评估,结果发现非直角双曲线模型对嫩叶和成熟叶均有好的拟合效果,即具有高的决定系数2和低的,完全适合描述嫩叶和成熟叶光响应曲线变化规律。老鼠簕长期处于高盐高温以及强光的滨海环境中,其光合系统逐步适应了恶劣环境,因此推测老鼠簕的嫩叶和成熟叶之间光对光强响应的差别主要取决于其自身的环境适应性。本研究还表明叶片处于不同方位均存在着明显光响应曲线的差异。尽管老鼠簕耐阴性强,但创造良好环境有助于红树林保护和恢复。
[1] SHARKEY T D, BERNACCHI C J, FARQUHAR G D, et al. Fitting photosynthetic carbon dioxide response curves for C3 leaves[J]. Plant, Cell & Environment, 2007, 30(9): 1035-1040.
[2] FARAZDAGHI H, EDWARDS G E. A Model for photosynthesis and photorespiration in C3 plants based on the biochemistry and stoichiometry of the pathways[J]. Plant, Cell & Environment, 1988, 11(9): 799-809.
[3] SHARP R E, MATTHEWS M A, BOYER J S. Kok effect and the quantum yield of photosynthesis: light partially inhibits dark respiration[J]. Plant physiology, 1984, 75(1): 95-101.
[4] DIAS-FILHO M B. Photosynthetic light response of the C4grassesandunder shade[J]. Scientia Agricola, 2002, 59: 65-68.
[5] KUBISKE M E, PREGITZER K S. Effects of elevated CO2and light availability on the photosynthetic light response of trees of contrasting shade tolerance[J]. Tree physiology, 1996, 16(3): 351-358.
[6] 叶子飘.光合作用对光响应新模型及其应用[J].生物数学学报, 2008, 23(4): 710-716.
[7] FARQUHAR G D, VON CAEMMERER S von, BERRY J A. A biochemical Model of photosynthetic CO2assimilation in leaves of C3species[J].Planta,1980,149(1):78-90.
[8] YE Z P, SUGGETT D J, ROBAKOWSKI P, et al. A mechanistic Model for the photosynthesis–light response based on the photosynthetic electron transport of photosystem II in C3and C4species[J]. New Phytologist, 2013, 199(1): 110-120.
[9] LONG S P, BERNACCHI C J. Gas exchange measurements, what can they tell us about the underlying limitations to photosynthesis? Procedures and sources of error[J]. Journal of experimental botany, 2003, 54(392): 2393-2401.
[10] DUBOIS J J B, FISCUS E L, BOOKER F L, et al. Optimizing the statistical estimation of the parameters of the Farquhar–von Caemmerer–Berry Model of photosynthesis[J]. New Phytologist, 2007, 176(2): 402-414.
[11] 林鹏.中国红树林生态系[M].北京:科学出版社, 1997.
[12] 林鹏,傅勤.中国红树林环境生态及经济利用[M].北京:高等教育出版社, 1995.
[13] BALY E C C. The kinetics of photosynthesis[J]. Proceedings of the Royal Society of London, Series B-Biological Sciences, 1935, 117(804): 218-239.
[14] THORNLEY J H. Mathematical Model s in plant physiology[M]. London: Academic Press, 1976.
[15] YE Z P. A new Model for relationship between irradiance and the rate of photosynthesis in[J]. Photosynthetica, 2007,45(4): 637-640.
[16] 王秀伟, 毛子军.7个光响应曲线模型对不同植物种的实用性[J].植物研究,2009,29(1):43-48.
[17] BASSMAN J H, ZWIER J C. Gas exchange characteristics of,and×clones[J].Tree physiology,1991,8(2):145-159.
[18] 李义博,宋贺,周莉,等.C4植物玉米的光合-光响应曲线模拟研究[J].植物生态学报,2017,41(12):1289-1300.
[19]BASLAM M, MITSUI T, HODGES M, et al. Photosynthesis in a changing global climate: scaling up and scaling down in crops[J]. Frontiers in Plant Science, 2020, 11:882.
[20] ZHAN N, HUANG L, WANG Z, et al. Comparative transcriptomics and bioinformatics analysis of genes related to photosynthesis in[J]. PeerJ, 2022(10):e14351.
[21] SMITH W K, VOGELMANN T C, DELUCIA E H, et al. Leaf form and photosynthesis[J]. BioScience,1997,47(11): 785-793.
[22] SHANG X, ZHANG P, LIU G, et al. Comparative transcriptomics analysis of contrasting varieties ofreveals wind resistance genes[J]. PeerJ, 2022(10): e12954.
[23]POORTER H, NAVAS M L. Plant growth and competition at elevated CO2:on winners, losers and functional groups[J]. New Phytologist, 2003,157(2):175-198.
[24] CANNELL M G R, THORNLEY J H M. Temperature and CO2responses of leaf and canopy photosynthesis: a clarification using the non-rectangular hyperbola Model of photosynthesis[J]. Annals of Botany,1998,82(6):883-892.
Photosynthetic Properties and Light Response Curve Models of Mangrove
LIN Mingwei1, CHEN Rongqiang2, WU Zhihua2*
()
Light response curves can reflect the characteristics of light energy utilization by plants. In this study, six models of light response curves were used to fit the photosynthetic curves of young and mature leaves of. These fitted models were used to assess photosynthetic properties of this species, and all six models had coefficients of determination above 0.9, which could well explain responses of its leaves to light. Differences among young leaves and mature leaves had significant effects on the model fitting, while the difference between various models as judged by R-squared (2, coefficient of determination) and(residual sum of squares) were small. The non-rectangular hyperbolic model was suitable for fitting the light response curves of, and this could be used for evaluating the efficiency ofin utilizing light. With this model, the maximum photosynthetic rate was estimated to be 6.191μmol·m‒2·s‒1in mature leaves and this was significantly higher than that of 3.247μmol·m‒2·s‒1in young leaves. Correlation analysis showed that light intensity (PAR) was strongly correlated with Pr (photosynthetic rate), VpdL(vapor pressure deficit based on leaf temperature), and WUE (water use efficiency), and Pr was strongly negatively correlated with Ci (intercellular CO2concentration), while it was strongly positively correlated with Tr(transpiration rate) and Cond (Stomatal conductance) with significant differences (<0.01). Cond was an important factor in limiting photosynthetic rate.
; photosynthetic characteristic parameters; photosynthetic response model
S718.43
A
10.13987/j.cnki.askj.2022.04.009
广东省重点领域研发计划资助项目(2020B020214001-ZKT03);中央级公益性科研院所基本科研业务费专项资金(CAFYBB2022MA005)
林明伟(1984— ),男,大学,从事红树林资源管理与保育工作。
吴志华,E-mail:wzhua2889@163.com
