以聚乙二醇水凝胶膜为载体构建的角膜上皮移植片对LSCD治疗的可行性
2023-01-07郭译远贤惠敏ShereenTanQiangFu金鑫MarkDanielGregQiao张弘
郭译远 贤惠敏 Shereen Tan Qiang Fu,4 金鑫 Mark Daniel Greg.G.Qiao 张弘
1哈尔滨医科大学附属第一医院眼科医院,哈尔滨 150001;2哈尔滨医科大学附属第二医院心血管内科,哈尔滨 150001;3墨尔本大学化学与生物分子工程系,墨尔本 3001;4悉尼理工大学土木与环境工程系,悉尼 2000;5澳大利亚眼科研究中心皇家维多利亚眼科耳科医院,墨尔本 3002
角膜缘干细胞移植是治疗角膜缘干细胞缺乏症(limbal stem cell deficiency,LSCD)的有效办法,但是由于自体移植取材受限和异体移植排斥反应等问题,移植手术受到较大限制。角膜缘干细胞(limbal stem cells,LSCs)可分化成角膜上皮细胞(corneal epithelial cells,CECs),但手术、外伤、感染等因素损伤LSCs后可引起LSCD,导致角膜完整性和透明性的丧失,最终出现角膜结膜化、血管化等眼表慢性炎症改变[1-2]。目前,LSCs移植手术被认为是恢复LSCs储备、重建眼表结构和治疗LSCD的有效办法。其中,自体角膜缘干细胞移植不存在免疫排斥,移植成功率高,但是仅适合单眼小范围损伤的患者,而且也有因手术操作导致健侧眼出现不可逆损害者。异体角膜缘干细胞移植治疗适合双眼大范围损伤的患者,但存在供体角膜源不足、免疫排斥反应等问题[3]。近年来,随着组织工程学的发展,利用组织工程的方法体外扩增CECs、构建上皮移植片为治疗LSCD提供了新的途径,可以有效解决自体和异体角膜缘干细胞移植的相关问题,为治疗LSCD提供了新途径。载体的正确选择对组织工程的成功具有决定意义,目前常用的CECs载体包括羊膜、丝素蛋白膜、胶原水凝胶、壳聚糖水凝胶等[4-5],这些载体均有透光度较差、供体间差异大、不稳定、机械强度差等缺点[6-7],因此寻找一种合适的CECs组织工程载体势在必行。研究团队前期的实验已经证明,聚乙二醇水凝胶膜(polyethylene glycol hydrogel films,PHFs)作为一种新型扩增载体,具有透光度高、韧性强、免疫排斥反应小、制作成本低、可批量生产等优点[8],推测其可作为载体实现CECs的体外扩增,进而构建工程化角膜上皮,但目前鲜见相关研究报道。本研究拟以PHFs为载体在体外构建工程化角膜上皮移植片并进行LSCD治疗的在体研究,评估该工程化角膜上皮移植片重建眼表结构的可行性,为临床上治疗LSCD提供实验依据。
1 材料与方法
1.1 材料
1.1.1实验动物 健康清洁级新西兰白兔19只,雌雄不限,体质量2~3 kg,兔龄5~6个月,哈尔滨医科大学附属第一医院动物中心提供。本实验方案经哈尔滨医科大学附属第一医院科研和临床试验伦理委员会批准(批文号:2021006)。实验动物的使用遵守美国国立卫生研究院颁布的实验动物使用和护理原则。
1.1.2主要试剂及仪器 癸二酰氯(sebacoyl chloride,SC)、聚氧乙基甘油醚(glycerol ethoxylate,GE)、聚已酸内酯(polycaprolactone,PCL)二醇(美国Sigma-Aldrich公司);甲基噻唑基四唑(methyl thiazolyl tetrazolium,MTT,美国Sigma-Chemical公司);TUNEL检测试剂盒(美国R&D Systems公司);荧光素钠(天津晶明公司);小鼠抗角蛋白(AE1/AE3)抗体(北京中山金桥公司);DAPI(美国Santa Cruz公司);小鼠抗p63抗体(ab110038,英国Abcam公司);山羊抗小鼠IgG抗体(1583138)、猴抗鼠IgG抗体(1608644)(美国Life Technologies公司);妥布霉素地塞米松眼膏(瑞士诺华公司)。扫描电子显微镜(PharosG1,荷兰飞纳公司);手术显微镜(XT-X-8A,湖南梅溪湖新城医疗投资有限公司);光学显微镜(Leica DM1000,德国徕卡公司);裂隙灯显微镜(SL-3G,日本拓普康公司)。
1.2 方法
1.2.1PHFs的合成 将PCL二醇(0.104 g,10 wt% PCL)溶解在二氯甲烷(15 ml)中合成二羟基聚己内酯(dihydroxy polycaprolactone,DPCL)溶液,将GE(0.62 ml,0.70 mmol/L)、SC(0.30 ml,1.42 mmol/L)添加到DPCL溶液中,充分混合,室温静置1 h。取7.5 ml溶液加入直径10 cm玻璃培养皿中,置于真空烤箱中60 ℃加热30 min,取出冷却1 h至室温。用无菌手术刀将膜的周边切除,并在培养皿中加入去离子水20 ml,浸泡15 min,用四氢呋喃水代替去离子水(1∶ 1,40 ml)继续浸泡。将薄膜取出置于250 ml蒸馏水中,每15 min更换1次洗液,重复3次,将PHFs在25 kGy的γ辐照下灭菌。
1.2.2PHFs理化性质检测 (1)PHFs厚度 在低真空条件下,将PHFs安装在碳片上,通过扫描电子显微镜观察薄膜的水化厚度。使用样品架调整倾斜度,观察PHFs的横截面。(2)PHFs透光度 将PHFs在磷酸盐缓冲液(phosphate buffered saline,PBS)中浸泡1 h后置于紫外下照射,记录在25 ℃条件下290~750 nm的透光度。(3)PHFs机械拉伸性能 将PHFs置于PBS溶液中膨胀至平衡,切成2 cm×2 cm大小、骨头形状的薄膜以评价其拉伸性能。在35 ℃水浴温度下,用50-N测压元件以0.1 mm/s速率拉伸被夹住的样品,直至在测量区域发生断裂。所有计算均假设泊松比为0.5。
1.2.3角膜缘上皮细胞的原代培养 取清洁级新西兰大白兔4只,以过量戊巴比妥钠麻醉处死实验兔,无菌条件下迅速摘取8只眼球,用PBS反复冲洗后浸泡于含质量分数3%青链霉素双抗的PBS中。手术显微镜下,按照无菌操作原则,再次将角膜组织用含3%青链霉素双抗的PBS冲洗数次,去除残留结膜组织,切取包括Vogt栅栏区大小约1 mm宽的角膜缘组织,移入超净台内,再次用含双抗的PBS冲洗数次,用眼科显微剪切成约1 mm×1 mm×1 mm大小的组织块,正面朝下贴在24孔板内,置于37 ℃、体积分数5% CO2培养箱内原代培养,隔日换液。待细胞爬满孔底,进行传代培养,倒置显微镜下观察并记录细胞每日生长情况。
1.2.4光学显微镜下观察细胞黏附情况 将细胞分为对照组和PHFs+CECs组,分别种植于普通96孔板和带有PHFs的96孔板中,细胞密度均为30%,24 h后在普通光学显微镜下观察并拍照,随机选取3个相同面积视野计数贴壁细胞数,取平均数。
1.2.5荧光显微镜下观察培养细胞中角蛋白标志物AE1/AE3和干细胞标志物p63的表达 为了确定原代细胞培养纯度和角膜上皮干性,选择AE1/AE3和p63染色进行验证。待细胞长至约80%时,弃去培养液,PBS冲洗;质量分数4%多聚甲醛中固定15 min,PBS冲洗;封闭液(PBS+质量分数10%BSA+体积分数0.1% Triton X-100)封闭1 h;加入一抗(AE1/AE3、p63),4 ℃湿盒过夜,PBS冲洗;加入荧光二抗,室温下避光孵育1 h,PBS冲洗;加入DAPI染核15 min,PBS冲洗;甘油封片,荧光显微镜下观察并记录。阳性率根据荧光染色阳性细胞百分比进行统计,采用免疫组织化学HSCORE定量法进行计算。实验重复3次,取平均值。
1.2.6MTT法检测角膜上皮在PHFs上的增生情况 将细胞分为阴性对照组、阳性对照组和PHFs+CECs组,其中阴性对照组将细胞直接种植在培养皿底,加入普通细胞培养液,阳性对照组将细胞种植在培养皿后加入含有100 μmol/L H2O2的普通细胞培养液,PHF+CECs组将细胞种植在铺有PHFs的培养皿中用普通细胞培养液培养,各组培养24 h。将相同密度和体积的角膜上皮细胞悬液分别接种于96孔板内,每组设6个复孔,96孔板周围用PBS填充,37 ℃、5% CO2培养箱内培养24 h,加入MTT溶液10 μl/孔,培养箱内避光孵育4 h,弃去培养液,加入二甲基亚砜200 μl/孔,室温下置于低速摇床10 min,测定波长490 nm处的吸光度(A490)值。每组实验重复3次,取平均值。
1.2.7TUNEL法检测角膜上皮在PHFs上的凋亡情况 细胞分组处理同1.2.6。将细胞用PBS冲洗3次,4%多聚甲醛固定30 min,体积分数3% H2O2封闭10 min,0.1% Triton在4 ℃穿透3 min,加TUNEL反应混合液(A液和B液体积比为1∶ 9)于37 ℃避光孵育1 h,DAPI避光染核15 min,荧光显微镜下扫描并拍照,根据TUNEL阳性细胞数/DAPI阳性细胞数计算TUNEL阳性细胞率。实验重复3次,取平均值。
1.2.8构建LSCD兔模型及动物实验分组 取清洁级新西兰大白兔15只,在文献[9]方法的基础上加以改良建立LSCD模型。以戊巴比妥钠(40 mg/kg)全身麻醉实验兔,每30 min补充2~4 mg/kg。麻醉后置开睑器,用显微剪环形剪去全周角巩膜缘组织(内2 mm至外2 mm,深度100~150 μm),并用角膜刮匙刮除直径6 mm范围的中央角膜上皮。采用随机数字表法将建模成功的实验兔分为3个组,每组5只,均取右眼为实验眼。对照组为空白对照,造模后不给予任何处置;PHFs组为阴性对照,造模后将直径为12 mm的空PHFs膜置于LSCD兔模型的角膜表面;PHFs+CECs组将CECs传代后同时种植于5个直径为12 mm的PHFs上构建组织工程移植片,细胞密度为(2 118±32)个/cm2,随后将移植片置于LSCD兔模型的角膜表面。所有实验动物完成处置后在上下眼睑正中置褥式牵引缝线,并用活结结扎行暂时性眼睑缝合。各组术后给予左氧氟沙星滴眼液和地塞米松磷酸钠滴眼液点眼,每天3次,连续14 d。
1.2.9荧光素钠染色法检测各组实验兔角膜缺损面积大小 于手术当日(0 d)及术后3、5、7、14 d行角膜荧光素钠染色。实验兔麻醉后,松开褥式缝线的线结,用质量分数0.2%荧光素钠溶液10 μl滴加到实验兔角膜表面,30 s后使用裂隙灯显微镜的钴蓝光观察染色面积,并行眼前节照相。荧光素钠染色评分标准:无损伤为0分,<1/8损伤面积为1分,≥1/8~<1/4损伤面积为2分,≥1/4~<1/2损伤面积为3分,≥1/2损伤面积为4分[10]。实验重复3次,取平均值。完成操作后拉拢褥式缝线继续闭合眼睑。
1.2.10苏木精-伊红染色检测各组实验兔角膜上皮组织学特点 14 d后取下实验兔角膜行苏木精-伊红染色,将组织块用质量分数10%中性甲醛固定后,依次在100%、100%、95%、80%乙醇,以及二甲苯中脱水、透明。石蜡包埋,切片,然后依次在二甲苯、乙醇中脱蜡、水化,用苏木素和伊红染色。接着在不同浓度梯度(100%、100%、95%、80%)的乙醇、二甲苯中脱水透明,甘油封片,光学显微镜下观察并拍照。
1.3 统计学方法

2 结果
2.1 PHFs的理化特性
PHFs是一种人工合成的透明水凝胶薄膜,由DPCL、GE和SC 3种物质在60 ℃下交联而成(图1A)。扫描电子显微镜下可见,PHFs表面光滑、截面均一,厚度不超过150 μm(图1B)。紫外可见光透过率观察进一步显示,当光线从紫外光谱移动到可见光光谱时,PHFs在增加透光率方面与人眼角膜相似,在400~700 nm具有>99%的透过度(图1C)。此外,拉伸测试表明,PHFs拉伸度好,能承受约6 MPa的拉力(图1D),可满足手术操作要求。

图1 PHFs的合成过程及理化特性 A:PHFs合成过程 B:PHFs厚度(标尺=200 μm) C:PHFs透光度 D:PHFs的拉伸能力 PCL:聚已酸内酯;DCL:二氯甲烷;PHFs:聚乙二醇水凝胶膜Figure 1 Synthesis and physicochemical properties of PHFs A:Synthesis of PHFs B:Thickness of PHFs (bar=200 μm) C:Transmittance of PHFs D:Tensile strength of PHFs PCL:polycaprolactone;DCM:dichloromethane;PHFs:polyethylene glycol hydrogel films
2.2 角膜上皮中角蛋白和干细胞标志物的表达
原代细胞培养纯度和角膜上皮干性检测结果显示,AE1/AE3染色后,大部分细胞的细胞质呈红色,阳性率为(98.60±2.40)%(图2);p63染色后,多数细胞的细胞核呈绿色,阳性率为(61.20±3.60)%(图3)。
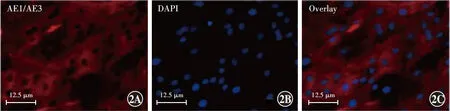
图2 原代培养角膜上皮中角蛋白AE1/AE3的表达(×400,标尺=12.5 μm) AE1/AE3染色后,大部分细胞的细胞质呈红色 A:AE1/AE3染色 B:DAPI染色 C:融合图Figure 2 Expression of keratin AE1/AE3 in primary cultured corneal epithelium (×400,bar=12.5 μm) Red AE1/AE3 staining was seen in cytoplasm of most cells A:AE1/AE3 staining B:DAPI staining C:Overlay

图3 原代培养角膜上皮中角蛋白p63的表达(×400,标尺=12.5 μm) AE1/AE3染色后,大部分细胞的细胞核呈绿色 A:p63染色 B:DAPI染色 C:融合图Figure 3 Expression of keratin p63 in primary cultured corneal epithelium (×400,bar=12.5 μm)Green p63 staining was seen in nuclei of most cells A:p63 staining B:DAPI staining C:Overlay
2.3 各组PHFs上的细胞黏附情况比较
细胞贴壁结果显示,PHFs+CECs组和对照组贴壁细胞数分别为(2 282.33±144.00)个/cm2和(2 148.00±77.60)个/cm2,差异无统计学意义(t=1.70,P>0.05)。继续培养3 d,可见2个组细胞均呈圆形或椭圆形,排列紧密,细胞形态及大体数目均无明显差异(图4)。

图4 PHFs+CECs组与对照组细胞黏附情况比较(×100,标尺=200 μm) PHFs+CECs组细胞贴壁数目与对照组相比无明显差异A:对照组 B:PHFs+CSCs组Figure 4 Cell adhesion in two groups (×100,bar=200 μm) There was no significant difference in the number of adherent cells between control group and PHFs+CECs group A:control group B:PHFs+CSCs group
2.4 各组PHFs的细胞毒性比较
MTT实验结果显示,PHFs+CECs组、阴性对照组和阳性对照组A490值分别为0.59±0.01、0.65±0.07和0.06±0.04,总体比较差异有统计学意义(F=12.25,P<0.05),其中PHFs+CECs组和阴性对照组A490值明显大于阳性对照组,差异有统计学意义(均P<0.05)。TUNEL检测结果显示,PHFs+CECs组和阴性对照组无TUNEL阳性细胞,阳性对照组可见较多TUNEL阳性细胞。PHFs+CECs组、阴性对照组和阳性对照组TUNEL阳性细胞率分别为(1.68±0.25)%、(1.17±0.36)%和(62.35±3.68)%,总体比较差异有统计学意义(F=13.45,P<0.05),其中PHFs+CECs组和阴性对照组TUNEL阳性细胞率明显低于阳性对照组,差异均有统计学意义(均P<0.05)(图5)。
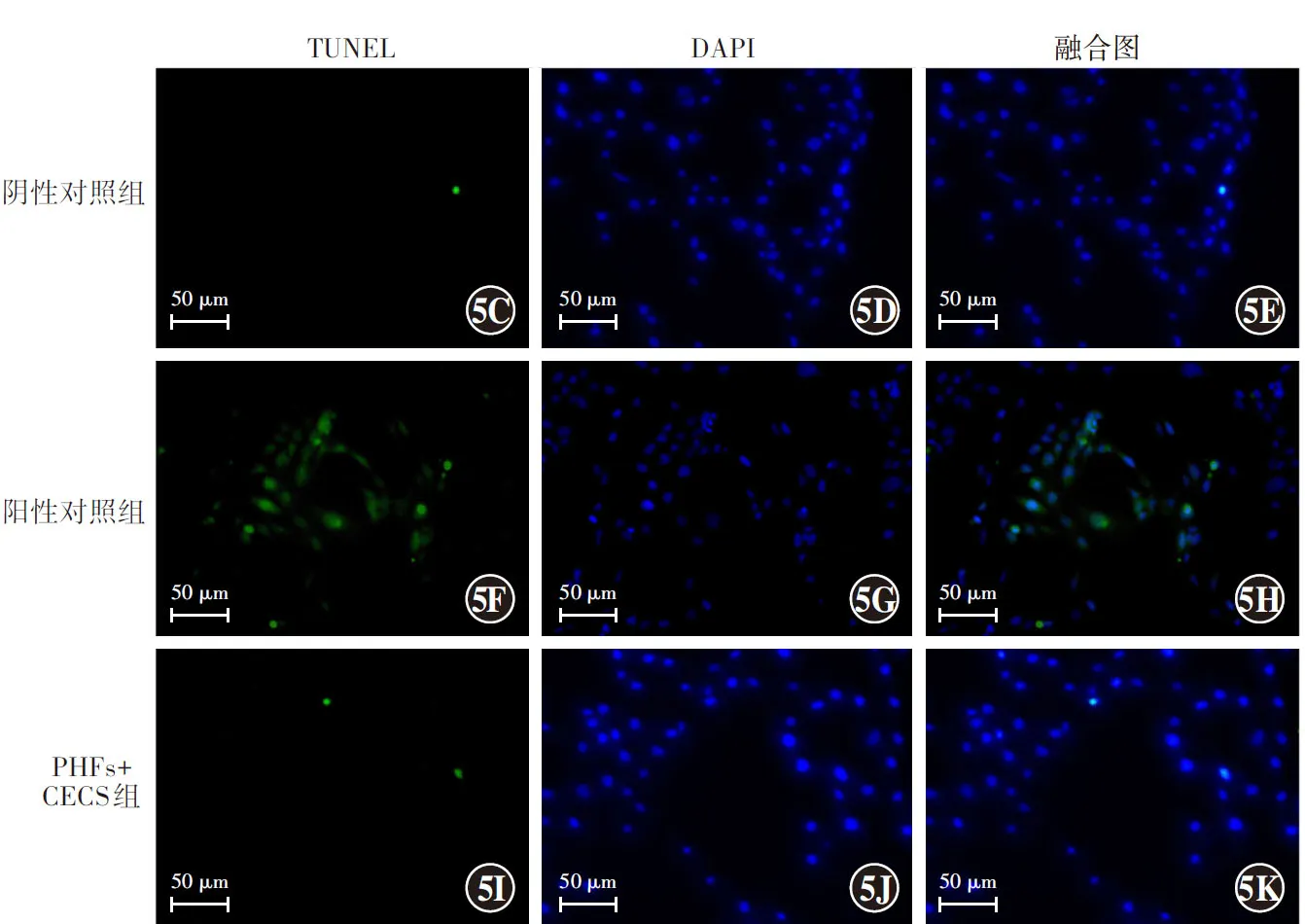
图5 各组PHFs的细胞毒性情况比较 A:3个组A490值比较 F=12.25,P<0.05.与阳性对照组比较,aP<0.05(单因素方差分析,LSD-t检验,n=3) B:3个组细胞凋亡率比较 F=13.45,P<0.05.与阳性对照组比较,aP<0.05(单因素方差分析,LSD-t检验,n=3) C:各组TUNEL染色情况(×400,标尺=50 μm) PHFs+CECs组和阴性对照组均未见细胞核着染为绿色(TUNEL阳性细胞),阳性对照组可见较多细胞核着染为绿色;所有细胞核着染为蓝色,3个组蓝色细胞核数量接近 PHFs:聚乙二醇水凝胶膜;CECs:角膜上皮细胞Figure 5 Comparison of cytotoxicity of PHFs among three groups A:Comparison of A490 values F=12.25,P<0.05.Compared with positive control group,aP<0.05 (One-way ANOVA,LSD-t test,n=3) B:Comparison of apoptosis rates F=13.45,P<0.05.Compared with positive control group,aP<0.05 (One-way ANOVA,LSD-t test,n=3) C:TUNEL staining (×400,bar=50 μm) Green nuclear staining of TUNEL-positive cells was not seen in PHFs+CECs group and negative control group,and was observed in positive control group.The nuclei of all cells were stained blue,and the number of blue nuclei in the three groups was similar PHFs:polyethylene glycol hydrogel films;CECs:corneal epithelial cells
2.5 各组LSCD实验兔角膜缺损面积和角膜上皮组织学特点比较
荧光素染色结果显示,造模前,3个组实验兔眼表均未见荧光染色;手术当日(0 d),3个组实验兔眼表满布绿色荧光,证明LSCD模型造模成功。随着术后时间的延长,各组角膜荧光素钠染色评分均降低,对照组、PHFs组和PHFs+CECs组角膜荧光素钠染色评分依次降低,3个组不同时间点荧光素钠染色评分总体比较,差异均有统计学意义(F分组=41.81,P<0.01;F时间=42.52,P<0.01),其中对照组术后7 d角膜荧光素钠染色评分明显低于术后3 d,PHFs组术后0、3、7、14 d角膜荧光素钠染色评分均较前一时间点明显降低,PHFs+CECs组荧光素钠染色评分术后3 d较术后0 d、术后7 d较术后3 d均明显降低,差异均有统计学意义(均P<0.05);术后3、7、14 d,PHFs+CECs组荧光素钠染色评分均明显低于对照组和PHFs组,差异均有统计学意义(均P<0.05)(图6A,表1)。
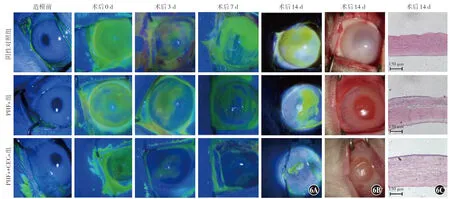
图6 各组LSCD兔角膜缺损面积和角膜上皮组织学特点比较 A:造模前,3个组实验兔眼表均未见荧光染色;手术当日(0 d),3个组实验兔眼表布满绿色荧光,随着术后时间的延长,各组角膜荧光染色逐渐减少 B:对照组结膜重度水肿,出现大量分泌物,角膜混浊呈白色,虹膜窥不清;PHFs组结膜轻度水肿,角膜弥漫水肿,虹膜轻度充血;PHFs+CECs组结膜无水肿,角膜局部水肿,虹膜正常 C:苏木精-伊红染色结果显示,对照组存在较少形状不规则的角膜上皮细胞,PHFs组一些区域出现单层稀疏的角膜上皮细胞;PHFs+CECs组角膜上皮覆盖范围最大,细胞层数增加到3~5层,形态较规则,排列较紧密(×100,标尺=150 μm) PHFs:聚乙二醇水凝胶膜;CECs:角膜上皮细胞Figure 6 Comparison of corneal defect area and histological characteristics of corneal epithelium in LSCD rabbits A:Before modeling,no luciferin sodium staining was observed on the ocular surface of rabbits in the three groups.On the day of operation (0 d),the ocular surface of rabbits in the three groups was full of luciferin sodium staining,and the staining decreased gradually with the extension of postoperative time B:In control group,severe conjunctival edema,a large amount of secretions,turbid and white cornea as well as unclear iris were observed.In PHFs group,mild conjunctival edema,diffuse corneal edema and mild iris congestion were seen.In PHFs+CECs group,conjunctival edema was not found,and local corneal edema were seen and iris was normal C:Hematoxylin-eosin staining results showed that there were fewer irregularly shaped corneal epithelial cells in the control group,while a single layer of sparse corneal epithelial cells appeared in some areas of the PHFs group.In the PHFs+CECs group,the corneal epithelium coverage was the largest,and the cell layers increased to 3-5.The morphology was regular and the arrangement was close (×100,bar=150 μm) PHFs:polyethylene glycol hydrogel films;CECs:corneal epithelial cells

表1 各组LSCD实验兔不同时间点角膜荧光素钠染色评分比较(x±s,分)Table 1 Comparison of corneal fluorescein sodium staining scores of LSCDrabbits among different groups at different time points (x±s,score)组别样本量不同时间点荧光素钠染色评分0 d3 d7 d14 d对照组54.00±0.003.60±0.552.60±0.55b2.00±0.71PHFs组54.00±0.003.40±0.55a2.20±0.45b1.60±0.55cPHFs+CECs组54.00±0.001.80±0.45ade0.60±0.55bde0.20±0.45de 注:F分组=41.81,P<0.01;F时间=42.52,P<0.01;F交互作用=0.13,P=0.97.与同组0 d比较,aP<0.05;与同组3 d比较,bP<0.05;与同组7 d比较,cP<0.05;与同时间点对照组比较,dP<0.05;与同时间点PHFs组比较,eP<0.05(重复测量两因素方差分析,LSD-t检验) LSCD:角膜缘干细胞缺乏症;PHFs:聚乙二醇水凝胶膜;CECs:角膜上皮细胞 Note:Fgroup=41.81,P<0.01;Ftime=42.52,P<0.01;Finteraction=0.13,P=0.97.Compared with the same group at day 0,aP<0.05;compared with the same group at day 3,bP<0.05;compared with the same group at day 7,cP<0.05;compared with control group at corresponding time points,dP<0.05;compared with PHFs group at corresponding time points,eP<0.05 (Two-way re-peated measures ANOVA,LSD-t test) LSCD:limbal stem cell deficiency;PHFs:polyethylene glycol hydrogel films;;CECs:corneal epithelial cells
裂隙灯显微镜普通光照下观察可见,14 d时对照组结膜重度水肿,出现大量分泌物,角膜混浊呈白色,虹膜窥不清;PHFs组结膜轻度水肿,角膜弥漫水肿,虹膜轻度充血;PHFs+CECs组结膜无水肿,角膜局部水肿,虹膜正常(图6B)。
苏木精-伊红染色结果显示,对照组存在较少形状不规则的角膜上皮细胞,甚至一些区域未再上皮化,与上述荧光素结果一致;PHFs组一些区域出现单层稀疏的角膜上皮细胞,再上皮化不明显;PHFs+CECs组角膜上皮的覆盖范围最大,细胞层数增加到3~5层,形态较规则,排列较紧密(图6C)。
3 讨论
组织工程为角膜上皮移植片提供了批量生产的途径,并且克服了自体移植取材受限和异体移植的排斥反应问题,是目前较优越的治疗方法。但是不同的载体各有优缺点,目前组织工程学常用的载体是羊膜,但羊膜作为一种天然生物材料,各批次之间差异大、存在疾病传播风险等[11]。合成生物材料领域中研究较热的载体包括胶原、丝素蛋白、角蛋白、温敏材料、壳聚糖等,但存在韧性差、降解过快、透明度差、强度不足等问题[12]。所以,寻找并构建一种更适合角膜上皮种子细胞生长、生物相容性更高、免疫排斥反应更小的载体支架势在必行。
本实验制备了一种超薄PEG水凝胶膜PHFs,从体外和体内水平研究了其作为角膜上皮细胞体外扩增的载体并移植用于治疗兔LSCD的可行性,结果显示PHFs较薄、韧性强、透光度高、安全无毒、生物相容性好,适合用作角膜上皮移植片;PHFs能够体外扩增、移植角膜上皮并促进兔LSCD角膜的再上皮化。
水凝胶是一种具有网络结构的亲水性多聚物,与细胞外基质成分相似,既能保持一定的形状,又能吸收大量的水分[13-14]。这种结构使其具有良好的生物相容性,并且对水溶性代谢产物,如葡萄糖、氧气等有很高的通透性[15],目前已经广泛应用于组织工程支架、药物释放系统、软组织替代物等生物领域。水凝胶可分为天然水凝胶和合成水凝胶,天然水凝胶主要包括海藻酸、透明质酸、壳聚糖、胶原、纤维素等[16],合成水凝胶主要包括聚乙二醇(polyethylene glycol,PEG)、聚丙烯酸、聚甲基丙烯酸羟乙酯、聚丙烯酸-2-羟乙酯等[17-20]。PHFs最重要的组成部分PEG水凝胶具有无毒、透明、稳定、生物相容性好、免疫原性低、抑制非特异性蛋白吸收、融合生物物理和生物化学特性等优点[21-23]。我们前期利用PHFs体外扩增了角膜内皮[8],为进一步扩增角膜上皮提供了充分的研究基础。本研究中通过对PHFs的理化特性分析可知,合成的PHFs厚度较薄、表面光滑、韧性强、透明度高,满足了成为合格的眼表载体所需要的物理条件。此外,用于合成PHFs的3种化学成分癸二酰氯、聚氧乙基甘油醚、聚已酸内酯二醇均无化学毒性。癸二酰氯是一种二酸,来自于天然的癸二酸[24]。聚氧乙基甘油醚是一种无毒的亲水性支状聚合物,由3个聚乙二醇臂组成,广泛用于纺织工业、润滑油、金属清洗、造纸工业、印染工业、石油工业等。聚已酸内酯二醇是一种可生物降解的无毒性脂肪族聚酯,可赋予材料高拉伸伸长率性能,已获得美国食品药品监督管理局批准用于人体[5]。本研究体外细胞毒性和凋亡实验结果证实,PHFs及其降解产物不会对细胞增生产生影响。
水凝胶能使细胞黏附及生长是其可以用于组织工程材料领域的关键。本研究角膜缘细胞黏附测试结果表明,在PHFs上和普通培养皿上细胞贴壁能力相似。以往用PEG作为细胞载体的研究,由于PEG的抗蛋白特性,在使用PEG材料时必须加入胶原或其他黏着剂以利于细胞黏附和贴壁[23]。
构建角膜移植片的关键,除了制备具有优良特性的载体外,提供优质的供体细胞也至关重要。本实验通过角膜缘组织的原代培养,提供具有更高干性的角膜上皮细胞。为了验证供体细胞的种类和计算干细胞比例,使用荧光颜料进行角蛋白和干细胞标志物的观察。AE1/AE3能特异性地识别包括CK3在内的一组酸性角蛋白,在角膜缘处的角膜上皮中呈阳性反应,在角膜中央处的角膜上皮中呈阴性反应[24]。p63是一种触发角化细胞分化的核转录因子,在角膜中主要表达于角膜缘上皮的基底层,被认为是LSCs的特异性标志物[25]。本实验获得的供体细胞是纯度较高、干性较强的角膜上皮细胞,为今后实验兔眼表角膜上皮的再生可以提供充足的来源。
LSCs是角膜上皮细胞再生的来源,若角膜干细胞保存完好,则角膜上皮在2~3 d内可恢复完全。因此,本研究选择在刮除角膜上皮的基础上,进一步剪除部分角膜缘组织,延缓角膜上皮修复,利于实验观察。体内实验中,携载角膜上皮的PHFs移植片对上皮缺损的恢复十分有利,14 d后角膜缺损面积大幅度缩小,剩余约5%,证明角膜上皮细胞再生能力较强,能覆盖整个眼表,形态正常。此外,角膜水肿、角膜透明度、新生血管程度较对照组均有所改善,由此证明PHFs是携载及移植角膜上皮细胞的优良载体,并且对眼部无毒性。我们前期将PHFs角膜内皮移植片移植到LSCD实验兔角膜内表面,经过28 d的裂隙灯显微镜下观察,亦发现PHFs内皮移植组的角膜依然保持透明,无角膜水肿等毒性表现[8]。由于在合成生物材料领域中,尚无已上市、公认的眼科材料可以作为阳性对照,所以本研究体内实验仅选择空白PHFs作为阴性对照。结果显示,无上皮细胞携载的PHFs移植片虽然对角膜上皮的恢复影响不大,但是与对照组相比,仍能起到一定的修复作用,推测与该膜减少了眼睑摩擦对角膜上皮再生的损害有关。
本研究PHFs动物实验结果为日后进一步开展LSCD患者的临床试验提供了基础。PHFs的使用将在一定程度上缓解角膜供体资源紧张的压力,扩宽角膜移植手术的思路。此外,PHFs载体的合成为角膜组织工程学提供了新的依据,PHFs不仅可以作为其他实验细胞移植的载体,还可以作为人工合成载体材料的模板。关于PHFs的研究尚有很多问题有待解决,如PHFs的镜片含水量、透氧率是否能够满足要求,PHFs的降解产物进入血液循环后是否会影响其他器官的功能、工程化角膜上皮移植片的免疫排斥等相关问题,我们将在后续研究中进一步探讨。
利益冲突本研究所有作者均声明与任何组织或实体无任何相关的利益冲突
作者贡献声明郭译远:参与设计实验、实施研究、采集整理数据、分析解释数据、论文撰写;贤惠敏、Shereen Tan、Qiang Fu:参与实施研究、采集数据、分析解释数据、论文撰写;金鑫:参与设计实验、数据整理;Mark Daniel、Greg.G.Qiao:参与分析解释数据、对文章的知识性内容作批评性审阅;张弘:参与设计实验、分析解释数据、对文章的知识性内容作批评性审阅
