多数据库联合分析宫颈癌中CXCL1的表达及意义
2023-01-07李末娟广东医科大学广东湛江5403佛山市南海区医院妇科58099广东佛山
刘 静,王 帅,李末娟,叶 国,黄 浩* (.广东医科大学,广东湛江 5403;.佛山市南海区医院妇科,58099 广东佛山)
宫颈癌占全球女性癌症发病率和死亡率的第4位,给社会带来沉重的负担[1]。持续的人乳头瘤病毒(HPV)感染是宫颈癌最常见的病因[2]。在感染HPV 的女性中,炎症持续存在是导致宫颈上皮恶性转化的原因[3],这表明癌症相关的炎症反应可能参与宫颈癌的发病机制。CXCL1基因编码的蛋白质是CXC 趋化因子家族的成员,是炎症反应的主要介质,广泛表达于多种组织中,并参与肿瘤的发生与发展[4]。趋化因子在激活宫颈癌进展中的免疫检查点调节剂中起关键作用,并且与肿瘤细胞增殖、侵袭、血管生成、化疗耐药和免疫抑制的预后相关。目前已有研究初步表明宫颈癌中CXCL1的表达上调,且高表达的CXCL1与较差的预后相关[5-7],但对于CXCL1的研究不够深入。本研究通过基于癌症基因组图谱(TCGA)、基因表达谱交互式分析2(GEPIA2)、Kaplan-Meier Plotter、LinkedOmics、TIMER 等数据库对CXCL1进行生物信息学分析,探索CXCL1在宫颈癌中表达的临床意义及生物学作用,从而为宫颈癌治疗的基础及临床研究提供参考。
1 资料和方法
1.1 基于GEPIA2 和Kaplan-Meier Plotter 数据库的分析
GEPIA2 数据库具有来自TCGA 和基因型-组织表达(GTEx)的基因表达数据,通过GEPIA2 分析CXCL1在泛癌中的表达水平,并进一步通过其在线工具“Expression DIY”和“Survival Plots”分析CXCL1在宫颈癌中的表达水平及其对生存结局的影响。Kaplan-Meier Plotter 数据库是一个公开的综合数据库,用于评估基因表达与多种癌症的生存结局之间的关系,使用该数据库进一步验证CXCL1mRNA 表达水平与宫颈癌预后的相关性。
1.2 TCGA 数据提取
从TCGA 数据库中提取宫颈癌mRNA 表达谱数据,格式为RNA-Seq-FPKM,同时下载相应的患者临床数据,宫颈癌的少见类型如囊性、黏液性、浆液性肿瘤和复杂的上皮肿瘤未被纳入研究。
1.3 生存预后分析及列线图绘制
使用R 软件包“limma”“survival”“survminer”“timeROC”分析TCGA 的RNA-Seq-FPKM 数据及临床数据,分析宫颈癌患者中CXCL1高低表达两组生存结局的差异,并绘制ROC 曲线。使用R 软件包“rms”对以上数据进行多变量Cox 分析绘制列线图(Nomogram),以评估影响患者预后的相关因素,纳入因素包括肿瘤分级、分期、年龄、CXCL1基因表达量。
1.4 基于LinkedOmics 和GEPIA2 数据库的分析
LinkedOmics 是一个公共数据库,包含来自32 种TCGA 癌症类型的多维数据。基于LinkedOmics 中的“LinkFinder”模块,使用Spearman 检验对CXCL1进行共表达统计分析,结果显示为火山图(横坐标为r值,纵坐标为P值)。使用GEPIA2 数据库生成与CXCL1相关的显著表达基因的热图。在LinkedOmics 中的“LinkInterpreter”模块中,本文通过基因集富集分析(GSEA)进行基因本体(GO)分析和京都基因与基因组百科全书途径(KEGG)分析,筛选标准设定为FDR<0.05。GO 富集分析,包括细胞成分(CC)、分子功能(MF)和生物过程(BP)。KEGG 用于分析包含富集基因的生物途径。
1.5 基于TIMER 数据库的分析
肿瘤免疫评估资源(TIMER)数据库是一个系统分析多种癌症与免疫细胞浸润相关的大型综合数据库,基于TIMER 数据库评估CXCL1表达水平和免疫细胞浸润之间的相关性。此外,通过使用TIMER 数据库中的Spearman 相关分析,本文评估CXCL1表达与免疫检查点CD276、PVRL2、TGFBR1的相关性。
2 结果
2.1 宫颈癌中CXCL1 的表达量及其与生存结局的相关性
将CXCL1输入GEPIA2 在线工具进行泛癌分析,发现CXCL1在宫颈鳞癌和腺癌(CESC)、胆管癌(CHOL)、结肠癌(COAD)等多个癌组织中均高表达(图1A)。通过“Expression DIY”和“Survival Plots”模块分析得出CXCL1在宫颈癌中显著高表达,且高表达CXCL1与较差的总生存期(OS)相关(P<0.05)(图1B~C)。通过Kaplan-Meier Plotter 数据库对CXCL1进行生存分析,结果提示CXCL1高表达组无进展生存期(PFS)和OS 较低表达组更短(P<0.05),见图1D~E。

图1 基于GEPIA2 和Kaplan-Meier Plotter 数据库分析CESC 中CXCL1 的表达情况及预后相关性图
2.2 验证CESC 中CXCL1 的表达量与及其与生存结局的相关性
根据CXCL1的表达量将TCGA 宫颈癌患者分为高、低表达两组,结果显示CXCL1高表达组与较差的OS 和PFS 相关(图2A~B)。通过Roc 曲线评估的结果显示CXCL1表达量对宫颈癌患者1、3、5 a 生存结局预测的准确性较高(图2C)。此外,将CXCL1基因表达量、年龄、肿瘤分级和TNM 分期纳入在内进行列线图的绘制,结果显示对1、3 a 总生存率有良好的预测精度,见图3。

图2 基于TCGA 数据库使用R 语言验证CESC 中CXCL1 表达与预后的相关性
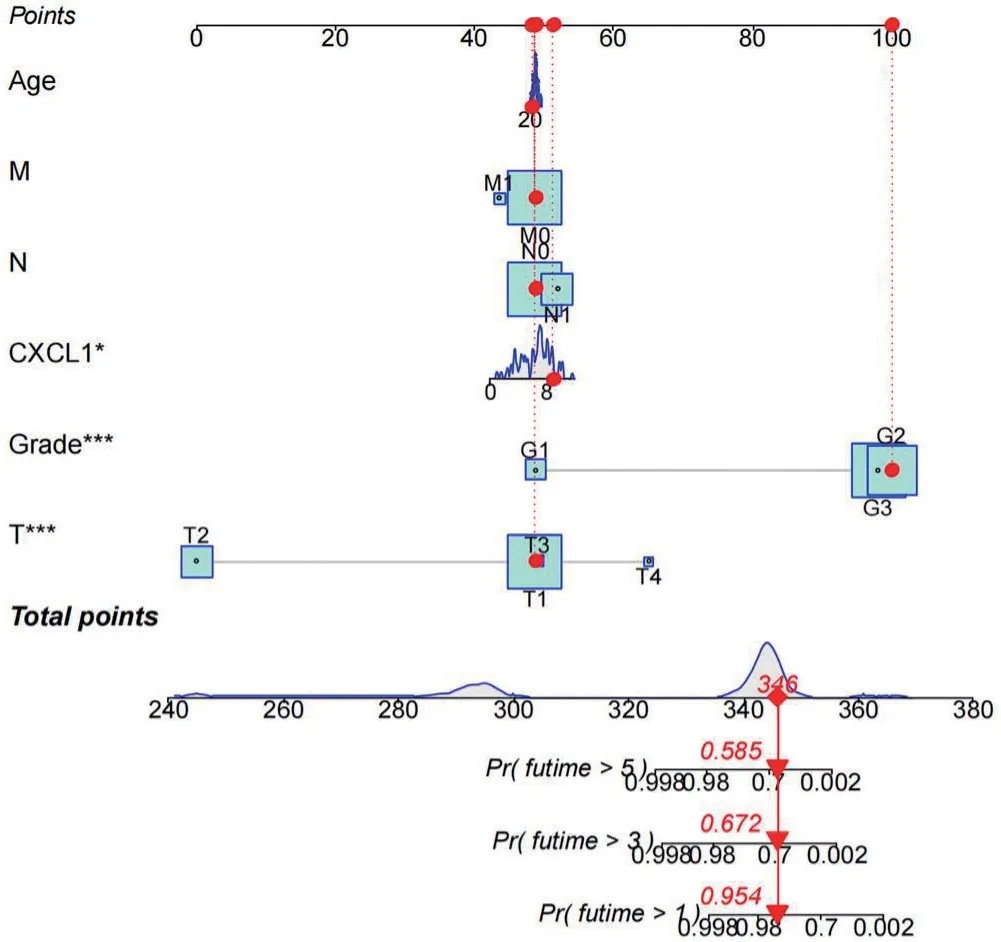
图3 纳入CXCL1 表达量、年龄、肿瘤分级和TNM 分期绘制列线图
2.3 基于LinkedOmics 数据库的共表达及功能富集分析
为进一步探究CXCL1在CESC 中的意义,使用LinkedOmics 中的“LinkFinder”模块探索CXCL1的共表达基因。结果显示在CESC 中,有7 922 个基因(深红点)与CXCL1呈正相关,有11 982 个基因(深绿点)与CXCL1呈负相关(P<0.05)(火山图4A)。图4B、C显示与CXCL1明显相关(正相关和负相关)的前50个基因,其中14/50 个正相关基因具有高风险比(P<0.05),11/50 个负相关基因(P<0.05)具有低风险比。对以上共表达基因进行富集分析,BP 分析表明共表达基因在急性炎症反应、细胞对脂多糖的反应、肽基酪氨酸磷酸化的正调控等过程中显著富集(图5A)。CC 分析表明共表达基因主要在bcl3/NF-kappaB2 复合物中富集(图5B)。MF 分析表明共表达基因主要富集于泛酸水解酶活性、趋化因子受体结合(图5C)。KEGG 富集分析表明共表达基因在IL-17 信号通路、泛酸和辅酶A 的生物合成等途径中富集(图5D)。

图4 基于LinkedOmics 数据库的共表达分析图
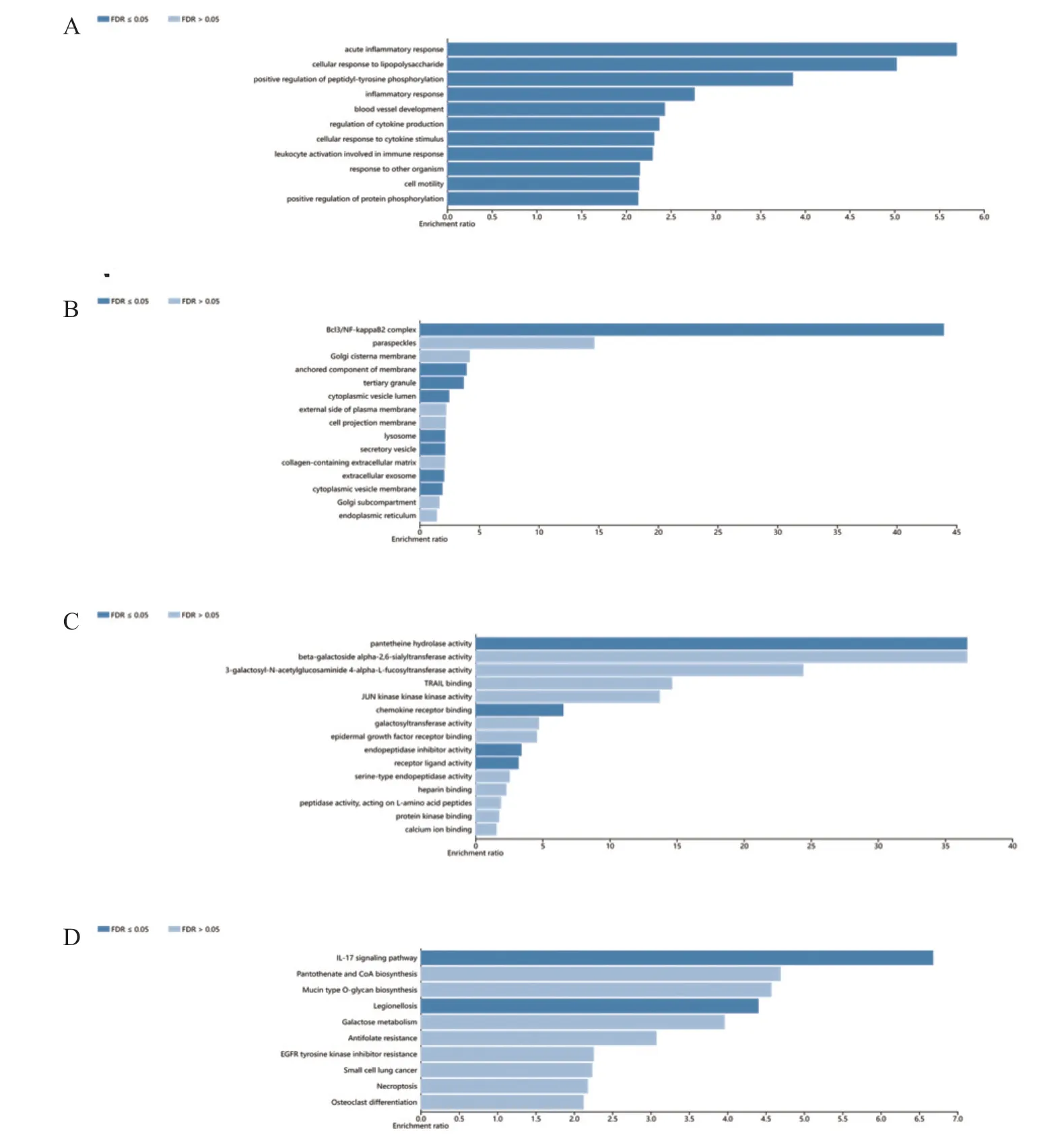
图5 基于LinkedOmics 数据库的功能富集分析图
2.4 免疫浸润分析
基于TIMER 数据库,使用Spearman 检验探索CXCL1与免疫浸润细胞的相关性,发现在CESC 中CXCL1表达量与肿瘤细胞纯度、CD8+T 细胞、M1 巨噬细胞呈负相关;与浆细胞、中性粒细胞、静息NK 细胞、CD4+静息记忆性T 细胞呈正相关(均P<0.05),见图6。

图6 基于TIMER 数据库分析CXCL1 表达与免疫浸润细胞的相关性
2.5 CXCL1 表达量与免疫检查点表达量相关性
TIMER 数据库分析显示,CXCL1在宫颈癌组织中的表达量与免疫检查点CD276(r=0.184)、PVRL2(r=0.244)、TGFBR1(r=0.171)的表达量呈正相关(P<0.05),见图7A~C。

图7 基于TIMER 数据库分析CXCL1 表达与免疫检查点的相关性图
3 讨论
细胞间信号传递是多细胞生物功能的重要组成部分,而趋化因子是负责细胞间信号传导的一组因子,CXCL1属于CXC 趋化因子亚家族[8-9]。CXCL1也称作中性粒细胞激活肽-3(NAP-3),该名称与其诱导中性粒细胞趋化的能力相关[10]。Finegan 等[11-12]的研究表明在皮肤癌中致癌物诱导CXCL1表达后,通过募集中性粒细胞参与炎症反应,而慢性炎症的形成导致了肿瘤形成。事实上,越来越多的证据表明,CXCL1可能通过其在肿瘤促进炎症反应中的作用在许多肿瘤过程中发挥关键作用,包括肿瘤增殖、癌细胞迁移、淋巴结转移、诱导血管生成等方面[13-18]。我们通过泛癌分析发现CXCL1在宫颈癌、胆管癌、结肠癌等多种癌症中均高表达。经过多个数据库验证发现在CESC 中CXCL1的mRNA 均较高,并且CXCL1高表达组的OS和RFS 较短。ROC 曲线分析提示CXCL1表达量对宫颈癌患者1、3、5 a 生存结局预测的准确性较高。此外本文绘制了列线图,可用来评估包括CXCL1表达量在内的不同因素对宫颈癌患者生存结局的潜在影响。以上结果有助于将CXCL1用于临床,协助判断患者生存预后。
对CXCL1共表达基因进行富集分析,GO 富集分析显示共表达基因与急性炎症反应、细胞对脂多糖的反应、bcl3/NF-kappaB2 复合物、泛酸水解酶活性、趋化因子受体结合等方面相关性较强。KEGG 富集分析表明共表达基因与IL-17 信号通路、泛酸和辅酶A 的生物合成等方面相关。Wu 等[19]的研究提示IL-17 可以增加CXCL1mRNA 的稳定性和CXCL1的转录,从而增加CXCL1的表达。这些研究提示CXCL1深度参与了免疫调节的过程。
肿瘤微环境由癌细胞、细胞外基质和不同类型的基质细胞亚群组成[20],而细胞之间的相互作用有助于形成肿瘤特异性微环境,并通过趋化因子与其相应受体相互作用的旁分泌进一步促进致癌作用[21]。因此,我们进一步研究CXCL1表达与免疫细胞浸润之间的相关性,发现在CESC 中CXCL1表达水平与肿瘤细胞纯度、CD8+T 细胞、M1 巨噬细胞呈负相关;与浆细胞、中性粒细胞、静息NK 细胞、CD4+静息记忆性T 细胞呈正相关。目前肿瘤微环境中的浸润免疫细胞已被证明在多种癌症的生物学功能中发挥着显著的作用,这在一定程度上决定了对免疫治疗的反应[22]。
越来越多的证据揭示了免疫检查点抑制剂在宫颈癌中的治疗潜力[23]。近年来一些新的免疫检查点被发现,如B7-H3(CD276)在T 细胞免疫应答中起发挥负性调节作用,并且B7-H3 在多种肿瘤组织及细胞中异常高表达[24]。Li 等[25]采用免疫组化法发现72%宫颈癌组织中存在B7-H3 蛋白表达,B7-H3 高表达患者的预后更差。PVRL2也称作CD112,CD112R与其配体CD112结合可以抑制 T 细胞和 NK 细胞对癌症的反应强度。CD112在抗原呈递或肿瘤细胞上很容易检测到,其高水平表达与大多数癌症患者的肿瘤进展和不良预后有关[26]。转化生长因子-β(TGF-β)可以调节肿瘤微环境中免疫细胞的浸润[27],其中I 型TGF-β 受体(TGFBR1)是TGF-β 信号的核心[28]。何旻蕙等[29]的研究表明TGFBR1 在乳腺癌中高表达,且高TGFBR1是乳腺癌预后的危险因素。本研究发现CXCL1的表达与CD276、PVRL2、TGFBR1均呈正相关,以上发现可能对宫颈癌免疫治疗的基础研究提供新思路。
综上所述,本研究提示CXCL1是一种致癌因子,可能成为宫颈癌的潜在诊断和预后标志物,以及评估治疗效果的预测因子。CXCL1的表达量与免疫检查点表达量、免疫细胞浸润程度的相关性都具有统计学意义,这可能为宫颈癌患者的预后评估和精准免疫治疗的研究提供新思路。但是,以上结论仍需要进一步的实验来验证。
