氮芥新衍生物抗白血病细胞活性研究
2023-01-06杨雪莲唐文鑫代天志龙晓燕孙德群
杨雪莲 刘 帅 杨 丽 唐文鑫 代天志 龙晓燕 孙德群
(1.西南科技大学生命科学与工程学院 四川绵阳 621010;2.山东大学海洋学院 山东威海 264200)
白血病(Leukemia),亦称作血癌,是一种造血系统的恶性肿瘤。病原是克隆性白血病细胞出现增殖失控、分化障碍、凋亡受阻等情况并在骨髓中出现大量增殖,浸润其他非造血性组织和器官,同时抑制正常造血功能。临床上将白血病分为急性白血病和慢性白血病,具体分为急性淋巴细胞白血病(ALL)、急性髓系白血病(AML)、慢性髓系白血病(CML)、慢性淋巴细胞白血病(CLL),白血病在各年龄段均有发病风险[1]。目前,白血病是儿童癌症死亡的主要原因,约占所有儿童癌症的30%[2],在发展中国家中,儿童白血病治愈率甚至低于35%[3]。临床上成人白血病治愈率也不乐观。这是由于常规药物特异性和选择性较差,没有明确的白血病预防和治疗效果[4]。因此,迫切需要开发效果更佳、选择性更好的新药。
氮芥属于一种DNA烷化剂,是细胞毒性类药物,起源于二战时期的芥子气,它可对接触者造成骨髓和淋巴系统增生低下,有较强的毒副作用。为了将芥子气运用于临床,对其进行了不同的结构修饰,产生了各种类型的氮芥类衍生物[5]。由于氮芥衍生物是基于双(2-氯乙基)硫化物对白细胞的杀伤作用开发,因此其最开始主要用于治疗白血病[6]。由于氮芥衍生物具有较强的抗增殖活性,临床上将其广泛应用于各类肿瘤的化疗。比如:最早应用于临床的盐酸氮芥,主要用于治疗恶性淋巴瘤以及慢性白血病[6];临床常用的氮芥类药物环磷酰胺,具有广泛抗瘤谱,对恶性淋巴瘤有显著治疗效果,对急性或慢性淋巴细胞白血病以及乳腺癌等也有不错疗效[7]。对氮芥的抗肿瘤机制研究发现,氮芥可通过与DNA结合,交联两条链,防止DNA复制并导致细胞最终死亡而发挥其生物活性。在分子水平上,氮芥类衍生物主要是与DNA双螺旋中的腺嘌呤或者鸟嘌呤的N7位或腺嘌呤的N3位结合,使DNA发生链内或双链间交联[8],由此刺激了相对的遗传毒性应激反应,影响细胞中DNA损伤调节反应、能量代谢、细胞周期或者细胞凋亡(线粒体凋亡通路、内质网凋亡通路)等多个信号通路[9]。
由于氮芥类化合物属于非特异性DNA烷基化,因此对正常细胞毒性极大,给患者带来许多副作用[10],这些副作用和耐药性[11]已成为临床治疗的主要限制因素。为了解决这些问题,药物化学家在过去做了很多努力。Hu等[12-14]设计并合成了各种氮芥与吴茱萸碱杂合体,此类生物碱具有多种抗肿瘤活性,所合成的化合物对HL-60细胞具有优良的细胞活性,IC50值为0.5μmol/L。Xiang等[15]合成并评估了一系列与氮芥偶联的enmein型二萜类化合物,这一系列化合物表现出一定细胞毒性和选择性。Wen等[16]描述了具有各种芳香取代基和硼酸酯的新型芳香族氮芥类化合物,这类化合物可有效交联DNA。综上可知,对氮芥进行有效结构修饰,可降低其毒副作用,有利于氮芥类化合物的临床应用。
本文以氮芥为基础,设计并合成了氮芥新衍生物,并通过白血病细胞抗增殖活性实验及一系列荧光染色实验证明了化合物Y-65体外抗白血病细胞增殖活性。
1 实验材料
1.1 主要仪器和试剂
仪器:ICX41系列倒置生物显微镜(宁波舜宇仪器有限公司);5404低速冷冻离心机(上海安亭科学仪器厂);SW-CJ-1D型超净工作台(上海力辰邦西仪器科技有限公司);ReadMax1900型光吸收全波长酶标仪(上海闪谱生物科技有限公司);KG-SX-700型高温蒸汽灭菌锅(KAGOSHIMA SEISAKUSYO INC);培养箱(SANYO)。
试剂:DMEM高糖培养基、RPMI1640培养基、IMDM培养基(Biological Industeries);胎牛血清(Gibco);青链霉素(中国Beyotime研究所);四甲基噻唑蓝(MTT)(中国Beyotime研究所);胰蛋白酶消化液(中国Beyotime研究所);PBS(中国Beyotime研究所);二甲基亚砜(DMSO)(成都市科隆化学品有限公司);超纯水(实验室配制);线粒体膜电位试剂盒(JC-1)(中国Beyotime研究所);Annexin VFITC细胞凋亡检测试剂盒(中国Beyotime研究所);Hoechst33258检测试剂盒(中国Beyotime研究所);苯丁酸氮芥(安耐吉化学);浓盐酸、十二烷基硫酸钠(SDS)、异丁醇(成都市科隆化学品有限公司)。
细胞株来源:人慢性髓原白血病细胞系K562、人急性淋巴细胞白血病T淋巴细胞系CCRFCEM、人早幼粒细胞白血病细胞HL-60和人正常肝细胞L02,上海揽宝生物技术有限公司。
1.2 试剂配制
DMEM高糖完全培养基配制:在DMEM高糖基础培养基中加入质量分数10%FBS(胎牛血清)和质量分数1%PS(青霉素链霉素),配制好的完全培养基放置在4℃冰箱中保存。
DMEM高糖维持培养基配制:在DMED高糖基础培养基中加入质量分数2.5%的FBS(胎牛血清)和质量分数1%的PS(青霉素链霉素),配制好的维持培养基放置在4℃冰箱中保存。
IMDM完全培养基配制:在IMDM(含谷氨酸)基础培养基中加入质量分数20%的FBS(胎牛血清)和质量分数1%的PS(青霉素链霉素),配制好的完全培养基放置在4℃冰箱中保存。
IMDM维持培养基配制:在IMDM(含谷氨酸)基础培养基中加入质量分数5%的FBS(胎牛血清)和质量分数1%的PS(青霉素链霉素),配制好的维持培养基放置在4℃冰箱中保存。
RPMI-1640完全培养基和维持培养基的配制方法与DMEM配制方法相同。
MTT溶液配制:称取500 mg四甲基噻唑蓝(MTT)倒入灭菌后的玻璃瓶中,加入100 mL PBS(磷酸缓冲液)溶解,再用0.22μm无菌滤膜过滤,得到的MTT溶液用2 mL EP管分装置于-20℃冰箱中避光保存。
三联裂解液配制:称取10 g SDS(十二烷基硫酸钠),量取10 mol/L HCl 0.1 mL、异丁醇5 mL,用双蒸水溶解并定容至100 mL,再用0.22μm滤膜过滤,最后进行高压蒸汽灭菌,常温保存备用。
1.3 氮芥新衍生物结构式
氮芥新衍生物为西南科技大学生命科学与工程学院合成实验室设计合成[17],并经氢谱、碳谱、高分辨质谱确定结构式。
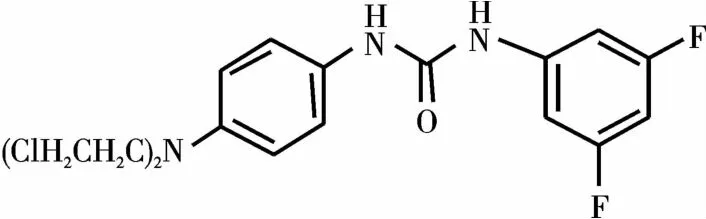
化合物Y-65
1H NMR(500 MHz,DMSO-d6)δ8.94(s,1H),8.49(s,1H),7.40~7.06(m,4H),6.81~6.61(m,3H),3.85~3.58(m,8H)。13C NMR(126 MHz,DMSO-d6)164.11,163.98,162.19,162.06,152.90,143.29,142.70,129.66,121.55,112.94,101.26,101.20,101.08,101.02,97.00,96.79,96.58,52.87,41.70。HRMS(ESI)m/z:[C17H17Cl2F2N3OH+]388.0790(计算值),388.0793(实验值)。
2 实验方法
2.1 细胞培养
HL-60细胞系、CCRF-CEM和K562细胞系、L02细胞系分别使用IMDM完全培养基、RPMI-1640完全培养基培养、DMEM完全培养基培养。上述细胞系均在37℃恒温,体积分数5%CO2的饱和湿度的无菌细胞培养箱中培养,1~2 d更换一次细胞液,培养4 d进行细胞传代。
2.2 MTT比色法检测细胞抑制率
贴壁细胞[17]:将对数生长期细胞接种到96孔板,每孔100μL细胞悬液,待细胞贴壁后,分别加入各浓度化合物Y-65,每个浓度设置3个复孔,对照组为不加药维持培养基,阳性对照药为苯丁酸氮芥(CLB)。将96孔板在培养箱中培养72 h,然后每孔加入100μL MTT工作液(0.5 mg/mL)。培养箱中孵育4 h,吸弃工作液,再向每孔加入100μL DMSO溶解10 min后,检测490 nm吸光度,计算细胞抑制率。细胞抑制率(%)=(1-OD实验组/OD对照组)×100%。IC50值利用GraphPad Prism 8分析得出。
悬浮细胞:采用三联法[17]检测570 nm波长处的吸光度,抑制率计算和IC50值分析同贴壁细胞的计算分析方法。
2.3 白血病细胞在化合物的不同浓度和不同处理时间下的抑制活性
(1)铺板。同2.2,浓度为0,0.05,0.10,0.50,2.5,5.0,10.0,20.0,40.0,60.0μmol/L。
(2)检测。将96孔板放入细胞培养箱中培养24,48,72 h后,然后用三联法在570 nm处检测其吸光度,根据公式计算其抑制率,用软件GraphPad Prism 8绘制CCRF-CEM细胞经化合物Y-65不同浓度和不同处理时间下的抑制活性曲线图。
2.4 化合物对白血病细胞形态的影响
(1)接种细胞。用RPMI-1640维持细胞液将对数生长期CCRF-CEM细胞制成适当细胞数量的细胞悬液,然后用此细胞悬液,稀释药物为0,3.0,6.0,10.0,20.0,30.0μmol/L,然后将各浓度细胞悬液接种到24孔板中,每孔1 mL,培养箱中培养24 h。
(2)观察。约24 h后,在荧光倒置显微镜下观察细胞形态,并用ImageView软件进行拍照。
2.5 Hoechst33258染色下细胞核形态变化
接种细胞同2.4节,24 h后,4 min,1 000 g离心收集细胞,加入试剂盒中固定液,孵育30 min;离心,每个浓度组细胞沉淀用PBS洗涤两遍;离心,留50μL PBS,将细胞混悬,然后滴在载玻片上,待细胞贴在载玻片上后,滴加0.2 mL Hoechst33258染液,避光染色2 min;从边缘吸掉染色液,用PBS洗涤两遍,在荧光显微镜下进行核形态观察,并拍照记录。
2.6 Annexin V-FITC和PI染色下不同阶段的细胞凋亡
接种细胞同2.4节,离心,收集细胞,用PBS洗涤;离心,将细胞在195μL结合液中重悬,再依次加入5μL Annexin V-FITC和10μL PI染色工作液,混匀,25℃避光孵育20 min后在荧光显微镜下观察并拍照记录,此过程尽量避光进行。
2.7 JC-1染色下细胞线粒体膜电位的变化
接种细胞同2.4节,离心,将细胞重悬于0.5 mL细胞液中,加入0.5 mL JC-1染色工作液混匀后,在培养箱中孵育20 min,孵育结束后,称量600 g,4℃离心,再用JC-1染色缓冲液(1×)洗涤两遍;离心,用适量JC-1染色缓冲液(1×)重悬细胞,在荧光显微镜下观察并拍照记录,使用荧光光度计对荧光强度进行定量,此过程尽量避光进行。
3 实验结果讨论
3.1 化合物Y-65对3种白血病细胞系的抗肿瘤活性
据表1可知,化合物Y-65对3株白血病细胞均有较好抗增殖活性,特别是对CCRF-CEM细胞株增殖抑制作用显著,其IC50值为4.3±0.3μmol/L。同时发现化合物Y-65对HL-60白血病细胞活性(IC50值12.4±6.2μmol/L)高于CLB(IC50值34.4±2.7μmol/L[17]);除此之外更值得注意的是,化合物Y-65对K562细胞系抗增殖活性(IC50值25.9±1.7μmol/L)明显优于CLB(IC50值>100μmol/L),显著提高了氮芥对人慢性髓原白血病细胞系抗增殖活性。可见,氮芥新衍生物(化合物Y-65)对3株白血病细胞均有较好抗增殖作用,且研究发现其对急性白血病细胞(CCRF-CEM,HL-60)的抗增殖作用(IC50值4.3±0.3,12.4±6.2μmol/L)明显优于对慢性白血病细胞(K562)的抗增殖作用(IC50值25.9±1.7μmol/L)。由于化合物Y-65对3株白血病细胞均有较好抗增殖活性,可进一步研究其作用机制。
通过选择性指数分析可确定化合物Y-65作用于哪一株白血病细胞更值得进行机制研究。根据表1数据,化合物Y-65对CCRF-CEM细胞的最大选择性指数为1.3,高于化合物Y-65对HL-60细胞的最大选择性指数0.5,因此,选择化合物Y-65作用于CCRF-CEM抗白血病细胞活性机制研究。

表1 氮芥新衍生物对3种白血病的抑制活性以及选择性指数(x±SD,n=3)Table 1 Inhibitory activity and selectivity index of new nitrogen mustard derivatives on three kinds of leukemia
3.2 化合物浓度、作用时间与化合物抗细胞增殖活性的关系
图1表明,化合物Y-65浓度越高,作用时间越久,对白血病细胞抗增殖活性越好。通过比较24,48 h时间浓度抑制曲线,我们发现只有24 h和48 h抗白血病活性表现出时间依赖,而48 h抑制曲线很接近72 h,推测可能是由于化合物Y-65处理细胞48 h后,CCRF-CEM细胞对化合物Y-65敏感性下降所致。
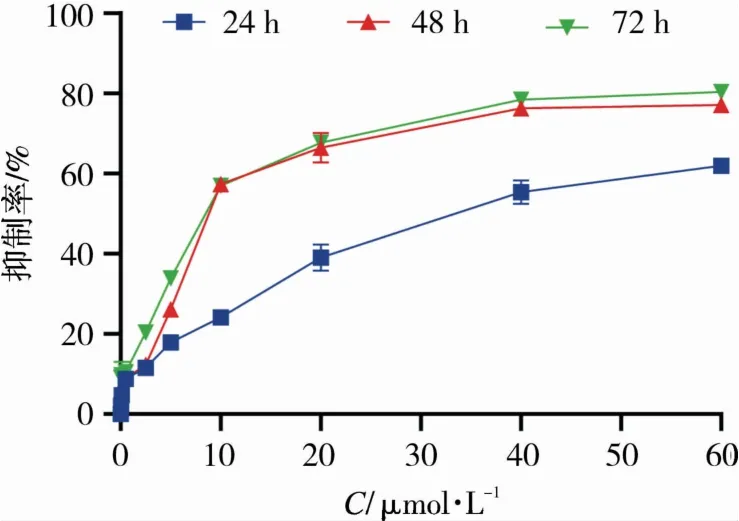
图1 化合物Y-65在不同浓度和不同时间对CCRF-CEM细胞的增值抑制活性Fig.1 Inhibitory activity of compound Y-65 on proliferation of CCRF-CEM cells at different concentrations and different time
3.3 化合物Y-65对白血病细胞形态的影响
细胞凋亡呈现出的形态学变化主要包括细胞皱缩、染色质凝集、形成凋亡小体、细胞骨架解散等,可以通过观察白血病细胞外观变化来初步判断化合物Y-65对细胞的作用情况。图2显示,CCRF-CEM细胞经化合物Y-65作用后发生了明显的形态学变化。从第一张图(0μmol/L)可知,未进行化合物处理CCRF-CEM细胞饱满、圆润,并且大小较为均匀;从后6张图(3~40μmol/L)可知,随着化合物浓度增加,细胞形态学发生了变化,细胞开始皱缩,细胞膜出现破损,这种变化表明细胞骨架崩解,细胞逐渐凋亡;且随着化合物Y-65浓度增加,细胞凋亡增多,且细胞大小无法保持均匀。据此可知,氮芥新衍生物(化合物Y-65)对CCRF-CEM细胞毒性作用显著,且随着浓度递增,毒性作用随之递增。
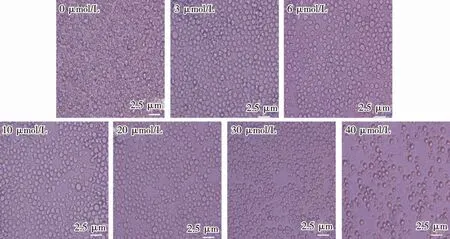
图2 化合物Y-65作用后CCRF-CEM细胞形态图Fig.2 Morphology of CCRF-CEM cells treated with compound Y-65
3.4 Hoechst33258染色下的白血病细胞核形态变化
为确定化合物Y-65对CCRF-CEM细胞抗增殖活性是否与其诱导细胞凋亡有关,进行了Hoechst33258实验。经Hoechst33258染色后,正常未凋亡细胞呈现浅蓝色荧光;凋亡细胞由于染色质凝集,细胞核会呈现致密浓染,出现深蓝色荧光。图3显示,未经化合物Y-65作用的CCRF-CEM细胞染色后呈现浅蓝色,未出现由于染色质凝集产生的深蓝色荧光(0μmol/L)。图3中后5张图(3~30 μmol/L)显示,经过化合物Y-65作用的CCRFCEM细胞,由于化合物诱导细胞凋亡,导致细胞核中染色质凝集,经染色后细胞核出现致密浓染,产生深蓝色荧光,且随着化合物浓度加大,细胞凋亡数量增加,导致深蓝色荧光量增加。当化合物浓度增加到30μmol/L时,细胞几乎全部凋亡。由此可知氮芥新衍生物(化合物Y-65)是以浓度依赖方式诱导白血病细胞(CCRF-CEM)凋亡。

图3 Hoechst33258染色CCRF-CEM细胞的显微图像Fig.3 Microscopic image of CCRF-CEM cells after Hoechst33258 staining
3.5 Annexin V-FITC和PI两种染色下不同阶段的细胞凋亡
为进一步评价化合物Y-65抗白血病活性是否与细胞凋亡有关,采用Annexin V-FITC和PI染色实验来确定化合物Y-65能否诱导细胞凋亡。Annexin V-FITC用绿色荧光探针FITC标记Annexin V,根据Annexin V-FITC与细胞中的磷脂酸酰丝氨酸结合情况,可以直接检测到磷脂酰丝氨酸外翻情况,从而测定出细胞凋亡状态。碘化丙啶可以对坏死的细胞或凋亡晚期丧失细胞膜完整性的细胞进行染色,呈现红色荧光。图4显示,当化合物浓度为0μmol/L时,有极少数细胞出现凋亡或者坏死;当化合物浓度增加时(从3~30μmol/L),凋亡早期细胞数量增加同时,凋亡晚期或者坏死细胞数量也随之增加。同时发现随着化合物浓度增加,凋亡晚期或者坏死细胞数量增加比凋亡早期细胞数量增加更多。由此可知,随着化合物Y-65浓度增加凋亡细胞总数增加,且化合物浓度增加可能更易诱导细胞发生晚期凋亡,具体机制有待进一步研究。此实验结果表明,化合物Y-65可以通过诱导细胞凋亡或者坏死,产生对白血病细胞的抗增殖活性。
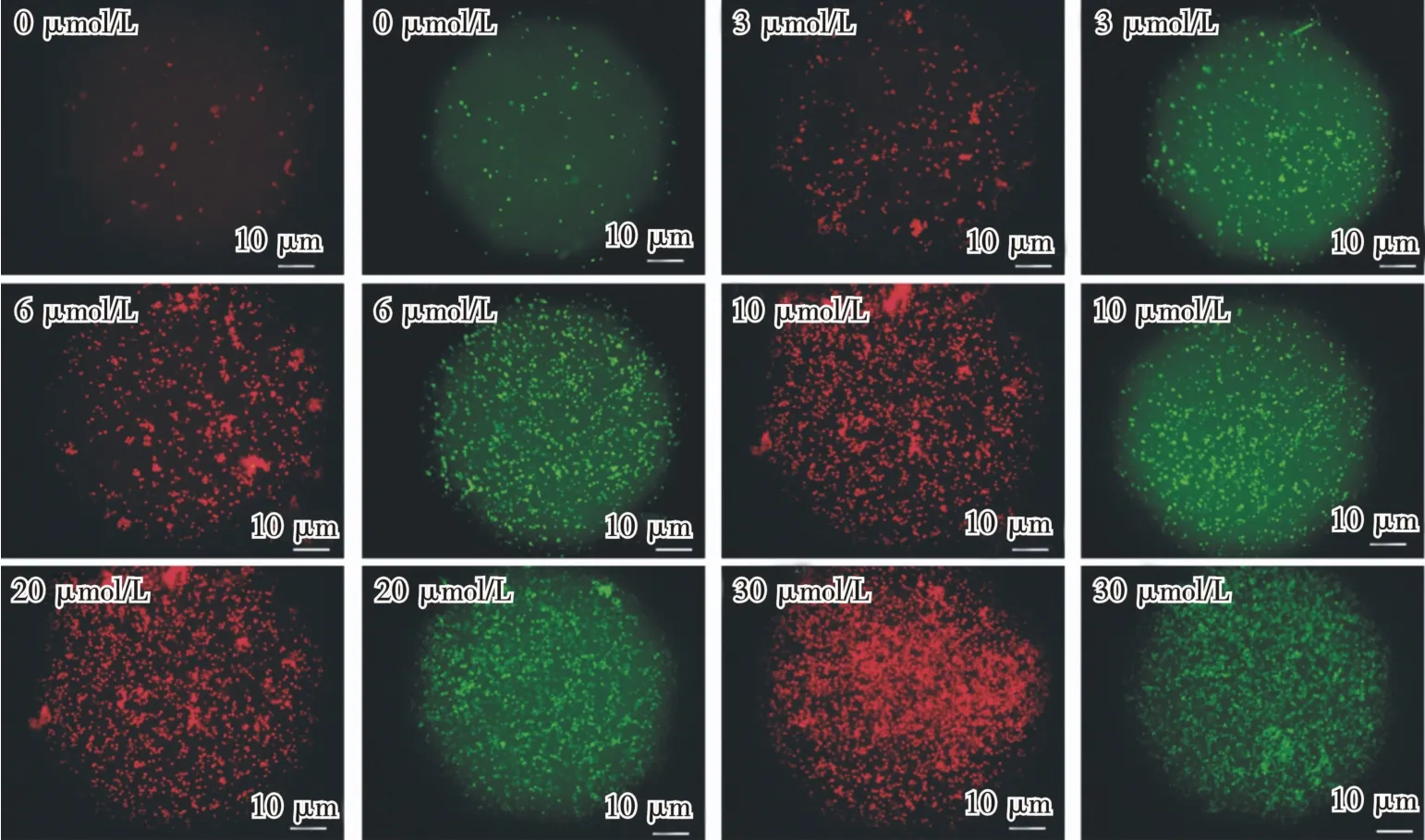
图4 Annexin V-FITC和PI染色CCR-CEM细胞的显微图像Fig.4 Microscopic images of CCRE-CEM cells after annexin V-FITCand PI staining
3.6 JC-1染色下细胞线粒体膜电位的变化
线粒体是细胞内参与多种信号通路和功能的细胞器,在确定细胞存活与死亡中起着关键作用[20]。线粒体膜电位下降是细胞凋亡早期一个标志性事件。为了验证化合物Y-65是否通过线粒体通路导致细胞凋亡,进行了线粒体膜电位(JC-1)染色实验。在正常细胞中,线粒体膜电位较高,此时JC-1染料是聚合体可以产生红色荧光;在早期凋亡细胞中,线粒体膜电位较低,此时JC-1染料是单体可以产生绿色荧光。图5显示,当未用化合物作用时,只有极少数细胞凋亡,此时大多数细胞线粒体膜电位较高,染色后呈现红色荧光。当化合物浓度为3μmol/L时,部分细胞出现凋亡,凋亡细胞线粒体膜电位下降,染色后呈现绿色荧光,但还是有不少细胞未凋亡,当加大化合物浓度后,凋亡细胞数量随之增加,当化合物浓度达到30μmol/L时,绝大多数细胞已经凋亡,绿色荧光量达到最大。由图6(a)、图6(b)可知,由于化合物浓度增加,细胞凋亡增加,染色后绿色单体荧光强度增加,红色聚合物荧光强度降低。从图6(c)可知,绿色单体荧光强度/红色聚合物荧光强度的去极化随着浓度增加而递增,说明化合物Y-65对细胞内线粒体产生显著影响,并呈现浓度依赖性效应。通过线粒体膜电位(JC-1)染色实验证明化合物Y-65对CCRF-CEM细胞抗增殖活性可能是通过线粒体介导的细胞凋亡途径。

图5 线粒体膜电位(JC-1)染色CCRE-CEM细胞的显微图像Fig.5 Microscopic image of CCRE-CEM cells after mitochondrial membrane potential(JC-1)staining
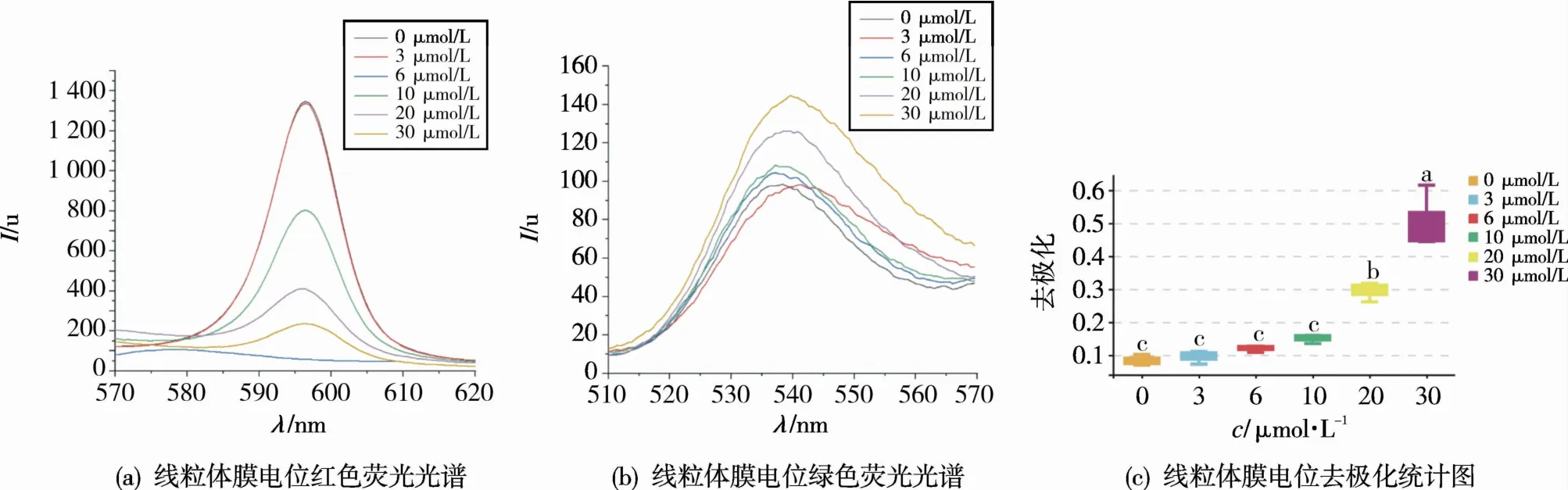
图6 线粒体膜电位荧光光谱及去极化统计图Fig.6 Statistical diagrams of fluorescence spectrum of mitochondrial membrane potential and depolarization
4 结论
设计合成的氮芥新衍生物Y-65对CCRFCEM,K562细胞的IC50值分别为4.3±0.3,25.9±1.7 μmol/L,明显优于苯丁酸氮芥对CCRF-CEM,K562的抗增殖活性(IC50值分别为17.7±0.1,>100μmol/L)。对化合物Y-65抗肿瘤机制初步研究表明,其可诱导白血病细胞CCRF-CEM发生细胞凋亡,呈现浓度和时间依赖性,且通过降低线粒体膜电位来诱导细胞凋亡。由于缺少对不同阶段细胞凋亡的定量研究,本课题无法准确判断化合物Y-65能否诱导白血病细胞发生晚期凋亡,其作用机制也有待进一步研究。
