柠檬桉幼叶和顶梢枯死病菌的鉴定及生物学特性
2023-01-06李安杰何普林易润华王晓洋
李安杰,何普林,易润华,王晓洋*
柠檬桉幼叶和顶梢枯死病菌的鉴定及生物学特性
李安杰1,何普林2,易润华3,王晓洋3*
(1.广东省连山林场,广东 清远 513200;2.中林集团雷州林业局有限公司,广东 遂溪 524348;3.广东海洋大学滨海农业学院,广东 湛江 524088)
通过形态学和系统发育分析将柠檬桉幼叶和顶梢枯死病的病原菌鉴定为彼特氏桉座孢()。生物学特性研究结果表明,环境因子(不同培养基、温度、光照、碳氮源和pH值)对病原菌菌丝生长和产孢影响差异显著。
柠檬桉;叶斑病;彼特氏桉座孢
柠檬桉()是桃金娘科(Myrtaceae)、伞房桉属(spp.)的高大乔木,在化工、医药、食品等领域都有着重要的经济价值。柠檬桉原产于澳大利亚,现于我国广东、广西和云南等地广泛种植。
2020年,在广东省雷州市桉树种植区,发现了一种引起柠檬桉幼叶和顶梢枯死的病害。为确定该病的病原菌,采用形态学和DNA序列同源性比较对该病原菌进行鉴定并研究了其生物学特性,以期为该病害的防治提供理论依据。
1 材料与方法
1.1 病原菌
2020年8月,从广东湛江雷州市纪家镇的桉树林场(20°59'04"N,109°51'11"E)采集的柠檬桉发病样品中分离得到菌株EDF,经过致病性测定确定该菌株为桉树幼叶和顶梢枯死病菌,由广东海洋大学微生物实验室提供。
1.2 病原菌鉴定
形态学鉴定:将菌株EDF孢子悬浮液均匀涂布在PDA培养基上,在25 ~ 28 ℃黑暗条件下培养7 d,记录菌落形态特征,孢子形态和孢子大小。
分子鉴定:菌株EDF培养3 d后挑取少量菌丝置于50 μL反应体系中,通过PCR反应扩增ITS片段,扩增引物为ITS1(5′- TCC gTA ggT gAA CCT gCg g -3′)和ITS4(5′- TCCTCC gCT TATTgATATgC -3′)[1]。PCR反应程序为:94 ℃预变性5 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,35个循环后,72 ℃延伸10 min。PCR产物经测序后,在NCBI进行Blast,选取近缘种序列进行Clustal W比对,采用邻接法(Neighbor-joining,NJ)用MEGA软件[2]构建系统发育树,自展重抽样次数1 000次检测系统发育树的可信度。
1.3 生物学特性
将菌株EDF活化后,用无菌水制备孢子悬浮液,均匀涂布到培养基平板上,培养后测定温度、pH值、光照、碳源、氮源和不同培养基对病原菌菌落直径和产孢量的影响。采用十字交叉法测量菌落直径后,挑取单菌落放入适量的无菌水中,制备孢子悬浮液,用血球计数板测量孢子的浓度,计算出病原菌的产孢量。
(1)温度:使用PDA培养基接种病原菌后,分别置于4、16、20、25、30 ℃恒温培养箱中黑暗培养7 d,测定菌落直径和产孢量,重复5次。
(2)pH值:PDA培养基灭菌后,将pH值分别调为4、5、6、7、8、9、10,接种病原菌后于25 ℃下黑暗培养7d,测定菌落直径和产孢量,重复5次。
(3)光照:将病原菌接种PDA培养基后,分别置于24 h光照、24 h黑暗、12 h光照+12 h黑暗、24 h光照+15 min UV、24 h黑暗+15 min UV条件下,室温培养7 d后,测定菌落直径和产孢量,重复5次。
(4)碳源:将察氏培养基作为碳源的蔗糖分别用等质量的木糖醇、甘露醇、葡萄糖、麦芽糖、果糖、乳糖和淀粉替代,接种病原菌后于25 ℃下黑暗培养7 d,测定菌落直径和产孢量,重复5次。
(5)氮源:将察氏培养基作为氮源的硝酸钠分别用等质量的甘氨酸、水解乳蛋白、硝酸钾、明胶、牛肉膏和酵母浸膏替代,接种病原菌后于25 ℃下黑暗培养7 d,测定菌落直径和产孢量,重复5次。
(6)不同培养基:配置各不同培养基并接种病原菌,置于25 ℃培养箱中培养,配方如下:PSA培养基:200 g土豆,20 g蔗糖,琼脂12 g,水1 L,自然pH值;SDA培养基:葡萄糖20 g,蛋白胨10 g,琼脂12 g,水1 L,自然pH值;燕麦琼脂培养基(OMA):燕麦30 g,琼脂12 g,水1 L,自然pH值;玉米粉培养基(CMA):玉米粉30 g,琼脂12 g,水1 L,自然pH值;胡萝卜培养基:胡萝卜200 g,琼脂12 g,水1 L,自然pH值。
2 结果与分析
2.1 病害症状
病原菌在自然条件下主要侵害幼叶、嫩梢,导致柠檬桉顶梢发育异常,甚至枯死。病菌从幼嫩叶片边缘侵染植株,初期形成褐色至黄褐色小点或斑块,无晕圈,后期颜色转深变黑或变深褐,并在病斑表面形成白色粉层(分生孢子梗和分生孢子),造成叶片扭曲和干枯(图1 A)。危害嫩枝梢时初期形成褐色斑点,表层形成白色粉层,病斑逐渐扩大开裂形成溃疡斑,流胶,严重时导致受害枝条枯死(图1 B)。

图1 柠檬桉幼叶和顶梢枯死病症状
2.2 病原菌鉴定
形态学特征:在PDA培养基上,菌落初期白色、小、隆起,菌丝绒毛状(图2A),菌丝不断向四周生长,形成中间凸起、边缘平坦的菌落(图2B和C),后边缘渐渐凸起(图2D),有酒香味。菌丝无色,有隔,少分枝;初级分生孢子无色、无隔、透明、光滑、长卵圆形、梨形或近椭圆形,10.0 μm × 3.0 μm,长宽比3.3(图2E);由初级分生孢子产生的次生分生孢子较小,5.0 μm × 2.0 µm,长宽比2.5,形态与初级分生孢子相似(图2E和F)。综上所述,菌株EDF与文献[3]描述的彼特氏桉座孢()形态特征相符[3]。
分子生物学鉴定:通过测序获得菌株EDF的ITS序列长度为672 bp(GenBank 登录号为OP357927)。序列在GenBank经BLASTn,结果显示菌株EDF的ITS序列与菌株CERC 9104[4]和模式菌株DAR 19773[5]的ITS序列同源性分别为100%和99.18%(CERC 9104的GenBank 登录号为KY615033;DAR 19773 的GenBank 登录号为NR_111242)。系统发育分析结果显示菌株EDF和的菌株聚集在同一分枝上,且与中国的3个菌株聚集在同一个亚分枝,而来自澳大利亚的菌株聚集在另外一个亚分枝(图3)。依据形态学和系统发育分析,将菌株EDF鉴定为彼特氏桉座孢()。
2.3 生物学特性
2.3.1 温度
菌株EDF的菌落生长速度随温度升高加快,最适产孢温度为20 ℃,产孢量为27.71×106个·cm‒2(表1)。菌落形态在不同温度下出现差异,温度越高,菌丝逐渐稀疏、菌落内部出现褶皱。
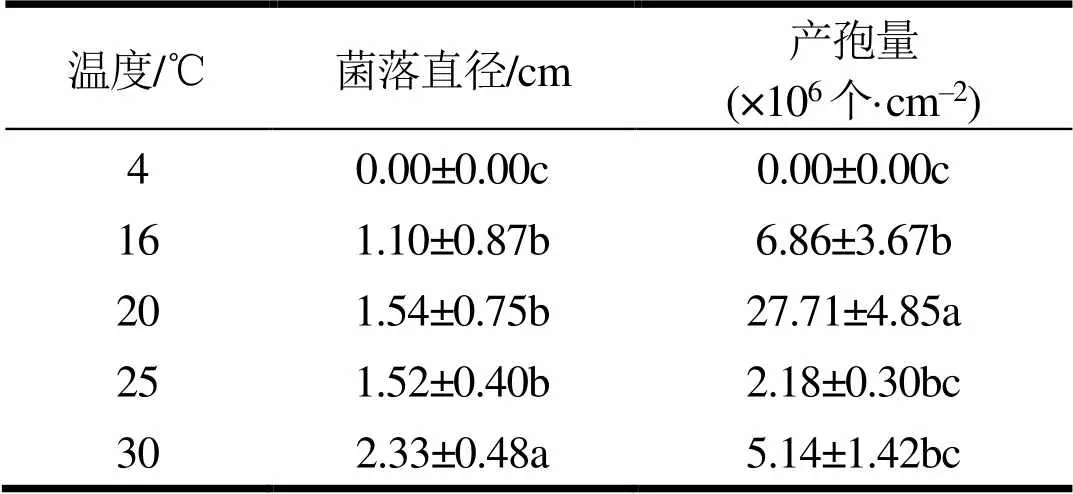
表1 温度对菌丝生长与产孢量的影响
注:表中数据为平均数±标准差,不同字母代表差异显著(<0.05),下同。
2.3.2 pH值
菌株EDF在培养基pH值>8时不生长,pH值对菌落直径和产孢量影响显著(表2)。菌丝生长最适pH值和产孢最适pH值均为6,菌落直径和产孢量分别为0.84 cm和42.59×106个·cm‒2。
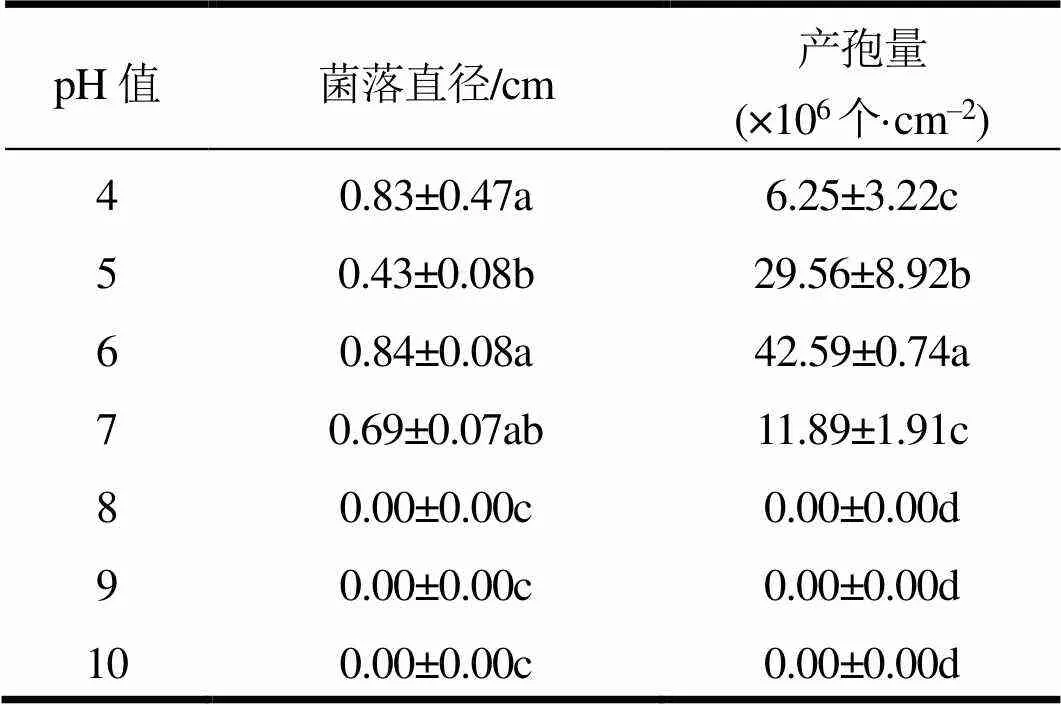
表2 pH值对菌丝生长与产孢量的影响
2.3.3 光照
光照对菌株EDF的菌落生长和产孢量影响差异显著(表3)。菌株在24 h黑暗条件下最适合菌丝生长,菌落直径最大,达1.95 cm,24 h光照下产孢量最大,达116.77×106个·cm‒2。

表3 光照对菌丝生长与产孢量的影响
2.3.4 碳源
碳源对菌株菌落直径和产孢量影响显著(表4)。病原菌在无碳源情况下可生长和产孢,但无碳源对其菌丝生长有强烈抑制作用,此外,病原菌对果糖和木糖醇的利用率低,菌丝生长受抑制,但在果糖条件下的产孢量仅次于葡萄糖,达到8.92×106个·cm‒2,而在乳糖和淀粉条件下产孢量极低,低于无碳源条件。菌丝生长的最优碳源为麦芽糖,菌落直径达1.81 cm,而产孢的最优碳源为葡萄糖,产孢量为21.57×106个·cm‒2。
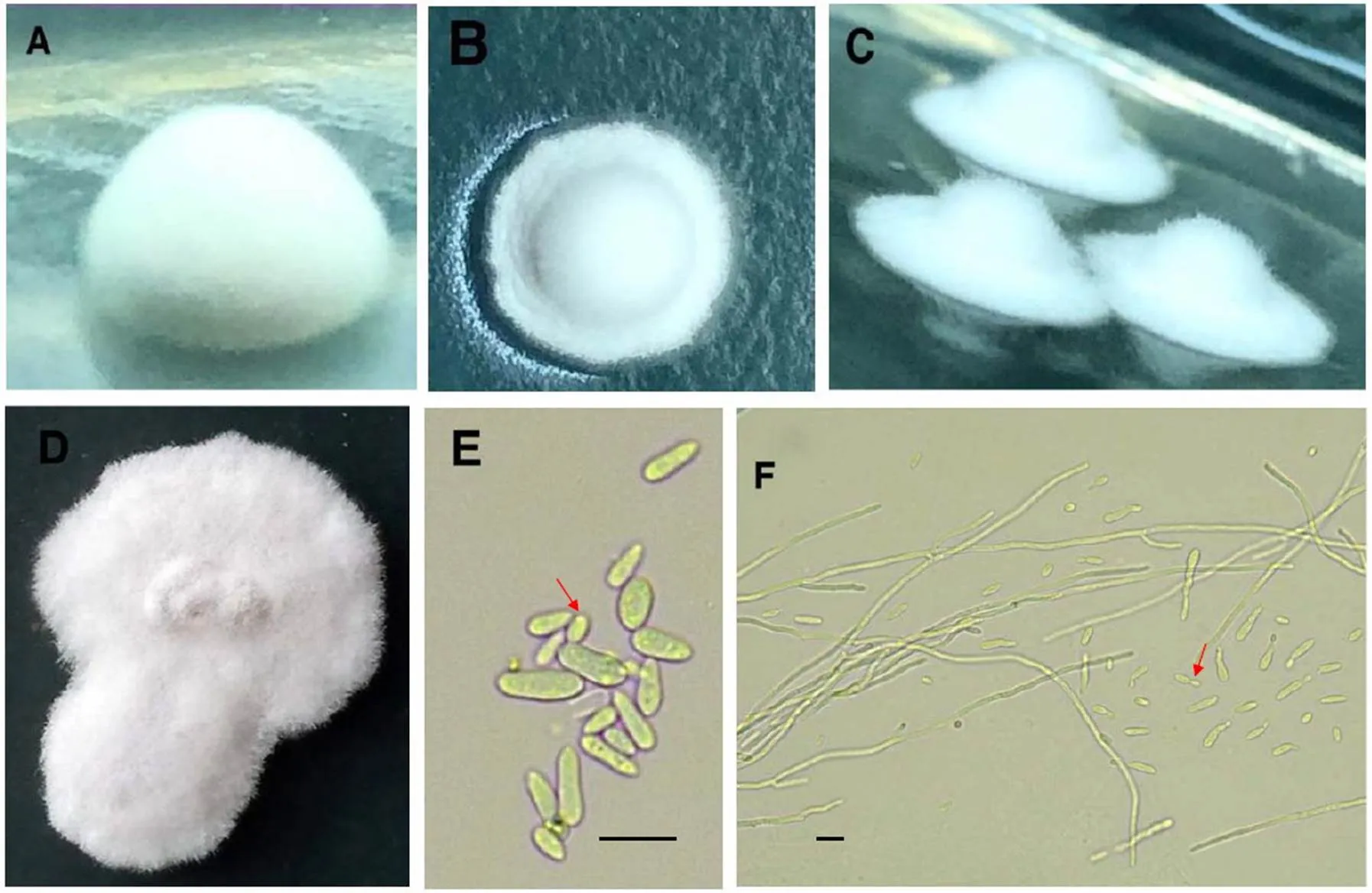
图2 病原菌的形态学特征
注:A-D,菌落形态;E,分生孢子和次生分生孢子;F,菌丝;E和F箭头所指为次生分生孢子;标尺:A=5µm,B=10µm。

图3 基于ITS序列构建的系统发育树
注:EDF为柠檬桉幼叶和顶梢枯死病菌菌株,RB2042为外群菌株。
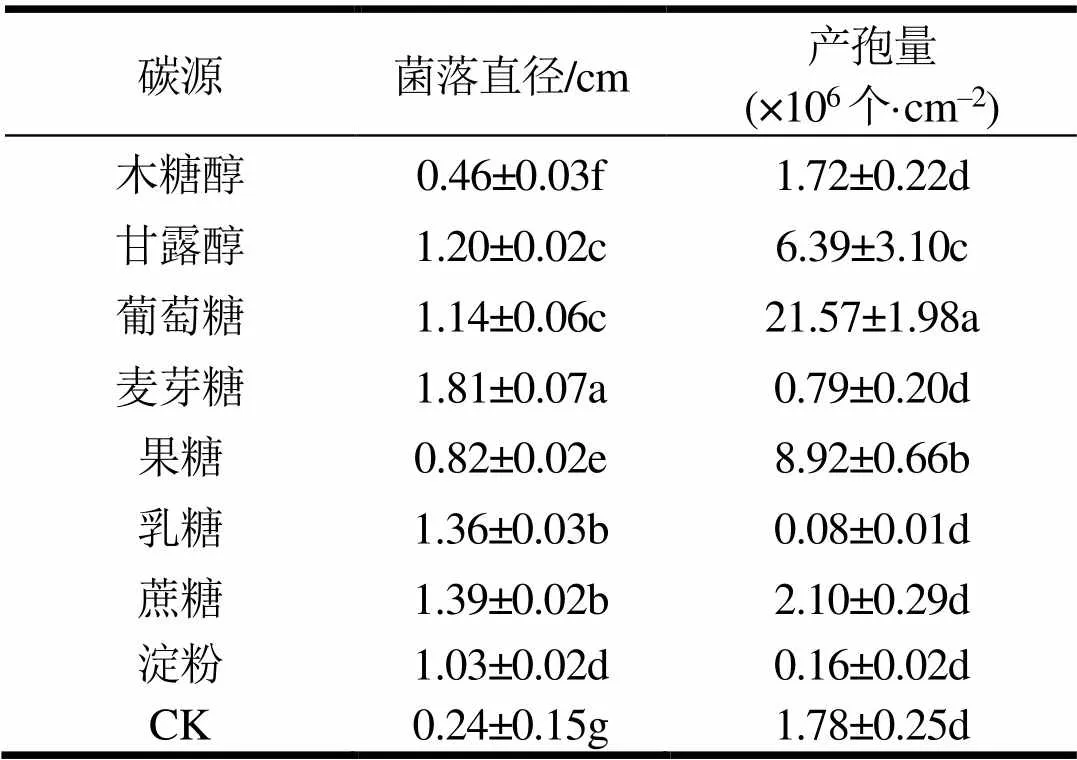
表4 碳源对菌丝生长与产孢量的影响
2.3.5 氮源
氮源对菌株EDF菌落直径和产孢量影响显著(表5)。病原菌在无氮源条件下可生长,但其正常生长、产孢均被抑制,同时甘氨酸对菌丝生长的抑制作用强于对照,但其最适合病原菌产孢,产孢量可达34.77×106个·cm‒2。最有利于菌丝生长的氮源为牛肉膏和酵母浸膏,菌落直径分别为1.71和1.73 cm。
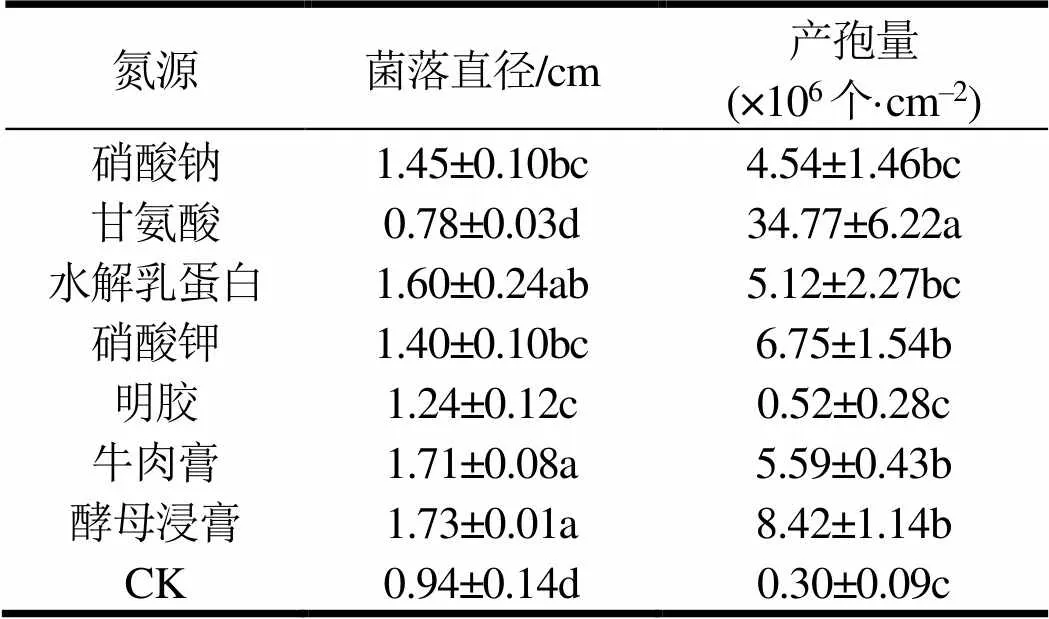
表5 氮源对菌丝生长与产孢量的影响
2.3.6 培养基
培养基对菌株EDF菌落生长影响不显著,但对产孢量影响显著(表6)。以燕麦培养基最适合菌丝生长,菌落直径可达到1.59 cm;而PSA培养基最适合产孢,产孢量为18.30×106个·cm‒2,玉米粉培养基不利于病原菌产孢,产孢量仅为0.32×106个·cm‒2。

表6 培养基对菌丝生长与产孢量的影响
3 结论与讨论
3.1 结论
根据形态学和系统发育分析,在雷州地区桉树林中引起柠檬桉幼叶和顶梢枯死的病原菌被鉴定为彼特氏桉座孢。生物学特性试验结果显示该病原菌喜温暖、不耐寒,温度、pH值、碳氮源、培养基和光照对病原菌生长影响差异明显。在20 ~ 30 ℃下菌丝生长快,pH值= 6时适合菌落生长和产孢,黑暗条件利于菌丝生长,而光照利于病原菌产孢。
3.2 讨论
彼特氏桉座孢()是一个寄主范围较窄的植物病原菌,目前报道仅危害伞房桉属桉树,如柠檬桉、美叶桉()、榕叶桉(),大叶斑皮桉()和托里桉()[6]等,未见危害其他寄主。柠檬桉是澳大利亚的本土树种,常受彼特氏桉座孢侵染而引起顶梢枯死,对桉树的材质、产量和应用价值有较大的影响,阻碍了桉树产业的发展[7-8]。在澳洲,桉树对彼特氏桉座孢的抗性在种源、种间和种内存在较大的差别,即桉树品种对病原菌的敏感性有明显不同[9],这为桉树抗病育种提供理论基础。在我国,陈帅飞等[3]报道了引起柠檬桉顶梢枯死和叶白枯萎的,其形态特征与菌株EDF一致。在我国引起桉树幼叶和顶梢枯死的菌株与澳洲的菌株均为,但在系统发育树上分别位于不同的亚分枝,这意味着不同地理位置的菌株存在遗传差异。本文研究了环境因子(包括温度、光照条件、pH值和营养条件)对病原菌生长以及产孢的影响,确定该菌在20 ℃下有利于病原菌生长和产孢,光照利于刺激孢子产生的生物学特性。研究结果为柠檬桉幼叶和顶梢枯死病害的防控提供了一些基础信息。
[1] WHITE T J, BRUNS T, LEE S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//PCR Protocols: a guide to methods and applications.New York, Academic Press Inc.,1990.
[2] Amura K, STECHER G, PETERSON D, et al. MEGA6: molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 2013,30(12): 2725-2729.
[3] 陈帅飞.中国桉树真菌病原汇录:2006—2013[J].桉树科技, 2014,31(1):37-65.
[4] CHEN S, LIU Q, LI G, et al.species associated with eucalypt diseases in southern China[J].Frontiers of Agricultural Science and Engineering2017(4): 433-447.
[5] SCHOCH C L, ROBBERTSE B, ROBERT V, et al. Finding needles in haystacks: linking scientific names, reference specimens and molecular data for Fungi [J].Database: The Journal of Biological Databases and Curation2014:bau061.
[6] PEGG G S, O’Dwyer C, CARNEGIE A J, et al.species associated with plantation and native eucalypts in Australia[J]. Plant Pathology, 2008,57: 702-714.
[7] PEGG G S, CARNEGIE AJ, WINGFIELD M J, et al.specie: increasing threat to eucalypt plantations in Australia [J]. Southern Forests: a Journal of Forest Science, 2009,71(2):111-114.
[8] PEGG GS, SHUEY L S, CARNEGIE A J, et al. Potential gains through selecting for resistance in spotted gum to[J]. Australasian Plant Pathology,2011, 40(2):197-206.
[9] PEGG G S, CARNEGIE A J, WINGFIELD M J, et al. Variable resistance toin spotted gum reveal opportunities for disease screening [J]. Australasian Plant Pathology, 2011, 40(1):76-86.
Identification and Biological Characteristics of Pathogen Causing Leaf and Shoot Blight on
LI Anjie1, HE Pulin2, YI Runhua3, WANG Xiaoyang3*
()
Based on morphological and phylogenetic analysis, the pathogen causing leaf and shoot blight disease onwas identified as. The research results of biological characteristics showed that environmental factors, including different media, temperature, light, carbon and nitrogen sources and pH, had significant effects on the mycelial growth and spore production of this pathogen.
; leaf and shoot blight;a
S763.15
A
10.13987/j.cnki.askj.2022.04.002
李安杰(1975— ),男,工程师,从事桉树培育及病虫害防治研究。E-mail: honglin923@sohu.com
通信作者:王晓洋,E-mail:974992084@qq.com
