藜麦NHX基因家族鉴定及盐胁迫下表达分析
2023-01-05张业猛朱丽丽陈志国
张业猛 朱丽丽 陈志国
(1.中国科学院大学,北京 100049;2.中国科学院高原生物适应与进化重点实验室 中国科学院西北高原生物研究所,西宁 810001;3.青海省作物分子育种重点实验室,西宁 810001)
土壤盐碱化是影响植物生长发育的主要非生物胁迫因素之一,土壤中高浓度的Na+、Cl-不仅造成生理干旱,过量积累也会引起离子毒害,破环植物的正常生理代谢[1-2]。长期的进化过程中植物各自形成了独特的代谢和调控机制来响应盐胁迫[3]。其中NHX 家族蛋白为Na+/H+逆向转运蛋白,含有Na+/H+exchange(PF00999)蛋白结构域,属于CPA1基因家族(cation:proton antiporter-1 family),广泛存在于细菌、酵母、植物和动物中,主要参与调控细胞内的离子重建和pH 平衡[4-5]。对NHX基因家族基于全基因组水平进行鉴定、分类和分析,不仅可以为NHXs基因应答盐胁迫机制提供重要信息,而且为作物改良提供候选基因。
自1976年,Ratner 等[6]在大麦中发现NHX基因之后,在拟南芥(Arabidopsis thaliana)[7]、水稻(Oryza sativa)[8]、普通小麦(Triticum aestivumssp.aestivum)[9]和玉米(Zea mays)[10]等植物中都相继发现了NHX基因。随着对NHX基因的深入研究,发现其不仅调控植物的生长发育过程,也受到各种非生物胁迫和激素的诱导[11-13]。如盐胁迫条件下,白菜(Brassica campestrisssp.chinensis)中BrNHX1-1和BrNHX1-2的转录水平在BrNHXs成员中上调最高[14]。聚乙二醇处理条件下,大豆(Glycine max)中GmNHX1的转录水平也显著增加[15]。脱落酸处理条件下,葡萄(Vitis vinifera)中VvNHX1转录水平上调,而VvNHX5转录水平下调[16]。此外,过表达NHX基因可以显著提升植物的耐盐性,董丽君等[17]发现转AlNHX1基因大豆系对盐胁迫的耐受性显著提升,Yarra 等[18]在茄子(Solanum melongenaL.)中过表达TaNHX2基因可以显著提升其盐碱条件下植物的耐盐性表现,异源表达HtNHX1或HtNHX2可以增强水稻对铝和土壤酸度的耐受性[19]。因此,NHX基因在植物中普遍存在,且在非生物胁迫应答过程中发挥着关键作用。
藜麦(Chenopodium quinoaWilld.)原产于南美洲安第斯地区,为苋科藜属一年生叶草本植物,是喜冷凉的高海拔盐生植物,具有较强耐旱、耐盐碱和耐瘠薄等特征[20-22]。NHX基因虽然在多种植物中已有研究,但在藜麦中NHX基因家族的报道甚少。随着藜麦基因组数据的公布[23]和生物信息学的不断发展,有助于藜麦NHX基因家族在全基因组水平上进行鉴定与分析。对其理化性质、基因结构、系统发育等信息进行全面分析,研究藜麦NHX基因家族在盐胁迫处理下的表达特性,为后续NHX基因功能研究和进一步利用该类基因进行藜麦的耐盐性遗传改良提供理论依据。
1 材料与方法
1.1 材料
以青藜4 号为参试材料,品种认定编号:青认备2019001。
1.2 方法
1.2.1 藜麦NHX基因家族成员鉴定 藜麦、拟南芥、小麦、玉米基因组数据在Ensembl 数据库(https://www.ensembl.org/index.html)下载,Na+/H+exchange 结构域的HMM 模型(PF00999)来自Pfam 数据库(http://pfam.xfam.org/)。利用HMMER 3.0 进行序列比对,比对结果利用InterPro(http://www.ebi.ac.uk/interpro/)和Pfam 网站(http://pfam.xfam.org/)进行验证,去除不含Na+/H+exchange 结构域的蛋白序列。
1.2.2 藜麦NHX 蛋白的理化性质分析 利用ExPASy ProtParam(https://web.expasy.org/protparam/)在线软件对藜麦NHXs 蛋白序列长度、相对分子量、理论等电点、亲水性、不稳定系数进行分析,采用Cell-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plantmulti/)在线软件对NHXs 蛋白进行亚细胞定位预测。
1.2.3 藜麦NHX基因家族成员的基因结构和保守结构域分析 使用GSDS 2.0(http://gsds.gao-lab.org/index.php)在线软件对NHXs基因结构进行可视化分析,采用MEME 4.12 进行NHXs 蛋白motif 分析,通过TBtools 进行可视化。
1.2.4 藜麦NHX基因家族成员系统发育树构建 利用MRGA 7.0 中Neighbor-joining 法,设置Bootstrap值为1 000,对HMMER 搜索到的藜麦、拟南芥、小麦和玉米的NHXs基因进行系统发育进化树的构建,采用iTOL(https://itol.embl.de/)在线软件进行调整。
1.2.5 盐胁迫处理 挑选籽粒饱满、大小一致的种子,用75%的乙醇溶液消毒5 min 后,无菌水冲洗至干净无味,用滤纸吸取种子表面水分,平整铺放在放有2 层滤纸的种子萌发盒中,置于12 h(25℃)光照/12 h(20℃)黑暗条件的人工气候培养箱中萌发。萌发1 d 后,选取生长状态良好、一致的幼苗进行300 mmol/L NaCl 胁迫处理,分别于0、24、48和72 h 整株取样,液氮迅速冷冻,-80℃保存备用。
1.2.6 藜麦盐胁迫条件下表达模式分析 总RNA提取和cDNA 模板第一链的制备分别采用生工生物有限公司(上海)的植物总RNA 快速提取试剂盒和AMV 第一链cDNA 合成试剂盒。产物在-80℃保存,委托生工生物有限公司进行转录组测序。选取4 个具有不同表达模式的NHX基因(AUR62041754、AUR62027477、AUR62043892和AUR62017691) 进行RT-qPCR 验证转录组数据。引物在生工生物有限公司合成(表1),反应体系为20 μL(cDNA 1 μL、上下游引物各0.8 μL、MIX 10.4 μL、ddH2O 7 μL)。反应程序为95℃ 30 s、95℃ 5 s、60℃ 34 s、95℃15 s、60℃ 60 s、95℃ 15 s,共35 个循环,3 次生物学重复。

表1 藜麦NHXs 基因实时荧光定量引物Table 1 RT-qPCR primers of NHXs in quinoa
1.2.7 数据分析 数据采用Excel 2010 进行统计处理,Graphpad 9.2 进行作图。
2 结果
2.1 藜麦NHXs蛋白理化性质分析及亚细胞定位预测
在藜麦基因组中共鉴定出46 个NHXs 蛋白(表2),其蛋白序列差异较大,长度为109-1 820 aa,分子质量为11 472.74-204 381.58 Da。等电点为5.00-9.27,其中有19 个为碱性蛋白。亲水性为-0.226-1.112,除AUR62009395编码的蛋白以外,其他全为亲水蛋白。不稳定指数在21.71-50.73 之间,有11个不稳定系数大于40,为不稳定蛋白,其余全为稳定蛋白。亚细胞定位预测显示,仅有AUR62033334、AUR62004319和AUR62033325编码的蛋白定位在细胞核,其余都定位在细胞膜或液泡。
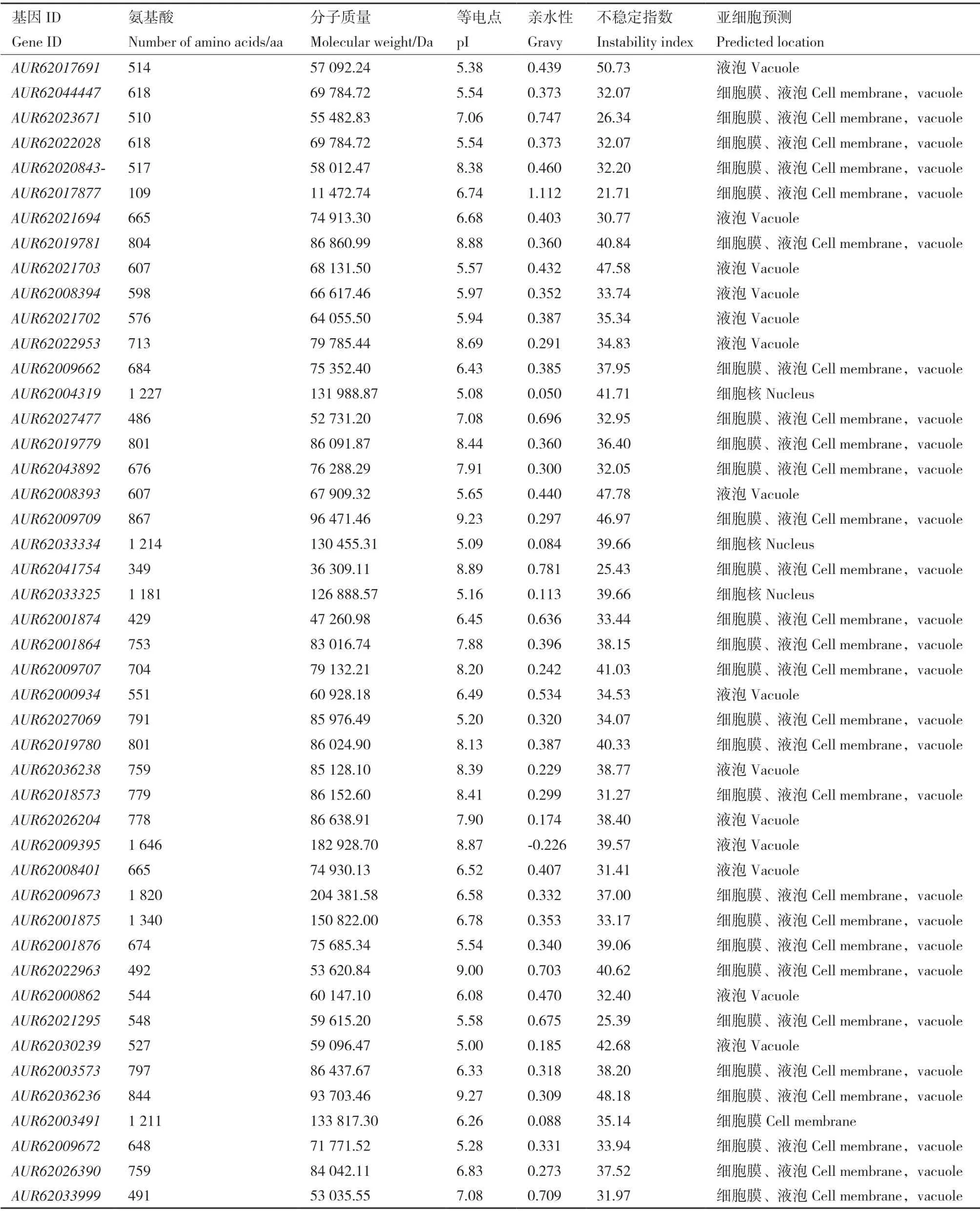
表2 藜麦NHXs 蛋白的理化性质及亚细胞定位Table 2 Physicochemical properties and subcellular localizations of quinoa NHXs proteins
2.2 藜麦NHX基因家族基因结构分析
根据NHX基因家族的序列信息绘制每个基因的结构,结果(图1)显示,46 个NHXs基因外显子数量为2-24 个,内含子为1-23 个,结构差异较大。通过系统发育进化树得出藜麦NHXs基因分为5个亚组(Subgroup I-V),且在进化树中位置相近的NHXs具有相似的基因结构。
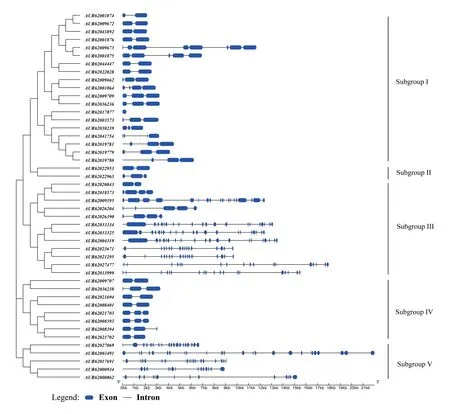
图1 藜麦NHXs 基因系统进化树和基因结构Fig.1 Phylogenetic tree and gene structure of NHXs genes in quinoa
2.3 藜麦HNX基因家族motif分析
根据46 个NHXs 蛋白的全长序列预测到10个保守结构域(图2),每个motif 的E 值都显著。motif 的长度在21-50 个保守氨基酸,其中motif 1 最长,含有50 个保守氨基酸,具有33 个位点;motif 8-10 最短,含有21 个保守氨基酸,位点分别为28、30 和39。此外,在进化树中位置相近的NHXs蛋白具有相似motif 结构(图3),其中Subgroup I、II、III 和IV 中除AUR62008394 和AUR62021702 以外,41 个NHXs 蛋白N 端都含有motif 7,高度保守。Subgroup V 中的5 条NHXs 蛋白都包含motif 10,N端为motif 7 或motif 10。
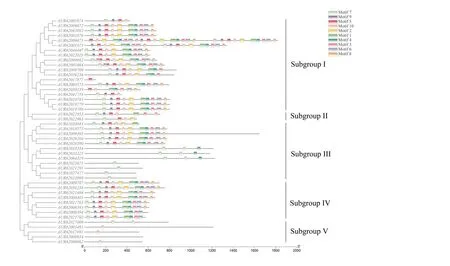
图3 藜麦NHXs 基因motif 分析Fig.3 Motif analysis of NHXs gene in quinoa
2.4 藜麦NHXs蛋白序列系统发育树分析
为分析藜麦NHXs 蛋白的进化,将拟南芥(60个)、小麦(119 个)、玉米(66 个)和藜麦(46 个)共291 个含有Na+/H+exchange 保守结构域的蛋白序列进行系统进化分析(图4)发现,291 个蛋白可分为4 类,分别命名为Group I、Group II、Group III 和Group IV。其中Group I 中含有63 个蛋白序列,拟南芥、小麦、玉米和藜麦分别含有10、27、18 和8个;Group II 含有86 个蛋白质序列,拟南芥、小麦、玉米和藜麦分别含有15、42、25 和4 个;Group III含有29 个蛋白质序列,拟南芥、小麦、玉米和藜麦分别含有3、11、10 和5 个;Group IV 含有113 个蛋白质序列,拟南芥、小麦、玉米和藜麦分别含有32、39、13 和29 个。
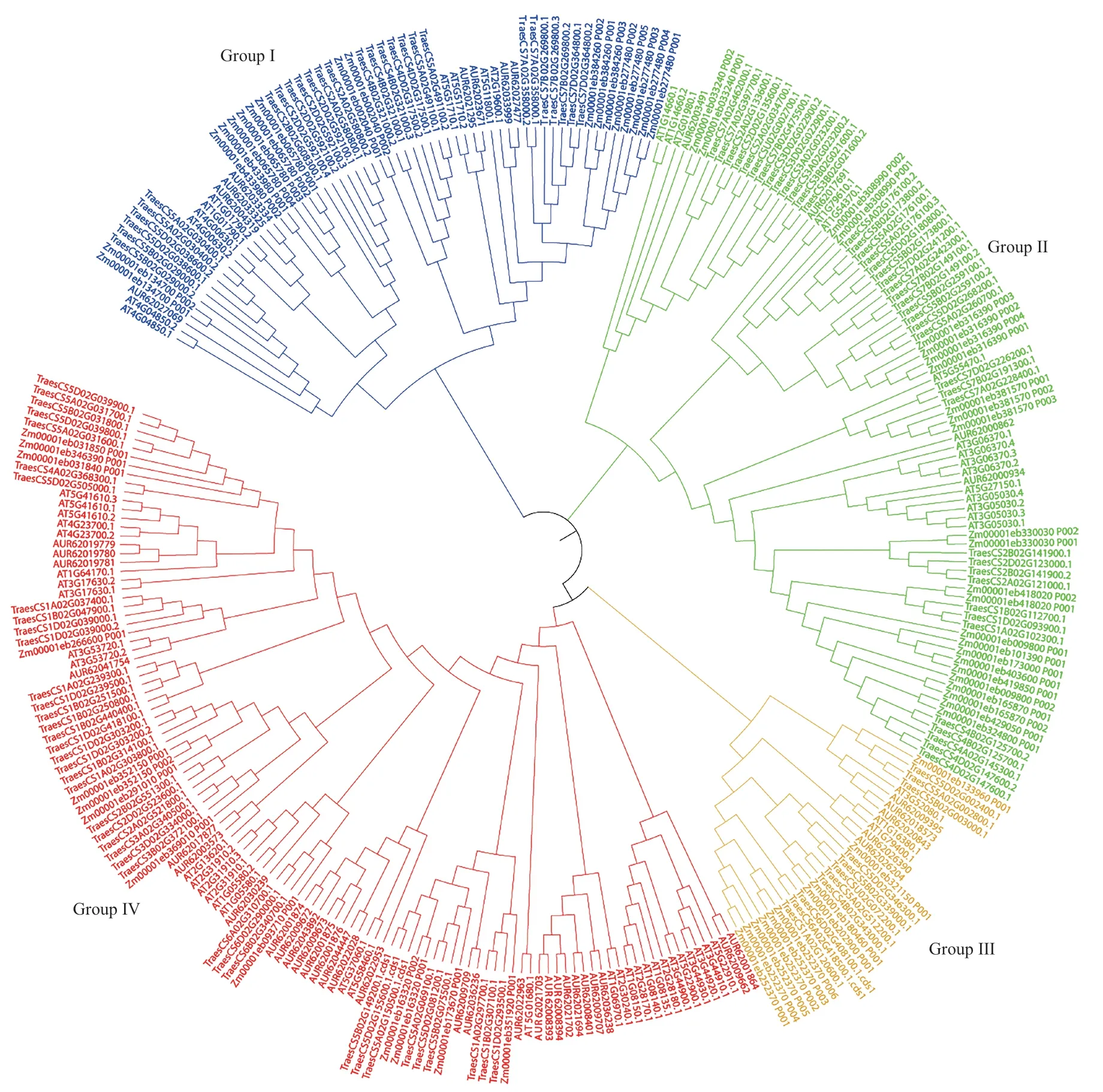
图4 拟南芥、小麦、玉米和藜麦的NHXs 蛋白的系统进化分析Fig.4 Phylogenetic analysis of NHXs proteins in Arabidopsis,wheat,maize and quinoa
2.5 藜麦NHXs基因盐胁迫下表达模式及GO注释
NaCl 胁迫下转录组分析结果(图5-A)显示,随胁迫时间增加,16 个NHXs 基因的表达模式为先上升后下降,10 个一直上升,9 个一直下降,11 个无明显变化。通过GO 注释到37 个具有基因注释的NHXs 基因,其中分子功能4 个,生物学过程33 个。4 个分子功能基因编码的蛋白为离子跨膜转运蛋白活性基因,33 个生物学过程基因包含1 个金属离子稳态、1 个钠离子质膜导入、1 个正向调控代谢过程、21 个稳态过程、4 个蛋白质定位、4 个调节代谢过程和1 个钾离子稳态基因(图5-B)。选择表达模式不同的4 个NHX基因进行RT-qPCR 验证转录组准确性发现,AUR62017691随胁迫时间的增加表达量上升,AUR62043892随胁迫时间的增加表达量先上升后下降,而AUR62041754和AUR62027477随胁迫时间的增加表达量均降低,与转录组结果基本一致(图5-C)。
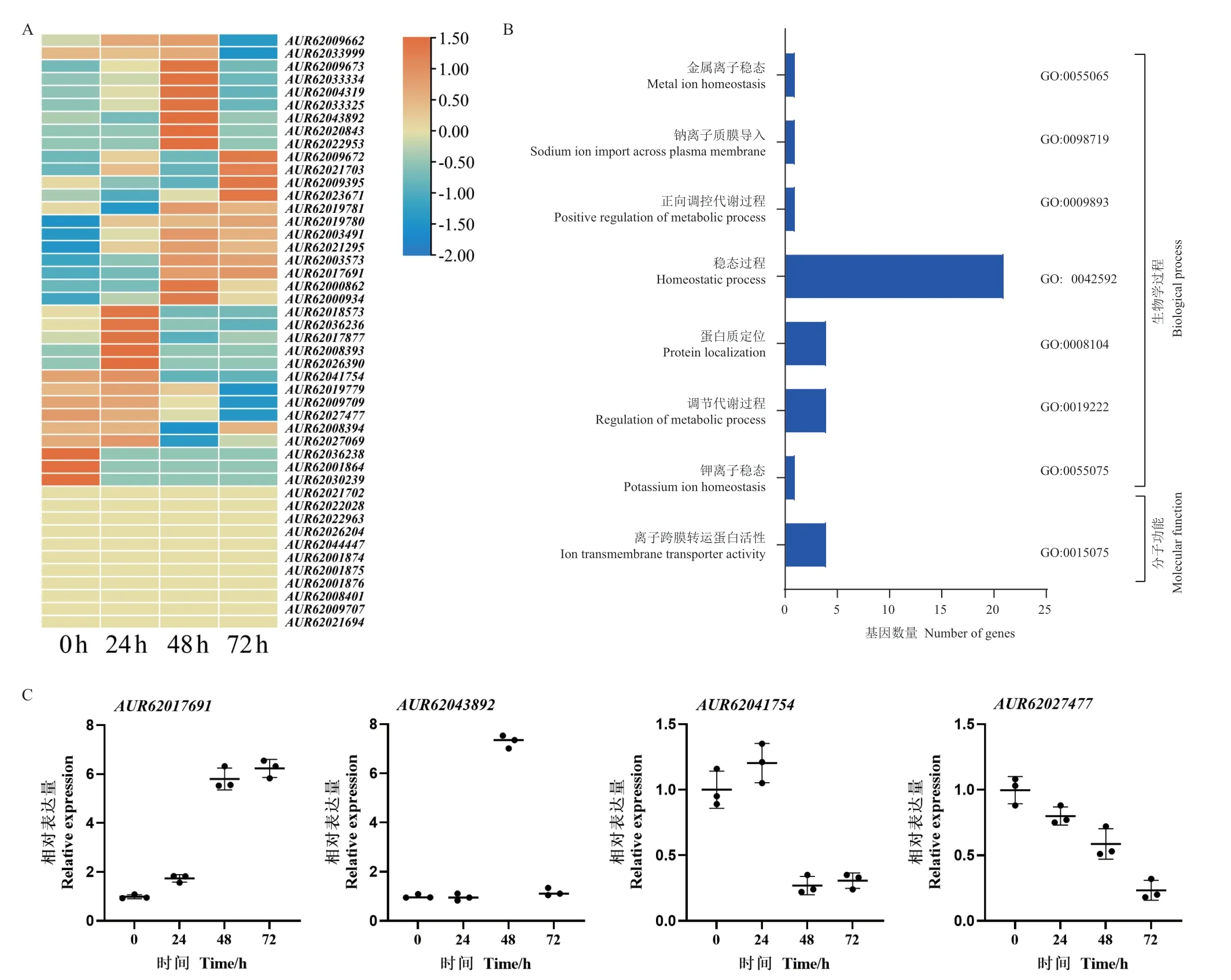
图5 藜麦NHXs 基因表达模式与GO 注释Fig.5 Gene expression patterns and GO annotations of NHXs in quinoa
3 讨论
3.1 藜麦NHXs基因的结构与系统进化
NHXs 蛋白主要依靠液泡膜质子泵建立的质子浓度差提供能量进行Na+和H+跨膜反向运输,将Na+区隔化,可以降低胞质中的渗透势,也避免了过高的离子浓度对胞质中细胞器的损伤[25]。液泡膜NHXs 蛋白与质膜上的NHXs 蛋白协同调控整个植株的盐分分配,构成了细胞内盐分区隔化的基础。前人对NHX基因家族已有大量研究,且多个物种的NHXs基因家族已经被鉴定出来,例如在葡萄中发现了8 个NHX基因家族成员[26],在香蕉(Musa acuminata)中鉴定出了11 个NHX基因家族成员[27]。藜麦在我国是一种新型的小宗作物,具有较强的耐盐性[20],Na+在盐囊泡中大量积累和液泡区隔化以维持细胞内离子稳态,是藜麦适应盐胁迫的重要策略。因此本研究基于藜麦基因组数据,共鉴定了46个NHXs基因,编码46 个NHXs 蛋白,在进化树中位置相近的NHXs基因具有相近的结构,NHXs 蛋白具有相似motif 结构,并且在拟南芥、小麦和玉米中分别鉴定出含有Na+/H+exchange 结构域的NHXs 蛋白60、119 和66 个,对拟南芥、小麦、玉米和藜麦中鉴定的291 个NHXs 蛋白亲缘关系进行分析发现,4 种植物在系统进化树中分布均匀,并未出现同一植物的NHXs 蛋白成员聚在同一分支中,说明不同植物间NHXs 蛋白多为直系同源蛋白。推测Na+区隔化是藜麦应对盐胁迫的重要机制之一,且与拟南芥、小麦和玉米的调控机制相似。
3.2 藜麦NHXs基因参与盐胁迫条件下的离子稳态和盐分分配
随着高通量测序技术及现代分子克隆技术的发展,越来越多的NHX 蛋白在植物、动物和真菌中被发现,并将NHXs 蛋白家族分为Class-I 和Class-II 两个亚组,Class-I 主要定位在液泡膜,Class-II 主要定位在小囊泡内,且二者具有20%-25%的同源性[28]。此外,Lu 等[29]也表示植物中的NHXs 蛋白主要分为两类,一类主要定位在质膜上,另一类主要定位在液泡膜上。藜麦中鉴定出的46 个NHX蛋白通过亚细胞定位显示多数蛋白定位在细胞膜和液泡中,推测该基因家族在藜麦中集中在质膜或内膜系统表达,这与多种植物中NHXs 蛋白的定位一致[27,30]。并且越来越多的研究结果表明,过表达NHXs 基因可以显著提升植株对盐胁迫的耐受性[17-18]。例如,郝东风等[31]将盐角草(Salicornia)的NHX基因导入甘蓝型油菜(B.napus)中可以提升植株对NaCl 胁迫的耐受性。赵云霞等[32]将无苞芥(Arabidopsis pumila)中OpNHX1基因导入到拟南芥中可以显著提升转基因植株在盐胁迫下的存活率。而藜麦中鉴定出的46 个NHXs基因在NaCl 胁迫下,有26 个随胁迫时间逐渐升高,9 个随胁迫时间逐渐下降,但是响应时间和表达量存在较大差异,表明35 个NaCl 胁迫诱导表达的NHXs基因在藜麦盐胁迫过程响应机制存在差异,与Ruiz 等[33]报道的藜麦在盐胁迫条件下,响应基因的表达具有时间依赖性一致。此外,46 个NHXs基因通过GO 注释到37 个,其中参与生物学过程的33 个,具有分子功能的4 个,2 级注释多是参与离子、细胞稳态和离子跨膜运输过程。因此,推测受到盐胁迫诱导表达且GO 注释到功能的35 个NHXs基因,参与调控藜麦盐胁迫条件下的离子稳态和盐分分配。
4 结论
共鉴定出46 个藜麦NHX基因家族成员,编码46 个NHX 蛋白,同一亚组具有相似的基因结构和蛋白质motif,多数定位在细胞膜和液泡中,与小麦、玉米、拟南芥为直系同源蛋白。其中35 个参与藜麦盐胁迫调控过程,为NHXs基因家族响应盐胁迫的分子机制研究奠定理论基础。
