经颅直流电刺激在纤维肌痛综合征治疗中的应用综述
2023-01-04陈伟宏万伟霞林小英冯国栋何燕倩方月清黄晓勉
陈伟宏,阮 兢,万伟霞,林小英,冯国栋,何燕倩,方月清,黄晓勉
(联勤保障部队第909医院/厦门大学附属东南医院中医康复科,福建漳州 363000)
0 引言
纤维肌痛综合征(fibromyalgia syndrome,FMS)又称纤维肌痛症,是一种非关节性风湿病,其以广泛的肌肉骨骼疼痛为主要特征,并伴有乏力、焦虑、抑郁、睡眠障碍、认知障碍等症状,是临床最难诊治的慢性疼痛疾病之一,大大地影响了患者的生活质量[1]。根据流行病学研究显示,全球FMS的总体发病率为2.1%,我国的发病率为0.8%,发病年龄多在20~55岁,其中女性患者数量高于男性[2]。目前,FMS的病因与发病机制尚不完全清楚,多数研究认为中枢敏化是FMS的核心发病机制。此外,神经胶质细胞活化、神经递质代谢异常、细胞因子及基因多态性异常等在FMS发病机制中也起到重要作用[3]。由于FMS在临床上缺少客观体征和特异的实验室指标,所以不管是在其诊断还是治疗等方面均存在一定挑战[4]。目前,FMS多采用多学科协同治疗模式包括药物、教育、运动疗法以及认知行为治疗等,但药物治疗效果有限且具有一定不良反应,在非药物治疗方面治疗证据也相对有限[5-6]。因此,寻找安全、有效的替代或辅助疗法成为该领域的研究重点。
经颅直流电刺激(transcranial direct current stimulation,tDCS)是一种无创的神经调节技术,通过电极将恒定、微弱的直流电(1~2 mA)作用于特定靶点,经极性依赖调节大脑皮质兴奋性,阳极tDCS靠近神经元胞体时,会引起静息膜电位去极化,增加皮质兴奋性,而阴极tDCS可以引起静息膜电位超极化,从而使皮质的兴奋性降低[7-8]。以往研究表明,在大脑中植入电极行深部脑刺激可以改善顽固性疼痛,然而其有创性和安全性的问题限制了该技术在临床上的应用[9]。tDCS具有安全、无创、患者耐受性好等特点,在疼痛领域研究中取得了可喜的成果。因此,本文对tDCS治疗FMS的可能机制、治疗效果、影响因素、安全性与局限性进行综述。
1 tDCS治疗FMS的可能机制
1.1 局部与远程效应
tDCS不仅有局部皮质刺激作用,还可通过刺激区域的神经网络连接发挥远程作用。神经元网络对直流电刺激甚至比单个神经元更为敏感,tDCS不仅能调节和诱发单个神经元的活动,还可以引起神经网络的同步振荡以及功能连接的改变[10]。tDCS刺激初级运动皮层,可导致广泛的神经网络调制,包括前额叶背外侧皮层、扣带回、丘脑、纹状体、岛叶以及中脑导水管周围灰质(periaqueductal gray,PAG)等区域,共同发挥镇痛效应[11]。此外,tDCS不仅有即刻作用,还能产生一定时长的后效应。阳极tDCS刺激运动皮质可观察到突触后兴奋性电位持续增加,如果电刺激持续时间足够长,皮质兴奋性的改变可达1 h或更长时间[12]。其后效应可能是tDCS通过诱导N-甲基-D-天冬氨酸受体或γ-氨基丁酸(GABA)活性的长期神经化学改变,从而调节突触微环境,诱导刺激区域产生长时程增强或长时程抑制,进而调节突触的可塑性[13]。
1.2 影响内源性痛觉调制系统
内源性痛觉调制系统由下行抑制系统和易化系统组成,是一个以脑干中线结构为中心,主要由PAG、延髓头端腹内侧核群(rostroal venromedial medulla,RVM)和一部分脑桥背外侧网状结构组成的神经网络结构,其轴突主要经过脊髓背外侧束(dorsolateral fasciculus,DLF)和腹外侧束(ventrolateral funiculus,VLF)下行,对脊髓背角痛觉信息的传递进行调制。研究显示,FMS患者的脑脊液生化指标存在异常,表现为5-羟色胺(5-HT)和去甲肾上腺素(NA)含量低,而P物质和神经生长因子含量高。其中,5-HT和NA是下行抑制系统参与机体镇痛的重要神经递质,说明FMS患者下行抑制疼痛的途径受到损害[14-15]。下行抑制系统功能减弱会促进或维持疼痛,这也是导致疼痛“慢性化”的关键因素[16]。
1.3 调节神经递质代谢
Foerster等[17]的研究发现FMS患者的大脑代谢水平发生改变,表现为其后岛叶、杏仁核、后扣带回和腹侧前额叶皮质的谷氨酰胺(Gln)和谷氨酸(Glu)组合标记物水平升高。其中,Glu是神经系统的主要兴奋性神经递质,是疼痛传导神经通路的主要调节因子之一,而抑制性神经递质GABA在FMS患者大脑中的浓度却较低[18]。Glu是由Gln在谷氨酰胺酶的作用下水解形成的,然后可在谷氨酸脱羧酶催化下脱羧生成GABA[19]。因此,GABA的浓度降低可能反映大脑中Glu的积累,高浓度Glu会对神经产生毒性作用,导致神经元损伤。同时,FMS患者海马中N-乙酰天冬氨酸(NAA)浓度也降低。NAA是神经元根据其葡萄糖利用率而合成的代谢物质,可反映相关区域的激活状态[20-21]。
1.4 影响脑区局部血流
近年来,Merzagora等[22]通过功能性近红外光谱(functional near-infrared spectroscopy,fNIRS)技术发现,tDCS能显著增加氧合血红蛋白含量(如图1所示)。Zheng等[23]通过动脉自旋标记(arterial spin labeling,ASL)技术证明了tDCS能增加脑局部血流量,阳极刺激增加了17.1%[如图1(a)所示],阴极刺激增加了5.6%[如图1(b)所示],但刺激后阳极附近的脑血流量增加,而阴极附近的脑血流量降低。背外侧前额叶皮层(dorsolateral prefrontal cortex,DLPFC)是情绪处理和情绪状态(如疼痛)向下调节的重要脑区,FMS患者的丘脑、尾状核、桥脑被盖部、基底节等区域的血流灌注减少[24-25]。利用单光子发射CT研究显示,阳极tDCS不仅能缓解患者的疼痛、提高生活质量,还能提高其双侧顶叶、基底节的血流灌注,改善大脑功能。
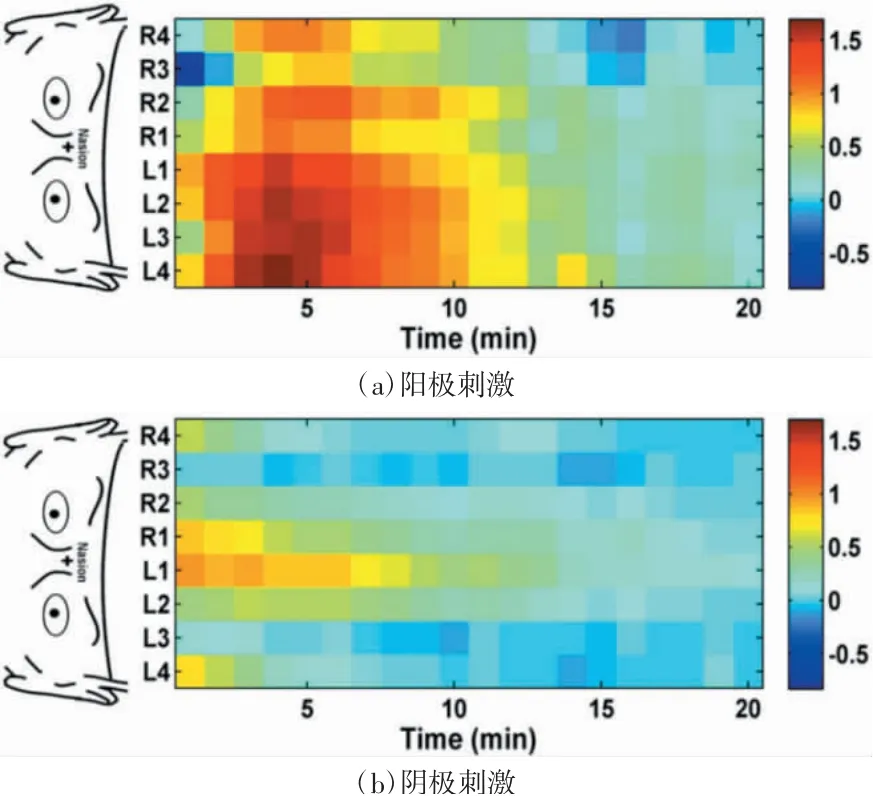
图1 tDCS阳极、阴极刺激后氧合血红蛋白含量变化示意图[22]
2 tDCS对FMS的治疗效果
2.1 tDCS对FMS不同临床症状的治疗效果
FMS常导致患者广泛的肌肉骨骼疼痛,并伴有乏力、焦虑、抑郁、睡眠障碍、认知障碍等症状。目前,大部分研究均证实tDCS在治疗FMS疼痛方面具有较好的治疗效果。Lloyd等[26]对tDCS治疗FMS疼痛强度的影响进行荟萃分析,共纳入14项临床研究,结果表明tDCS是一种安全的干预措施,可以降低FMS的疼痛程度。然而,在进行进一步的临床研究之前,需要对刺激靶点和最佳刺激参数进行更多的临床研究,以获得最好的治疗效果。除疼痛外,Santos等[27]的研究表明,利用tDCS阳极刺激DLPFC,可有效提高FMS患者认知功能,尤其是提高患者的定向和工作记忆能力。Okifuji等[28]的研究表明,tDCS可缓解FMS患者的疼痛、焦虑情绪,提高患者的生活质量。对于乏力、睡眠障碍等疗效,目前仍需要更多研究进行确定。
2.2 tDCS联合有氧运动(aerobic exercise,AE)对FMS的治疗效果
Koltyn[29]的研究表明AE可以通过患者运动皮层的激活和神经递质的释放来改变其大脑活动,对各种疼痛的缓解有积极作用。Mendonca等[30]将受试者分为3组:tDCS+AE组、AE组和tDCS组,分别干预4周。AE是在跑步机上实现,将运动强度控制在心率的60%~70%,每次30 min。治疗前后对受试者的疼痛、生活质量、抑郁焦虑程度以及皮质的兴奋性进行评价。结果显示,tDCS+AE组对受试者疼痛的改善较单独的tDCS组或AE组更为明显,对抑郁的改善作用也优于其他2组。Riberto等[31]也报道了tDCS与拉伸训练相结合的治疗结果,受试者每周进行3次拉伸训练和1次tDCS治疗,持续10周。但试验结果仅观察到SF-36生活质量问卷中(仅疼痛域)1个变量有所改善,tDCS治疗方案的不同可能是产生不同试验结果的原因。
2.3 tDCS联合手法治疗对FMS的治疗效果
FMS患者常伴有其他外周症状,如肌筋膜功能障碍,所以局部处理也不应被忽视。先前的一项研究[31]表明,在FMS的治疗中,如果tDCS与手法治疗相结合,会产生更好的治疗效果。Msda等[32]报道了1例病史长达10 a的FMS女性患者,对其施以周期性tDCS和手法治疗。将阳极电极置于患者左侧M1区,连续进行3次tDCS(2 mA,20 min,间隔10 min),每周2次,共干预8周。刺激结束后,根据具体临床表现和身体评估结果采用软组织脊柱推拿疗法、体位释放技术、综合神经肌肉抑制技术等治疗,每次30 min,每周2次,持续干预8周。在后续12个月的随访中,发现该治疗方案能够有效改善患者的疼痛指数、症状严重程度、FMS影响评分、疲劳焦虑评分状态、睡眠状态及生活质量。因此,今后的治疗可将tDCS与手法治疗相结合,以争取更大的疗效。
3 tDCS治疗FMS的影响因素
3.1 不同刺激靶点对FMS的影响
目前,关于FMS的刺激靶点在运动皮层(M1区)及DLPFC的探索最多[33](如图2所示)。Knotkova等[34]的研究结果表明,M1区是调节痛觉相关神经网络功能失调的可靠靶点,通过增加运动皮层的兴奋性,直接或间接影响丘脑的疼痛相关神经网络,从而对疼痛进行调节。Fagerlund等[35]将48例受试者随机分为真实组或伪刺激组,真实组用tDCS阳极刺激受试者的M1区(20 min,2 mA,连续5次),发现能显著改善FMS患者的疼痛和日常功能。同样,Khedr等[36]用tDCS阳极刺激受试者的M1区(20 min,2 mA,10次/2周),采用广泛疼痛指数、FMS严重程度、视觉模拟评分(visual analogue scale,VAS)、疼痛阈值、汉密尔顿抑郁和焦虑量表以及血清β-内啡肽水平反映治疗效果,结果显示,tDCS刺激M1区能明显减轻患者疼痛,改善其焦虑及抑郁情绪,提高血清内啡肽水平。另外,DLPFC也是常用的刺激靶点,DLPFC能够自上而下地控制初级运动区和初级感觉区,参与疼痛的感知和情绪、认知加工[37]。Silva等[38]观察单次tDCS(DLPFC,2 mA,20 min)对患者注意网络(包括警觉网络、导向网络、执行控制网络)及疼痛的影响,发现使用阳极刺激DLPFC可以显著提高患者的定向和执行注意力网络表现,但对警觉网络作用不大。
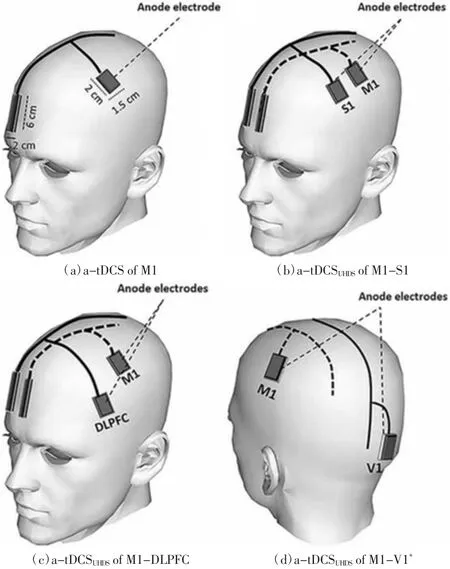
图2 tDCS在M1区、DLPFC区的刺激靶点[33]
有部分学者比较了不同刺激靶点之间产生的疗效差异。Valle等[39]将受试者随机分为3组,即M1区刺激组、DLPFC刺激组和伪刺激组,分别将阳极置于M1区、DLPEC区接受tDCS(2 mA,20 min,10次/2周)和伪刺激,阴极置于对侧眶上区,结果发现2个刺激靶点均能有效改善患者的疼痛和生活质量,但M1区的长期疗效更为显著。另一研究[40]将受试者随机分成DLPFC刺激组、枕神经刺激组(C2区)和伪刺激组,DLPFC刺激组、枕神经刺激组均接受8次tDCS治疗(2次/周,持续4周),对治疗前后患者的疼痛与疲劳程度进行评估,发现使用tDCS阳极刺激DLPFC与枕神经均可有效缓解患者的疼痛症状,但在缓解疲劳方面只有DLPFC刺激组表现出积极作用,说明刺激不同靶点对FMS不同症状的改善作用不同。此外,Mendonca等[41]将tDCS作用于前额叶皮层,发现也能改善患者的疼痛症状,并且与刺激极性无关。虽然针对额叶的大多研究靶点是DLPFC,而不是前额叶,但这一区域似乎在调节疼痛相关回路方面也表现出一定潜能,该区域与其他参与疼痛调节的大脑结构产生联系,如丘脑的内侧背核、边缘联合皮质、下丘脑和PAG等,这些区域在情绪和疼痛调节中起着重要作用[42]。
3.2 tDCS干预疗程及刺激间隔对FMS的影响
tDCS被认为是通过调节突触连接来产生临床效果的疗法,而干预疗程及刺激间隔是影响突触连接的关键因素。Fregni等[43]在受试者的M1区及DLPFC施以5次tDCS治疗(2 mA,20 min),发现只有M1区刺激显示出显著的镇痛效果,但疗效仅维持2周。Valle等[39]为进一步挖掘tDCS的长期疗效,将干预疗程增加至10次却得到了不同结果,研究显示M1区及DLPFC 2个刺激靶点均能有效改善FMS患者的疼痛和生活质量,其中M1区tDCS的疗效可维持60 d。Brietzke等[44]在受试者的DLPFC进行了60次的家庭tDCS治疗(2 mA,30 min),是迄今为止干预疗程最长的研究。研究显示,在20次疗程结束后,刺激在DLPEC区的受试者疼痛评分降低了45.65%,60次疗程结束后刺激组的疼痛评分降低了62.06%,而伪刺激组只降低了24.92%,并且刺激组受试者的睡眠情况、焦虑抑郁改善程度也优于伪刺激组。此外,临床疗效的维持不仅在于干预疗程的总次数,还可能与干预的时间间隔有关,FMS患者若每周只进行1次tDCS治疗,即使干预10次,可能也难以产生显著的临床效果,而若是每周干预5次,连续干预2周,则会产生显著的临床效果[35]。目前多数研究[45-46]证明每周连续5次的刺激(持续2周以上)可以显著改善FMS患者的疼痛及焦虑、抑郁情绪,提高其生活质量,且有更好的后续效应。上述研究说明,tDCS的干预疗程和较短间隔在诱导和维持临床的长期效应方面具有重要作用,这种效应在连续治疗过程中得以最大化。
4 结语
FMS是临床最难诊治的慢性疼痛疾病之一,大大地影响了患者的生活质量。目前,FMS的治疗仍然是一个棘手的问题[46],任何治疗措施都无法完全治愈,而单一干预措施的总体疗效也不理想,因此,急需一种新的、有效的临床干预方法。FMS的发病机制尚不清楚,目前倾向于认为其属于慢性疼痛的一种,与中枢敏化及疼痛处理系统功能紊乱有关。tDCS因其一定程度上可改变皮质神经元的活动及兴奋性而诱发脑功能变化,因此作为一种无创而高效的脑功能调节技术,在治疗慢性疼痛疾病中展示出极具潜力的价值[46]。本文通过回顾国内外近几年的相关研究,证实了tDCS在改善FMS患者疼痛、生活质量、抑郁焦虑程度中的可靠性。另一方面,tDCS在治疗FMS过程中也出现了一些问题,如部分受试者在tDCS治疗后出现皮肤潮红、刺痛和瘙痒等现象,但可自行缓解,未发现有诱发癫痫等严重不良反应。虽然多项研究证明tDCS可以有效改善FMS产生的临床症状,但从纳入的文献上看,疗效评估多采用功能性量表,仅从行为学或症状学角度比较疗效差异,其作用机制并未完全阐明。未来研究可从以下几个方面进行:(1)进一步结合神经功能成像技术如PET、功能性MRI、近红外光谱等,进行多中心、大样本试验,深入探究其作用机制;(2)根据FMS的不同症状优化刺激方案也是未来研究的重要方向之一,因为不同刺激靶点[47]、电流强度、尺寸大小、刺激极性、刺激频率和间隔变化等参数都可能会影响治疗效果;(3)个体差异性同样是未来要考虑的因素,如大脑初始功能状态(如血清脑源性神经营养因子水平),即使用相同刺激模式也可能产生不同效果[44];(4)目前治疗靶点的确定多根据10-20脑电系统分区,如果未来研究能用神经导航技术来实现精准定位,可能在治疗效果或机制研究上会有新的突破,同时也更贴近“精准康复”的治疗理念。
综上所述,tDCS可有效缓解FMS患者疼痛、焦虑及抑郁情绪,提高其生活质量,且该技术可接受性强、不良反应少,但由于目前仍存在临床研究较少、治疗参数不一致等问题,未来还需要更多大样本、多中心、高质量以及长时间随访的随机、双盲、对照研究,以进一步确定tDCS治疗FMS的最佳模式,更好地为FMS患者服务。
