基于基因表达谱的银屑病自噬相关关键基因筛选和候选药物预测*
2023-01-04郭宜城罗美兰许时贵李小兰付志媛
郭宜城,罗美兰,许时贵,李小兰,付志媛
(1.江西省皮肤病专科医院药剂科,南昌 330001;2.江西省皮肤病临床医学研究中心,南昌 330001)
银屑病是一种常见的慢性炎症性皮肤病,全球发病率为1%~3%[1-3],容易反复发作,给患者带来巨大困扰。银屑病的致病原因尚未完全阐明,涉及遗传学、免疫系统和环境暴露等因素,如白细胞介素17(IL-17)和IL-23认为是疾病的关键驱动因素[4-5],细胞因子如肿瘤坏死因子-α(TNF-α)和IL-6等在功能上参与发病过程[6]。
自噬是细胞维持稳态的进化保守过程,是缺陷细胞器、错误折叠或聚集的蛋白质,以及某些老化蛋白质的自我降解[7]。自噬与自身免疫性疾病如系统性红斑狼疮、银屑病、类风湿关节炎等疾病有关[8-10],自噬相关基因(ARGs)死骨片1在银屑病皮损区中表达显著增强,激活磷酸肌醇-3激酶/蛋白激酶B/哺乳动物雷帕霉素蛋白抑制自噬对IL-17a介导的银屑病具有积极的治疗作用[11]。
近年来,随着基因测序技术的发展与广泛应用,基于测序数据的生物信息学分析可高效地处理大量样本数据,并提供疾病的有价值信息。WANG等[12]基于生物信息学方法得到趋化因子(C-X-C型)配体 9(CXCL9)、脯氨酸的小蛋白1B(SPRR1B)、谷氨酰胺转移酶6(TGM6)和 S100钙结合蛋白A9(S100A9)4个银屑病进展的关键基因,其中CXCL9对炎症过程中具有关键作用的单核细胞、嗜中性粒细胞和T淋巴细胞具有很强的趋化作用[13];SPRR1B被确定为牛皮癣的潜在生物标志物[14];TGM6则影响角质形成细胞的分化[15];S100A9因趋化、黏附和嗜中性粒细胞的脱粒作用在银屑病炎性反应的扩增过程中发挥作用[16]。然而利用生物信息学分析银屑病自噬相关关键基因(Hub)鲜有文献报道,本研究选择基因表达综合数据库(GEO数据库)中银屑病的测序数据进行生物信息学分析和验证,探讨Hub和潜在治疗药物,现报道如下。
1 材料与方法
1.1 数据来源
GEO数据库(www.ncbi.nlm.nih.gov/geo/)是美国国立生物技术信息中心(NCBI)创建的基因数据库,收录全球范围研究机构提交的基因表达数据,是目前使用最广泛的基因数据库之一。通过GEOquery包从该数据库下载GSE41662、GSE13355两个数据集的表达谱,其中GSE41662作为分析数据集,GSE13355作为验证数据集,具体信息见表1。通过箱式图查看样本标准化的情况,通过主成分分析(PCA)图查看样本分组间聚类情况。另外通过HAMdb数据库(http://hamdb.scbdd.com/home/index/)收集ARGs。

表1 数据集GSE41662、GSE13355具体信息
1.2 方法
1.2.1分析和筛选自噬相关差异表达基因(DEARGs)
使用R语言Limma包分析GSE41662数据集中皮损区和正常区皮肤组织样本之间的差异表达基因(DEGs),筛选条件:P≤0.05、|log2(FC)|>1,采用R语言ggplot2包绘制火山图。运用DrawVennDiagram(http://bioinformatics.psb.ugent.be)工具对DEGs、ARGs作韦恩图取交集得到DEARGs,并通过Complex Heatmap包绘制热图。
1.2.2基因本体(GO)功能和京都基因与基因组百科全书(KEGG)信号通路富集分析
采用ClusterProfiler包和ggplot2包对DEARGs进行GO生物过程和KEGG通路富集分析及结果可视化,均以P<0.05作为分析标准。
1.2.3蛋白质-蛋白质作用网络(PPI)构建及Hub分析
STRIN数据库(https://string-db.org/)是目前应用最广泛的蛋白质相互作用的数据库之一,收录超过14 000个物种、200多亿个相互作用,通过该数据库构建DEARGs的PPI,筛选条件为combined score>0.4,删除游离点,随后将网络数据导入Cytoscape3.72软件,利用 MCODE算法插件筛选DEARGs最显著模块,条件为MCODE score>5,degree cut-off=2,node score cut-off=0.2,Max depth=100,k score=2,得到Hub。
1.2.4Hub验证
采用GSE13355作为验证数据集,分析Hub表达水平。此外,采用受试者工作特征(ROC)曲线评估Hub与银屑病的相关性。
1.2.5药物分子预测
DGIdb数据库(www.DGIdb.org/)是一个包含了NCBI Entrez、DrugBank、PharmGKB等临床试验数据及PubMed已经发表的文献数据等30个来源的综合数据库。通过搜索DGIdb数据库预测可能逆转异常表达Hub的潜在治疗药物,并构建药物-基因相互作用网络。采用DGIdb数据库分析可能与血管紧张素Ⅱ受体1(AGTR1)、过氧化物酶体增生激活受体γ(PPARG)、瘦素(LEP)、脂联素(ADIPOQ)、烟酰胺磷酸核糖转移酶(NAMPT)、IL6相互作用的药物,过滤条件选择Approved(已批准)。
2 结 果
2.1 DEGs的获取
共筛选出1 428个DEGs,其中上调基因647个(45.3%),下调基因781个(54.7%),样本标准化情况箱式图见图1A。数据集中于皮损区和正常区能显著分离。见图1B。差异分析结果可靠。结果的火山图见图1C。
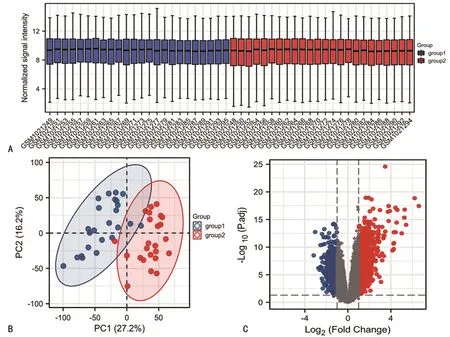
A:样本标准化情况箱式图;B:GSE41662数据集PCA分析;C:DEGs火山图,红色代表上调,蓝色代表下调。
2.2 DEARGs筛选
将获得的DEGs与收集到的797个ARGs取交集得到39个DEARGs,其中上、下调基因分别为23个(59.0%)和16个(41.0%)。见图2A。表达热图和箱式图见图2B~D。DEARGs差异表达见表2。

表2 DEARGs差异表达
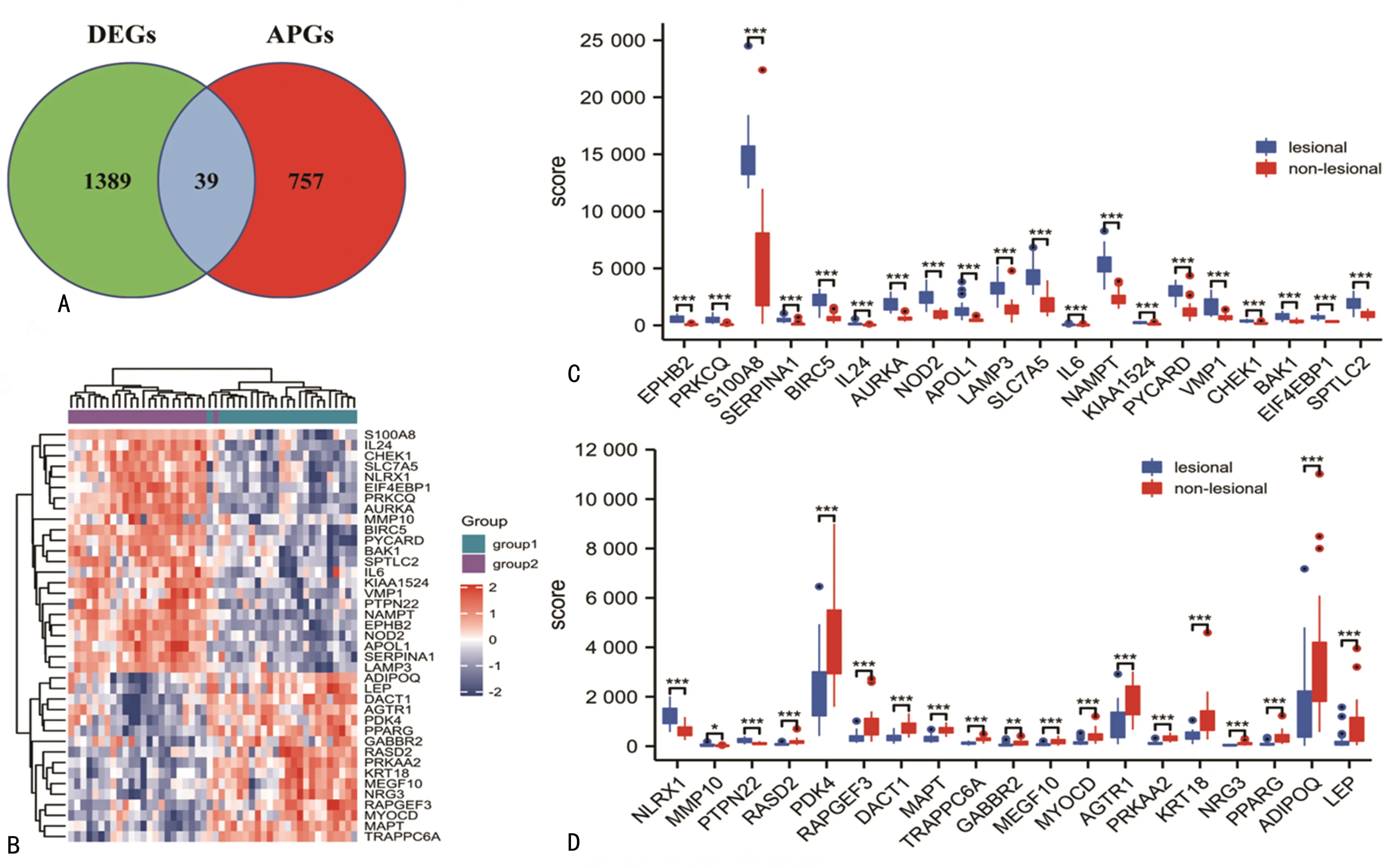
A:DEGs、ARGs韦恩图;B:DEARGs表达热图;C、D:DEARGs在样本中的表达差异箱式图。
2.3 富集分析
DEARGs主要参与炎性反应调控、细胞因子分泌调节、自噬调控,以及IL-8与IL-17的调节等生物过程;主要细胞成分位于内质网腔、浓缩染色体及纺锤丝微管;主要分子功能为受体激活剂活性、丝氨酸/苏氨酸酶活性、细胞因子活性及脂肪酸结合等相关。见图3A。DEARGs主要参与腺苷酸活化蛋白激酶(AMPK)、脂肪细胞因子、NOD样受体、胰岛素抵抗等通路。见图3B。
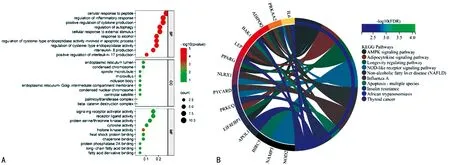
A:GO功能富集分析结果气泡图;B:KEGG通路富集分析圆圈图。
2.4 PPI构建及Hub筛选
运用STRING数据库构建DEARGs的PPI,其由27个节点和46条边组成。见图4A。通过Cytoscape的MCODE插件筛选出最显著模块得到Hub,分别是AGTR1、PPARG、LEP、ADIPOQ、NAMPT和IL-6。见图4B。
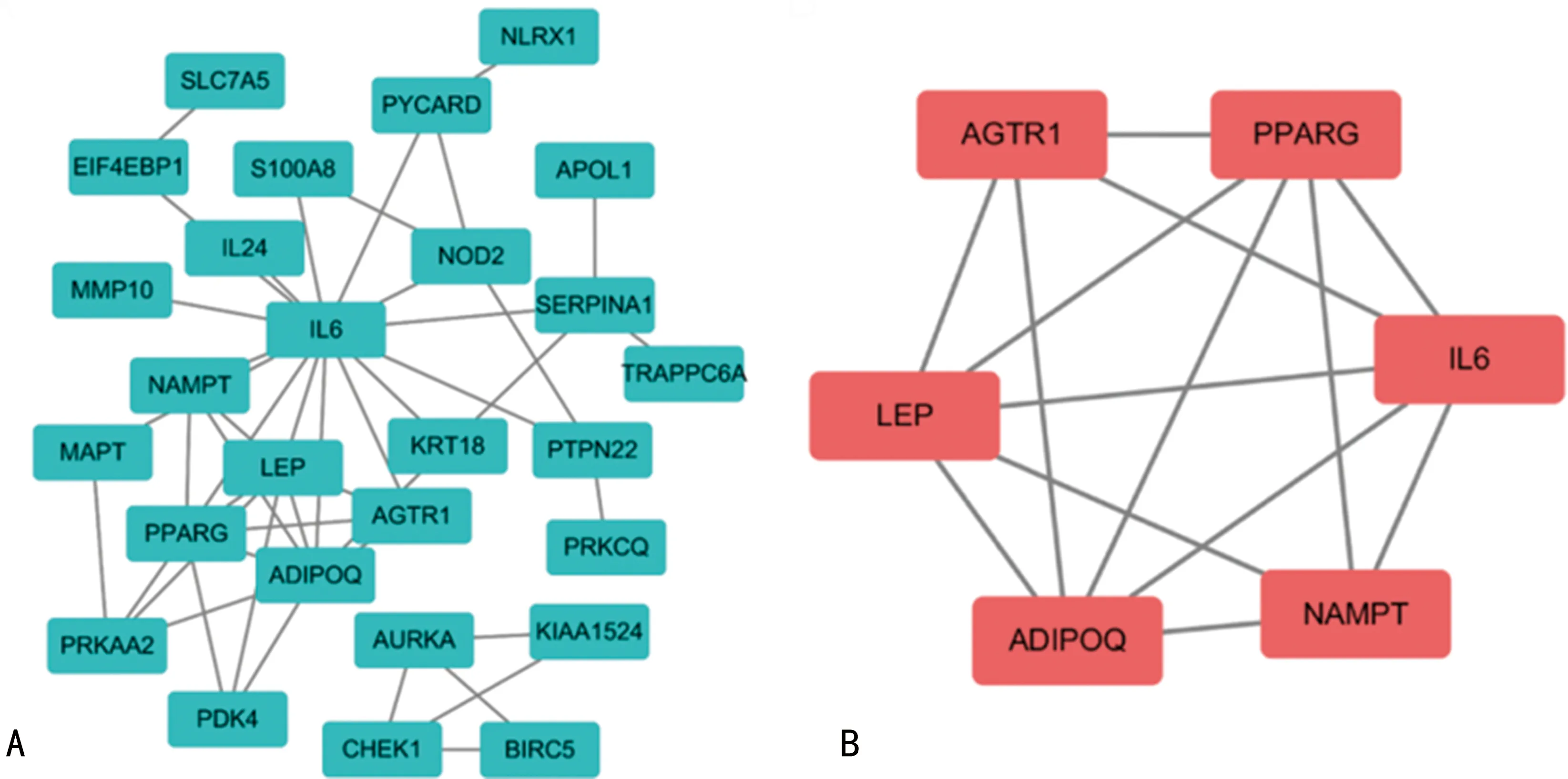
A:构建 DEARGs的PPI;B:MCODE筛选出最显著的模块。
2.5 Hub验证
Hub在验证数据集皮损区与正常区皮肤样本的表达水平显示,PPARGC1B、NAMPT、IL6在皮损区样本中的表达量明显高于正常区皮肤样本,表明基因PPARGC1B、NAMPT、IL6可能在银屑病发病过程中具有促进作用;而AGTR1、LEP、ADIPOQ在皮损区样本中的表达量明显低于正常区皮肤样本,表明AGTR1、LEP、ADIPOQ可能具有抑制银屑病进展的作用。见图5A。AGTR1、PPARG、LEP、ADIPOQ、NAMPT、IL6的ROC曲线下面积分别为0.946、0.961、0.810、0.763、0.995、0.887,见图5B,与表达水平分析结果一致。表明Hub在银屑病疾病的发生、发展中发挥了作用。
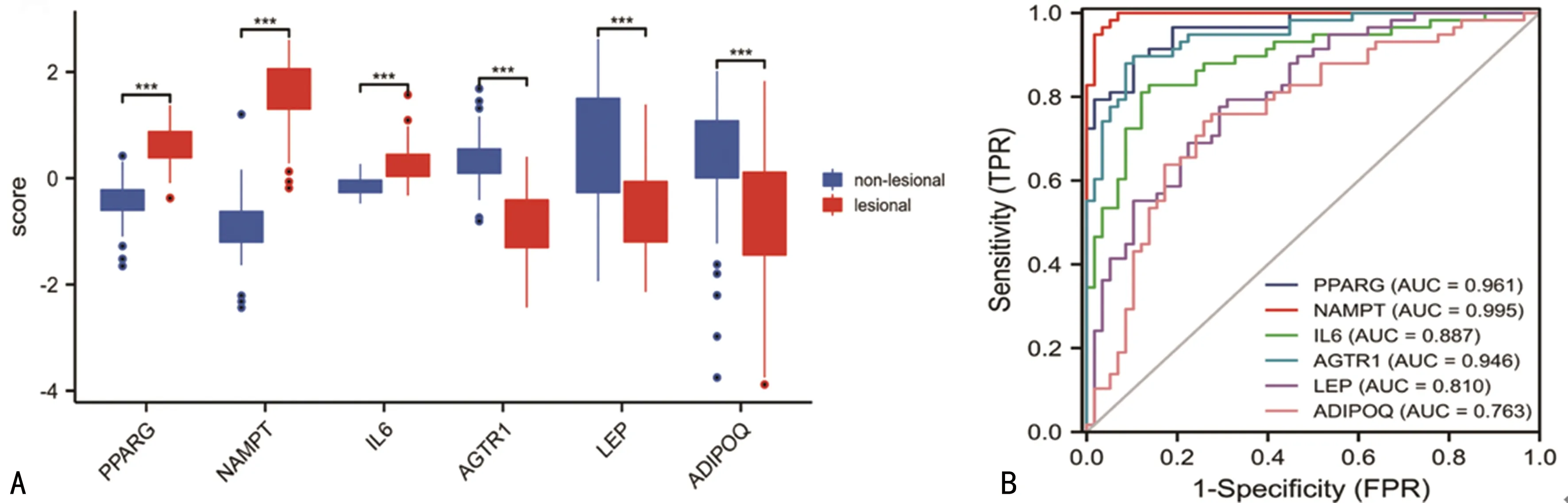
A:Hub在验证数据集GSE13355皮损区和正常区皮肤组织样本的表达差异;B:6个Hub的ROC曲线。
2.6 药物-基因相互作用
包括环孢素、阿达木单抗、利妥昔单抗、异环磷酰胺在内的77种药物与Hub存在相互作用,NAMPT未找到匹配的潜在治疗药物。见图6。
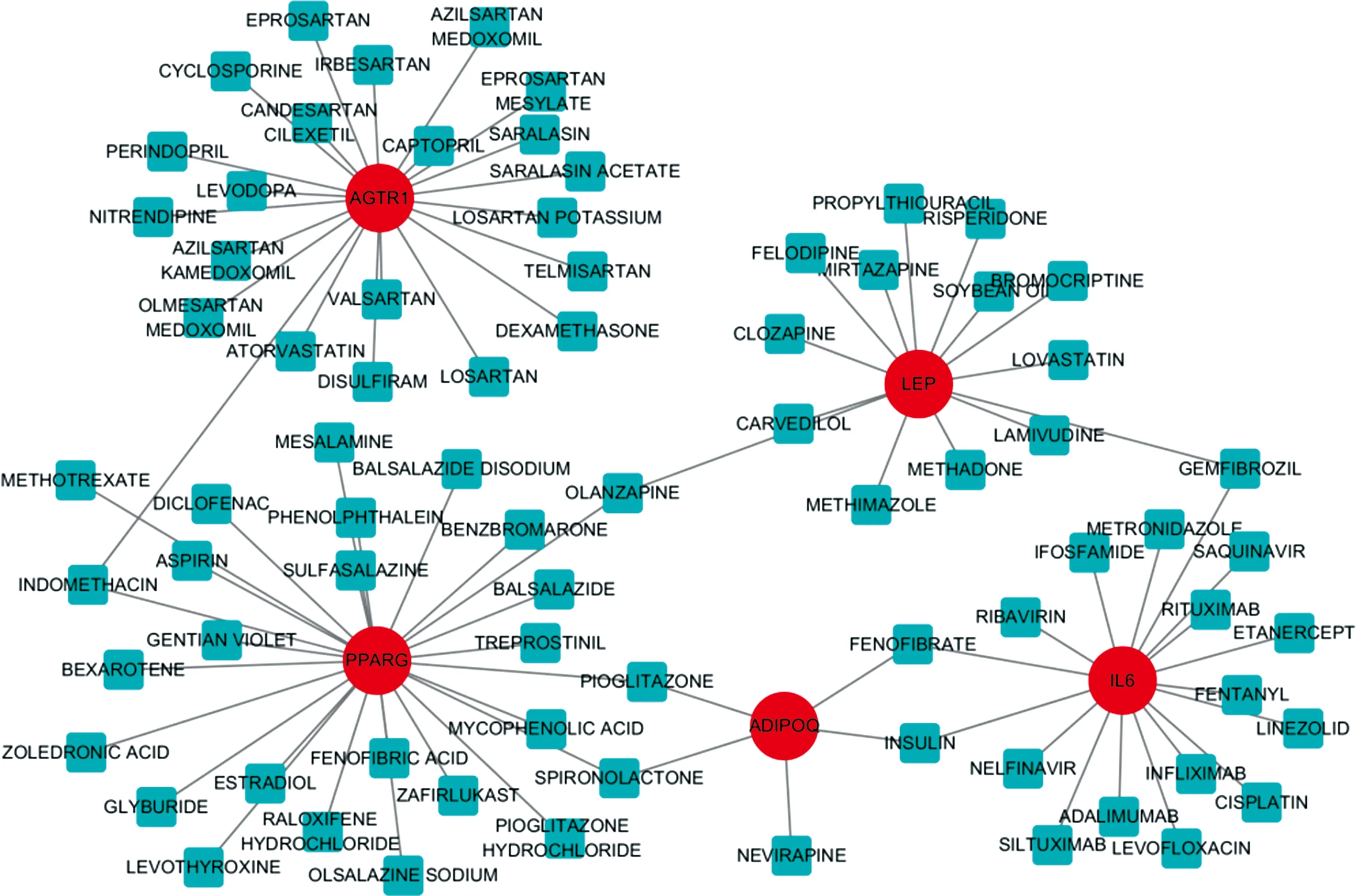
红色圆圈代表基因,蓝色方形代表药物。
3 讨 论
目前,仅有少量研究探索了银屑病与ARGs的关系。目前研究证实,自噬相关16样蛋白1缺失会诱发细胞死亡、组织损伤和炎症,其多态性与银屑病相关[17]。抑制自噬可刺激角质形成细胞产生自主的细胞增殖抑制[18]。在这项研究中选择了基于GPL570平台的数据集GSE41662对24例银屑病患者的皮肤组织转录组表达数据进行分析,筛选出39个DEARGs,并构建PPI得到6个Hub,基于GSE13355数据集和ROC曲线进行验证,结果均提示这些基因通过自噬通路参与了银屑病的疾病进展,最后预测出77个潜在的治疗药物。
在分析得到的Hub中AGTR1可作为介导自噬效应的中枢调节因子[19],已证实可通过干扰银屑病患者表皮细胞自噬、介导角质形成细胞增殖抑制发挥缓解病症的作用[20]。PPARG是脂肪细胞脂肪酸沉积的关键因子[21],其干预饱和脂肪酸代谢而改善脂代谢紊乱可对银屑病皮损改善具有积极作用,与本研究结果一致,有研究发现,LEP在进展期银屑病患者中表达显著增高[22],可能与LEP 的T1型细胞因子释放促进及Th2型细胞因子抑制对银屑病的免疫病理过程有关,其直接相关性需进一步证明。ADIPOQ具有炎症及促炎细胞因子IL-2、IL-6、IL-8的双重抑制作用,同时增加抗炎细胞因子的分泌,可能对银屑病的炎症状态具有极大的改善作用[23-24]。NAMPT介导的 NAD+代谢促进了银屑病皮肤中Th1/Th17 细胞因子诱导的过度增殖和终末分化损害进而加快了银屑病的进程[25],抑制其表达能否控制疾病尚需深入研究。IL-6被认为是银屑病炎症活性的标志物[26],参与了TNF-α、IL-23、IL-17信号通路的银屑病易感性位点,同时还与遗传易感性和对TNF-α抑制剂的反应有关[27]。另外,有研究表明,IL-6介导的慢性炎症状态可拮抗自噬[28],表明IL-6是通过多途径影响银屑病的进展。本研究中部分Hub已有相应的银屑病基础研究成果支持,说明本研究预测结果的可靠性,同时NAMPT、ADIPOQ的表达或功能在银屑病基础研究中未见文献报道,提示NAMPT、ADIPOQ可能为银屑病的诊治提供新的研究思路。
本研究富集分析结果显示,DEARGs与炎性反应、细胞因子、自噬、IL等多种免疫反应相关的功能活化有关,与银屑病是炎症细胞浸润和炎症细胞因子介导的炎症性皮肤病这一共识一致,同时也表明自噬在银屑病发病过程中的重要作用。KEEG富集分析提示,DEARGs涉及单磷酸腺苷激活的蛋白激酶(AMPK)、脂肪细胞因子、核苷酸结合寡聚化结构域(NOD)样受体、胰岛素抵抗等通路,其中AMPK是自噬生理过程中的关键位点,该位点激活后通过促使结节性硬化症复合物2和mTOR调节蛋白磷酸化,进而导致雷帕霉素靶蛋白复合体1(mTORC1)复合物下调和促进Unc-51样激酶1(ULK1)磷酸化的双重作用激活自噬过程[29]。脂肪细胞因子、NOD样受体、胰岛素抵抗等通路均涉及代谢功能方面的调节,通常银屑病与其他代谢性疾病合并发生,目前研究表明,银屑病严重程度评分与高密度脂蛋白胆固醇外流能力呈负相关,高密度脂蛋白胆固醇外流能力与银屑病患者冠状动脉疾病负担直接相关[30]。
干预银屑病自噬的潜在药物预测中,阿达木单抗特异性地与 TNF-α 结合并阻断其与细胞表面TNF受体p55、p75的相互作用而发挥治疗作用。一项阿达木单抗治疗银屑病的临床试验中,研究组71%患者皮损状态得以改善,而安慰剂组仅为7%[31]。环孢素影响干扰素γ和IL-2等炎性细胞因子转录,抑制角质形成细胞DNA的合成与增殖用于银屑病的治疗[32]。异环磷酰胺抑制T淋巴细胞增殖和干扰素γ产生而改善银屑病皮损状况和炎性反应[33]。氯沙坦降低血管紧张素受体Ⅰ(AT1R)和 IL-17a表达,减轻咪喹莫特乳膏诱导的银屑病模型小鼠的红斑、鳞屑及真皮T淋巴细胞浸润[34]。但筛选的潜在药物中有一些是尚未被文献报道具有逆转银屑病的功能,其治疗银屑病的可能性尚需更进一步的论证。
本研究运用生物信息学方法取得了预期研究结果,然而仍存在一定的局限:(1)样本中患者与对照者在年龄分布方面存在的差异导致结果无法区分不同年龄患者自噬水平的差异;(2)本研究分析数据均取自于GEO数据库,其数据的准确性和样本量的有限性可能会造成研究结果的偏差,需要在后续的基础实验及临床实践中加以验证。
总之,本研究运用生物信息学分析了银屑病自噬相关的Hub,并预测了涉及的信号通路及与Hub存在相互作用的潜在治疗药物,为研究银屑病的发病机制和治疗靶点提供了新的思考。
