Pim-3、p-S6、STAT-3在脂肪肉瘤的表达与临床病理特征及预后的关系*
2023-01-04寇天雷朱金磊孙书磊刘继尧郑淑芳
寇天雷,何 轩,朱金磊,孙书磊,刘继尧,郑淑芳
(武警特色医学中心病理科,天津 300162)
作为成人最常见的软组织肿瘤,脂肪肉瘤由分化程度及异型程度不同的脂肪细胞组成,发病率约为软组织肉瘤1/5[1]。脂肪肉瘤患者临床上无特殊症状和体征,起病多隐匿,缓慢性生长,确诊时常已到晚期。临床治疗脂肪肉瘤主要为外科手术切除,但病灶与正常组织边界不清晰,致使手术难以完整切除,脂肪肉瘤容易复发,因而患者多需行多期手术,严重影响预后,患者甚至因手术死亡[2]。靶向基因治疗是目前脂肪肉瘤的重要研究方向。作为原癌基因,Pim-3在正常组织不表达或表达较低,但在肺癌、前列腺癌、乳腺癌等恶性肿瘤组织呈过表达[3-4]。Pim-3在肿瘤细胞可调节细胞的信号传导、周期及相应蛋白合成,例如Pim-3可磷酸化促凋亡因子的表达调控细胞凋亡。另外,大量研究显示,靶向Pim-3的药物可达到抗癌效果[5],如华蟾素通过下调Pim-3的表达抑制高转移胃癌细胞[6]。磷酸化S6核糖体蛋白(phospho-S6,p-S6)是mTOR通路下游执行功能的重要蛋白,被激活的mTOR通路可激活S6,S6蛋白磷酸化为p-S6,p-S6可提高含有5′-TOR一类mRNA表达,这类mRNA约占所有mRNA的1/5,激活上述mRNA,促发大量细胞异常活跃增殖,导致癌症的发生发展,如ZHANG 等[7]研究显示p-S6上调的鼻咽癌患者生存时间明显缩短(P=0.044),可能是鼻咽癌患者预后不良的机制之一。信号转导子和转录激活子3(signal transducer and activator of transcription 3,STAT-3)广泛表达于多种类型的细胞与组织,参与并调控细胞的生长、转化与凋亡等功能。近年的研究显示,STAT-3作为癌基因,所编码的蛋白异常激活或过度表达与多种恶性肿瘤的发生发展及预后紧密相关,如STAT-3活化与多种恶性肿瘤的分期与淋巴结转移密切相关[8]。因而,有学者开始探讨 STAT-3抑制剂或成为新一代抗肿瘤药物[9]。本研究采用免疫组织化学法检测Pim-3、p-S6、STAT-3蛋白在脂肪肉瘤的表达,并探讨上述蛋白表达与脂肪肉瘤临床病理特征及预后的关系,为脂肪肉瘤的诊治及评估预后提供参考,现报道如下。
1 资料与方法
1.1 一般资料
收集本院病理科2009-2016年收治的42例确诊为脂肪肉瘤患者的肉瘤及瘤旁组织。42例脂肪肉瘤患者中,男18例,女24例;年龄26~80岁,平均(55.57±14.68)岁,肿瘤最大径3.0~25.0 cm,平均(11.64±5.39)cm;肉瘤位于四肢18例,躯干24例;临床TNM分期Ⅱ期11例、Ⅲ期22例、Ⅳ期9例;去分化型17例、黏液型15例、高分化型10例;多发病灶6例,单发病灶36例;局部复发3例,无复发39例;远处转移4例,无转移38例。本研究由本院研究伦理委员会审查通过。患者纳入标准:经病理确诊为脂肪肉瘤;患者行手术前意识清晰,病情稳定,配合治疗;无严重的心、肝、肾和脑功能障碍。排除标准:资料不全,不配合治疗,随访信息不完整;合并其他良恶性肿瘤;妊娠或哺乳期女性。
1.2 免疫组织化学
采用免疫组织化学 PV-6000 两步法染色,组织石蜡包埋,常规切片脱蜡水化,微波加热修复抗原,滴加一抗,4 ℃过夜,滴加二抗,DAB 显色,苏木素复染,脱水透明封固。采用已知阳性切片作阳性对照,用磷酸盐缓冲液(PBS)代替一抗作阴性对照。按阳性染色强度和阳性细胞所占百分比打分评估,按染色强度评分:0分为无色;1分为浅黄色;2分为棕黄色;3分为棕揭色。按阳性细胞所占百分比评分:无阳性细胞0分;1%~25% 1分;>25%~50% 2分;>50%~75% 3分;>75% 4分。积分=染色强度评分+阳性细胞所占百分比评分,分级标准为:0 分为-,2~3 分为+,4~5 分为++,6~7 分为+++,其中+、++与+++判定为阳性。每张切片由2名病理科医师以双盲法判断结果分别计数,计数之差>10%则重新计数。鼠抗人Pim-3、p-S6和STAT-3 单克隆抗体及免疫组织化学试剂盒均购自北京中杉金桥生物技术有限公司。
1.3 统计学处理
采用SPSS18.0软件进行数据分析,对计数资料进行χ2检验,不同蛋白表达的生存分析采用Log-rank分析,生存曲线采用Graph Pad Prism 8.0.1制作。检验水准α=0.05,取双侧,以P<0.05为差异存在统计学意义。
2 结 果
2.1 Pim-3、p-S6和STAT-3蛋白在脂肪肉瘤及瘤旁组织中的表达
Pim-3、p-S6和STAT-3蛋白表达主要位于细胞核,Pim-3、p-S6和STAT-3蛋白在脂肪肉瘤组织阳性表达分别为21例(50.00%)、19例(45.24%)和22例(52.38%),在瘤旁组织的阳性表达分别为10例(23.81%)、8例(19.05%)和9例(21.43%),与瘤旁组织比较,脂肪肉瘤组织Pim-3、p-S6和STAT-3阳性表达率较高,差异有统计学意义(P<0.05)。见表1和图2。
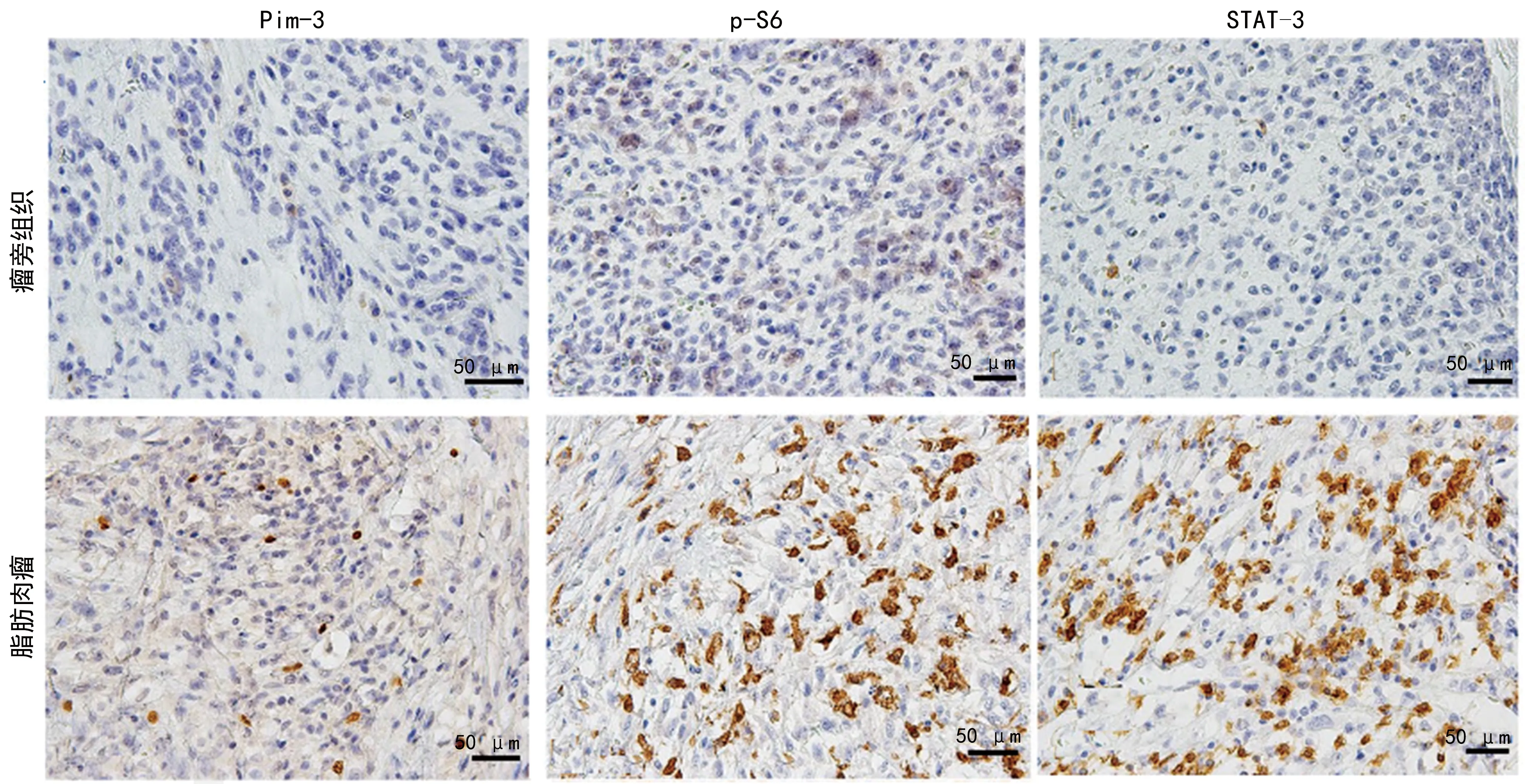
图1 Pim-3、p-S6和STAT-3蛋白在脂肪肉瘤及瘤旁组织表达
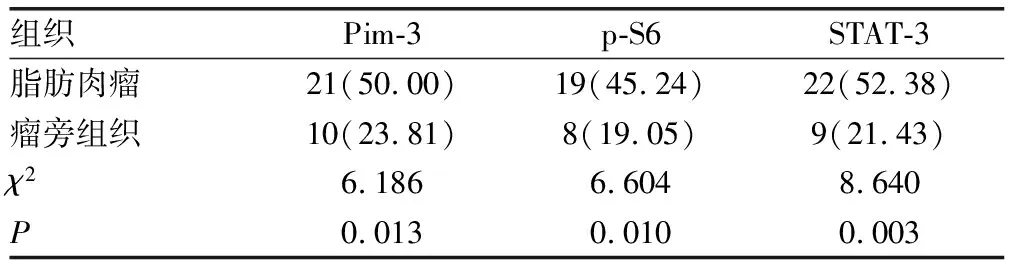
表1 Pim-3、p-S6和STAT-3蛋白在脂肪肉瘤及瘤旁组织的表达[n(%),n=42]
2.2 Pim-3、p-S6和STAT-3蛋白表达与脂肪肉瘤的临床病理关系
不同性别、年龄、肿瘤最大径、有无多灶的Pim-3、p-S6和STAT-3蛋白阳性表达率差异无统计学意义(P>0.05),不同肉瘤部位、TNM分期、病理类型、有无局部复发及有无远处转移的Pim-3、p-S6和STAT-3蛋白阳性表达率差异有统计学意义(P<0.05)。见表2。

表2 Pim-3、p-S6和STAT-3蛋白表达与脂肪肉瘤患者的临床病理关系[n(%)]
2.3 Pim-3、p-S6和STAT-3蛋白表达与脂肪肉瘤预后的关系
本研究42例患者均获得随访,随访率100%(42/42)。截至2021年随访结束,生存25例(59.52%),死亡17例(40.48%),均为脂肪肉瘤复发或恶化引起。Pim-3、p-S6和STAT-3阳性患者死亡率均分别高于 Pim-3、p-S6和STAT-3阴性患者死亡率(P<0.05)。见表3、图2。

表3 Pim-3、p-S6和STAT-3蛋白表达与脂肪肉瘤预后的关系[n(%),n=42]

图2 Pim-3、p-S6和STAT-3蛋白表达与脂肪肉瘤患者预后的关系
3 讨 论
脂肪肉瘤的发病原因尚不清楚,但大量研究显示脂肪肉瘤的发生发展与相关蛋白的异常表达密切相关。
Pim-3是丝氨酸/苏氨酸蛋白激酶,在肺癌和乳腺癌等许多恶性肿瘤中异常过表达,通过磷酸化底物的方式失活底物蛋白活性,促进细胞增殖,抑制细胞凋亡,敲除Pim-3则细胞周期进程与细胞生长均可出现明显的延迟[10-11],CHEN等[12]研究显示Pim-3还参与胰腺癌的放疗抵抗,与Pim-3参与细胞周期与DAN修复有关,因而Pim-3 蛋白被认为是多种恶性肿瘤的发病因素,是评估晚期癌症患者接受个体化治疗疗效的生物标志物,也是潜在指标[13]。但Pim-3 蛋白在脂肪肉瘤的表达研究较少,本研究采用免疫组织化学法检测其在脂肪肉瘤组织的表达,结果显示Pim-3 蛋白表达显著上调,同时在不同肉瘤部位、TNM分期、病理类型、有无局部复发及有无远处转移存在差异,提示随着脂肪肉瘤恶性程度增加,Pim-3 蛋白表达增加。
p-S6表达增高是mTOR通路活化的标记,p-S6上调5′-mTOR mRNA翻译,如上调核糖体蛋白、延伸因子等蛋白表达,SHIRATORI等[14]等检测347例患者,p-S6表达阳性148例,阳性率为42.7%,p-S6表达阳性与患者生存时间呈负相关。报道亦显示采用雷帕霉素通过抑制p-S6表达可抑制大肠癌细胞增殖[15]。本研究结果显示,p-S6在脂肪肉瘤组织的表达明显增高,提示mTOR通路被激活,参与脂肪肉瘤的发生发展,影响脂肪肉瘤患者预后。
STAT-3是STAT家族的转录活化因子蛋白,当STAT-3被激活可形成二聚体,促进细胞核内结合染色体的靶基因启动子,诱导下游靶基因转录激活,如诱导抗凋亡基因、增殖相关基因及血管生成基因的表达,同时STAT-3还可调控细胞周期,延长细胞生存时间,促进细胞恶性转变。因STAT-3在大量恶性肿瘤中过表达,因而已有研究将STAT-3作为靶点进行抑制肿瘤发生的研究,如YADAV等[16]采用STAT-3阻断药AG490体外阻抗癌细胞凋亡,结果显示AG490可选择性地抑制癌细胞生长,促进其凋亡,但对正常细胞无明显的影响。
关于Pim-3、p-S6、STAT-3蛋白表达与脂肪肉瘤病理类型的关系,本研究结果显示,大部分高分化脂肪肉瘤的Pim-3、p-S6、STAT-3蛋白多为弱阳性或阴性表达,且局部复发、远处转移或死亡的发生率相对较小,对应的去分化型、黏液型脂肪肉瘤的Pim-3、p-S6、STAT-3蛋白多为阳性表达,对应局部复发、远处转移或死亡的发生率相对较多,这类患者的恶性程度高且肿瘤位置相对较深,如位于腹股沟与腹膜后,预后不佳的可能原因在于肿瘤组织未能被完全切除,因此,建议对脂肪肉瘤患者在制订外科手术方案时,除了考虑病理类型与切除范围的关联[17],还需结合Pim-3、p-S6、STAT-3蛋白在肿瘤组织的表达,确定是否要扩大范围进行切除,必要时是否要联合切除肾和肠等脏器,以提高患者的总生存期(overall survival,OS)和肿瘤特异性生存期(cancer-specific survival,CSS)。另外,从新药研发角度看,靶向Pim-3、p-S6、STAT-3来加速瘤细胞凋亡或降低瘤细胞增殖速度可能是脂肪肉瘤未来的治疗方向之一。
本研究亦存在不足,如 Pim-3、p-S6、STAT-3蛋白低表达的脂肪肉瘤中是否与其基因突变相关,本研究未进行检测,因此下一步研究有必要增加上述蛋白在脂肪肉瘤的基因突变情况研究,为脂肪肉瘤的病理特点、诊治及预后等研究提供更多参考。综上所述,Pim-3、p-S6、STAT-3蛋白在脂肪肉瘤均呈异常表达,Pim-3、p-S6、STAT-3表达阳性与不同肉瘤部位、TNM分期、病理类型、有无局部复发及有无远处转移相关,与患者的预后不佳也相关。
