14例抗Hu抗体阳性神经系统副肿瘤综合征临床特征分析
2023-01-03潘佳丽刘举陈敏魏芷桦杨晓艳刘洪波
潘佳丽 刘举 陈敏 魏芷桦 杨晓艳 刘洪波
神经系统副肿瘤综合征(paraneoplastic neurologic syndrome,PNS)是由恶性肿瘤的远隔效应引起的神经系统自身免疫性疾病,可以累及神经系统各个部位,如大脑、脊髓、周围神经和神经肌肉接头[1],其临床表现复杂多样。2021年7月以Graus为首的PNS国际专家组提出了PNS最新诊断标准,提出了一个新的PNS诊断评分系统(PNS-Care Score),重新定义了PNS常见的临床表型,并将其分为高风险表型和中风险表型[2]。抗Hu抗体,又称抗神经元核抗体1型(ANNA-1)作为“高风险抗体”,与肿瘤有很强的相关性。目前国内外关于抗Hu抗体阳性的PNS研究大多依据2004版诊断标准,且多为个案报道。本研究依据2021版最新诊断标准分析14例确诊的抗Hu抗体阳性PNS患者的临床特征,期望为临床诊治提供经验。
1 对象和方法
1.1 研究对象选择2016年1月至2020年9月郑州大学第一附属医院确诊为抗Hu抗体阳性的PNS患者14例,其中男8例、女6例,年龄42~74岁,平均(58.93±9.50)岁;发病年龄42~74岁,平均(58.79±9.55)岁,病程3~48个月(病程定义为从出现神经系统症状到随访截止时间或死亡时间),中位数12.00(14.75,16.50)个月。纳入标准:符合2021年Graus等[2]修订的《神经系统副肿瘤综合征更新诊断标准》;所有入选患者均具有PNS相应的高风险表型或中风险表型,脑脊液(CSF)和(或)血清抗Hu抗体均阳性,并且均有经病理确诊的恶性肿瘤。排除标准:在血清、CSF中检测到抗Hu抗体且确诊恶性肿瘤,但神经系统症状可能是由肿瘤转移、压迫引起的。
1.2 方法收集并分析整理患者的临床表现,实验室检查(包括血清肿瘤标志物、电解质、副肿瘤抗体,脑脊液常规生化及电泳)、影像学、神经电生理、病理等检查结果,以及治疗和预后情况,并于2021年8月对所有患者进行随访。副肿瘤抗体检测采用免疫印迹法(BLOT)。
1.3 统计学处理计量资料若符合正态分布则以均数±标准差表示,非正态分布数据以中位数(四分位数)表示,计数资料以例或率(%)表示。
2 结果
2.1 临床表现14例中周围神经病变9例(64.3%),其中7例为感觉运动神经病,表现为进行性四肢麻木无力,感觉神经元病2例,主要表现为四肢麻木、疼痛;边缘性脑炎2例(14.3%),主要以嗜睡、认知障碍与精神障碍发病;快速进展性小脑综合征2例(14.3%),主要表现为头晕、视物模糊、共济失调,其中1例伴恶心呕吐,1例伴有言语不清;脑干脑炎1例(7.1%),以复视、吞咽困难、言语不清为首发表现。具体临床特征见表1。
2.2 实验室检查
2.2.1血清学检查:入院后查电解质,5例检出低钠血症,予补充电解质,之后复查发现患者2、10、12具有顽固性低钠血症(110~131 mmol/L,正常参考值范围135~145 mmol/L)且24 h尿钠增多(395~603 mmol/24 h,正常参考值范围130~260 mmol/24 h)。
所有患者均行血清肿瘤标志物筛查,异常10例(71.4%),其中CA-125升高4例,NSE升高3例,非小细胞肺癌抗原升高3例,CA72-4升高2例,PSA比值升高1例,CA15-3升高1例。
2.2.2CSF检查:所有患者均行CSF常规、生化和电泳检查,9例检出异常。CSF压力增高(210 mmH2O)1例,蛋白升高6例,细胞数增多5例,IgG指数升高5例,24 h鞘内合成率升高7例,寡克隆区带阳性1例。
2.2.3副肿瘤抗体检查:14例均检测出血清和(或)CSF抗Hu抗体阳性,其中9例血清阳性,3例CSF阳性,2例血清及CSF均阳性。2例双重抗体阳性,分别合并抗Yo抗体和抗CV2抗体。
2.3 影像学检查头MRI:14例患者均未发现脑占位性病变,其中患者12发现左侧海马异常信号,余均无特异性表现。
胸腹部CT:11例发现肺部占位,1例前上纵隔占位,1例回盲部占位。结果见表2。
PET-CT:3例行全身PET-CT检查,患者7显示纵隔(2R、4R、7区)肿大淋巴结代谢活跃,考虑恶性病变。患者10示右肺门片状软组织影代谢活跃,怀疑恶性病变。患者12提示左前中纵隔软组织肿块代谢活跃,考虑恶性病变。余系统未发现恶性病变。

表1 14例抗Hu抗体阳性PNS患者的临床特征
2.4 神经电生理检查9例患者行神经肌电图检查,其中3例行重复神经电刺激(RNS)检查。7例结果提示四肢被检神经周围运动及末梢感觉传导速度减慢,波幅降低,其中5例双胫H反射未引出;2例提示四肢部分周围神经末梢感觉传导异常,运动神经传导功能正常。RNS均未见异常。
2.5 病理检查14例患者均行病理活检,11例结果提示SCLC,其中1例合并回盲部小细胞癌;另外3例病理结果分别提示胸腺梭形细胞瘤、乳腺浸润性癌和非霍奇金淋巴瘤。
2.6 原发性肿瘤与神经症状发生顺序3例PNS发生在肿瘤确诊之后,1例乳腺癌,1例B细胞淋巴瘤,1例SCLC;11例PNS出现在发现肿瘤之前,1例胸腺小细胞癌,10例SCLC,其中1例合并回盲部小细胞癌。先出现神经系统症状的患者至确诊的时间为15 d至14个月,中位延迟诊断时间4.00(2.00,6.00)个月。
2.7 治疗及预后PNS发病后,6例患者接受糖皮质激素治疗,其中5例联合了肿瘤治疗;2例给予丙种球蛋白治疗;2例仅接受肿瘤治疗;余3例仅给予对症治疗。治疗后 9例患者症状缓解,5例患者症状无好转。于2021年8月对14例患者进行电话随访,3例患者病情好转,余11例死亡,多数死于肿瘤本身,部分死因不详,生存时间3个月至4年,中位生存时间12.00(4.75,16.50)个月。具体见表3。
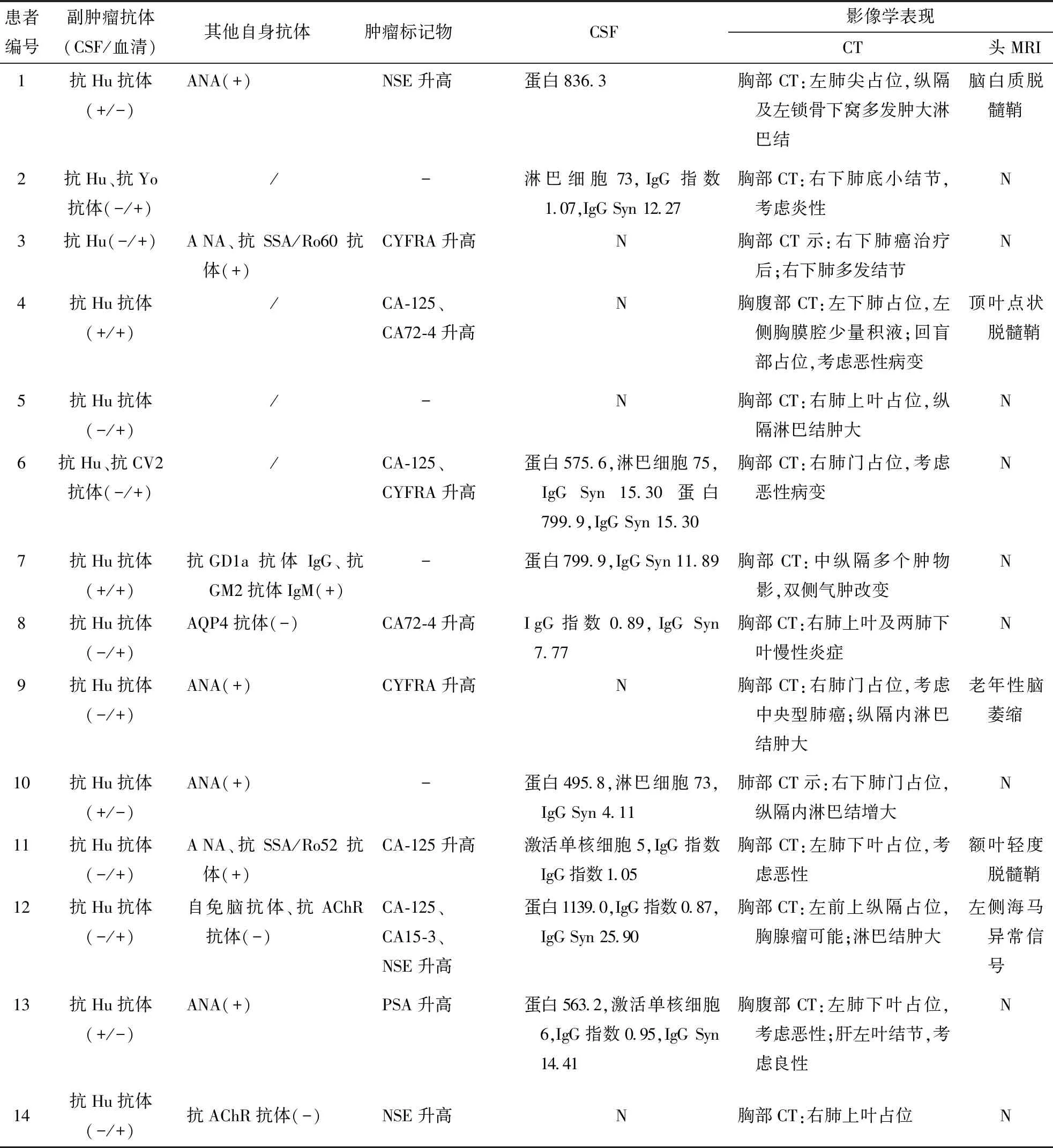
表2 14例抗Hu抗体阳性PNS患者实验室及影像学检查
3 讨论
PNS是由潜在恶性肿瘤驱动的神经系统自身免疫病。0.3%~1.0%的肿瘤患者会出现PNS[1],与PNS最相关的肿瘤主要有SCLC、乳腺癌、卵巢癌、淋巴瘤等[3]。2004版诊断标准认为具有一种经典或非经典的神经系统综合征和特征明确的肿瘤神经抗体,即使未发现癌症也可诊断PNS[4]。2021年最新诊断标准重新定义了PNS,由“高风险表型”代替原来的“经典PNS”,并引入“中风险表型”作为“高风险表型”的补充。高风险表型通常指具有副肿瘤病因的与癌症相关的神经系统综合征,是PNS最常见的临床表型,包括脑脊髓炎、边缘性脑炎、快速进展性小脑综合征、眼阵挛-肌阵挛综合征、感觉神经元病、胃肠道假性梗阻、Lambert-Eaton综合征。中风险表型指可能合并或不合并恶性肿瘤的神经系统疾病,但这些表型促使对PNS的考虑,包括抗NMDAR脑炎、脑干脑炎、Morvan综合征、僵人综合征、多神经根神经病等。此外,专家小组制定了一个新的PNS诊断评分系统,即PNS-Care Score,结合临床表型、抗体类型以及是否存在癌症将其分为3个等级:确诊的(≥8分),很可能的(6~7分),可能的(4~5分)。在诸多PNS抗体中,抗Hu抗体是最具有特异性的高风险抗体之一,新诊断标准提出该抗体85%与肿瘤相关,特别是SCLC[2],其靶抗原位于神经元细胞核内,是一种RNA结合蛋白,该蛋白在后根神经节的感觉神经元和浦肯野细胞中高表达,因此这些部位最易受累。目前研究认为抗Hu抗体本身不具有直接致病作用,主要致病机制是T细胞介导的针对神经元抗原的免疫反应[3,5]。基于此,我们采用2021年PNS最新诊断标准进一步总结抗Hu抗体阳性患者的临床特征。

表3 14例抗Hu抗体阳性PNS患者的治疗及预后
首先,本研究中所有患者均达到确诊标准(PNS-Care评分>8分)。本组患者以副肿瘤性周围神经病最多见,其次为边缘性脑炎、快速进展性小脑综合征。周围神经病中感觉神经元病仅占22.2%。既往研究显示,抗Hu抗体阳性的脑脊髓炎中,大部分(54%)患者为周围神经病,但只有少数(24%)表现为单纯的感觉神经元病[5],本研究与之相一致。多数PNS伴有自主神经功能障碍,但容易被忽视,本研究中便秘是最常见的自主神经症状。总之,对于出现不明原因的周围神经病变者需警惕PNS可能性,要及时完善副肿瘤抗体检查。
抗利尿激素分泌异常综合征(SIADH)是副肿瘤综合征的一种,多见于SCLC,大约15%的SCLC患者可合并SIADH[6]。本组3例顽固性低钠血症患者考虑是抗利尿激素分泌异常的结果。1例症状较轻,2例伴有恶心、呕吐、严重影响进食,患者10在住院期间出现呼之不应,烦躁不安,呼吸困难,考虑是血钠过低引起。研究显示,合并于SCLC的严重的低钠血症,可以增加患者的死亡率[7]。因此,对于发现顽固性低钠血症的患者,应警惕副肿瘤综合征的可能,及时发现肿瘤并纠正低钠血症可以改善患者症状、减少死亡率。
其次,本组PNS中,SCLC为最多见的肿瘤。抗Hu抗体的靶抗原在肿瘤和神经细胞中均有表达,它能诱导机体产生针对自身的Hu抗体,从而介导自身免疫性神经系统损害。抗Hu抗体对SCLC具有高度特异性,85%以上抗Hu抗体阳性患者与SCLC有关[5]。此外,抗Hu抗体还与其他恶性肿瘤,如非小细胞肺癌、神经母细胞瘤、神经内分泌肿瘤等相关。值得注意的是,约50%~80% PNS患者以神经系统症状首发,神经综合征出现在发现肿瘤之前[8]。本组11例(78.6%)患者神经系统症状在肿瘤确诊之前出现,延迟诊断15 d至14个月。因此,对于抗Hu抗体阳性且出现神经系统症状者,不要忽视对肿瘤的筛查,而对疑诊PNS的患者即使未发现肿瘤也要定期随访。
在影像学方面,本组患者中大多数患者的头MRI正常,仅1例边缘性脑炎患者头MRI发现左侧海马异常信号,快速进展性小脑综合征患者未发现小脑萎缩,原因可能是仍处于疾病早期阶段。此外,1例脑干脑炎患者也未发现特异性影像表现,可能如既往研究所述,大多数脑干脑炎患者头MRI检查不能发现责任病灶[9]。既往研究发现,在70%~80%的边缘性脑炎患者中可见FLAIR和T2WI序列颞叶内侧异常信号[10]。快速进展性小脑共济失调的患者初期无小脑萎缩的影像学表现,随着疾病的进展,MRI可能出现小脑萎缩[11-12]。可见,对于出现中枢神经系统症状但头MRI阴性的患者更要警惕PNS的可能。
PET-CT有助于发现隐匿肿瘤,尤其对于其他肿瘤检查未发现阳性结果但怀疑PNS的病例[13]。
本研究行PET-CT检查的3例患者结果均提示恶性病变,经病理活检,最终分别确诊为SCLC和胸腺小细胞癌,表明PET-CT可以为PNS的早期诊断提供依据。
PNS的治疗,除肿瘤治疗外主要是免疫抑制治疗,包括糖皮质激素冲击和静注丙种球蛋白。14例患者发病后,共8例接受了免疫治疗,其中5例联合了肿瘤治疗,3例仅接受肿瘤治疗,3例仅接受对症治疗。本研究中大部分患者预后差。既往研究发现,抗表面或突触抗原抗体的患者通常表现出对免疫治疗的良好反应[14]。抗Hu综合征对治疗的反应通常较差,原因是快速和永久性的神经元丢失[15]。但免疫治疗可以改善部分患者的临床症状,促使神经功能修复。既往研究显示,肿瘤治疗是疾病改善或稳定的独立预测因子[3],只有对原发肿瘤进行治疗才能显著改善患者的预后。
综上所述,本组14例抗Hu抗体阳性的PNS患者临床表现多样,以周围神经病变最多见,SCLC为最常见的原发肿瘤,大多数神经系统症状出现在肿瘤确诊之前。PNS整体预后不良,及早启用肿瘤治疗和免疫抑制治疗可以改善患者症状,延长生存时间。因此,需要临床医生提高对该病的认识,减少误诊和漏诊。
