Bmal1过表达对动脉粥样硬化斑块病变程度及稳定性的影响
2022-12-31朱胜奎丁家望汪心安张再强万剑桥
朱胜奎 丁家望 汪心安 张再强 万剑桥
动脉粥样硬化是大、中型动脉的慢性非特异性炎性病变,是冠状动脉粥样硬化性心脏病(冠心病)最常见的病理基础[1]。动脉粥样硬化发病机制复杂,涉及炎性反应、氧化应激、凋亡等。研究发现,昼夜节律相关基因参与了动脉粥样硬化的形成过程,昼夜节律紊乱会引起动脉粥样硬化的病理紊乱,促进心血管疾病的发生发展[2-3]。生物钟基因是生物昼夜节律呈现的分子基础,哺乳动物的生物钟主要位于下丘脑视交叉上核(SCN)。脑肌类芳烃受体核转位样蛋白1 基因(Bmal1)在昼夜节律系统中至关重要,是唯一单独缺失即可导致全身节律丧失的核心时钟基因[4-5],可影响动脉粥样硬化的发生发展过程[6-7]。基质金属蛋白酶(MMP)可局灶性破坏细胞外基质,导致粥样斑块不稳定[8]。本研究建立小鼠动脉粥样硬化模型,探讨Bmal1 对动脉粥样硬化病变程度及斑块稳定性的影响,为动脉粥样硬化的防治疗提供理论依据。
1 资料与方法
1.1 实验动物
8 周龄SPF 级ApoE-/-雄性、雌性种鼠各3 只,血管平滑肌细胞特异性Bmal1转基因的SM-Bmal1-TG/ApoE-/-雄性、雌性小鼠各3 只,均购自武汉大学动物实验中心并分笼喂养于三峡大学实验动物中心,繁殖后选取符合实验要求的小鼠,生产许可证号为SCXK(鄂)2016-0006。所有实验小鼠11周龄,体质量为15~20 g。动物饲养间温度(22±2)°C,湿度(60±5)%,保持明暗交替的光照条件,均予以高脂饮食(蛋白质15.8%、脂肪40%、碳水化合物44.2%),实验经动物实验伦理委员会批准,实验动物设施使用证明许可证号为SYXK(鄂)2017-0061。实验小鼠分为2 组,ApoE-/-组(雄性小鼠,n=12)、SM-Bmal1-TG/ApoE-/-组(雄性小鼠,n=12)。
1.2 动物模型构建
取出生1 周后的小鼠脚趾或尾部组织,运用琼脂糖凝胶电泳进行Bmal1转基因小鼠的鉴定。小鼠11 周龄时,分离ApoE-/-小鼠、SM-Bmal1-TG/ApoE-/-小鼠左侧颈总动脉血管,血管外置入外径0.5 mm、内径0.3 mm、长度为10 mm 的CAST 套管,造成局部血管狭窄,以利于形成湍流,促进动脉粥样硬化形成,小鼠造模前高脂喂养2 周,造模后继续高脂喂养 9 周。
1.3 血脂水平检测
各组小鼠通过眶静脉采血,按照试剂盒说明书检测三酰甘油(TC)、总胆固醇(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)水平。
1.4 苏木精-伊红染色
处死小鼠后分离小鼠行CAST 套管手术的颈总动脉,清除血管外组织,置于4%多聚甲醛缓冲液中固定,苏木精-伊红(HE)染色。镜下观察病理切片形态,每只动物取5 张切片,计算斑块面积平均值。
1.5 Western blot法检测MMP-2、MMP-9的蛋白表达水平
采用RIPA 裂解液提取小鼠颈总动脉组织总蛋白,测定蛋白浓度。蛋白经十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜后,TBST 室温封闭1 h,一抗4℃孵育过夜,洗膜后二抗室温孵育30 min,进行Western Blot 检测。扫描条带并计算目的蛋白的相对表达水平,具体操作步骤按试剂盒说明书进行,本实验所用试剂盒购于武汉三鹰生物技术有限公司。
1.6 统计学分析
采用 SPSS 20.0 软件进行统计学分析,计量资料以均数±标准差表示,两组间比较采用独立样本t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 2组小鼠血脂水平比较
与 ApoE-/-组比较,SM-Bmal1-TG/ApoE-/-组TG、TC、LDL-C 均显著降低(P均<0.05),2 组HDL-C 水平差异无统计学意义。见表 1。

表1 2组小鼠血脂水平比较(n=12)
2.2 2组小鼠斑块病理学检测结果比较
HE 染色可见 ApoE-/-组小鼠颈动脉血管内皮下有脂质沉积,动脉粥样硬化斑块形成,血管内膜增厚,并突向管腔,管腔中央有血栓形 成;SM-Bmal1-TG/ApoE-/-组小鼠颈动脉血管内皮下有少量脂质沉积,动脉粥样硬化斑块明显减少,血管内膜部分增厚,管腔中央可见少量血栓形成。与ApoE-/-组小鼠相比,SM-Bmal1-TG/ApoE-/-组小鼠动脉粥样硬化斑块面积减少25%[(14.62±0.79)%对(20.62±6.00)%,P<0.05],见图 1。
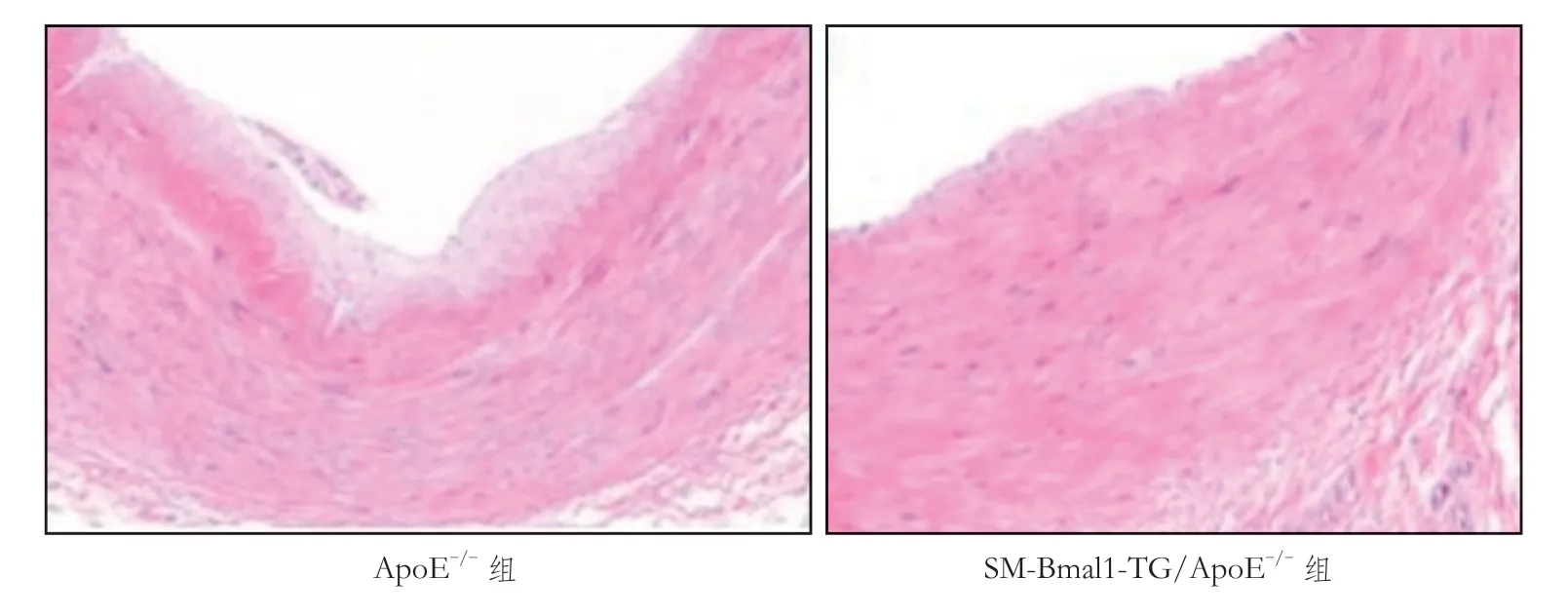
图1 2组小鼠颈总动脉HE 染色情况
2.3 2组小鼠MMP-2、MMP-9表达水平比较
与ApoE-/-组相比,SM-Bmal1-TG/ApoE-/-组MMP-2、MMP-9 的蛋白表达水平均明显降低(P< 0.05),见图2。

图2 2组小鼠MMP-2、MMP-9蛋白表达情况
3 讨论
动脉粥样硬化是长期的慢性炎性反应病变过程,单核细胞、巨噬细胞、淋巴细胞等多种炎性细胞共同参与斑块形成[9]。既往研究报道,Bmal1 在血管损伤后作为血管平滑肌细胞增殖的正向调节因子,可抑制血管内膜增厚程度,提示Bmal1 是治疗动脉粥样硬化的新靶点[10]。敲除全身及肝细胞特异性Bmal1,可诱导ApoE-/-小鼠高脂血症并增强动脉粥样硬化程度,而过表达Bmal1后则可改善高脂血症及动脉粥样硬化程度[11]。本研究旨在探讨昼夜节律基因Bmal1与动脉粥样硬化斑块病变程度及稳定性的相关性。MMP-2、MMP-9 属于MMP家族成员,与斑块不稳定有密切关系。在不稳定斑块区域,MMP-2、MMP-9 表达水平较高,酶活性明显增强,易引起不稳定斑块发生破裂。MMP-2 和MMP-9 是血管平滑肌细胞增殖和迁移所必需的,在纤维帽的发育和维持中起重要作用,尤其是在晚期斑块中,MMP-2、MMP-9 水平明显增加,与巨噬细胞聚集有关,其可能通过促进斑块内出血导致斑块破裂[8,12]。研究显示,在Bmal1-/-小鼠的动脉中,MMP-2 和MMP-9 表达水平均增加[13]。Bmal1过表达可维持斑块的稳定性。
本研究显示,SM-Bmal1-TG/ApoE-/-、ApoE-/-小鼠经高脂喂养后,Bmal1过表达小鼠的颈动脉斑块病变面积明显减少,且斑块内MMP-2、MMP-9蛋白表达水平下降。因此,Bmal1 在一定程度上可抑制动脉粥样硬化斑块的病变程度并有利于维持斑块的稳定性,具有抗动脉粥样硬化的作用。随着对动脉粥样硬化发病机制研究的不断深入,Bmal1可能成为抗动脉粥样硬化的新靶点。
