基于酶活力和细胞模型分析广佛手多糖降血糖活性及作用机制
2022-12-30杨玉洁王淑惠柳春红陈树喜周爱梅
杨玉洁,刘 焕,王淑惠,柳春红,陈树喜,周爱梅,*
(1.华南农业大学食品学院,广东省功能食品活性物重点实验室,广东 广州 510642;2.广东展翠食品股份有限公司,广东 潮州 515634)
糖尿病是一种以高血糖浓度为特征的代谢性疾病,会伴随许多并发症,包括中风、神经病变、视网膜病变和肾病等[1],严重危害人体健康。截至2021年,我国20~79 岁糖尿病患病人数约1.4 亿,位居世界第一[2]。临床一般采用注射胰岛素和口服降糖药进行治疗。为了避免药物带来的不良反应,一些具有降血糖作用的天然活性物质成为了研究热点。其中多糖的降血糖作用得到广泛的研究,如灵芝多糖[3-4]、麦冬多糖[5]和黄芪多糖[6]等都表现出良好的降血糖效果。
常用于体外评价多糖降血糖活性的方法包括酶活力抑制实验和细胞实验。α-葡萄糖苷酶和α-淀粉酶是控制餐后血糖浓度的重要靶点,Bu Tong等[7]研究发现,海带多糖可以有效抑制α-葡萄糖苷酶的活性,半抑制质量浓度(half-maximal inhibitory concentration,IC50)为38 μmol/L,体内实验也证实海带多糖可以降低糖尿病小鼠的血糖浓度;Hasan等[8]研究证明,石岩枫多糖具有α-淀粉酶抑制活性(IC50=2.038 mg/mL),并且能有效降低大鼠血糖浓度。同时,有证据显示血糖浓度与血管紧张素转化酶(angiotensin converting enzyme,ACE)活力有关,Aluko等[9]研究表明ACE抑制剂可降低大鼠血糖浓度。这是由于糖尿病是一种复杂的代谢疾病,高血压与其之间存在共同的病理途径。所以多糖抑制ACE活性的研究也逐渐增多,ACE活性也成为研究胰岛素抵抗的指标之一。例如,Gara等[10]在探究囊链藻硫酸多糖对糖尿病大鼠降血糖作用前,在体外进行了α-淀粉酶和ACE的活性抑制实验,其IC50分别为39.16、58.35 μg/mL。
3T3-L1前脂肪细胞经诱导可分化为成熟的脂肪细胞,常用于脂肪细胞功能及糖脂代谢研究。脂肪细胞葡萄糖转运体4(glucose transporter 4,GLUT4)的表达降低会产生胰岛素抵抗[11]。而GLUT4是磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,也称AKT)通路的重要蛋白之一。多糖可以通过PI3K/AKT通路来缓解胰岛素抵抗[12],如Ke Bin等[13]发现黄芪多糖促进3T3-L1脂肪细胞的葡萄糖摄取,增加胰岛素敏感性,可能涉及PI3K/AKT信号通路。
佛手(Citrus medica‘Fingered’)为芸香科柑橘属果实,是一种传统的药食两用植物,具有抗氧化、抗肿瘤、降血糖和提高免疫力等多种生物活性。佛手多糖是佛手中主要活性组分之一,具有抗氧化[14-16]、免疫[17]、抗衰老[18]和抗肿瘤[19]等生物活性,但目前鲜见佛手多糖降血糖活性的研究,其作用机制也尚不明确。佛手按产地分为金佛手(产自浙江)、川佛手(产自四川)、建佛手(产自福建)和广佛手(产自广东)4种。课题组在前期研究[20]中已经建立了广佛手多糖分离纯化方法并制得4种广佛手多糖组分(FCP、FCP-1、FCP-2和FCP-2-1),其中以FCP-2-1纯度最高,对其进行结构鉴定,结果表明FCP-2-1的重均相对分子质量为1.503×104,半乳糖醛酸、半乳糖、阿拉伯糖的物质的量比为0.685∶0.032∶0.283,推测其化学结构为→[5)-α-L-Araf-(1]5→[4)-α-D-GalAp-(1]7→。
基于此,本研究通过测定广佛手多糖各分离纯化组分对α-葡萄糖苷酶、α-淀粉酶和ACE的抑制效果,并利用3T3-L1脂肪细胞建立胰岛素抵抗细胞模型,测定细胞糖代谢、脂代谢、肿瘤坏死因子(tumor necrosis factor,TNF)-α分泌量,初步评价和筛选出降血糖活性较高组分FCP-2-1,分析FCP-2-1对PI3K/AKT通路蛋白表达的影响,以期为广佛手精深加工及其在健康食品领域中的应用提供参考。
1 材料与方法
1.1 材料与试剂
广佛手由广东展翠食品股份有限公司提供;3T3-L1前脂肪细胞由美国模式培养物保藏所(american type culture collection,ATCC)提供。
广佛手多糖组分FCP、FCP-1、FCP-2和FCP-2-1由实验室自制[20]。
α-葡萄糖苷酶(比活力50 U/mg) 美国Sigma公司;α-淀粉酶(猪胰腺,比活力10 U/mg)、4-硝基苯-α-D-吡喃葡萄糖苷(4-nitrophenyl-α-D-glucopyranoside,PNPG)、N-马脲酰组氨酰亮氨酸(N-hippuryl-histidylleucine,HHL)、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methyl-7H-xanthine,IBMX)上海源叶生物科技有限公司;DMEM高糖培养基、青-链霉素、0.25%(质量分数)胰蛋白酶、胎牛血清、pH 7.4 0.1 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS) 美国Gibco公司;聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)、RIPA裂解液、TBST(Tris-HCl+Tween)缓冲液、二喹啉甲酸(bicinchoninic acid,BCA)蛋白质定量试剂盒、增强化学发光(enhanced chemiluminescent,ECL)试剂武汉赛维尔生物科技有限公司;PI3K、AKT、磷酸化-AKT(phosphorylated-AKT,p-AKT)、GLUT4和β-actin抗体英国Abcam公司;油红O染色试剂盒 北京雷根生物技术有限公司;葡萄糖、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high density liptein cholesterol,HDL-C)、TNF-α测定试剂盒 南京建成生物科技有限公司;氯化钠、可溶性淀粉、硫酸、苯酚、氢氧化钠、酒石酸钾钠、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)均为国产分析纯。
1.2 仪器与设备
ZA120R4 万分之一分析天平 上海赞维衡器有限公司;FD-1型冷冻干燥机 海门其林贝尔仪器制造有限公司;ECLIPSE Ti系列倒置显微镜 日本尼康株式会社;5415R高速冷冻离心机 德国Eppendorf公司;SMA4000微量紫外分光光度计 美林恒通(北京)仪器有限公司;2300多功能酶标仪 美国PerkinElmer公司;KZ-II型研磨仪 武汉赛维尔生物科技有限公司。
1.3 方法
1.3.1 体外相关酶活力抑制能力测定
1.3.1.1α-葡萄糖苷酶活力抑制能力测定
参考Deng Yejun等[21]的方法并稍作修改。取广佛手多糖FCP、FCP-1、FCP-2和FCP-2-1和阿卡波糖(阳性对照)分别用PBS配制成不同质量浓度(0.25、0.50、1.00、2.00、4.00 mg/mL)的多糖溶液;采用PBS分别配制7.5 mmol/L PNPG溶液与0.2 U/mLα-葡萄糖苷酶溶液。采用96 孔板反应体系,分别取50 μL多糖溶液加入孔板中,每孔加入100 μLα-葡萄糖苷酶溶液,于37 ℃下温孵10 min后加入50 μL PNPG溶液,37 ℃反应25 min后,测定405 nm波长处吸光度A1。以等体积PBS取代多糖溶液,测定吸光度A0;以等体积PBS取代α-葡萄糖苷酶溶液,测定吸光度A2。按式(1)计算α-葡萄糖苷酶活力抑制率,采用SPSS Statistics 21软件拟合计算IC50。
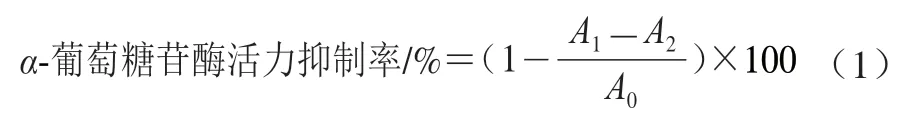
1.3.1.2α-淀粉酶活力抑制能力测定
采用Deng Yejun等[21]的方法并略作修改。采用PBS分别配制质量分数5%可溶性淀粉溶液与2 U/mLα-淀粉酶溶液。参考赵凯等[22]的方法配制DNS试剂。向各试管中分别加入300 μL 1.3.1.1节不同质量浓度的多糖溶液及400 μLα-淀粉酶溶液,混合均匀后于37 ℃下温孵10 min,随后分别加入300 μL可溶性淀粉溶液并在37 ℃反应15 min。最后分别加入2 mL DNS试剂显色,并立即煮沸10 min以终止反应;冷却后将混合体系用PBS定容至10 mL,测定其540 nm波长处吸光度A1。以等体积PBS取代多糖溶液,测定其540 nm波长处吸光度A0;以等体积PBS取代α-淀粉酶溶液,测定其540 nm波长处吸光度A2。按式(2)计算α-淀粉酶活力抑制率,采用SPSS Statistics 21软件拟合计算IC50。
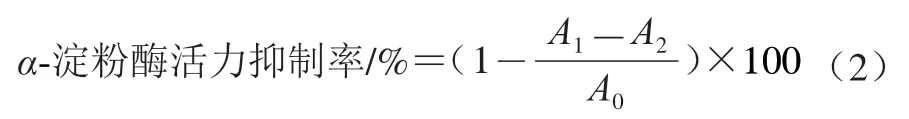
1.3.1.3 ACE活力抑制能力测定
参考Liu Jingbo等[23]的方法并略作修改。以PBS为溶剂分别配制不同质量浓度(0.25、0.50、1.00、2.00、4.00 mg/mL)的广佛手多糖溶液和卡托普利溶液(阳性对照);采用pH 8.3、0.1 mol/L磷酸-硼砂缓冲液分别配制0.1 U/mL ACE溶液与2.5 mmol/L HHL溶液。取10 μL ACE溶液分别与40 μL不同质量浓度的广佛手多糖溶液、卡托普利溶液混合,并在37 ℃孵育5 min,然后加入150 μL HHL溶液启动反应,37 ℃孵育30 min,最后加入200 μL 1.0 mol/L HCl溶液终止反应。反应溶液经0.25 μm水系针式过滤器过滤后采用LC-10ATVP plus高效液相色谱仪进行分析。高效液相色谱条件:Diamonsil C18色谱柱(200 mm×4.6 mm);流动相A为体积分数0.1%冰乙酸水溶液,流动相B为色谱纯乙腈;梯度洗脱程序:0~5 min,10%~15%流动相B;5~15 min,15%~25%流动相B;检测波长228 nm,流速0.8 mL/min,柱温25 ℃,进样量10 μL。以等体积蒸馏水取代多糖溶液作为空白组,以马尿酸为标准品制作标准曲线,采用外标法计算各组溶液中马尿酸质量浓度。按式(3)计算ACE活力抑制率,采用SPSS Statistics 21软件拟合计算IC50。
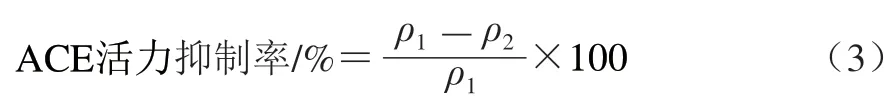
式中:ρ1为空白组中马尿酸质量浓度/(mg/mL);ρ2为广佛手多糖组或阳性对照组中马尿酸质量浓度/(mg/mL)。
1.3.2 体外细胞实验
1.3.2.1 3T3-L1脂肪细胞培养及胰岛素抵抗细胞模型建立
参考Shen Shengnan等[24]的方法并略作修改。3T3-L1前脂肪细胞在5% CO2、37 ℃、饱和湿度环境下用高糖完全培养基(含10%胎牛血清、1%青链霉素的DMEM高糖培养基)培养至单层贴壁并接触抑制状态(细胞融合度≥90%)。胰酶消化液消化细胞后接种至6 孔培养板(5×105个/孔)中,并继续培养至细胞完全融合,进行诱导分化。待分化的3T3-L1脂肪细胞用诱导液A(含10%胎牛血清、1%青链霉素、10 μg/mL胰岛素、0.5 μmol/L IBMX、1 μmol/L罗格列酮、1 μmol/L地塞米松的DMEM高糖培养基)培养2~3 d后,换用诱导液B(含10%胎牛血清、1%青链霉素、10 μg/mL胰岛素的DMEM高糖培养基)培养2~3 d,最后换高糖完全培养基继续培养至10 d,当95%以上的细胞内出现脂滴(约9~10 d)即得到3T3-L1成熟脂肪细胞。空白对照组为正常3T3-L1前脂肪细胞。使用含100 nmol/L胰岛素的高糖完全培养基分别刺激两组细胞30 min,采用葡萄糖试剂盒测定两组细胞刺激前后培养液中葡萄糖质量浓度,验证胰岛素抵抗模型是否建立成功。
1.3.2.2 3T3-L1脂肪细胞的显微镜观察和油红O染色鉴定
取1.3.2.1节3T3-L1成熟脂肪细胞和3T3-L1前脂肪细胞用PBS清洗2 次后在显微镜下观察并拍照;采用质量分数4%多聚甲醛溶液固定细胞20 min后用PBS清洗2 次;按照油红O染色试剂盒说明书配制染色液,避光静置10 min;取1 mL油红O染色液覆盖培养板,室温下染色10 min;弃去油红O工作液,用PBS清洗1~2 次,如有残余的油红O染色液,用体积分数60%异丙醇溶液清洗,随后立即置于显微镜下观察并拍照。
1.3.2.3 3T3-L1脂肪细胞存活率的测定
将1.3.2.1节3T3-L1成熟脂肪细胞接种于96 孔板(1×104个/孔),用含不同终质量浓度(0(空白)、0.2、2、20、200、2 000 μg/mL)FCP-2-1的高糖完全培养基分别处理24、48 h和72 h后,每孔加入20 μL 5 mg/mL噻唑蓝溶液,避光孵育培养4 h,吸去孔内培养液,每孔加入150 μL二甲基亚砜,摇床振荡10 min,使结晶物充分溶解。每组设6个平行。采用酶标仪测定492 nm波长处光密度值(OD492nm),按式(4)计算细胞存活率。

1.3.2.4 细胞耗糖量、脂代谢相关指标和TNF-α质量浓度的测定
将接种于24 孔板上的胰岛素抵抗3T3-L1成熟脂肪细胞(1×105个/孔)用含不同终质量浓度(10、50、150 μg/mL)广佛手多糖的高糖完全培养基培养;阴性对照组加入高糖完全培养基培养,胰岛素组加入含100 nmol/L胰岛素的高糖完全培养基培养;二甲双胍(阳性对照)组加入含40 μg/mL二甲双胍的高糖完全培养基培养。各组细胞培养48 h后收集培养液,900 r/min离心5 min取上清液备用。
分别按照相应试剂盒说明书测定阴性对照组、广佛手多糖组和胰岛素组的葡萄糖质量浓度;测定阴性对照组、广佛手多糖组和二甲双胍组的TG、TC、LDL-C、HDL-C、TNF-α水平。
1.3.2.5 免疫印迹分析
取1.3.2.4节阴性对照组、不同终质量浓度(10、50、150 μg/mL)FCP-2-1组和二甲双胍组细胞,吸去培养液后用PBS清洗细胞,然后每孔加入100 μL RIPA裂解液提取细胞总蛋白,采用BCA法测定蛋白质量浓度。每孔装载60 μg总蛋白,用质量分数8%十二烷基硫酸钠-聚丙烯酰胺凝胶进行电泳,然后转移至PVDF膜,质量分数5%脱脂奶粉封闭1 h,在4 ℃下与一抗孵育18 h。用TBST缓冲液洗净后与相应的二抗在室温下孵育30 min,再次用TBST缓冲液洗净。避光条件下配制ECL工作液,使PVDF膜与其充分反应1 min,弃去ECL工作液后加入显影、定影试剂进行显影和定影,然后使用曝光仪曝光显色并拍照。采用AlphaView软件分析目标蛋白条带灰度。蛋白相对表达水平以相应蛋白灰度与内参蛋白(β-actin)灰度的比值表示,以p-AKT与AKT相对表达水平的比值表示AKT磷酸化水平。
1.4 数据处理与统计分析
实验设置3个平行,结果以平均值±标准差表示,采用SPSS Statistics 21软件进行数据处理和单因素方差分析,采用Duncan检验进行显著性分析,P<0.05为差异显著,P<0.01为差异极显著。采用Origin 2018软件作图。
2 结果与分析
2.1 广佛手多糖对相关酶活力的体外抑制能力
2.1.1 广佛手多糖对α-葡萄糖苷酶活力抑制能力
如图1所示,各组分广佛手多糖的α-葡萄糖苷酶活力抑制率随质量浓度的升高而增加,呈剂量-效应关系。4.00 mg/mL FCP-2-1对α-葡萄糖苷酶活力抑制能力最强,抑制率为65.66%,是相同质量浓度阿卡波糖抑制率的75.04%。FCP-2-1对α-葡萄糖苷酶活力的IC50为2.74 mg/mL。FCP-2抑制能力其次,最高抑制率为49.76%,IC50为7.25 mg/mL。FCP-1和FCP抑制能力最差,最高抑制率分别为28.71%和15.18%,IC50分别为16.71、17.01 mg/mL。通过比较IC50可知,FCP-2-1对α-葡萄糖苷酶活力的抑制能力达到FCP的6.23 倍,FCP-2对α-葡萄糖苷酶活力的抑制能力达到FCP-1的3.96 倍。α-葡萄糖苷酶在人体消化系统中起到重要作用,也是临床控制血糖的重要靶点[25]。多糖对α-葡萄糖苷酶活力的抑制作用被广泛研究,其抑制作用与多糖支链基团、蛋白质含量、葡萄糖含量和三螺旋构象有关[26-27]。本研究结果与Jia Yanan等[28]的结果相似,该研究发现,玉米须多糖(CSP20)含有58.7%(质量分数,下同)中性糖、27.9%糖醛酸、6.36%蛋白质,对α-葡萄糖苷酶活力的IC50为7.75 mg/mL,高于本研究广佛手多糖FCP-2-1和FCP-2。
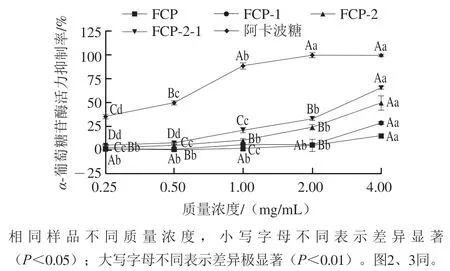
图1 广佛手多糖对α-葡萄糖苷酶活力的抑制效果Fig. 1 Inhibitory effects of polysaccharides of finger citron from Guangdong province on α-glucosidase activity
2.1.2 广佛手多糖对α-淀粉酶活力抑制能力
如图2所示,各组分广佛手多糖的α-淀粉酶活力抑制率随质量浓度的升高而增加,呈剂量-效应关系。当质量浓度为4.00 mg/mL时,各组抑制率达到最高,FCP-1和FCP抑制率较低,分别为42.44%和37.91%,IC50分别为6.60、11.77 mg/mL;FCP-2抑制能力较强,最高抑制率为49.15%,IC50为1.37 mg/mL;FCP-2-1抑制α-淀粉酶活力的能力最强,抑制率为74.20%,IC50为0.87 mg/mL,其抑制率是阳性对照阿卡波糖的74.95%。由IC50可知,FCP-2-1对α-淀粉酶活力的抑制能力达到FCP的13.53 倍,FCP-2对α-淀粉酶活力的抑制能力达到FCP-1的4.82 倍。与α-葡萄糖苷酶类似,α-淀粉酶的活力也可影响餐后血糖浓度,因为二者都是消化吸收的关键酶,可水解食物中的糖类物质产生葡萄糖。Zeng Aoqiong等[29]研究发现,红海藻紫菜多糖在体外对α-淀粉酶具有较好的抑制作用,其IC50为12.72 mg/mL。该研究进一步证明,红海藻紫菜多糖可在体内抑制正常和糖尿病大鼠餐后血糖的升高。由此推测FCP-2-1组分具有较好的体内降血糖效果。
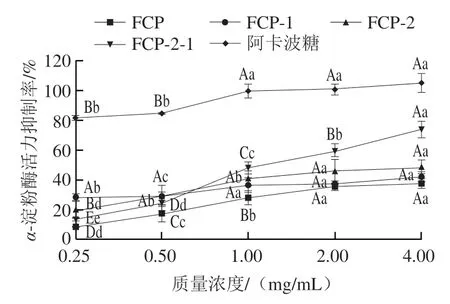
图2 广佛手多糖对α-淀粉酶活力的抑制效果Fig. 2 Inhibitory effects of polysaccharides from finger citron from Guangdong province on α-amylase activity
2.1.3 广佛手多糖对ACE活力抑制能力
如图3所示,各组分广佛手多糖的ACE抑制率也呈剂量-效应关系。4.00 mg/mL FCP-2-1、FCP-2、FCP-1、FCP溶液的ACE抑制率依次为88.02%、86.86%、66.71%、85.24%,其IC50依次为0.85、1.03、1.89、1.09 mg/mL。比较IC50可知,FCP-2-1对ACE的抑制能力是FCP-1的2.22 倍;FCP-2对ACE的抑制能力是FCP-1的1.83 倍。ACE活力抑制实验常用于评价物质的降血压活性,同时,ACE活力也与II型糖尿病及其并发症的发展密切相关[30],对于ACE抑制剂类药物的运用有助于降低心脑血管及肾脏疾病患者II型糖尿病的发病率[31]。因此,多糖抑制ACE活力也被广泛研究,如Gara等[10]的研究表明,硫酸酯化的囊链藻多糖对ACE的IC50为58.35 μg/mL,并且使糖尿病大鼠的血糖浓度下降56%。
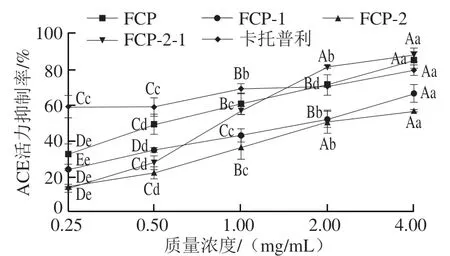
图3 广佛手多糖对ACE活力的抑制效果Fig. 3 Inhibitory effects of polysaccharides of finger citron from Guangdong province on ACE activity
2.2 3T3-L1胰岛素抵抗模型建立
3T3-L1脂肪细胞属于小鼠胚胎原纤维细胞,经过诱导可分化为成熟脂肪细胞。脂肪细胞是发生胰岛素抵抗的主要场所[32-33],所以此细胞广泛用于肥胖、代谢异常等生理活性研究。正常形态的3T3-L1前脂肪细胞呈梭状(图4A),经过诱导分化后,细胞形态发生明显改变,细胞体积变大,边缘圆润,呈典型的戒环状,油红O染色观察结果中脂滴呈橙红色(图4B)。经100 nmol/L胰岛素刺激后,成熟脂肪细胞培养液中葡萄糖质量浓度极显著高于空白对照正常3T3-L1前脂肪细胞(P<0.01),和胰岛素刺激前的正常3T3-L1前脂肪细胞没有显著差异(P>0.05)(图4C),说明细胞对胰岛素刺激产生抵抗,不能及时将葡萄糖转运至细胞内。由此可知,胰岛素抵抗的3T3-L1脂肪细胞模型建立成功。
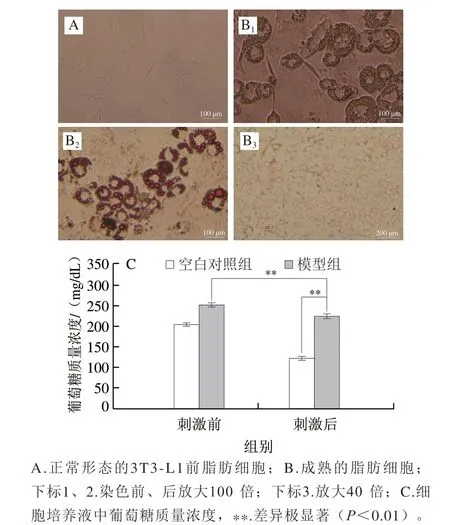
图4 油红O染色结果及胰岛素抵抗建模结果Fig. 4 Results of oil red O staining and insulin resistance modeling
2.3 广佛手多糖对3T3-L1脂肪细胞存活率的影响
如图5所示,与空白组相比,在作用时间24 h、广佛手多糖作用质量浓度为0.2~2 000 μg/mL时,3T3-L1脂肪细胞的存活率最大增加了10.92%。FCP-1、FCP-2和FCP-2-1在高质量浓度时对细胞的生长表现出抑制作用,当作用时间24 h、质量浓度2 000 μg/mL时,FCP-1、FCP-2和FCP-2-1组细胞存活率分别为68.25%、92.60%、71.57%。并且这种抑制作用随着作用时间的延长而加强,当作用时间72 h、质量浓度2 000 μg/mL时,FCP-2和FCP-2-1组的细胞存活率分别仅为46.91%和50.91%。因此,4种广佛手多糖的作用时间应不超过48 h、质量浓度为0.2~200 μg/mL。
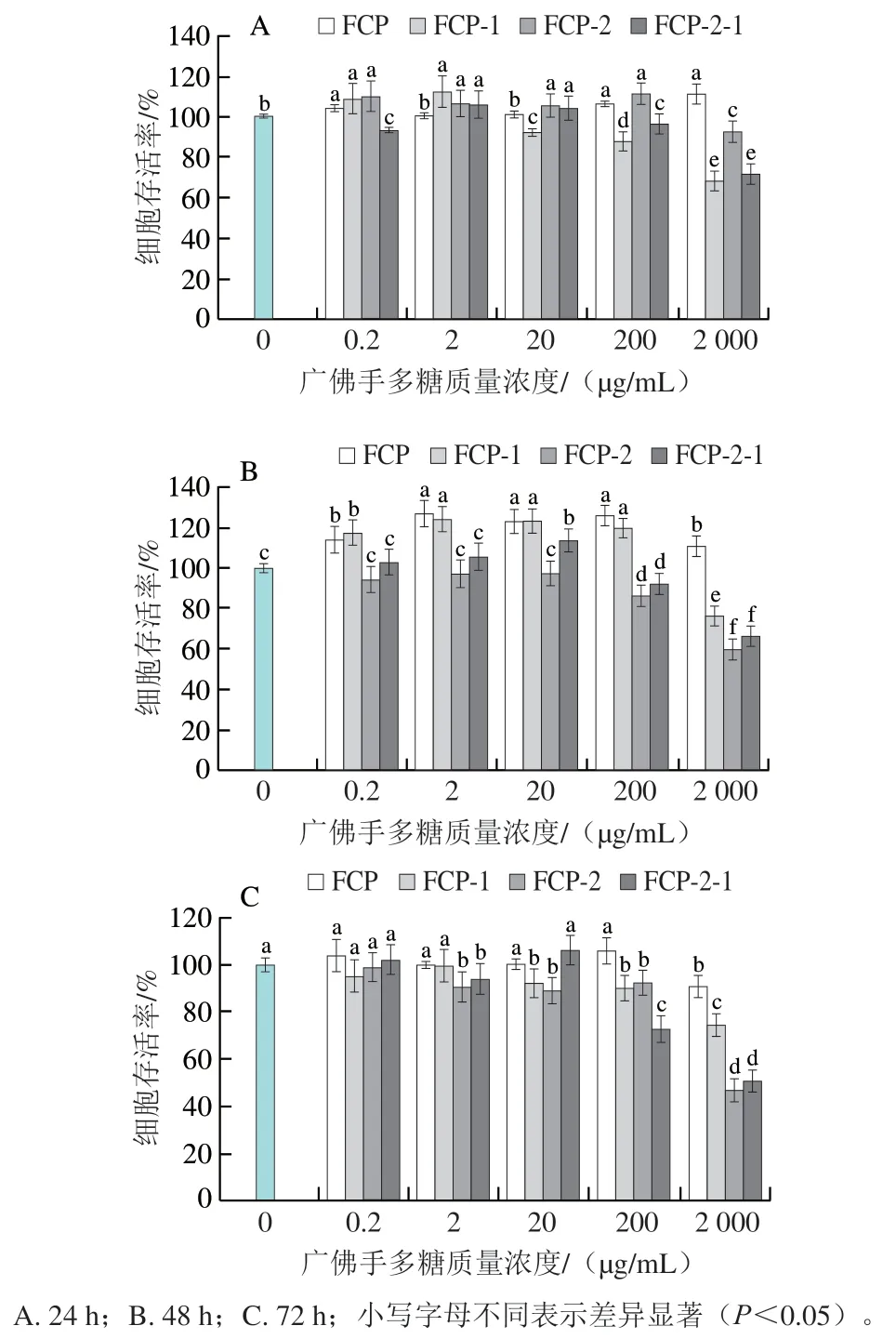
图5 广佛手多糖对3T3-L1脂肪细胞存活率的影响Fig. 5 Effects of polysaccharides of finger citron from Guangdong province on the proliferative viability of 3T3-L1 adipocytes
2.4 广佛手多糖对3T3-L1脂肪细胞糖代谢的影响
如图6所示,胰岛素抵抗细胞经胰岛素刺激后,细胞培养液中葡萄糖质量浓度极显著下降(P<0.01)。经不同质量浓度广佛多糖组分处理后,与阴性对照组相比,各组葡萄糖质量浓度均极显著降低(P<0.01),最高下降了45.06%。其中,不同质量浓度的FCP-2-1干预后,细胞培养液中葡萄糖质量浓度较胰岛素组均极显著下降(P<0.01),最高下降了31.90%,同时与其他相同质量浓度的广佛手多糖组分相比也具有显著差异(P<0.05),说明FCP-2-1促进细胞葡萄糖转运的效率最高。
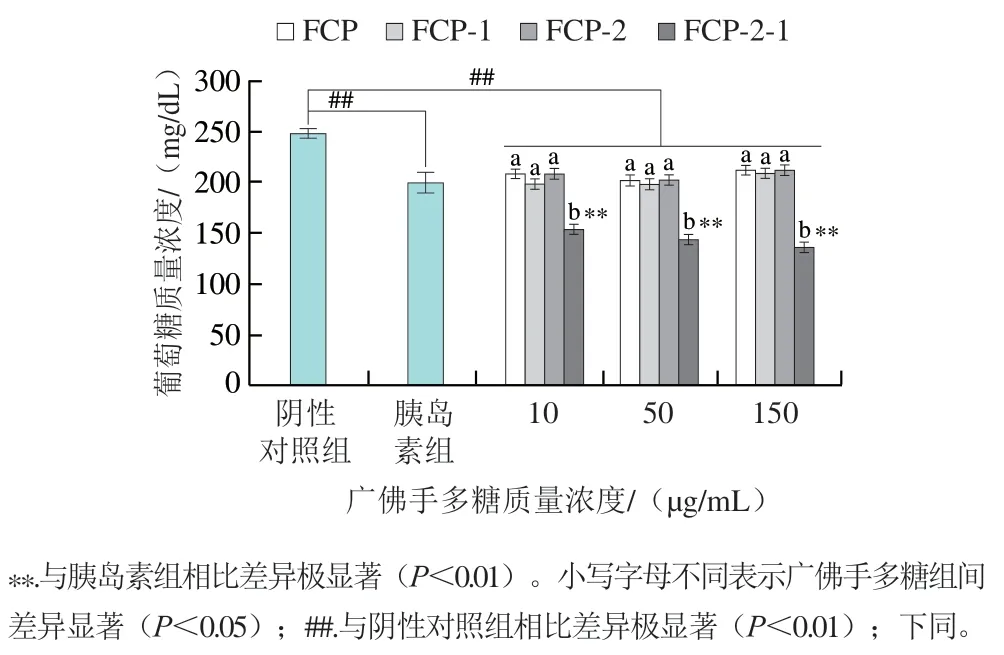
图6 广佛手多糖对3T3-L1脂肪细胞糖代谢的影响Fig. 6 Effects of polysaccharides of finger citron from Guangdong province on glucose metabolism in 3T3-L1 adipocytes
2.5 广佛手多糖对3T3-L1脂肪细胞TNF-α分泌量的影响
如图7所示,各质量浓度的FCP-2-1和二甲双胍均可以显著降低胰岛素抵抗细胞上清的TNF-α质量浓度(P<0.01)。其中,FCP-2-1能有效抑制TNF-α分泌,且呈剂量-效应关系。150 μg/mL FCP-2-1处理后TNF-α质量浓度相比阴性对照组下降了67.09%,相比二甲双胍组下降了50.06%。50、150 μg/mL的FCP-2和150 μg/mL的FCP-1也能显著抑制TNF-α的分泌(P<0.05),与阴性对照组相比分别下降了38.53%、48.53%和40.88%。糖尿病的发生常伴随着氧化应激、细胞炎症等不良反应,Litvinova等[34]通过分析临床数据发现,TNF-α等炎症因子的水平和患者体质量、血糖和胆固醇的增加有关。因此,广佛手多糖抑制TNF-α分泌可能有助于缓解或减慢糖尿病病情的进程。
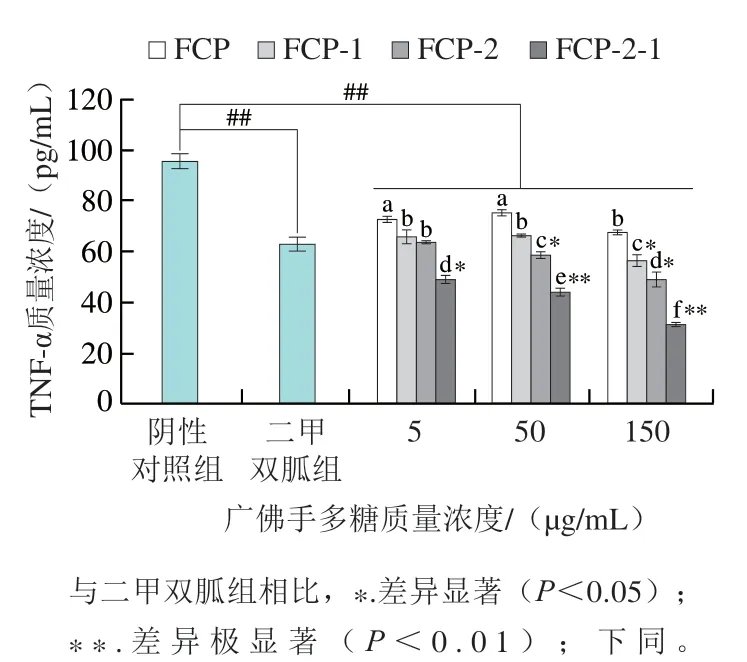
图7 广佛手多糖对3T3-L1脂肪细胞分泌TNF-α的影响Fig. 7 Effects of polysaccharides of finger citron from Guangdong province on TNF-α secretion from 3T3-L1 adipocytes
2.6 广佛手多糖对3T3-L1脂肪细胞脂代谢的影响
如图8所示,不同质量浓度广佛手多糖各组分均能极显著降低3T3-L1脂肪细胞TG、LDL-C浓度(P<0.01),极显著提高HDL-C浓度(P<0.01)。相比阴性对照组,FCP-2-1降低了细胞TC、TG和LDL-C分泌量,分别最高可降低35.68%、65.37%和46.42%,HDL-C分泌量最高可提高444%。与二甲双胍组相比,不同质量浓度FCP-2-1抑制TG分泌的效果更好,在作用质量浓度为150 μg/mL时,FCP-2-1组TG浓度为阴性对照组的32.68%。其中FCP和FCP-2-1处理组随质量浓度的增加,TC浓度呈下降趋势。现有研究表明,脂代谢异常会加速脂质沉积异常和胰岛素抵抗的发展,国内外临床数据已证明脂代谢相关指标与胰岛素抵抗具有相关性[35-36]。在多糖领域,Li Jiping等[37]和Qu Jian等[38]的研究表明,板蓝根多糖和铁皮石斛多糖可改善3T3-L1脂肪细胞的胰岛素抵抗,并且两种多糖降低了糖尿病小鼠和大鼠的血糖浓度,可能与其改善脂质代谢有关。
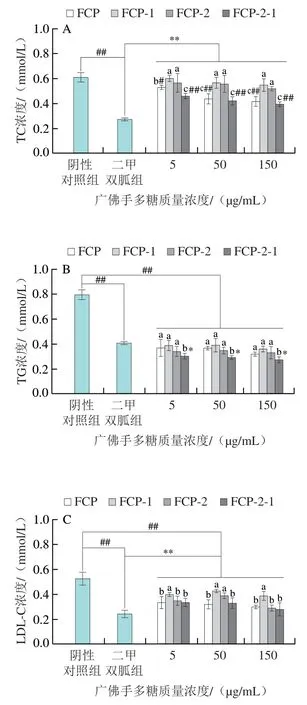
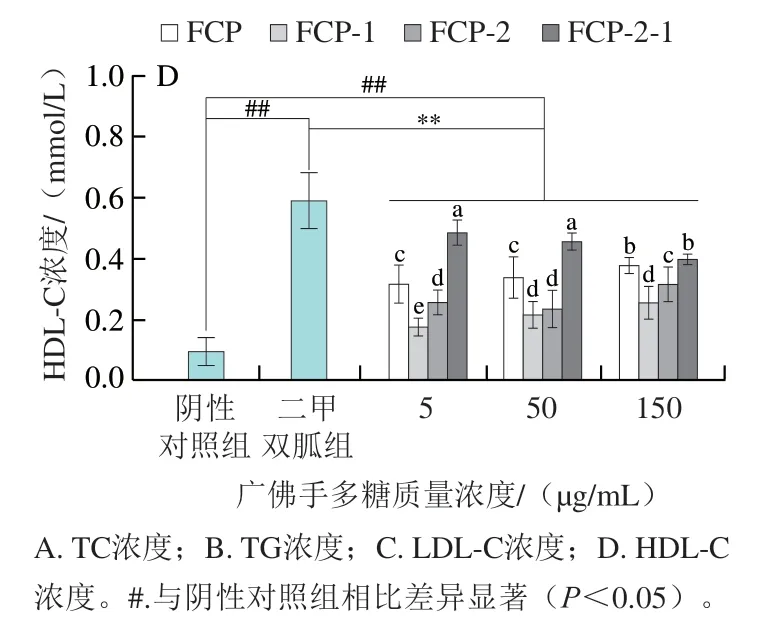
图8 广佛手多糖对3T3-L1脂肪细胞脂代谢的影响Fig. 8 Effects of polysaccharides of finger citron from Guangdong province on lipid metabolism in 3T3-L1 adipocytes
2.7 广佛手多糖对3T3-L1脂肪细胞PI3K/AKT相关通路蛋白表达的影响
PI3K/AKT通路在组织和细胞中起到转运葡萄糖的重要作用。其中PI3K、AKT、GLUT4蛋白的表达会影响细胞或组织对葡萄糖的利用率。有研究报道,此通路被抑制与II型糖尿病的发生密切相关,例如Jia等[39]研究发现,患有II型糖尿病的大鼠其PI3K/AKT通路异常,损害了胰岛素信号传导。
综合体外酶活力和细胞实验结果,选择FCP-2-1探究其对3T3-L1脂肪细胞PI3K/AKT相关通路蛋白表达的影响,结果如图9所示。相比于阴性对照组,二甲双胍和不同质量浓度FCP-2-1均能使3T3-L1脂肪细胞中PI3K、GLUT4、AKT和p-AKT蛋白相对表达水平极显著增高(P<0.01),其中FCP-2-1质量浓度与AKT磷酸化水平呈剂量-效应关系。50 μg/mL FCP-2-1促进PI3K蛋白表达的效果极显著优于二甲双胍(P<0.01),相比提高了157.14%。50 μg/mL FCP-2-1促进GLUT4和p-AKT表达的效果也显著优于二甲双胍(P<0.05),促进率分别提高了38.46%和26.67%。类似的结果在Xu Hui等[40]的研究中也有体现,其发现海参中的褐藻多糖可增强3T3-L1脂肪细胞中PI3K的磷酸化,促进GLUT4易位,在体内实验中褐藻多糖可降低糖尿病小鼠的空腹血糖水平,提高口服葡萄糖耐受能力。
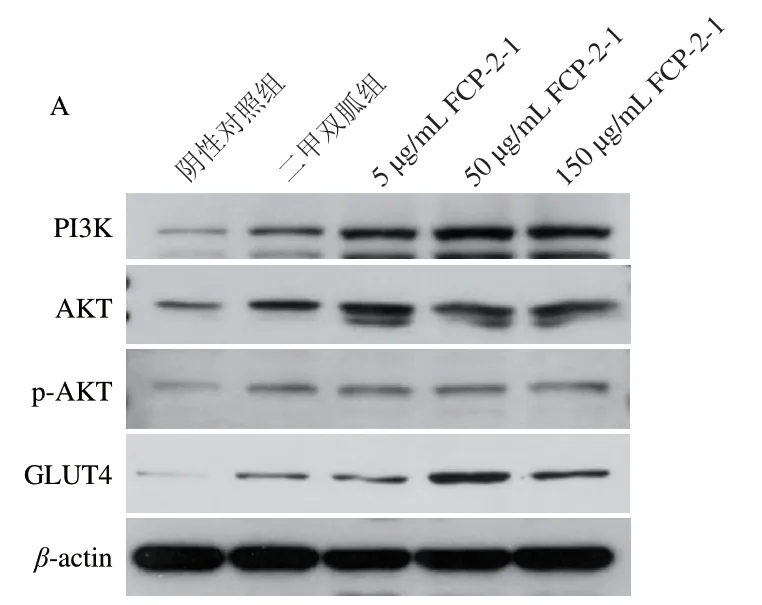
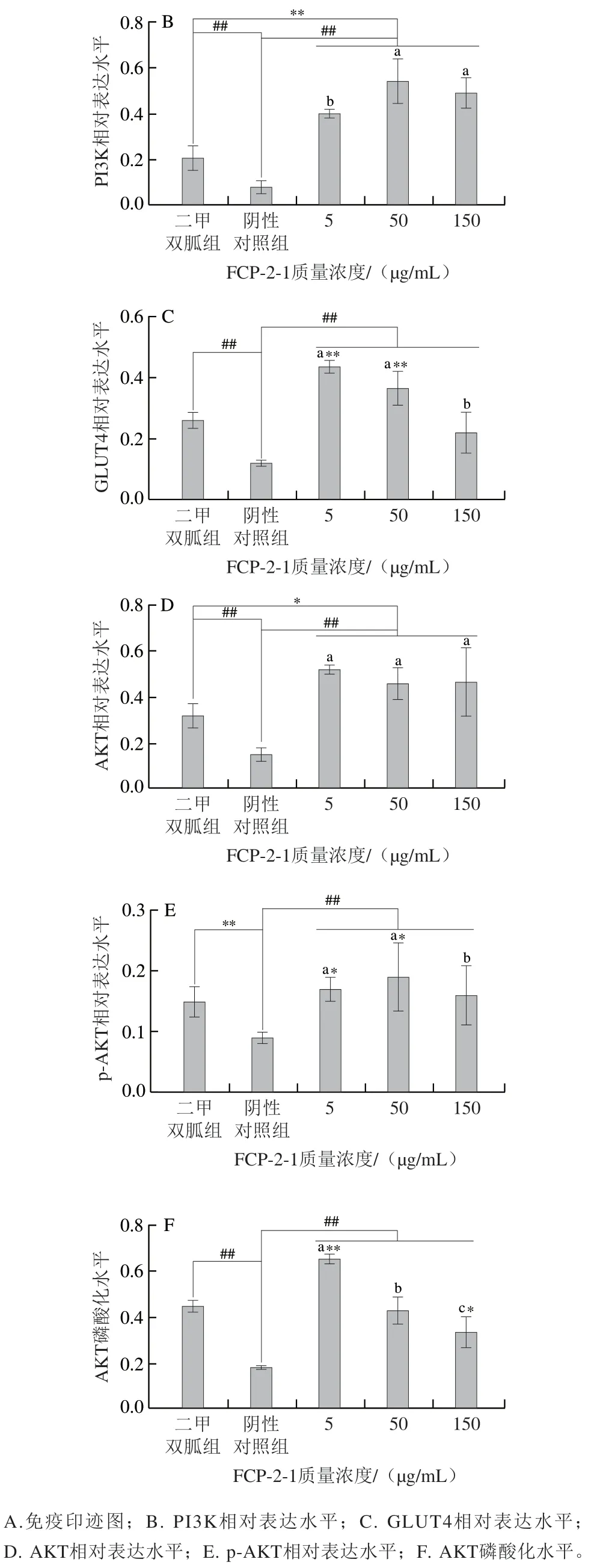
图9 广佛手多糖对3T3-L1脂肪细胞PI3K/AKT通路蛋白表达的影响Fig. 9 Effects of polysaccharides of finger citron from Guangdong province on protein expression in the PI3K/AKT signaling pathway in 3T3-L1 adipocytes
3 结 论
广佛手多糖通过分离纯化得到FCP、FCP-1、FCP-2和FCP-2-1 4个不同纯化程度的组分,通过体外酶活力模型筛选出降血糖活性最优的组分为FCP-2-1,其次为FCP-2,两者可有效抑制α-葡萄糖苷酶、α-淀粉酶和ACE的活力。通过体外建立胰岛素抵抗的3T3-L1脂肪细胞模型,结果发现FCP-2-1可改善3T3-L1脂肪细胞的糖、脂代谢和TNF-α分泌量,缓解细胞胰岛素抵抗,同时可提高细胞PI3K/AKT通路中PI3K、GLUT4、AKT和p-AKT蛋白的表达。综上所述,FCP-2-1可通过抑制相关酶活力和改善糖、脂代谢发挥其降血糖活性,其机制可能是FCP-2-1激活了葡萄糖转运重要通路PI3K/AKT中相关蛋白的表达。
