双重实时荧光PCR快速鉴别人参和西洋参*
2022-12-29滕少娜陈亭旭任风鸣潘英文孔德英
孙 涛,周 林,滕少娜,何 玲,陈亭旭,任风鸣,潘英文,孔德英**
(1.重庆海关技术中心 重庆 400020;2.国家中药材物种鉴定及质量安全检测重点实验室 重庆 400020;3.重庆市药物种植研究所 特色生物资源研究与利用川渝共建重点实验室 重庆 408435;4.海口海关热带植物隔离检疫中心 海口 570311)
人参(Panax ginseng)和西洋参(P.quinquefolium)是五加科人参属中药用价值很高的药材。人参具有大补元气,补脾益肺,生津养血,安神益智等功效;西洋参能清心安神,养阴润肺,用于阴虚燥咳,劳嗽咳血,虚烦痉挛,失眠多梦,精神恍惚等[1]。因此,人参和西洋参是备受追捧的名贵滋补良药,强根固本佳品。但是,目前人参、西洋参市场除正品外,尚有较多的代用品、伪品、混淆品,一些市售药品、饮片不含标签明示的人参、西洋参成分,给中药材市场管理带来极为不利的影响,因此有必要开展人参、西洋参成分及真假鉴别技术研究。同时,随着国内外对于中药材的广泛认可,人参、西洋参等药材使用量和采挖量日益加大,开展人参与西洋参的鉴别技术研究,对其进行资源保护和安全合理利用具有重要意义。
有关人参和西洋参传统的鉴定方法,主要是性状鉴别,即通过眼观、鼻闻、口尝、手摸等手段来对药物的形状、大小、颜色、表面特征、断面、气味等进行鉴别和描述。但由于这些性状特征常受到外界环境的影响,需要经验丰富的专业人员才能进行准确的鉴别,并且随着制成中成药后,性状鉴别难度会进一步增加。现代生物技术的发展为人参属药用植物的鉴定提供了新的方法。从1994年随机引物PCR(randomly primed PCR,AP-PCR)首次用于人参、西洋参的鉴别以来[2],DNA分子标记技术应用于中药材鉴别已有不少的报道,包括SCAR[3]、AFLP[4]、PCR-RFLP[5-6]、条形码鉴定技术[7-9]、RAPD[10]、Bar-HRM[11]等现代分子生物学鉴定手段得到广泛应用,并逐步随着DNA分子水平的遗传分析发展而达到鉴别标准化[12]。在众多的分子生物学方法中,实时荧光PCR方法因具有准确、快捷、灵敏的特点,而被应用于人参和西洋参的快速鉴别上[13-15]。但是,目前还未有针对人参和西洋参的单管同时鉴别的实时荧光PCR检测的研究报道。运用多重实时荧光PCR方法能在同一反应中同时对多个靶基因进行检测,可以减少操作步骤,缩短检测时间,降低检测成本。本研究旨在建立一种能同时鉴别人参和西洋参的双重实时荧光PCR方法,以期为人参、西洋参的快速鉴别提供新的解决方案。
1 材料、试剂与仪器
1.1 材料
供试样品包括7个人参样品、6个西洋参样品以及其他10个样品,共计12种23个样品(表1)。样品经国家中药材物种鉴定及质量安全检测重点实验室(重庆)孔德英正高级农艺师鉴定,保存于重庆海关技术中心。

表1 试验材料信息
1.2 试剂与仪器
磁珠法植物基因组DNA提取试剂盒购自珠海宝瑞生物公司;Premix Taq® Version 2.0、Premix Ex Taq(Probe qPCR)购自宝生物(大连)有限公司。引物探针由生工生物工程(上海)股份有限公司合成。
球磨仪为德国莱驰的MM400,全自动核酸提取仪为赛默飞世尔的Kingfisher Duoprime,超微量核酸蛋白检测仪为赛默飞的NanoDrop one,实时荧光PCR仪为美国ABI stepone plus。
2 方法
2.1 DNA提取
用75%酒精对样品进行擦洗,清水冲洗晾干后用球磨仪将样品研磨成粉。随后按照磁珠法植物基因组DNA提取试剂盒说明书方法进行样品DNA提取,提取的DNA用Nanodrop One超微量核酸蛋白检测仪测定核酸质量和浓度,保存于-20℃冰箱备用。
2.2 引物设计
比对分析人参属物种及近似种的常用备选条码基因及18S基因序列,根据人参在18S基因序列中497和501 bp处与其他物种的差异(图1),利用Primer Express3.0软件设计特异性引物探针,引物为Pgf(5'-CACGGGGAGGTAGTGACAATA-3')/Pgr(5'-AGACTT GCCCTCCAATGGAT 3'),探针为Pgp(FAM-CGGGCTG ATTCAGTCT-MGB)。西洋参引物探针在黄永辉等[14]基础上,对探针做适当调整,引物为Pqf(5'-AGTTGCGCCCGAAGCC ATTA-3')/Pqr(5'-AGACACG GGAGGCCATTATC-3'),探针为Pqp(VIC-ATCACTCC TTTGC GGGAGTCGA-BHQ1)。

图1 人参与其近似种的18S序列比对图
2.3 单重实时荧光PCR
以7个人参样品、6个西洋参样品及其他10个样品,共计23个样品DNA为模板,进行引物验证。PCR反应体系为20 µL,包括10 µL 2×荧光PCR反应预混液,上下游引物各0.5 µL(10 µmol/L),探针0.5 µL(10 µmol/L),DNA模板2 µL,灭菌去离子水补至20 µL。实时荧光PCR反应程序为:95℃预变性30 s;然后以95℃5 s,60℃30 s进行40个循环。每个循环中60℃30 s结束时设置荧光通道采集荧光信号。
2.4 双重实时荧光PCR
应用矩阵法对引物和探针进行最佳配比和筛选,最终PCR反应体系为20 µL,包括10 µL 2×荧光PCR反应预混液,人参引物Pfg、Prg各0.5µL(10µmol/L),西洋参引物Pfq、Prq各0.3µL(10µmol/L),探针Prog、Proq各0.4 µL(10 µmol/L),DNA模板2 µL,灭菌去离子水补至20 µL。实时荧光PCR反应程序为:95℃预变性30 s;然后以95℃5 s,60℃30 s进行40个循环。每个循环中60℃30 s结束时设置荧光通道检测荧光信号。
2.5 特异性测试
为了验证该方法是否能够同时检出人参与西洋参,在样品研磨成粉后,取重量相当的人参粉与西洋参粉进行混合,提取混合样品的DNA做模板进行检测。共制备4份人参西洋参混合样品DNA进行检测,4份混合样品分别为人参PG-01混西洋参PQ-01、人参PG-02混西洋参PQ-02、人参PG-03混西洋参PQ-03、人参PG-04混西洋参PQ-04。以7个人参样品、6个西洋参样品、10个其他样品以及4个混合样品共计27份样品DNA为模板,评价本试验所建立方法的特异性。
2.6 灵敏度测试
将人参样品PG-02及西洋参样品PQ-05的DNA测定核酸浓度后分别稀释至200 ng/µL,然后等体积混合(混合后,人参及西洋参DNA浓度均为100 ng/µL),将该混合样品进行10倍梯度稀释,稀释成8个浓度梯度,然后按照2.4中的方法进行实时荧光PCR扩增测试该方法对人参及西洋参的检测灵敏度,并根据CT值绘制标准曲线。
3 结果
3.1 引物探针验证
利用设计的人参引物探针对23份样品的DNA进行验证,结果显示7个人参DNA样品均出现特异扩增曲线,其他非人参样品及空白对照均无特异性扩增(图2),表明该引物探针用于人参检测具有良好的特异性。

图2 人参实时荧光PCR特异性扩增图谱
利用引用的西洋参引物探针对23份样品的DNA进行验证,结果显示6个西洋参DNA样品均出现特异扩增曲线,其他非西洋参样品及空白对照均无特异性扩增(图3),表明该引物探针用于西洋参检测具有良好的特异性。

图3 西洋参引物探针实时荧光PCR特异性扩增图谱
3.2 双重荧光定量PCR探针特异性
应用本实验建立的方法对7个人参样品、6个西洋参样品、10个其它样品及4个人参西洋参混合样品共计27个样品的DNA进行检测,结果表明7个人参样品及6个西洋参样品均出现单条典型扩增曲线(图4,图5),4个人参西洋参混合样品均出现双条典型扩增曲线(图6),而供试的其他10份样品DNA及空白对照均无扩增曲线(图6),说明该引物与探针用于人参与西洋参检测具有良好的特异性,所建立的双重荧光定量PCR方法具有较好的可靠性。注:27份DNA样品检测为同一实验进行,为便于结果观察,将人参、西洋参及剩余其它处理分别做图。

图4 人参样品双重荧光定量PCR特异性扩增图谱
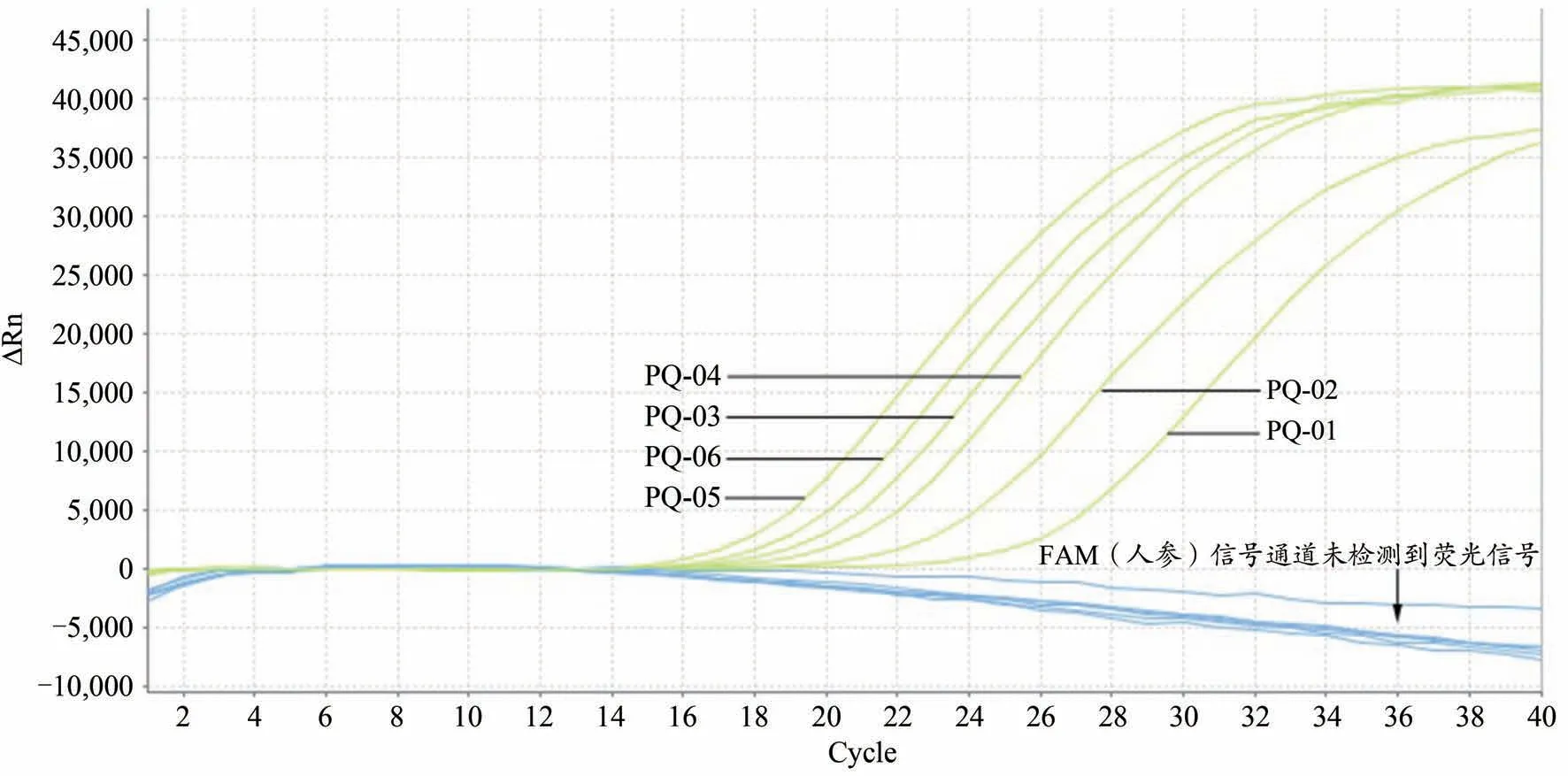
图5 西洋参样品双重荧光定量PCR特异性扩增图谱
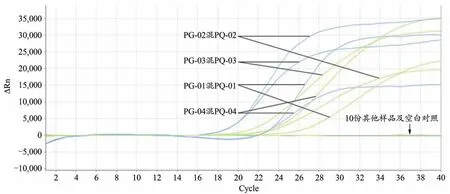
图6 人参西洋参混合样品及其它样品双重荧光定量PCR特异性扩增图谱
3.3 灵敏度测试
将人参样品PG-02及西洋参样品PQ-05的DNA测定核酸浓度后分别稀释至200 ng/µL,然后等体积混合(混合后,人参及西洋参DNA浓度均为100 ng/µL),将该混合样品进行10倍梯度稀释,稀释成8个浓度梯度,稀释后人参及西洋参DNA浓度均为1×105pg/µL至1×10-2pg/µL,取2 µL作为模板用于灵敏度检测。结果表明人参DNA浓度在1×105pg/µL至1×10-0pg/µL时,均能得到典型的扩增曲线(图7),西洋参DNA浓度在1×105pg/µL至1×100pg/µL时,能够得到典型的扩增曲线(图8)。
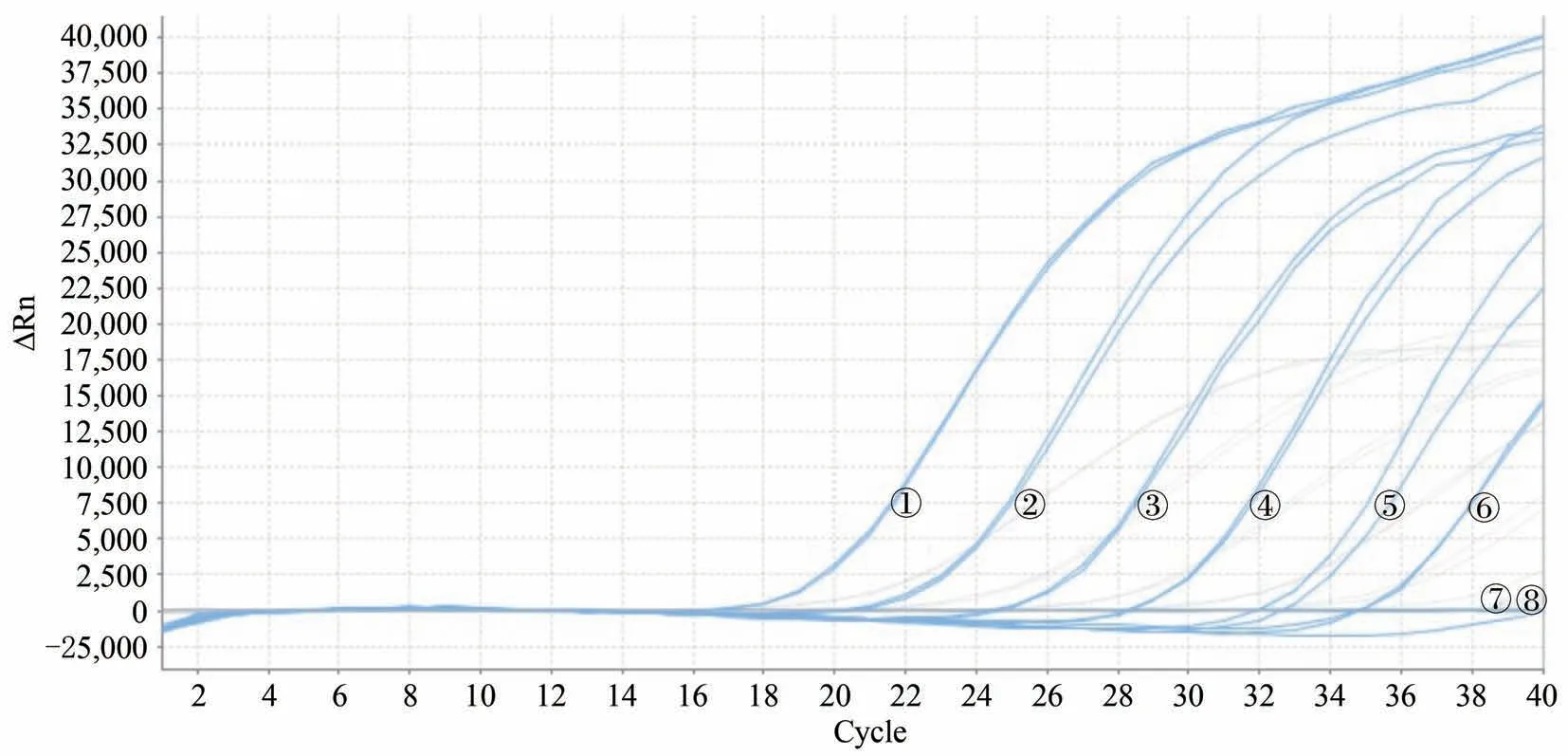
图7 双重荧光定量PCR检测人参的扩增图谱
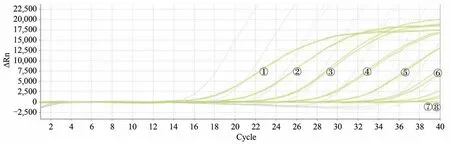
图8 双重荧光定量PCR检测西洋参的扩增图谱
人参样品DNA浓度从1×105pg/µL至1×100pg/µL对应的CT值分别为16.58、20.39、24.62、28.36、32.34、34.89,以扩增曲线的CT值为纵坐标,相应浓度为横坐标,绘制标准曲线(图9),所得线性方程为y=-3.567x+38.557,R2=0.993,扩增效率=90.685%,最低检测限是2 pg DNA/反应。

图9 双重荧光定量PCR检测人参的标准曲线
西洋参样品DNA浓度从1×105pg/µL至1×100pg/µL对应的CT值分别为17.73、21.25、24.71、28.61、32.19、35.64,以扩增曲线的CT值为纵坐标,相应浓度为横坐标,绘制标准曲线(图10),所得线性方程为y=-3.59x+42.83,R2=0.998,扩增效率=89.901%,最低检测限是2 pg DNA/反应。

图10 双重荧光定量PCR检测西洋参标准曲线
4 讨论
基于高通量、易操作、易观察等诸多优点,多重实时荧光PCR技术已广泛应用于人类疾病检测、动植物物种及病原微生物鉴定、转基因检测等领域[16-19]。在中药材的鉴定方面多重实时荧光PCR技术也有较广泛的研究。张全芳等[20]利用多重实时荧光PCR方法来鉴定南柴胡和北柴胡,刘艳艳等[21]将多重实时荧光PCR法应用于药用贝母属系统发育关系分析及检测等。但,关于人参与西洋参的多重实时荧光PCR方面的研究还未见报道。
本研究首先比对分析了人参属物种常用条形码基因,根据人参在18S基因(Genebank登录号:KC593817.1)序列中497和501 bp处与其他物种的差异设计人参特异性引物探针(图1),西洋参引物探针在黄永辉等[14]基础上,对探针做适当调整,将发光基团改为VIC。随后对两种引物进行验证,结果发现设计的人参引物探针可以从23份样品中准确地识别出7份人参样品(图2),西洋参引物探针能够从23份样品中准确地识别出6份西洋参样品(图3)。随后应用矩阵法对引物和探针进行最佳配比筛选,建立了人参与西洋参双重实时荧光PCR方法,运用本方法对27份DNA样品进行检测,结果显示7个人参样品及6个西洋参样品均出现单条典型扩增曲线,4个人参西洋参混合样品均出现双条典型扩增曲线,而供试的其他10份DNA样品及空白对照均无扩增曲线(图4、图5、图6),表明该方法具有良好的特异性。最后灵敏度测试结果显示,建立的双重实时荧光PCR方法检测人参与西洋参的最低检测限均达到2 pg DNA/反应,表明该方法具有较高的灵敏度。人参与西洋参样品在双重实时荧光PCR反应中扩增曲线的ΔRn峰值较单重实时荧光PCR反应中扩增曲线的ΔRn峰值有明显降低,从单重PCR实验的100000左右(图2)及70000左右(图3)下降到双重PCR实验的40000左右(图4、图5),这可能和引物探针添加量降低以及引物探针互相干扰有关。但在比较人参与西洋参样品在单重实时荧光PCR以及双重实时荧光PCR实验中前后的CT值可以看出,差异并不大,说明这种干扰对CT值的影响较小。
人参、西洋参的快速鉴别已有较多研究。刘丽等[22]建立了能同时鉴别人参、西洋参及三七的多重普通PCR方法,只存在150 bp条带的为人参、只存在400 bp带为三七,同时存在150 bp和400 bp条带为西洋参,但该方法无法用于混合样品的区分,同时该方法的灵敏度在10 ng DNA/反应。实时荧光PCR法灵敏度高,可用于微量甚至痕量检测[23],本研究针对人参、西洋参设计特异性引物探针,将人参与西洋参的探针标记上不同的发光基团(人参探针标记FAM发光基团,西洋参探针标记VIC发光基团),当在FAM信号通道检测到荧光信号时即判定样品为人参,在VIC信号通道检测到荧光信号时即判定为西洋参,在两个信号通道同时检测到荧光信号时即判定为人参西洋参混品,从而实现对人参、西洋参的同时检测,可用于人参与西洋参混合样品的检测。同时,所建立的双重实时荧光PCR法检测人参与西洋参方法灵敏度均达到2 pg DNA/反应,灵敏度也有较大的提升。
本研究针对人参和西洋参的特异性基因序列,建立了一种灵敏度高,准确性好的双重实时荧光PCR方法,可在单一反应管内同时完成对人参和西洋参的检测。运用单一的人参DNA、西洋参DNA样品,混合的人参与西洋参DNA样品及其他物种的DNA样品对该方法进行多维度的特异性评价,结果显示该方法具有良好的特异性。而且,灵敏度测试显示该方法检测人参与西洋参的最低检测限均可达到2 pg DNA/反应。总之,本研究首次建立了人参西洋参双重实时荧光PCR检测方法,该研究降低了检测成本,提高了检测效率,可应用于人参、西洋参成分的快速检测,可辨别样品中是否含有相应成分,在药品真伪鉴别领域具有一定的应用前景。
