基于网络药理学探究王琦院士治疗精液不液化核心组方的作用机制及实验验证
2022-12-28刘柘君刘振权郑燕飞沈真如佟科锦于淑俊王帅强汤轶波
刘柘君 刘振权 郑燕飞 沈真如 佟科锦 唐 田 于淑俊 王帅强 汤轶波
(1 北京中医药大学中医学院,北京,100029;2 北京中医药大学中药学院,北京,100029)
精液不液化是指男性禁欲3~5 d后排出体外的精液,置于室温60 min内不能产生液化的现象[1]。正常情况下,精液以液体的形式存在于男性的生殖道内,射精时即为一种均匀黏稠的淡黄色或灰白色液体,射精后立即变为胶冻状,5~20 min后再次液化[2]。精液最开始的液体状态利于男性的射精,而后的胶冻状利于精液在女性阴道的停留,精液第2次的液化则利于精子在女性宫颈内的游动,使女性受孕。而一旦精液无法液化,则影响精子的释放,导致精子的有效运动下降,干扰精卵结合,最终导致不孕不育[3]。
本研究根据“中医传承辅助平台系统(V2.5)”中的“组方规律”功能对王琦院士门诊期间收治精液不液化患者病历处方进行数据挖掘,基于关联规则分析得出王琦院士治疗精液不液化的核心组方,该方由黄芪、当归、巴戟天、菟丝子和枸杞子5味药组成[4]。
网络药理学能使复杂的组方成分降维,通过多靶点、多通路的方法多层次进行研究,而分子对接技术可使活性成分与靶点之间的结合状态具体化和可视化,因此本研究通过网络药理学和分子对接技术,探究王琦院士治疗精液不液化核心组方的作用机制,同时针对所得出的作用靶点及信号通路开展动物实验进行验证,以便为核心组方的临床应用提供更多的理论数据支撑。
1 资料与方法
1.1 核心组方组成药物靶点收集 进入中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology,TCMSP)(https://tcmsp-e.com/)中,检索核心组方中当归、黄芪、巴戟天、菟丝子、枸杞子5味中药的化学成分。根据TCMSP数据库提供的药代动力学(吸收、分布、代谢、排泄)相关数据,筛选口服生物利用度(Oral Bioavailability,OB)≥30%和类药性(Drug Likeness,DL)≥0.18的化学成分。通过Uniprot数据库(https://www.uniprot.org/)将筛选得出的化学成分所对应靶蛋白转化为基因名称进行信息统一规范。
1.2 构建核心组方成分-靶点网络图 将“1.1”筛选得到的活性成分转化得到基因名称形成网络文件和属性文件后,输入Cytoscape 3.7.2软件中,构建核心组方“活性成分-靶点”网络图,点击“Network Analyzer”功能对网络分析,计算自由度(Degree)值,该值越大则该节点越重要,并以不同形状和颜色的节点表示核心组方活性成分和作用靶点。
1.3 精液不液化疾病靶点收集并构建韦恩图 精液不液化相关疾病靶点以“nonliquefaction of semen”“sperm liquefaction retardation”及“abnormal sperma liquefaction”与精液不液化相关的疾病作为关键词,检索GeneCard数据库(https://www.genecards.org/)及在线人类孟德尔遗传数据库(Online Mendelian Inheritance in Man,OMIM)(https://omim.org/)后剔除重复靶点,以获取精液不液化相关疾病靶点。并利用在线软件作图工具平台(https://bioinfogp.cnb.csic.es/tools/venny/)对药物靶点与疾病靶点进行映射,获得交集靶点并绘制韦恩图。
1.4 构建“药物靶点-疾病靶点”蛋白质-蛋白质相互作用网络 将核心组方药物靶点与疾病靶点的交集靶点即组方治疗疾病的作用靶点通过String Version平台(https://string-db.org/)构建蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络,选择研究物种为“Homo sapiens”,并将下载的interactions.tsv文件导入Cytoscape 3.7.2软件可视化PPI网络,点击“Network Analyzer”功能对网络进行分析,节点越大颜色越深,说明度值越高则该靶点越重要。
1.5 对交际靶点进行基因本体富集分析和京都基因和基因组百科全书富集分析 通过R语言平台运用Cluster Profiler程序包进行基因本体(Gene Ontology,GO)和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路富集分析,设定阈值P<0.05对结果进行处理和可视化分析。
1.6 构建核心组方成分-核心靶点-疾病通路网络 将富集的KEGG信号通路根据count值排序,并将排序前15条通路作为主要疾病通路。将核心组方成分、作用靶点及疾病通路分别进行一一对应后导入Cytoscape 3.7.2软件,采用Merge功能合并网络,构建成分-靶点-疾病通路网络进行可视化分析。
1.7 分子对接验证 将1.6中的核心组方成分-核心靶点网络中筛选度值最高的5个成分作为核心组方的关键成分,在PPI网络中筛选度值最高的5个靶点作为核心靶点。在蛋白质结构数据库(Protein Data Bank,PDB)(https://www.rcsb.org/)和Uniprot网站分别下载5个关键成分的3D结构图以及5个关键靶点的蛋白结构图,使用AutoDockTool软件对关键成分及核心靶点进行对接,并使用Pymol软件对对接的结果进行绘图和分析。
1.8 验证实验
1.8.1 材料
1.8.1.1 动物 本实验所涉及的44只雄性7周龄,体质量(180±200)gSprague Dawley大鼠购自北京斯贝福(北京)生物技术有限公司,许可证编号:SCXK(京)20190010,动物购买后适应性喂养7 d,饲养过程中大鼠均自由进食饮水,饲养室恒温恒湿,温度维持在20~25 ℃,湿度维持在55%。经北京中医药大学动物伦理委员会批准,该动物实验符合动物实验伦理学要求(伦理审批号:BUCM-4-2022071306-3020)。
1.8.1.2 药物 核心组方药物组成及剂量分别为当归20 g、黄芪20 g、巴戟天20 g、菟丝子20 g、枸杞子20 g,以上药物均采用单味颗粒剂进行配伍,所有中药颗粒剂由北京康仁堂药业有限公司统一生产并提供,生产批号分别为:当归,21018391;黄芪,21025221;巴戟天,21015111;菟丝子,21019621;枸杞子,21008741。
1.8.1.3 试剂与仪器 白细胞介素(Interleukin,IL)-1β试剂盒(江苏晶美,货号:JM-01454R1),IL-6试剂盒(江苏晶美,货号:JM-01597R1),肿瘤坏死因子(Tumor Necrosis Factor,TNF)-α试剂盒(江苏晶美,货号:JM-01587R1),纤溶酶原激活物抑制物-1(Plasminogen Avtivator Inhibitor-1,PAI-1)/丝氨酸蛋白酶抑制物E支成员1(Serine Protease Inhibitor Clade E Member 1,SERPINE1)试剂盒(江苏晶美,货号:JM-11054R1),二喹啉甲酸(Bicinchoninic Acid,BCA)试剂盒(普利莱,货号:P1511-3),完全弗氏佐剂(Sigma-Aldrich;美国;货号:F5881-10X10ML),总RNA抽提试剂(Total RNA Extraction Reagent,Trizol)(Ambion,美国,货号:15596018),逆转录试剂盒(康维世纪,货号:CW2582M);多功能酶标仪(Labsystems Multiskan MS,芬兰,型号:352),微量高速离心机(长沙湘智,型号:TG16W),超声波细胞破碎机(宁波新芝,型号:JY92-IIN),涡旋振荡仪(海门市其林贝尔仪器制造有限公司,型号:QL-902),生物分光光度计(Eppendorf,德国,型号:BioPhotometer),荧光定量PCR仪(BIO-RAD,美国,型号:CFX connectTM)。
1.8.2 方法
1.8.2.1 分组与模型制备 采用随机数字表法将24只大鼠分为空白组、模型组和核心组方组,每组8只。剩余20只大鼠处死后提取前列腺蛋白用于模型组及核心组方组大鼠造模,造模方法参照文献[5]方法,即通过慢性前列腺炎诱导精液不液化的方法进行造模。
1.8.2.2 给药方法 结合王琦院士临床治疗精液不液化患者常用药物剂量,进行人与大鼠剂量换算后,得出核心组方组灌胃核心组方的剂量为10 g/kg,模型组和空白组灌胃蒸馏水,灌胃给药4周,1次/d。
1.8.2.3 检测指标与方法 大鼠末次给药后隔天处死,取前列腺分为2部分于液氮中保存用于后续检测。取各组大鼠前列腺称定质量后稀释5倍进行匀浆并静置,3 000 r/min,离心半径4.55 cm,离心15 min,取上清液使用酶联免疫吸附试验(Enzyme Linked Immunosorbent Assay,ELISA)检测IL-1β、IL-6、TNF-α、SERPINE1的水平。另一部分前列腺装入无菌EP管,Trizol试剂盒提取前列腺组织中的总RNA,按照逆转录试剂盒说明书逆转录为cDNA,以cDNA为模板进行实时荧光定量聚合酶链式反应(Polymerase Chain Reaction,PCR)扩增IL-17。PCR条件为:95 ℃预变性15 min,95 ℃ 30 s、56 ℃ 30 s、72 ℃ 30 s,共40个循环,在72 ℃ 30 s处收集荧光信号,72 ℃延伸5 min。以空白组大鼠前列腺组织为1倍目的基因表达量的对照样本,根据2-△△ct计算其他各组大鼠前列腺组织中目的基因IL-17 mRNA的相对表达。引物序列见表1。
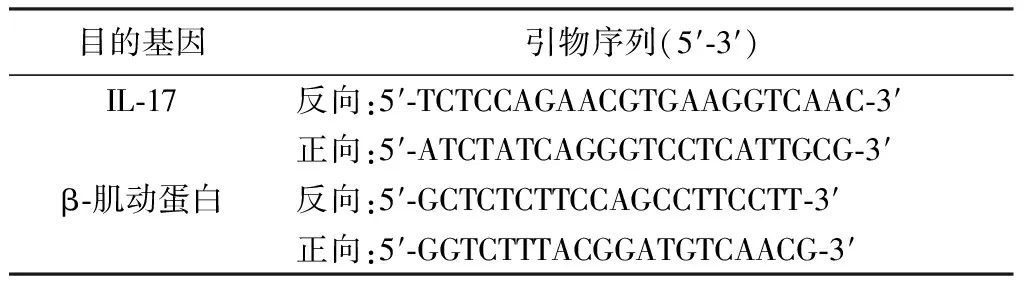
表1 IL-17基因引物序列

2 结果
2.1 核心组方活性成分及其作用靶点 得到核心组方活性成分29种以及作用靶点194个。核心组方活性成分基本信息见表2。

表2 核心组方活性成分、基本信息及其度值
2.2 “核心组方成分-靶点”网络的构建与分析 “核心组方成分-靶点”网络包括223个点,324条边。蓝色正方形代表核心组方29种活性成分,黄色圆形代表所对应的194个靶点,核心组方成分度值大则该节点较大,则说明核心组方中该成分较重要。见图1。

图1 “核心组方成分-靶点”网络
2.3 精液不液化疾病靶点及韦恩图的构建 经检索合并去重后,共获得精液不液化相关基因共1 113个,核心组方作用靶点与疾病靶点进行韦恩分析后得到核心组方治疗精液不液化的24个交集靶点。见图2。

图2 精液不液化与核心组方交集靶点韦恩图
2.4 “药物靶点-疾病靶点”PPI网络 通过24个交集靶点初步构建的PPI网络包括24个点,137条边。见图3。进一步可视化处理后网络包括22个点,274条边。颜色越深节点越大,则表明该节点degree值越高。见图4。

图3 基于String的PPI网络
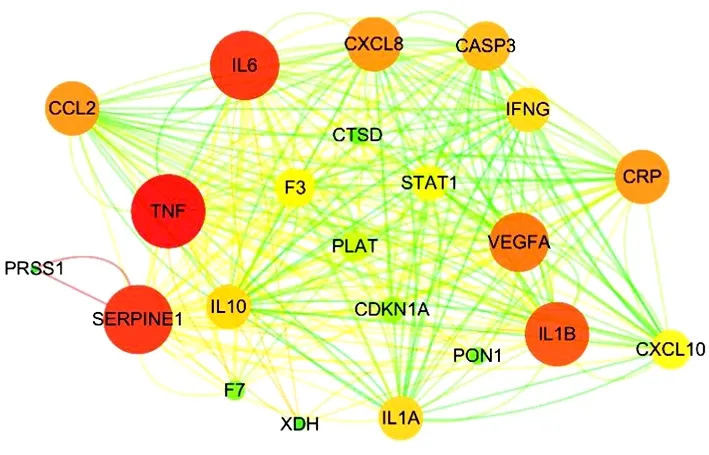
图4 核心组方治疗精液不液化的PPI网络
2.5 GO富集分析及KEGG富集分析结果 获得GO基因功能注释共21条,KEGG通路富集分析30条,颜色表示通路富集到的数目,数目越大则越偏向红色见。见图5~6。
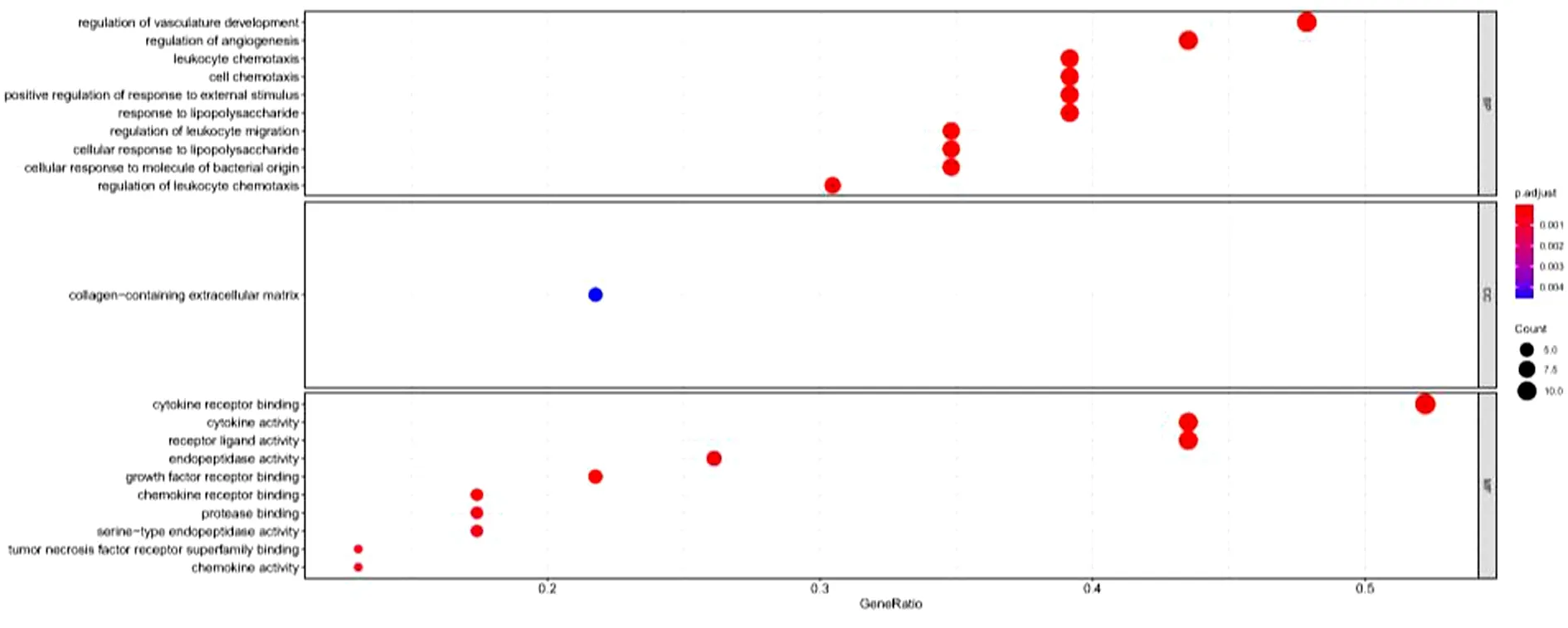
图5 GO基因功能注释富集分析

图6 KEGG通路富集分析
2.6 “核心组方成分-靶点-疾病通路”网络的构建 “核心组方成分-靶点-疾病通路”网络包括238个点,444条边。黄色三角形代表194个靶点,粉色正方形代表15条疾病通路,蓝色六边形代表核心组方的29个成分。见图7。

图7 “核心组方成分-靶点-疾病通路”网络
2.7 核心组方关键成分和核心靶点的分子对接验证 将5个关键成分和5个核心靶点进行分子对接并按照结合能进行排序,结果表明关键成分中的槲皮素、β-谷甾醇和异鼠李素与5个核心靶点之间结合性较好。见表3。图8可知,将结果进行可视化后显示槲皮素、β-谷甾醇和异鼠李素与5个核心靶点蛋白残基通过氢键形成稳定构象。
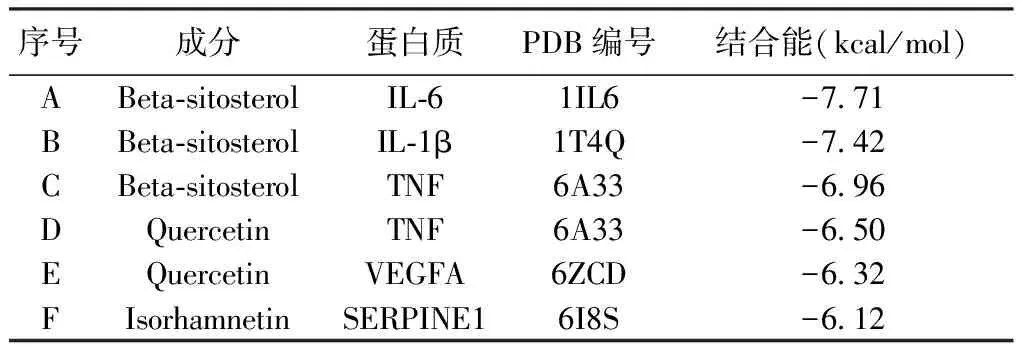
表3 分子对接最佳构象组合(1 cal=4.184 J)

图8 分子对接构象图
2.8 验证实验结果
2.8.1 核心组方对于模型组大鼠IL-1β、IL-6、TNF-α、SERPINE1的影响 与空白组比较,模型组大鼠前列腺组织中的IL-1β、IL-6、TNF-α、SERPINE1水平显著增加(均P<0.05);与模型组比较,核心组方组大鼠前列腺组织中的IL-1β、IL-6、TNF-α、SERPINE1水平则显著下降(均P<0.05)。见表4。
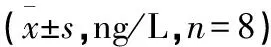
表4 各组大鼠前列腺组织中IL-1β、IL-6、TNF-α、SERPINE1水平
2.8.2 核心组方对于模型组大鼠IL-17 mRNA表达量的影响 与空白组比较,模型组大鼠前列腺组织中IL-17 mRNA表达量显著增加(P<0.05);与模型组比较,核心组方组大鼠前列腺组织中的IL-17 mRNA表达量显著下降(P<0.05)。见表5,图9。

表5 各组大鼠前列腺组织中IL-17 mRNA表达量
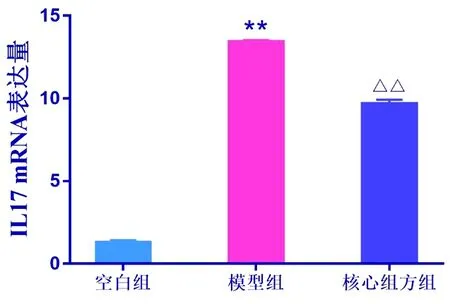
图9 各组大鼠前列腺组织中IL-17 mRNA表达量
3 讨论
中医文献中虽无精液不液化症名,但精液不液化属于“精滞、精寒、精热”等疾病的范畴,精液亦属于津液,津液的液化通过阳气的气化作用来推动,气化作用又和机体的阴阳协调密切相关,同理,精为肾之所属,精液的液化又有赖于肾的气化功能,因此王琦院士治疗精液不液化时着眼于肾阴阳失调,气化失常的病机[4],核心组方中的当归、黄芪气血双补调和阴阳,滋养后天气血以养先天肾精,巴戟天补肾填精益筋骨,加之菟丝子、枸杞子滋肾阴益肾阳使气机畅通,符合王院士对于精液不液化“扶正祛邪、恢复气化功能”的治疗原则。而西医治疗精液不液化常从慢性前列腺炎、精索静脉曲张等引起精液不液化的病因入手,用药上常选择喹诺酮类抗生素和维生素,通过抗炎和抗氧化进行治疗,但长时间服用抗生素易引发不良反应,影响男性生精功能和精子质量;技术层面常采用人工授精技术,但花费较高、成功率低[6]。中草药成分复杂,具有多环节多靶点多通路的特点,因此在治疗精液不液化上更加具有优势。网络药理学可将组方有效成分、对应靶点、疾病通路进行系统整合,进一步揭示药物的系统性药理机制[7-8],为中医药治疗疾病的机制探究提供了新的思路和启发。
本研究前期将王院士门诊收治的精液不液化患者病历导入“中医传承辅助平台系统(V2.5)”后通过关联规则分析的方法进行数据挖掘,得出由当归、黄芪、巴戟天、菟丝子和枸杞子组成的核心组方。结果显示该方关键活性成分主要是槲皮素、山柰酚、异鼠李素、黄豆黄素等黄酮类化合物以及β-谷甾醇的甾体类化合物。有研究表明槲皮素具有抗氧化和抗炎作用,能减轻大鼠睾丸和附睾的氧化应激程度,减少氧化产物的产生,经槲皮素治疗后炎症介质的产生和表达均有明显的下降[9-10]。山柰酚能抑制晚期糖基化终末产物(Advanced Glycation End Product,AGE)的形成,具有较强的抗氧化作用,能减少细胞内脂类和DNA的氧化损伤,抑制前列腺增生和前列腺癌的发展,有利于雄性生殖功能损伤的恢复[11-12]。异鼠李素能缓解由TNF、IL-6、IL-1β等炎症介质引起的炎症反应过表达,并诱导前列腺癌细胞凋亡[13]。黄豆黄素能通过对雄激素受体信号通路的介导,阻断雄性激素依赖性基因的表达,起到预防和治疗前列腺癌的作用[14]。β-谷甾醇对雄性白化大鼠进行治疗后可使精子水平和睾丸体质量增加,能够减轻生殖系统的损伤,促进生殖功能的恢复[15]。
通过对核心组方药物成分、靶点与疾病靶点的总体综合分析,共得出24个交集靶点,将交集靶点输入String网站后将网站生成文件导入Cytoscape 3.7.2,根据靶点degree值进行排序得出TNF、SERPINE1、IL-6、IL-1β是关键靶点。关键靶点中的炎症介质TNF、IL-6和IL-1β与前列腺炎的发生发展密不可分[16],前列腺炎会引起白细胞数量增加,导致前列腺上皮细胞功能异常,减少以前列腺特异性抗原(Prostate Specific Antigen,PSA)和前列腺酸性磷酸酶为主的蛋白分解酶生成及分泌,最终造成精液不液化[17]。根据流行病学调查研究表明,90%的精液不液化患者有前列腺炎,慢性前列腺炎患者中约有23.16%的患者会产生精液不液化[18]。SERPINE1是一种调节纤维蛋白溶解的遗传糖蛋白,是纤维蛋白溶解酶原激活因子类特异性抑制物[19]。纤维连接蛋白(Fibronectin,FN)、精胶蛋白(Semenogelin,Sg)等是精囊腺分泌的主要蛋白,是引起精液凝固的原因,精液液化时FN也会随之降解为多肽片段,当PSA作为水解底物时,FN水平与精液液化程度和精子活动率密切相关[20-21],因此FN等蛋白的及时降解有利于精液的及时液化。有研究认为当精液中的SERPINE1/PAI-1水平增高时,会使精液中的纤溶酶等蛋白水解酶活性受到抑制,导致精液中的纤维蛋白无法及时降解为多肽片段,造成精液液化时间的延长[22]。分子对接结果进一步验证了核心组方关键活性成分与核心靶点TNF、SERPINE1、IL-6、IL-1β和血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)A具有良好的亲和力,当结合能小于-5.0 kcal/mol(1 cal=4.184 J)时说明具有较好的结合活性,小于-7.0 kcal/mol时则提示配体与受体之间具有强烈的结合活性[23]。因此分子对接结果可表明,核心组方关键活性成分与核心靶点之间具有较好的结合性,能形成较为稳定的构象,在抗炎和调节纤维蛋白方面具有较好的作用效果。课题组前期临床研究和实验研究表明,核心组方能有效改善精液不液化,因此,在此基础上开展药理验证性实验,对核心靶点及信号通路进行验证,结果表明经该方干预后,模型组大鼠前列腺组织中的TNF-α、SERPINE1、IL-6、IL-1β水平显著性降低(均P<0.01),说明核心组方中主要成分的作用靶点与精液不液化的疾病基因关联度较高,即本研究方法具有一定的可信度。
核心组方治疗精液不液化的过程涉及多个信号通路,包括糖尿病并发症晚期糖基化终末产物-晚期糖基化终产物受体(AGE-receptor for Advanced Glycation End Products,AGE-RAGE)信号通路及炎症通路IL-17信号通路等通路。研究表明AGE暴露后与RAGE相互作用通过磷脂酰肌醇-3-激酶/蛋白激酶B通路诱导前列腺癌细胞的生长和增殖[24]。IL-17由辅助性T细胞17(T Helper Cell,Th17)分泌,在炎症性肿瘤中,IL-17与受体结合后经信号通路转导诱导靶细胞合成释放炎症介质如TNF-α、IL-1等,并促进VEGFA的表达以生成新的血管[25]。此外有研究表明,IL-17及其受体在前列腺癌组织中表达显著增加,与前列腺癌关系密切[26],实时荧光定量-PCR实验结果表明经核心组方治疗后模型组大鼠前列腺组织中IL-17 mRNA表达量显著下调,说明由网络药理学所得出的IL-17信号通路是核心组方治疗精液不液化的主要作用通路之一,再一次验证了本研究的可行性。
本研究通过网络药理学对王琦院士治疗精液不液化核心组方成分、靶点、通路和机制进行探索,根据分子对接技术对关键成分和核心靶点之间的结合程度进行分析和验证。预测发挥治疗作用的关键成分有槲皮素、山柰酚、β-谷甾醇、异鼠李素和黄豆黄素,作用的核心靶点可能是TNF、SERPINE1、IL-6、IL-1β等,关键通路是糖尿病并发症AGE-RAGE信号通路及IL-17信号通路等,且通过动物实验发现经核心组方给药后大鼠前列腺组织中的TNF、SERPINE1、IL-6、IL-1β水平及IL-17 mRNA表达量均显著下降,与网络药理学研究结果存在一致性,说明核心组方成分通过对应靶点可直接或间接作用于疾病信号通路,围绕抗炎、抗氧化以及调节纤维蛋白等生物学进程多层次、多环节地治疗精液不液化。
综上所述,本研究为临床治疗精液不液化提供新的理论数据和科学根据,也进一步传承王琦院士的学术经验。
