CNPY2调控内质网应激PERK/eIF2α通路在有氧运动干预非酒精性脂肪性肝病中的作用
2022-12-28李军汉王佳倩李亚龙蒋昌君
李军汉 王佳倩 李亚龙 蒋昌君
成都体育学院运动医学与健康学院(成都 610041)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是代谢综合征的肝脏表现[1]。大多数NAFLD 患者有单纯性脂肪肝(肝脏轻度脂肪性变),少数患者发展为非酒精性脂肪性肝炎,并可逐步发展为肝硬化和肝癌[2]。在过去的几十年里,NAFLD 是全球最常见的慢性肝病之一,也被认为是肝酶异常的最常见原因[3]。随着肥胖和糖尿病的日益流行,NAFLD 的发病率在全世界范围内逐渐上升[4]。目前,NAFLD 的治疗方法主要包括服用减肥药物、实施减肥手术以及采用胰岛素增敏剂、降脂剂、抗氧化剂、益生菌、抗肿瘤坏死因子药、细胞保护剂和其他新药等[5]。 NAFLD 在临床治疗上尚无特效药[5]。有研究发现[6],NAFLD 的发生与久坐少动呈正相关。近期文献[7]报道,饮食调整和运动等包含在内的生活方式改变为治疗NAFLD 的首选方法。研究发现[8],运动可有效改善NAFLD。但迄今为止,运动改善NAFLD 的分子作用机制不详。
Canopy 成纤维细胞生长因子信号调节因子2(Canopy FGF signaling regulator 2,CNPY2)是一种含有皂苷B-型域的成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)调节蛋白。Hatta 等[9]首次通过实验研究,检测了CNPY2蛋白和CNPY2 mRNA在小鼠体内的表达,结果发现CNPY2在骨骼肌、心肌、平滑肌、血液、内皮和上皮等不同器官和组织中广泛分布,以心脏、肺、胰腺和肝脏中表达较高,在骨骼肌、肾脏、脾脏和胃中表达次之,在睾丸、大脑、大肠和小肠中表达最少;其次,在唾液腺、乳腺和甲状腺管腔中,CNPY2 染色显阳性,提示CNPY2 作为内分泌蛋白发挥细胞外泌体作用的可能性。目前,CNPY2 没有得到广泛的研究,其已知的生物学功能十分有限。有限的文献研究报道,CNPY2 参与神经突生长、胶质瘤C6细胞和血管平滑肌细胞的增殖和迁移过程[10]。在缺氧时,低氧诱导因子 1α(hypoxia inducible factor 1,HIF-1α)可引起血管平滑肌细胞CNPY2 表达增加[11]。CNPY2通过FGF21调节低密度脂蛋白受体和细胞脂蛋白代谢[12]。此外,在人类非小细胞肺癌(non-small cell lung cancer,NSCLC)中,CNPY2 通过激活核因子-κB(nuclear factor-κB,NF-κB)抑制NSCLC 细胞凋亡[13]。由此可见,CNPY2 在细胞生长、迁移、凋亡和脂质代谢中扮演重要作用[14]。近期文献[15]报道,CNPY2在肝细胞癌中表达上调。有学者[16]通过10周高脂膳食喂养成功诱导NAFLD 小鼠模型,结果发现CNPY2 调控PKR 样内质网状激酶(protein kinase R-like ER ki⁃nase,PERK)/真核细胞翻译起始因子2α(eukaryotic translation initiation factor 2α,eIF2α)信 号 通 路 在NAFLD发生发展中发挥重要作用。运动作为一种低成本治疗手段,可有效预防和改善NAFLD,其深层机制被证实与运动调控内质网应激(endoplasmic reticulum stress,ERS)水平相关[17]。然而,运动是否通过CNPY2调控内质网应激 PERK/eIF2a 通路,从而发挥其对NAFLD 的改善作用,尚不得而知。
有关运动改善非酒精性脂肪性肝病的研究多为人体[18]和动物[19]实验,细胞实验未见文献报道。研究表明,体内能量代谢关键蛋白激酶—腺苷磷酸活化蛋白激酶(adenosine monophosphate-activated protein ki⁃nase,AMPK)在不同运动时均可被激活,因此,AMPK激动剂在细胞实验中常用来模拟运动刺激[20,21]。本研究聚焦于CNPY2 调控内质网应激PERK/eIF2a 信号通路,通过高脂膳食诱导NAFLD 小鼠模型,并进行有氧运动干预;同时,通过棕榈酸(palmitic acid,PA)诱导构建HepG2 细胞NAFLD 体外模型[22],采用AMPK 激动剂(GSK621)、CNPY2 重组蛋白和 PERK 抑制剂(GSK2606414)干预,探讨CNPY2 调控内质网应激PERK/eIF2α信号通路在有氧运动干预NAFLD 中的可能作用机制,以期为NAFLD 的运动康复和相关靶点筛选提供实验依据和理论参考。
1 材料与方法
1.1 主要仪器与试剂
主要仪器:LEICARM2126 切片机、YT-6C 生物组织摊烤片机、匀浆机、蛋白定量仪、Bio-Rad 水平电泳仪和转移槽、凝胶成像系统、BMII 型病理组织包埋机、Olympus BX51 光学显微镜、Nikon Eclipse55i 荧光显微镜等。
主要试剂:人肝癌HepG2 细胞株购自中国科学院上海细胞库;棕榈酸(P5585)和油红O(01391)购自美国Sigma公司;抗体CNPY2(14635-1-AP)和PERK(20582-1-AP)购自proteintech 公司;抗体血红素加氧酶- 1(haem oxygenase- 1,HO- 1)(ET1604- 45),NADPH 氧 化 酶- 1(NADPH oxidase 1,NOX- 1)(ER1913-99)和p-eIF2α(ET1603-14)购自华安生物;抗体核因子E2 相关因子2(nuclear factor E2-related factor 2,Nrf2)(ab92946)、IgG(ab6721)购自abcam 公司;β-actin(AC026)购自abclonal 公司;ELISA 检测试剂盒白介素-1a(interleukin-1α,IL-1α)(ZC-32340)、白介素-6(interleukin-6,IL-6)(ZC-32446)和 肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)(ZC-35733)购自上海茁彩。CNPY2 重组蛋白(13771-H08H)购自Sino Bilogical 公司;AMPK 激动剂(GSK621)(516535-5MC)购 自MCE 公 司;PERK 抑 制 剂(GSK2606414)(B6020-1mg)购自APEBIO公司。
1.2 动物分组及模型评价
1.2.1 动物分组及运动方案
30只8周龄雄性C57/BL6J小鼠由江苏集萃药康生物科技有限公司提供,SPF/VAF 级,许可证编号:JSNJ(苏)2020-0003,按随机数字表法分为普通饮食组(普饮组)、高脂饮食组(高脂组)和高脂饮食运动组(高脂运动组),每组10 只。所有小鼠在成都体育学院实验中心小动物房内分笼饲养,室温18℃~22℃,相对湿度45 %~55 %,12 h阴暗交替,自由饮食饮水。普饮组给予普通饲料饲养,高脂组和高脂运动组给予高脂饲料饲养,连续饲养18周。在实验第9周,从各组中分别随机抽取2 只小鼠,禁食12 h,以4 ml/kg 腹腔内注射2 % 戊巴比妥钠溶液麻醉,取肝脏左叶做油红O病理形态检测,结合血脂变化,以确认模型制备成功[23]。从第10 周开始,高脂运动组进行有氧运动训练干预,直至实验结束,取小鼠肝脏。
运动训练方案[24]:高脂运动组小鼠先进行1周跑台适应性训练,初始速度为8 m/min×10 min,20 min/d,每天以0.5 m/min的速度和10 min/d的时间递增,直至运动时间达到60 min/d,运动速度达到12 m/min,正式运动持续8 周,每周运动5 天,普饮组和高脂组小鼠静置于没有开机的跑步机上,持续时间和频率与高脂运动组相同。
1.2.2 取材和模型评价
为避免运动应激反应,实验结束后48 h取材。取材前禁食12 h,以4 ml/kg 腹腔内注射2 % 戊巴比妥钠溶液麻醉,以腹部正中切口打开腹腔,迅速取出肝脏。用4%多聚甲醛将肝组织固定,常规石蜡包埋,切片后苏木精-伊红(HE)染色,光镜下观察肝组织病理学改变。采用NAS 评分[25]标准对肝组织脂肪性变进行病理学评分。NAS 评分标准如下:含脂肪滴肝细胞散在、稀少,0分;含脂肪滴肝细胞≤1/4,1分;含脂肪滴肝细胞≤1/2,2 分;含脂肪滴肝细胞≤3/4,3 分;肝组织几乎被脂滴所代替,其面积>3/4,4分。
1.3 HepG2细胞培养与分组
HepG2 细胞用含10% FBS 和1% 青链霉素的DMEM 培养基培养,并放置在条件为37℃、5% CO2和95%空气的细胞培养箱中,至细胞融合率达80%~90% 时加入0.25% 胰蛋白酶消化细胞,按1:3比例进行传代及后续实验操作。
实验分为8 组:即空白对照组(C 组),模型组(M组),AMPK 激动剂干预组(GSK621 组),CNPY2 重组蛋白干预组(CNPY2 组),CNPY2 重组蛋白+ AMPK激动剂干预组(CNPY2+ GSK621 组),CNPY2 重组蛋白+ PERK 抑制剂干预组(CNPY2+GSK2606414 组),AMPK 激动剂+PERK 抑制剂干预组(GSK621+GSK2606414 组),CNPY2 重组蛋白+AMPK 激动剂+PERK 抑制剂干预组(CNPY2+ GSK621+ GSK2606414组)。
除空白对照组外,其余各组在加入棕榈酸(palmit⁃ic acid,PA)(浓度250 μM)孵育肝细胞24 h,诱导NAFLD 体外模型后[22],采用AMPK 激动剂(GSK621)(浓度1 μM)模拟细胞水平运动效应[21],以及CNPY2重组蛋白(CNPY2)(浓度2.5 ng/mL)和PERK 抑制剂(GSK2606414)(浓度0.5 μM)干预24 h。具体干预方案为:GSK621组加入AMPK 激动剂干预24 h;CNPY2组加入CNPY2 重组蛋白干预24 h;CNPY2+ GSK621组加入AMPK 激动剂和CNPY2 重组蛋白共同干预24 h;CNPY2+ GSK2606414 组加入CNPY2 重组蛋白和PERK 抑制剂共同干预 24 h;GSK621 +GSK2606414 组加入AMPK 激动剂和PERK 抑制剂共同干预 24 h;CNPY2+ GSK621+ GSK2606414 加入AMPK 激动剂、CNPY2 重组蛋白和PERK 抑制剂共同干预24 h。
1.4 蛋白提取和Western Blotting检测
提取肝组织和肝细胞总蛋白,具体步骤如下:肌组织50 mg,加人预冷RIPA 裂解液500 μ1,电动匀浆机匀浆,静置10 min后,12 000 rpm低温离心15 min,取上清;收集肝细胞蛋白,超声细胞破碎仪破碎细胞后静置10 min,4℃离心,取上清,BCA法测肝组织和肝细胞总蛋白含量。SDS-PAGE 凝胶电泳分离蛋白,湿转法转膜,室温下5%BSA 封闭1 h,4℃过夜孵育一抗,CNPY2 稀释浓度为1∶400,PERK、HO-1、Nrf2、NOX-1、p-eIF2α稀释浓度均为1∶1000,β-actin 稀释浓度为1∶100000。次日TBST 清洗,室温孵育二抗1 h,再次TBST 清洗。ECL 发光,凝胶成像系统成像。βactin 作为内参,使用 Gel-pro 图像分析软件,对Western Blot 结果进行灰度扫描并量化分析,蛋白表达量用“目的蛋白/β-actin”计算。
1.5 HepG2细胞油红O染色
用预冷PBS 清洗细胞3 次,然后用4%多聚甲醛固定细胞10 min。加入油红O 染液于6 孔板内,室温反应10 min,用60%的异丙醇进行脱色,紧接着用苏木素染核30 s,重新用60%的异丙醇清洗2~3 次,倒置显微镜下观察,油红O 染色结果进行量化分析。同时将细胞种植于96 孔板,重复上述操作,最后使用100%异丙醇溶解已染色的细胞,酶标仪在波长600 nm 处检测其吸光度值。
1.6 HepG2 细胞qRT-PCR 检测
按照Trizol 法提取HepG2 细胞总RNA,用Nano⁃drop ND-1000 分光光度计测定RNA 的纯度及浓度,选取OD 值在1.80~2.0 间的样品按照TAKARA Prime Script TM RTMaster Mix 试剂盒说明书进行逆转录,逆转录体系为20 μL。RT-PCR 反应体系为10 μL,按照TAKARASYBR Premix Ex TaqTM Ⅱ(TliR⁃NaseH Plus)试剂盒说明书,采用LightCycler480 进行实时荧光定量PCR反应。所有引物设计与合成委托由上海生工生物工程技术服务有限公司设计合成,并以ULTRAPAGE 纯化,引物设计见表1。以β-actin 作为内对照,计算相对量,采用2-ΔΔCT法分析。
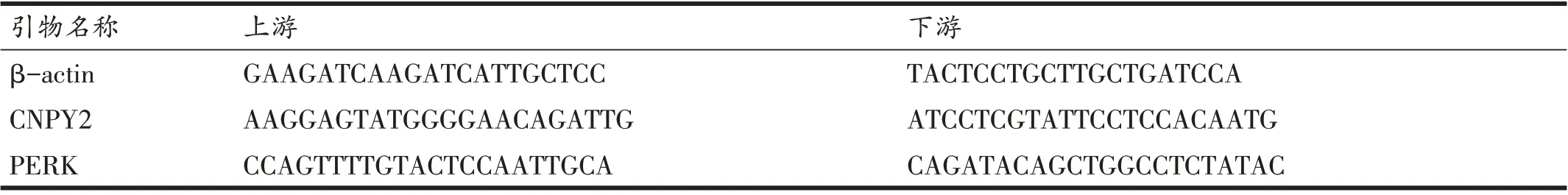
表1 引物设计
1.7 HepG2 细胞上清液ELISA 检测
将各组细胞培养基移取至离心管中,在4℃下以1500 rpm 的速度离心10 min,收集各组细胞上清液,按照ELISA 试剂盒说明书,检测各组上清液中IL-6、IL-1α、TNF-α细胞因子水平。每个样本和标准品均设3个复孔,用酶标仪在450 nm 波长下测定吸光度(OD值),绘制标准曲线,计算样品浓度。
1.8 统计学方法
2 结果
2.1 小鼠肝组织病理形态变化
各组小鼠肝脏病理形态结果(图1A)显示:高脂组肝细胞可见明显脂肪性变,肝细胞内有大量脂肪空泡充填;高脂运动组肝细胞脂肪性变程度显著减轻。肝细胞脂肪性变积分结果(图1B)显示:高脂组肝细胞脂肪性变积分较普饮组显著升高(P<0.05),高脂运动组肝细胞脂肪性变积分较高脂组显著降低(P<0.05),提示有氧运动显著改善小鼠肝组织病理形态。
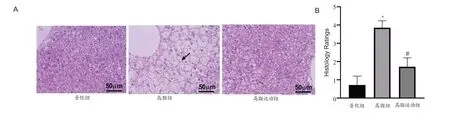
图1 各组肝脏病理形态变化(×400)
2.2 各组小鼠肝组织CNPY2 介导PERK/eIF2α信号通路表达变化
各组小鼠肝组织Western Blotting 结果(见图2)显示,与普饮组比较,高脂组CNPY2、PERK、p-eIF2α蛋白表达显著升高(P<0.05);与高脂组比较,高脂运动组以上指标显著降低(P<0.05),提示有氧运动下调小鼠肝组织CNPY2 表达,抑制内质网应激PERK/eIF2α信号通路。
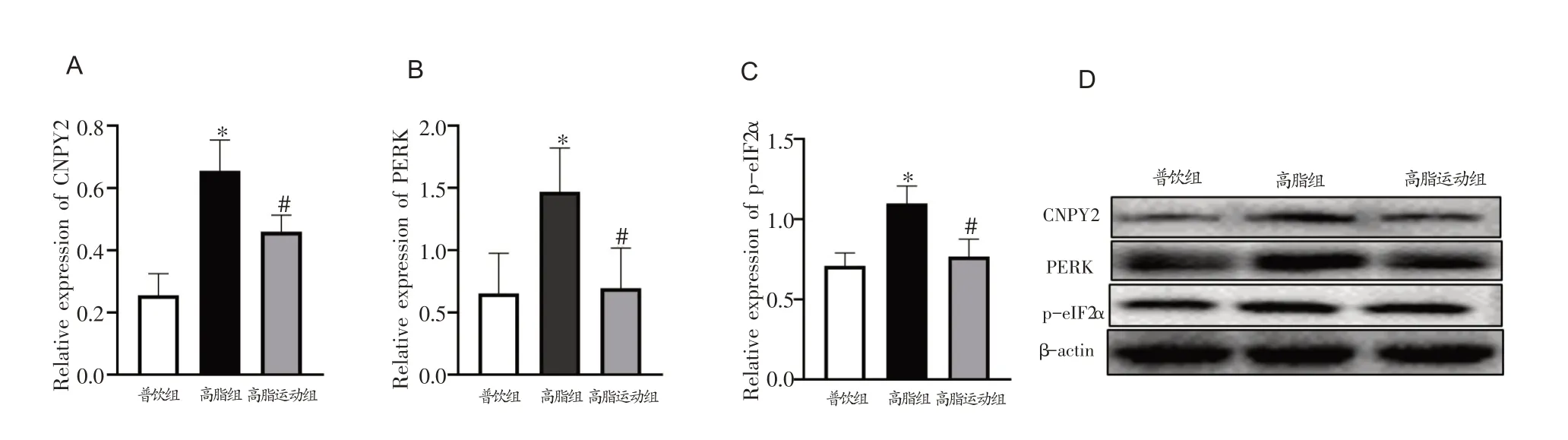
图2 各组小鼠肝组织CNPY2 介导PERK/eIF2α信号通路表达变化
2.3 各组HepG2 细胞油红O染色变化
各组HepG2 细胞油红O 染色结果(见图3 A)显示,对照组肝细胞数量多,细胞排列整齐,肝细胞呈不规则多角形或卵圆形生长,胞质染色浅淡或无明显着色;与对照组比较,模型组肝细胞内脂滴明显增多;与模型组比较,CNPY2 重组蛋白干预组红染颗粒增加,其余干预组脂滴数量较模型组不同程度减少。各组肝细胞脂滴光密度结果(见图3 B)显示:模型组(M组)肝细胞脂滴光密度较对照组(C组)显著增加(P<0.01);与模型组(M 组)比较,CNPY2 重组蛋白干预组(CNPY2组)肝细胞脂滴光密度显著增加(P<0.05),AMPK 激动剂干预组(GSK621组)肝细胞脂滴光密度显著下降(P<0.05);与CNPY2 组比较,CNPY2+GSK2606414 组和CNPY2+GSK621 组肝细胞脂滴光密度均显著下降(P<0.05);与 GSK621+ GSK2606414 组比较,GSK621+GSK2606414+CNPY2 组肝细胞脂滴光密度显著升高(P<0.05)。
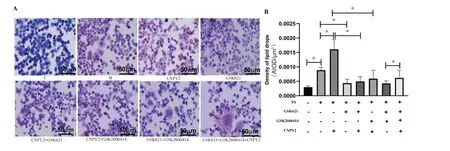
图3 各组HepG2细胞脂滴变化(×400)
2.4 各组HepG2 细胞CNPY2 介导PERK/eIF2α信号通路表达变化
各组HepG2 细胞CNPY2 介导PERK/eIF2α信号通路表达变化结果(见图4)显示:与对照组(C 组)比较,模型组(M 组)肝细胞CNPY2、PERK 和p-eIF2α、CNPY2 mRNA 和PERK mRNA 表 达 显 著 增 加(P<0.05);与M 组比较,CNPY2重组蛋白干预组(CNPY2)以上分子表达均显著升高(P<0.05),AMPK激动剂干预组(GSK621)以上分子表达显著降低(P<0.05);与CNPY2 组 比 较,CNPY2+ GSK621 组 和CNPY2+GSK2606414 组以上分子表达均显著降低(P<0.05);与GSK2606414 + GSK621 组比较,GSK2606414 +GSK621+CNPY2组以上分子表达显著升高(P<0.05)。
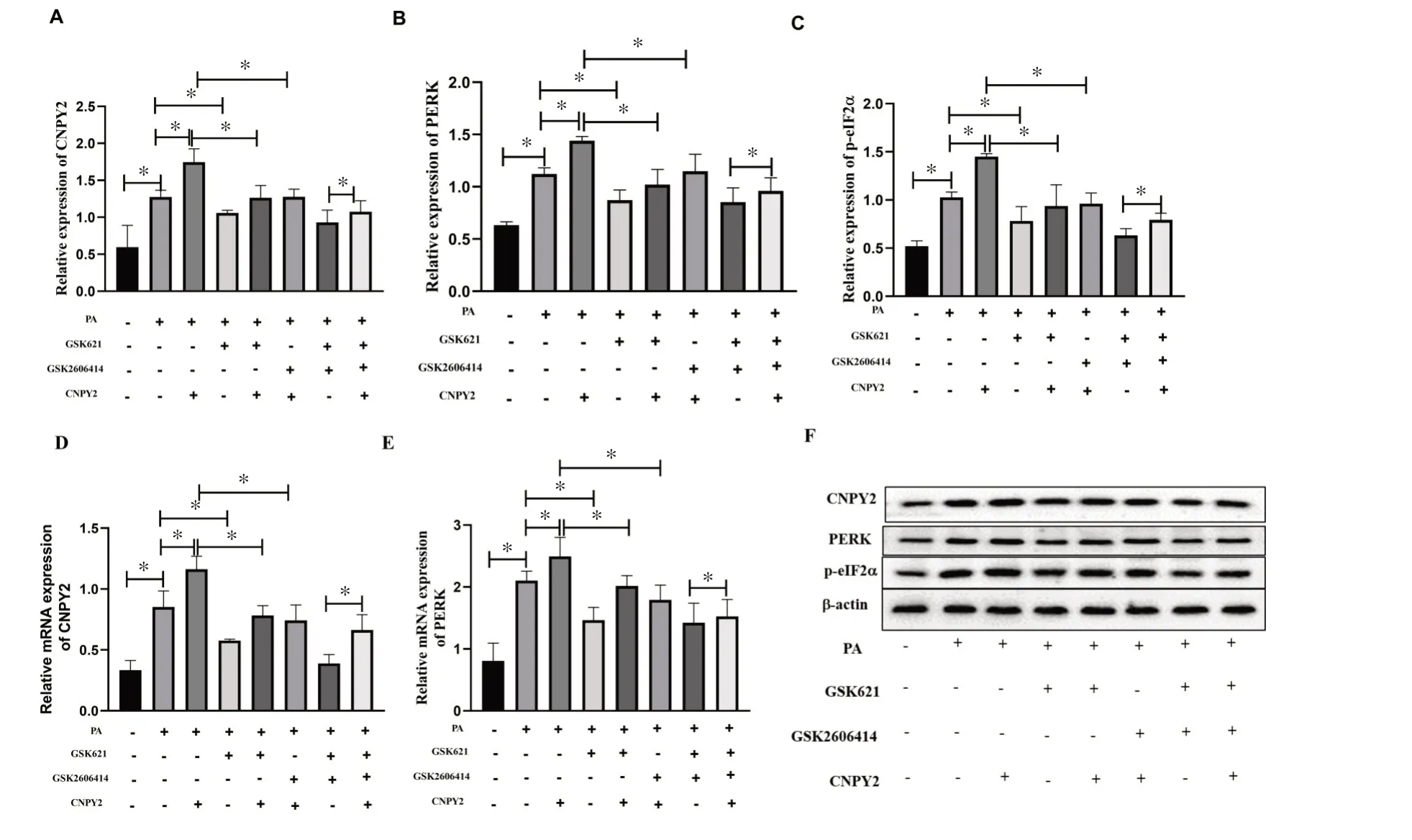
图4 各组HepG2 细胞CNPY2 介导PERK/eIF2α信号通路表达变化
2.5 各组HepG2 细胞氧化应激分子表达变化
各组HepG2 细胞氧化应激分子表达变化结果(见图5)显示:与对照组(C组)比较,模型组(M组)肝细胞Nrf2、HO-1、NOX-1 蛋白表达显著增加(P<0.05);与M 组比较,CNPY2重组蛋白干预组(CNPY2)以上分子表达显著升高(P<0.05),AMPK 激动剂干预组(GSK621)以上分子表达显著降低(P<0.05);与CNPY2组 比 较 ,CNPY2 + GSK621 组 和 CNPY2 +GSK2606414 组以上分子表达均显著降低(P<0.05);与GSK2606414 + GSK621 组比较,GSK2606414 +GSK621+CNPY2组以上分子表达显著升高(P<0.05)。
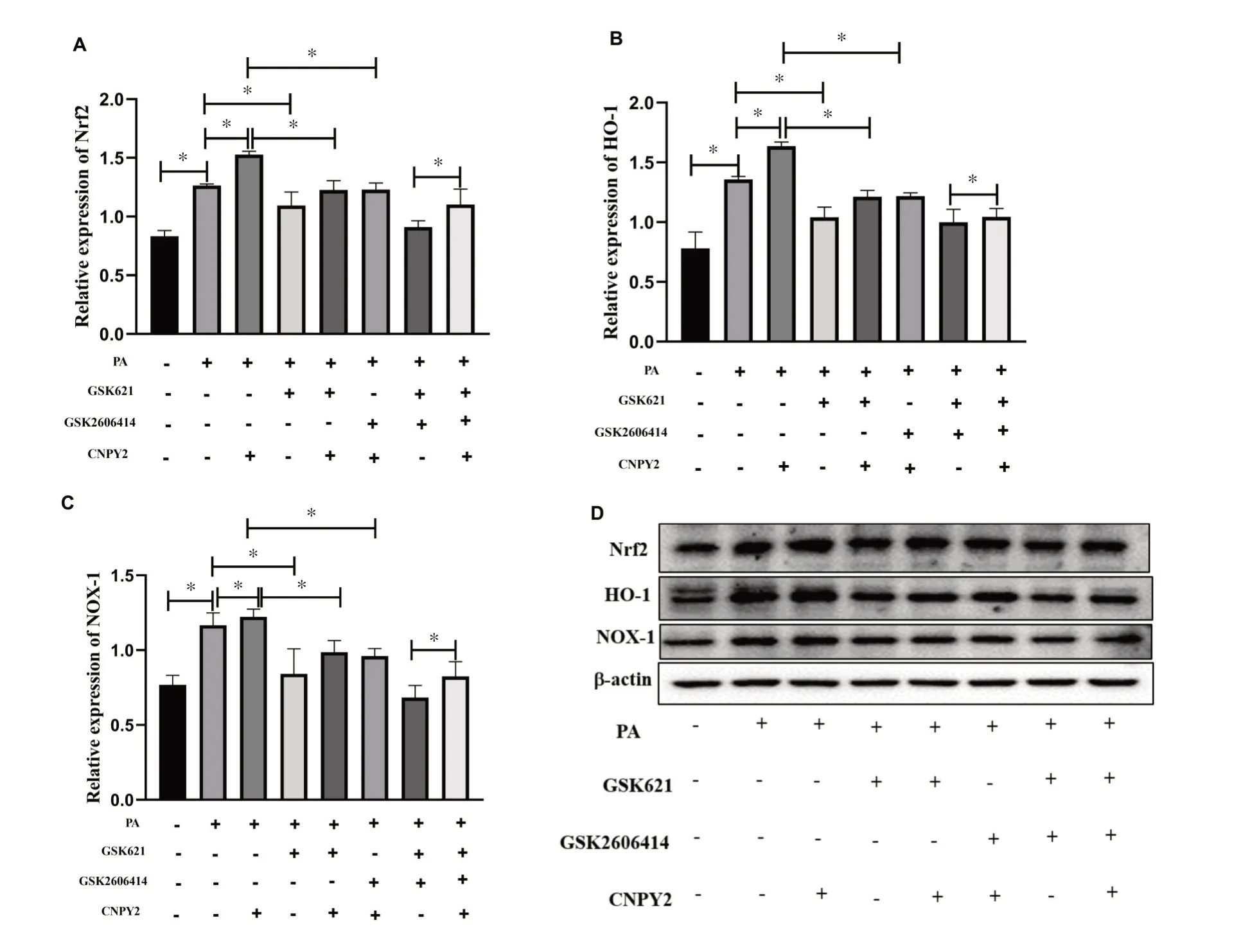
图5 各组HepG2 细胞氧化应激分子表达变化
2.6 各组HepG2 细胞炎症因子浓度变化
各组HepG2 细胞炎症因子浓度变化结果(见图6)显示:与对照组(C 组)比较,模型组(M 组)肝细胞上清液IL-1a、IL-6 和TNF-a 浓度显著增加(P<0.05);与M 组比较,CNPY2重组蛋白干预组(CNPY2)以上分子浓度显著升高(P<0.05),AMPK 激动剂干预组(GSK621)以上分子浓度显著降低(P<0.05);与CNPY2组比较,CNPY2+GSK621 组和CNPY2+GSK2606414组以上分子浓度显著降低(P<0.05);与GSK2606414+GSK621 组比较,GSK2606414 + GSK621+CNPY2组以上分子浓度显著升高(P<0.05)。

图6 各组HepG2 细胞炎症因子浓度变化
3 讨论与分析
NAFLD 是代谢综合征在肝脏的表现,其主要病理学特征为肝细胞内脂质沉积,早期病理仅为单纯性肝细胞脂肪样变,而中晚期会继发炎性细胞浸润、肝细胞凋亡和坏死[26]。动物模型和细胞模型是NAFLD 研究的常用手段。动物模型实验周期长、能模拟体内环境,但个体差异较大[27];细胞模型简便、高效,能克服个体差异的影响,更适于开展机制研究[28]。病理形态组织学是NAFLD诊断的金标准[29]。本研究采用高脂饮食诱导NAFLD 小鼠动物模型,肝组织病理形态结果显示,高脂组肝细胞脂肪性变较普饮组显著增加,提示NAFLD 动物模型复制成功。NAFLD 体外模型的构建常采用棕榈酸诱导、油酸诱导、游离脂肪酸诱导、油酸与棕榈酸按一定比例混合诱导等方法[30]。棕榈酸(PA)容易引发肝脏的脂肪变性,是饮食和血清中最丰富的游离脂肪酸[31]。PA 常用于诱导肝细胞HepG2 体外模拟非酒精性脂肪肝的损伤及脂质沉积[32].。研究报道[22],棕榈酸诱导HepG2 细胞24 h,肝细胞内脂质积累显著增多,提示棕榈酸诱导HepG2 细胞24 h 可成功建立NAFLD 体外模型。本研究结果显示:模型组在棕榈酸诱导HepG2 细胞24 h 后,油红O 染色可见其肝细胞内脂滴显著增加,提示本研究成功诱导肝细胞NAFLD 体外模型。
研究报道,内质网应激(ERS)是NAFLD 发展进程中重要的病理基础[33]。ERS 的信号通路由PERK、ATF6 和IRE1α三种内质网跨膜蛋白和内质网分子伴侣GRP78(BiP)组成。在非应激状态下,BiP 的腔域抑制着PERK、ATF6和IRE1α的活性,并与这些跨膜蛋白结合。然而,当未折叠蛋白在内质网中积累时,BiP 与PERK、IRE1α和ATF6α解离,优先与未折叠蛋白结合,从而激活ERS信号通路[34]。 CNPY2是CNPY蛋白家族(CNPY1、CNPY2、CNPY3 和CNPY4)之一,它是位于内质网的可溶性蛋白[15]。有研究[16]报道,CNPY2参与内质网应激,CNPY2 可激活PERK/eIF2α通路,是内质网应激的重要分子组成之一。本研究动物实验结果显示,CNPY2 介导PERK/eIF2α通路参与高脂膳食诱导小鼠NAFLD 形成,有氧运动可有效抑制CNPY2/PERKeIF2α通路活性,降低CNPY2/PERK-eIF2α通路相关分子表达,从而有效改善NAFLD。细胞实验结果显示,棕榈酸诱导肝细胞NAFLD 体外模型,与对照组比较,模型组CNPY2/PERK-eIF2α通路相关分子表达显著升高。与模型组比较,CNPY2 重组蛋白干预组上述通路相关分子表达显著升高,AMPK 激动剂干预组上述通路相关分子表达显著降低,提示CNPY2 重组蛋白干预可激活CNPY2/PERK-eIF2α信号通路,促进棕榈酸作用效应,而AMPK 激动剂有效抑制CNPY2/PERKeIF2α信号通路,逆转棕榈酸作用效应。研究结果还显示,AMPK激动剂和PERK 抑制剂均可逆转CNPY2 重组蛋白干预效应,提示AMPK 激动剂(模拟细胞运动效应)通过CNPY2 有效抑制PERK/eIF2α信号通路活性,从而逆转棕榈酸诱导的肝细胞NAFLD。以上研究结果共同表明,CNPY2介导PERK/eIF2α信号通路在有氧运动干预NAFLD 中发挥重要作用。有氧运动可能通过下调CNPY2 表达,抑制PERK/eIF2α信号通路活性,降低PERK/eIF2α信号通路相关分子表达,从而改善NAFLD。
研究报道,NAFLD 中肝细胞ERS 与肝细胞脂质异常积聚、氧化应激和炎症反应等密切相关[35]。血红素加氧酶-1(haem oxygenase-1,HO-1)是一种广泛存在的抗氧化防御酶,几乎分布于所有的组织和器官,对氧化损伤具有良好的保护效应,成为研究抗氧化损伤的首选靶基因之一[36]。在炎性反应中,HO系统被认为是细胞最重要的保护通路之一,参与抗炎与多种急慢性氧化应激损伤[37]。核因子E2相关因子2(nuclear fac⁃tor E2-related factor 2,Nrf2),在机体抗氧化应激中起着重要作用。Nrf2 感受氧化应激,使抗氧化酶(包括HO-1)分子表达升高,减轻自由基损伤,是调节细胞抗氧化应激的重要转录因子[38]。有研究表明,Nrf2抑制脂质沉积和氧化应激[39]。NADPH 氧化酶(NADPH oxi⁃dase,NOX)是细胞内氧自由基的主要来源[40]。NOX-1可以调控细胞内自由基的生成,是NOX 蛋白家族成员之一[41]。IL-1α、IL-6 和TNF-α是重要的炎症因子,在炎症反应启动中具有重要作用,其浓度与炎症反应程度密切相关[42]。我们推测,CNPY2 介导PERK/eIF2α通路在棕榈酸诱导NAFLD 中发挥作用,其机制可能与氧化应激和炎症有关。本研究细胞实验结果显示:与对照组比较,模型组肝细胞HO-1、Nrf2、NOX-1蛋白表达及肝细胞上清液IL-1α、IL-6 和TNF-α浓度均显著增加,提示棕榈酸诱导肝细胞NAFLD 体外模型形成,导致肝细胞氧化应激和细胞炎症增加。与模型组比较,CNPY2 重组蛋白干预组以上分子表达显著升高,AMPK 激动剂干预组上述分子表达显著降低,提示CNPY2 重组蛋白增加肝细胞氧化应激和炎症因子水平,对棕榈酸干预效应具有促进作用,而AMPK激动剂减少肝细胞氧化应激和炎症因子水平,抑制棕榈酸干预效应,提示AMPK 激动剂(模拟细胞运动效应)可有效抑制和逆转棕榈酸诱导的肝细胞NAFLD,其机制可能与AMPK 激动剂减少肝细胞氧化应激和炎症水平有关。以上研究结果表明,有氧运动可有效改善NAFLD,其机制可能与其抑制肝细胞氧化应激,减少细胞炎症有关。
4 结论
CNPY2 介导PERK/eIF2α信号通路参与NAFLD形成。有氧运动可有效改善NAFLD,其机制可能与其下调CNPY2 表达,通过抑制PERK/eIF2α通路活性,降低PERK/eIF2α信号通路相关分子表达,从而减少肝细胞氧化应激和细胞炎症有关。
