多头带绦虫成虫和幼虫的iTRAQ蛋白质组学分析
2022-12-28李文卉王建魁张念章曲自刚刘垠鞠贾万忠付宝权
李文卉,王建魁,张念章,曲自刚,刘垠鞠,贾万忠,付宝权,3
多头带绦虫(Taeniamulticeps)成虫寄生于犬等动物的小肠,多头带绦虫的中绦期幼虫脑多头蚴(Coenuruscerebralis)寄生于牛、羊等草食动物的大脑,引起一种中枢神经性疾病;人也可作为中间宿主误食多头带绦虫虫卵偶尔感染,可导致严重的病例状况[1-5]。该病在世界范围内普遍流行[6-8],在我国西北、华北、东北等广大牧区最为多见[9],该病感染动物后中晚期治愈率很低,致死率可达100%,给畜牧业生产造成了巨大的经济损失,是一种重要的人兽共患寄生虫病[10-11]。
多头带绦虫是两宿主的寄生虫,寄生于犬肠道成虫长度可达100 cm;而甚至有鸡蛋大小的幼虫期脑多头蚴则是充满囊液的半透明的包囊。显然,多头带绦虫的发育经历了两种不同的宿主、不同的寄生环境,而且形态学和生理学是也完全不同,而且每个发育阶段的生物学,包括发育调节、营养代谢和细胞周期仍不清楚。同位素标记相对和绝对定量(isobaric tags for relative and absolute quantification, iTRAQ)技术主要应用于蛋白质的鉴定与定量分析,结合串联质谱分析,该技术已成为目前蛋白质组学研究的主要手段之一。本研究应用iTRAQ技术分析多头带绦虫成虫及幼虫发育阶段差异蛋白,并用生物信息学方法对差异蛋白进行比较分析,从蛋白组学角度分析与发育有关的生物学过程和分子基础。
1 材料与方法
1.1 多头带绦虫成虫与幼虫的收集 从甘肃省景泰屠宰厂收集感染脑多头蚴的绵羊,开颅腔摘取完整的脑多头蚴包囊,分离原头节液氮保存备用。另将以上新鲜的原头节50~80个饲喂给提前驱过虫的2只比格犬,60 d后安乐处死犬,纵向剖肠取完整的多头带绦虫成虫,清洗干净后再用PBS洗涤3次,每个冻存管分装1条成虫液氮保存备用。
1.2 超声破碎法多头带绦虫成虫与幼虫总蛋白制备和SDS电泳 称取适量脑多头蚴原头节及多头带绦虫成虫样品,用PBS洗脱离心2次后,加入裂解液(1 mmol/L PMSF、2 mmol/L EDTA),置于冰上5 min后加入终浓度为10 mmol/L DTT,200 W冰浴超声裂解15 min。25 000×g 离心 20 min,取上清液转入新的离心管中,56 ℃使用10 mmol/L DTT处理1h,还原打开二硫键,接着在暗室使用55 mmol/L IAM 暗室室景置 45 min,进行半胱氨酸的烷基化封闭,最后加入1 mL冷冻的丙酮,在-20 ℃放置过夜。次日25 000×g 离心20 min 弃去上清液,沉淀在300 μL 0.5 mol/L TEAB中200W超声裂解15 min,25 000×g 离心20 min后上清液用于定量。Bradford 法测定蛋白质浓度。每个样品上样量30 μg,蛋白标志物上样量10 μg, 进行SDS-PAGE电泳检测。
1.3 iTRAQ标记 上述1.2制备的总蛋白用胰蛋白酶消化后,用真空离心泵抽干肽段,用0.5 mol/L TEAB复溶肽段,按照手册进行iTRAQ标记,每一组肽段被不同的iTRAQ 标签标记,室温培养2 h;将标记后的各组肽段混合,用SCX 柱进行液相分离。
1.4 液相串联质谱LC-MS/MS分析及生物信息学分析 采用高分辨力和高精度的AB SCIEXTriple TOP5600 质谱仪对分离后的肽段进行LC-MS/MS分析,配合在线微流高效液相色谱系统进行iTRAQ定量蛋白质组学分析。采用Mascot2.3.02蛋白质鉴定软件进行蛋白质数据库搜索。并对差异蛋白进行GO 分类注释及KEGG通路富集分析。
1.5 实时定量PCR(Real-time quantitative PCR, qRT-PCR)验证 TRIzol法提取多头带绦虫成虫和幼虫原头蚴总RNA,经1%琼脂糖凝胶电泳鉴定RNA质量。按照RNA反转录试剂盒(TaKaRa)反转录获得cDNA。将筛选的10个差异明显的蛋白序列分别匹配到多头带绦虫基因的CDS序列[12],根据CDS序列应用软件Primer Premier 6.0 设计引物(表1),选取β-tublin为内参基因,委托生工生物工程(上海)股份有限公司合成引物。选取的蛋白进行qRT-PCR 验证。PCR反应体系(20 μL):SYBR Green qPCR Master Mix(2×)10 μL、上下游引物(10 μmol/L)各0.4 μL、DNA模板2.0 μL、ddH2O 7.2 μL。反应条件为:95 ℃预变性3 min;95 ℃变性7 s, 57 ℃退火10 s和延伸15 s,进行45个循环反应。最后60 ℃~95 ℃制备熔解曲线。

表1 差异表达蛋白qRT-PCR引物Tab.1 qRT-PCR primers for differentially expressed proteins
1.6 统计学分析 采用2-(ΔΔCt)法验证荧光定量PCR检测结果,实验数据采用Graphpad Prism 6 软件分析处理,组间两两比较采用最小显著性差异法(LSD)-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 蛋白质浓度测定及SDS-PAGE电泳检测:提取的多头带绦虫成虫和幼虫蛋白,经Bradford 法测定蛋白质浓度和总蛋白质量(表2),通过SDS-PAGE检测蛋白,从图1可以看出,提取的蛋白质条带清晰,符合下一步质谱分析需求。
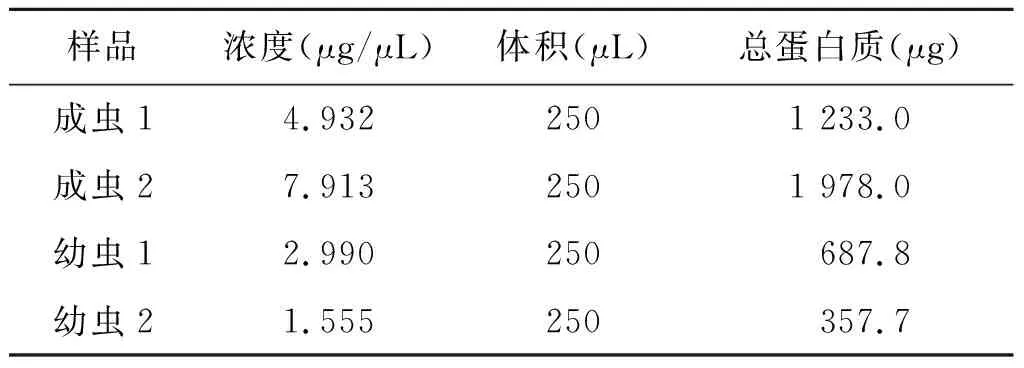
表2 多头带绦虫成虫和幼虫蛋白质的浓度Tab.2 Concentrations of proteins from of T.multiceps adults and larvae
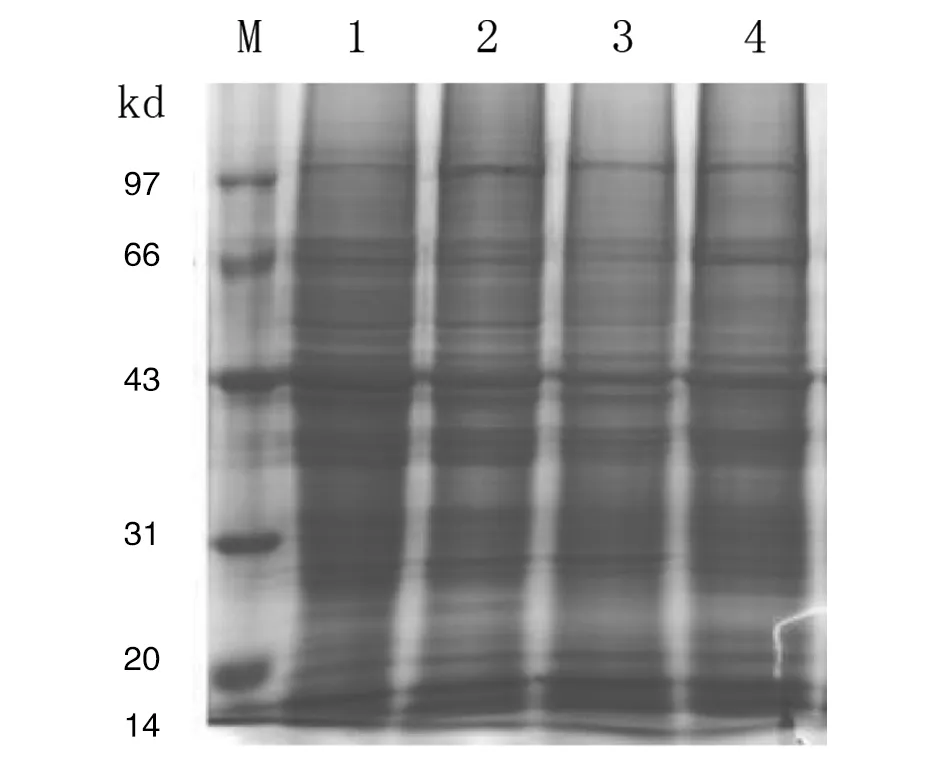
注:M:蛋白质标记物;1—2成虫; 3—4幼虫。图1 多头带绦虫成虫和幼虫蛋白质SDS-PAGE电泳结果Fig.1 SDS-PAGE electrophoresis profiles from T. multiceps adults and larvae
2.2 多头带绦虫蛋白质鉴定信息的质谱分析 从多头带绦虫成虫和幼虫共鉴定获得684个蛋白质,其中蛋白质质量在20~60 kDa为 472个,占全部鉴定蛋白的69.00%;蛋白质质量在60~100 kDa为109个,占全部鉴定蛋白的15.93%。在相对定量时,如果同一蛋白质的量在两个样品间没有显著的变化,那么其蛋白质丰度比接近于1。当蛋白的差异丰度比即差差异倍数达到1.5倍以上,且经统计检验LSD-t=-1.15,P<0.05,视该蛋白为不同样品间的差异蛋白。对每个蛋白质差异倍数以2为底取对数后作出分布图如图2。以此判定存在显著差异的有130个蛋白。其中相对于幼虫,成虫期上调蛋白数量为69个,下调蛋白61个。上调蛋白为副肌球蛋白,果糖-1,6-二磷酸酶,亮氨酰肽酶,钙结合蛋白,六钩蚴蛋白Tso22c,热休克蛋白70,8 kDa糖蛋白,肌球蛋白轻链,钙调蛋白等;下调蛋白为抗原cC1,钙蛋白酶,膜联蛋白B3,皮层蛋白,糖脂转移蛋白,微管相关蛋白,乳酸脱氢酶B,氨基酰化酶,xpa-结合蛋白等。
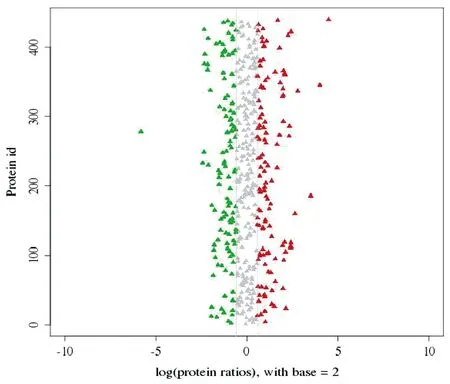
注:该图显示可定量的所有蛋白质的差异倍数的分布情况,其中横坐标表示差异倍数经过以2为底数的对数转化后的值。大于0的为表达量上调,小于0的为表达量下调。其中差异倍数大于1.5的点用红色和绿色标出(红色为表达量上调,绿色为表达量下调)。图2 蛋白质丰度比分布Fig.2 Protein ratio distribution
2.3 生物信息学分析及功能注释 对鉴定出的所有蛋白进行GO功能注释分析,通过protein2go针对3个本体:生物进程、细胞组成及分子功能中所涉及到各条目的分布情况,结果显示生物进程中16.40%的蛋白涉及细胞过程、13.75%的蛋白参与代谢过程;细胞组成中参与细胞和细胞组分的蛋白各占27.39%,两者占据了细胞组成中总蛋白数一半以上的比例;特别值得注意的是,分子功能中有一半以上(51.17%)是具有结合功能的蛋白,其次比例较高的34.27%的蛋白具有催化活性(图3)。在25个 COG分类中,数量最多的是通用功能预测的蛋白,接下来依次是参与翻译后修饰、蛋白质转换、伴侣及翻译、核糖体结构和生物发生的蛋白。将差异表达的蛋白进行代谢路径注释,表3 列举了数量较多的20个路径,其中参与代谢途径的差异蛋白数量最多(116,22.01%)。

表3 20个数量较多的差异表达蛋白质途径注释Tab.3 Top 20 pathway annotations for differentially expressed proteins
2.4 筛选差异蛋白序列做qRT-PCR 将多头带成虫和幼虫差异蛋白配比到已知多头带绦虫基因组序列上,得到对应的CDS序列,依据其序列随机选取5个上调蛋白(CL4425.Contig1/Tmu008054、CL4866.Contig1/Tmu01091、Unigene968/Tmu-000235、CL5675.Contig1/Tmu006666、Unigene5259/Tmu008659),5个下调蛋白(Unigene1651/Tmu002472、Unigene687/Tmu002004、Unigene728/Tmu003244、Unigene1485/Tmu009112、Unigene913/Tmu004362)设计qRT-PCR引物(表1),选择β-tublin(CL1614.Contig2/Tmu007343)基因作为内参基因,以幼虫为对照,计算2-(ΔΔCt)值。结果表明,相对于幼虫期,成虫期上调表达蛋白及下调表达蛋白与蛋白组差异表达分析结果基本相似(图4)。

(A)为生物学进程,(B)为细胞成分,(C)为分子功能图3 利用基因本体(GO)对蛋白质功能进行分类。蛋白质分为生物学、细胞成分、分子功能3种本体论过程Fig.3 Classification of protein functions by Gene Ontology (GO). Proteins were classified into three ontologies: biological process, cellular component, and molecular function

①P<0.05,②P<0.01,③P<0.001。图4 qRT-PCR验证多头带绦虫成虫与幼虫部分蛋白在基因转录水平的表达Fig.4 qRT-PCR confirmed the expression of a part of proteins in adult/larva T.multiceps at gene transcription level
3 讨 论
多头带绦虫的生活史需要经历两个宿主,成虫寄生于犬、狼等终末宿主的小肠,当成熟孕节随粪便排出体外后,被中间宿主羊吞食,虫卵在肠道消化液的作用下,六钩蚴逸出钻入肠壁血管并随血流到达脑和脊髓中,逐渐生长发育为脑多头蚴包囊。当犬等吞食了含有脑多头蚴的大脑后,原头蚴附着在小肠壁上逐渐发育,经41~73 d发育为成虫。众所周知,脑多头蚴对中间宿主神经系统大脑具有独特的偏好性,显然决定寄生虫寄生去向的根本原因是其与宿主蛋白的复杂调控作用。Podesta 等[13]认为扁型动物门寄生虫蛋白质的合成在转录后受到控制,并且这些细胞内调节机制被宿主免疫反应的效应器激活或抑制,显然这种时相特异性蛋白对于寄生虫适应宿主尤为重要。
因寄生虫在不同发育阶段表达虫体蛋白的差异和独特的生活史,其对宿主的选择性、致病性具有较大差异,将iTRAQ技术运用于寄生虫蛋白质组学研究,能有效找出不同阶段寄生虫表达的差异蛋白及感染后宿主表达的差异蛋白,并能对其进行高精度定量分析,这对进一步探索寄生虫生活史、研究与宿主的互作机制提供了技术支撑,同时对寄生虫病的快速诊断及治疗,寻找新的药物靶点等具有重要意义[14]。
前期我们研究小组通过双相电泳结合质谱分析初步鉴定了脑多头蚴原头节蛋白,鉴定的蛋白有抗氧化蛋白(苹果酸脱氢酶和烯醇化酶)、分子伴侣蛋白(热休克蛋白60和小热休克蛋白)以及一些结构蛋白(肌动蛋白、肌动蛋白调节蛋白和副肌球蛋白),这些蛋白参与催化、结合、代谢、分子进程及应急反应[15]。本研究通过iTRAQ 技术比较分析了多头带绦虫和幼虫差异表达蛋白,结果发现相对于幼虫期,成虫期69个上调表达的蛋白中,有35个六钩蚴蛋白Tso22c肽段,24个热休克蛋白60(Hsp60)肽段,20个副肌球蛋白肽段,12个8 kDa糖蛋白肽段,3个热休克蛋白70(Hsp70)肽段,以上结果可以看出Hsp60、副肌球蛋白、Hsp70在成虫期表达是富集的,且表达量是上调的,研究证实寄生虫可通过产生Hsp70来减少温度改变和氧化应激等反应对其造成的损伤,从而适应新的寄生环境[16],另外,最新研究发现副肌球蛋白可作为犬盘尾丝虫病血清诊断的候选生物标志物[17]。而相对于幼虫,61个成虫期下调表达的蛋白中钙蛋白酶的肽段数为20 个,抗原cC1和Ca2+转运ATP酶质膜各自分别鉴定出12个肽段。因为寄生在终末宿主肠道中的成虫,不仅需要适应复杂的肠道环境,还要快速生长发育,钙依赖性的蛋白酶是一类在多种生物体内广泛表达的蛋白酶,且与多种生理功能和病理过程如局部脑缺血和神经退行性疾病等相关。研究表明钙蛋白酶在棘球绦虫侵袭、迁移及免疫逃避中发挥重要作用,可能将是抗棘球蚴病药物和疫苗研究的理想靶标分子[18]。因此,我们推测以上差异表达蛋白可能在多头带绦虫具有相似的功能。
值得注意的是,本研究中鉴定的多头带绦虫路径注释的差异蛋白中总计约30%的蛋白参与代谢途径和次生代谢物的生物合成,我们发现差异蛋白注释路径与一些神经系统退行性或神经功能障碍的疾病如阿尔茨海默病、亨丁顿舞蹈症、帕金森病有关,不同的是脑多头蚴病是由感染寄生虫引起的一种神经系统寄生虫病,尽管目前的研究无法解释多头带绦虫寄生偏好性,但是当前的研究无疑对多头带绦虫不同阶段生长发育关键蛋白的探索提供实验依据和思路。
利益冲突:无
