2型糖尿病患者血清lncRNA MALAT1表达水平与视网膜病变的关系△
2022-12-28邱煜焱苟文军刘思源康海军刘灵琳
邱煜焱 杨 旭 苟文军 刘思源 康海军 刘灵琳
视网膜病变是2型糖尿病(T2DM)的常见并发症之一,发生率约为30%[1]。糖尿病视网膜病变(DR)的发病机制尚未完全明确,可能与免疫炎症和氧化应激损伤、线粒体损伤、血管内皮祖细胞功能障碍等有关[2]。长链非编码RNA(lncRNA)是一类转录本长度超过200 nt的RNA分子,在表观遗传调控、转录调控和转录后调控中起到重要作用。研究表明,lncRNA在DR发生和发展中有重要意义[3]。血清lncRNA表达异常在预测DR发生中的价值也逐渐受到重视。如许瑶等[4]研究发现,lncRNA非活性特异性转录本在DR患者血清中表达水平下降,有可能成为预测DR的良好分子标志物。人肺腺癌转移相关转录本1(MALAT1)最早在肺癌中被报道[5],后来逐渐发现MALAT1与炎症、氧化应激、血管生成和细胞凋亡等有关,也被证实在糖尿病并发症(心肌病和肾病)中起到重要作用[6]。在体外研究中发现,高糖处理人视网膜微血管内皮细胞后MALAT1表达水平升高,敲低MALAT1后细胞增殖、迁移和血管通透性明显受到抑制[7]。既往有关DR患者外周血MALAT1的表达及意义的报道较少。本研究分析T2DM患者血清lncRNA MALAT1与DR的关系,旨在为DR的早期诊断提供依据。
1 资料与方法
1.1 一般资料回顾性分析2019年1月至2021年6月本院184例(368眼)T2DM患者的临床资料,其中T2DM无并发症患者54例(非DR组),T2DM合并非增生型DR患者62例(非增生组),T2DM合并增生型DR患者68例(增生组)。纳入标准:(1)符合《中国2型糖尿病防治指南(2017年版)》[8];(2)年龄>18岁;(3)临床资料完整。排除标准:(1)T1DM患者;(2)严重的心、肝、肾功能障碍;(3)急、慢性感染;(4)免疫和代谢疾病;(5)肿瘤;(6)青光眼、白内障、屈光改变等眼部疾病;(7)妊娠期或哺乳期妇女。本研究已经过医院伦理委员会批准,所有受试者均签署知情同意书。
1.2 方法
1.2.1 临床资料采集收集患者性别、年龄、体重指数、糖尿病病程、高血压病史、高脂血症病史、吸烟和饮酒史等一般资料。用全自动生化检测仪检测患者谷丙转氨酶(AST)、谷草转氨酶(ALT)、血肌酐(Scr)、血尿酸(SUA)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖(FPG)。用酶联免疫吸附实验检测患者白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)。用化学发光免疫分析法检测患者空腹胰岛素(Fins),计算胰岛素抵抗指数(HOMA-IR)=(FPG×Fins)/22.5。用离子交换高效液相色谱法检测患者糖化血红蛋白(HbA1c)。
1.2.2 眼底检查所有患者入院时均接受眼底检查,用眼底检查仪对每眼各采集6个视野的45°眼底像。非增生型DR:仅见到微动脉瘤或者4个象限内有2处以上视网膜内出血,或者2个以上象限有视网膜静脉串珠样改变,或者1个以上象限有明显视网膜内微血管异常。增生型DR:有明显新生血管形成,视网膜前出血或者玻璃体积血[9]。
1.2.3 实时荧光定量PCR检测患者血清MALAT1表达水平所有患者均于入院次日抽取空腹肘静脉血,4 ℃、3000 r·min-1条件下离心15 min,留取血清。用Trizol法提取总RNA。将2 μg总RNA加入20 μL三氯甲烷中,用逆转录试剂盒(北京天根生化科技有限公司)将RNA反转录为cDNA,最后进行PCR扩增。反应条件:94 ℃ 10 min,94 ℃ 45 s,60 ℃ 45 s,72 ℃ 45 s,共40个循环。引物序列:MALAT1正向引物序列为5’-AAAGCAAGGTCTCCCCACAAG-3’;反向引物序列为5’-GGTCTGTGCTAGATCAAAAGGCA-3’;β-actin正向引物序列为5’-GGAGCGAGATCCCTCCAAAAT-3’;反向引物序列为5’-GGCTGTTGTCATACTTCTCATGG-3’。以β-actin为内参,用2-ΔΔCt计算患者血清MALAT1相对表达量。
1.3 统计学方法采用SPSS 20.0软件进行统计学分析。计量资料用均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;计数资料的组间比较采用χ2检验;相关性用Pearson分析;二元Logistic回归分析T2DM患者发生DR的影响因素;采用受试者工作特征曲线(ROC)分析MALAT1预测DR的价值,计算曲线下面积(AUC)、灵敏度和特异度。检验水准:α=0.05。
2 结果
2.1 三组患者临床资料比较增生组、非增生组、非DR组患者年龄、病程、LDL-C、HbA1c、HOMA-IR、IL-6、TNF-α和MALAT1差异均有统计学意义(均为P<0.001);增生组和非增生组患者以上各指标均高于非DR组(均为P<0.05),且增生组均高于非增生组(均为P<0.05)。其余资料三组间比较差异均无统计学意义(均为P>0.05)(表1)。

表1 三组患者临床资料比较
2.2 MALAT1与患者临床指标的相关性分析MALAT1与患者病程、LDL-C、HbA1c、HOMA-IR、IL-6、TNF-α均呈正相关(均为P<0.05),但是与ALT、AST、Scr、SUA、TC、TG、HDL-C、FPG均无相关性(均为P>0.05)(表2)。
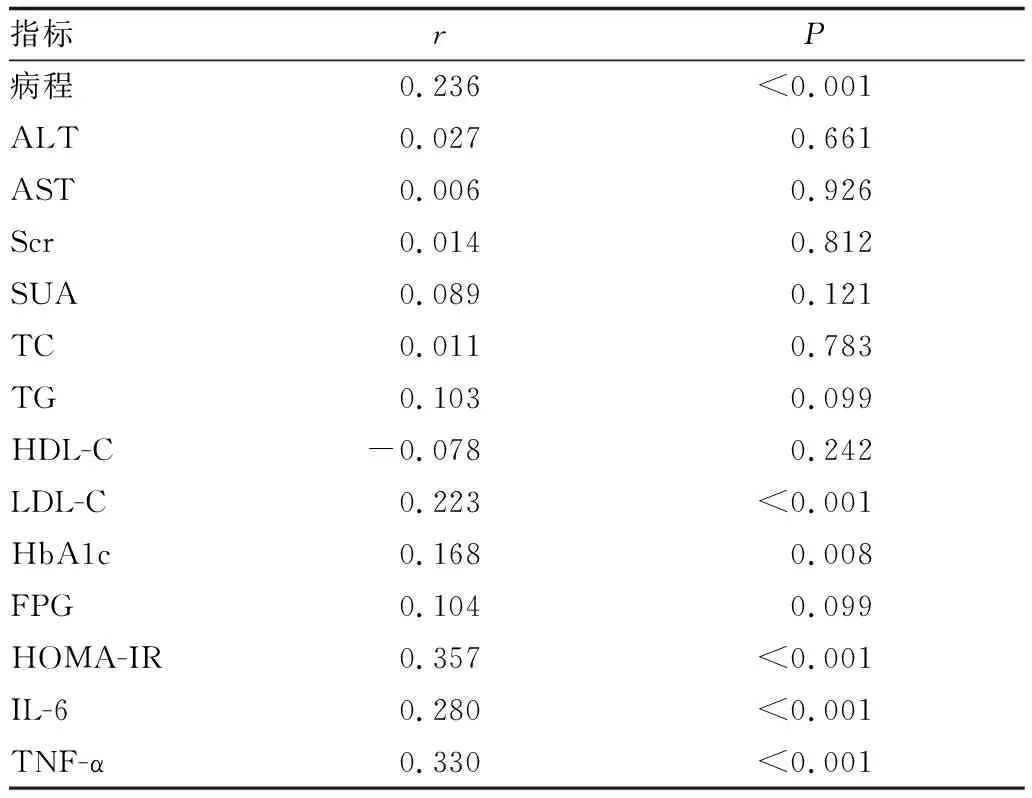
表2 MALAT1与患者临床指标的相关性分析
2.3 T2DM患者发生DR的影响因素分析以是否发生DR为因变量,以表1中存在统计学差异的变量(年龄、病程、LDL-C、HbA1c、HOMA-IR、IL-6、TNF-α和MALAT1)为自变量,进行二元Logistic回归分析。结果显示,年龄、病程、LDL-C、HbA1c、HOMA-IR、IL-6、TNF-α和MALAT1是T2DM患者发生DR的独立影响因素(均为P<0.05)(表3)。
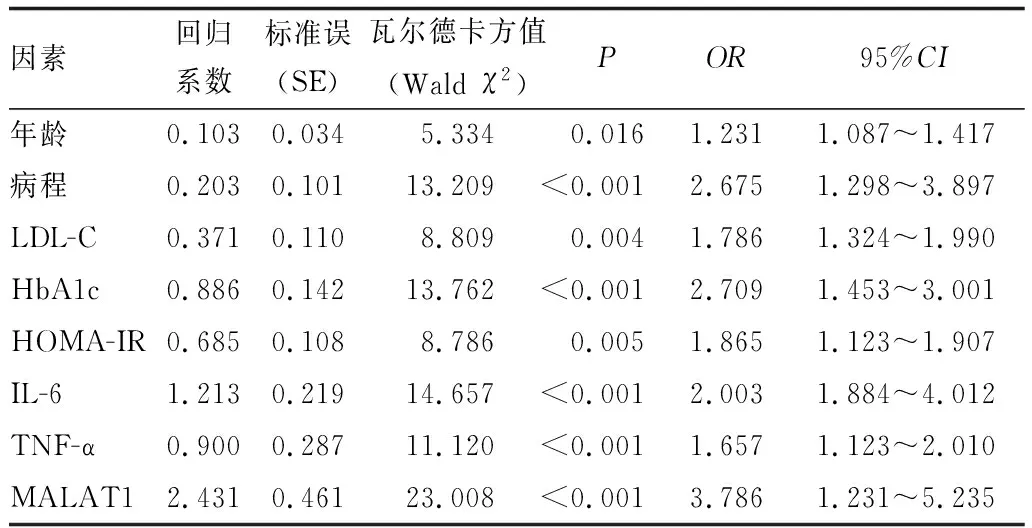
表3 T2DM患者发生DR的影响因素分析
2.4 ROC曲线分析血液指标预测T2DM患者发生DR的价值MALAT1预测T2DM患者发生DR的AUC为0.843,高于LDL-C(0.464)、HbA1c(0.606)、HOMA-IR(0.601)、IL-6(0.663)、TNF-α(0.694)。MALAT1预测T2DM患者发生DR的灵敏度和特异度分别为89.34%和71.55%(表4)。说明MALAT1预测T2DM患者发生DR的价值较高。
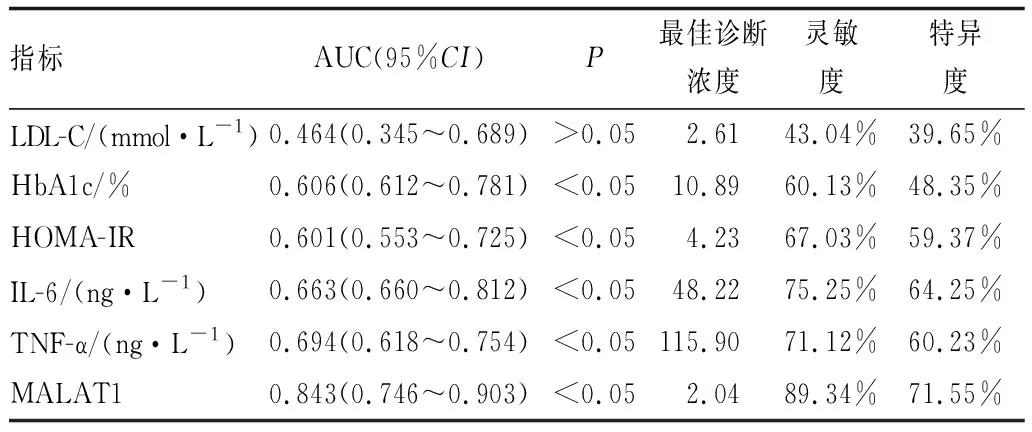
表4 血液指标预测T2DM患者发生DR的价值
3 讨论
lncRNA在表观遗传调控、转录调控和转录后调控中起重要作用,在血液和尿液等体液中表达相对稳定[10]。研究显示,糖尿病及相关微血管并发症中广泛存在lncRNA表达异常,lncRNA可能成为DR的诊断标志物和治疗靶点[11]。
MALAT1最初是在非小细胞肺癌中被发现的,随后也在心脏病和糖尿病中被报道。MALAT1位于人染色体11q13.1上,该基因产生一个高度保守的非编码转录本,其长度约8000个核苷酸。MALAT1与胰岛素抵抗和糖脂代谢关系密切,参与糖尿病的发生发展[12]。既往研究显示,MALAT1与糖尿病微血管并发症有关[13]。近年来研究表明, MALAT1可能通过p38分裂原激活蛋白酶信号通路[14]、miRNA-125b/血管内皮钙黏蛋白信号通路[7]、炎症信号通路[15]等参与DR的发生发展。然而, DR患者外周血MALAT1的表达及意义既往鲜有报道。
本研究结果表明,增生组和非增生组患者血清MALAT1均高于非DR组,且增生组患者高于非增生组,提示MALAT1可能参与DR的发生和病情进展。免疫炎症紊乱是DR发生发展的重要原因。有研究发现,DR患者血清和玻璃体内炎症因子IL-6、IL-8、单核细胞趋化蛋白-1和TNF-α表达水平均升高[16]。本研究结果表明,MALAT1与IL-6(r=0.280)、TNF-α(r=0.330)均呈正相关(均为P<0.001)。提示MALAT1可能通过免疫炎症损伤影响DR进展。本研究中多因素分析结果进一步证实,MALAT1(OR=3.786)是T2DM患者发生DR的独立影响因素。既往研究表明,MALAT1可能成为糖尿病相关并发症(心血管病、肾病、胃病)的诊断和治疗靶点[13]。本研究用ROC曲线分析了MALAT1对DR的预测价值,结果显示,MALAT1预测T2DM患者发生DR的AUC为0.843,均高于LDL-C(0.464)、HbA1c(0.606)、HOMA-IR(0.601)、IL-6(0.663)、TNF-α(0.694),MALAT1预测T2DM患者发生DR的灵敏度和特异度分别为89.34%和71.55%,结果提示预测价值较高。
综上所述,T2DM患者发生DR时血清MALAT1表达水平升高,并且与糖脂代谢、炎症指标及病情进展相关。MALAT1可能是预测T2DM发生DR的生物学指标。未来需要继续分析MALAT1的临床意义及生物学机制,以期开发潜在的诊断和治疗靶点。
