不同启动子eGFP载体在罗氏沼虾活体内的表达效率比较
2022-12-28任晋东牛宝龙楼宝
任晋东,牛宝龙,楼宝
(浙江省农业科学院 水生生物研究所,浙江 杭州 310021)
罗氏沼虾(Macrobrachiumrosenbergii)是世界上最大形的淡水虾之一。原产于印度洋-太平洋热带地区,自1976年引入我国后,产业规模不断扩大,市场需求不断上升,目前已成为我国重要的经济淡水虾类,年均总产值达到80多亿元[1]。罗氏沼虾的性别决定属于ZW型,雌雄个体表型差异较大,雄性个体体形较大,在生长速度、抗病性等方面都有着显著的优势[2],因此,利用生物技术探索罗氏沼虾性别决定机理,对培育罗氏沼虾单性群体具有重要的意义。但由于罗氏沼虾细胞培养技术体系的缺乏,目前常用的脂质体转化、病毒转染进行基因功能研究的方法在甲壳类动物上效率较低[2-3],探索有效的外源基因表达体系是罗氏沼虾发育、繁殖等分子遗传机理研究的基础。
已有相关研究表明,慢病毒表达体系能够携带外源基因进入对虾体内进行表达[4],也有研究进行精子介导的CMV启动子表达质粒能够整合到罗氏沼虾体内基因组中[5],但该研究未进行表达效果验证研究。在虾类疾病-白斑病毒研究过程中,发现其囊膜蛋白VP28启动子IE1在虾类体内具有较强的促转录表达作用[6],节肢类动物家蚕上同名的IE1启动子也有较好的促转录表达效果,但是表达效率不如融合了hr5增强子的IE1转录活性强[7],而目前关于罗氏沼虾的外源基因高效表达启动子效果的研究尚未有报道。
因此,本文利用当前常用启动子为研究对象构建表达载体,进行活体注射,并通过荧光报告基因和基因转录相对表达量来探索不同启动子在罗氏沼虾活体的表达效率,为罗氏沼虾开展基因功能验证研究提供有效的分子工具。
1 材料与方法
1.1 质粒构建
构建分别包含hr5-IE1、IE1、SV40启动子和下游表达基因eGFP及终止信号的表达质粒(图1)。
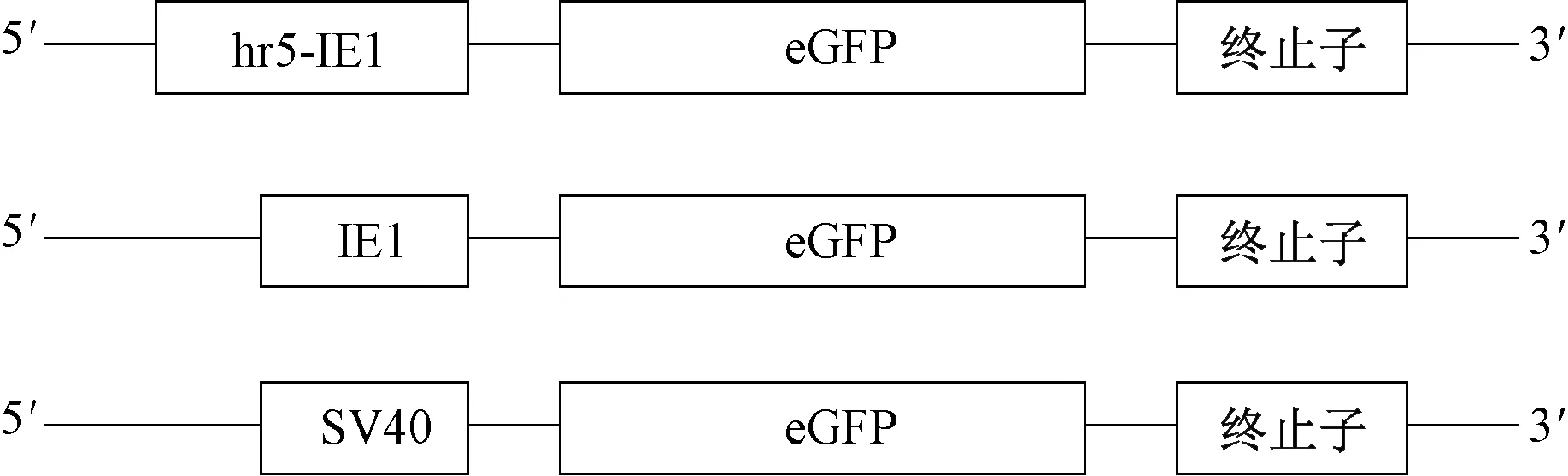
图1 不同启动表达质粒的结构
1.2 活体注射
按照构建的启动子质粒分3个组别和1个对照组,每组选择6只体重为5~7 g的罗氏沼虾个体注射表达质粒,对照组注射同样体积的PBS作为参照。注射部位选择头胸甲与后驱间的肌肉组织,注射量为每克体重1 μg的DNA浓度标准进行注射,注射12 h后采集所有个体肌肉组织,并立即置于液氮中用于后续分析。
1.3 组织荧光检测及定量分析
利用绿色荧光灯在黑色背景下检测各个组别样品的荧光特性。利用全式金Trizol UP试剂盒,提取各样品总RNA。并利用诺唯赞RT-PCR试剂盒反转录合格RNA样品,20 μL体系添加总RNA量控制在1 μg以内。
以β-Actin基因为内参基因,对eGFP基因表达量进行qPCR定量分析,qPCR引物序列如表1所示。按照10 μL 2×Mix buffer,2 μL Primer-F,2 μL Primer-R,2 μL cDNA和4 μL高纯水配制成20 μL的qPCR反应体系,利用Bio-Rad的CFX96型qPCR仪进行所有样品的两步法定量反应,程序运行结束记录所有样品β-Actin和eGFP基因Ct值用于后续统计分析。

表1 基因表达量qPCR用引物的序列
1.4 相对表达量统计分析
利用各样品测定的eGFP和β-Actin基因Ct值计算,以对照组为内参计算各组别内所有样品eGFP基因相对表达量2-ΔΔCt值。利用方差分析比较不同组间的相对表达量差异。
2 结果与分析
2.1 荧光检测
对实验个体注射12 h后,利用绿色荧光检测设备进行罗氏沼虾活体检测,结果表明,携带hr5-IE1启动子的样品组荧光亮度最大,IE1启动子组注射个体仅有微弱荧光,SV40和对照组看不到荧光效果(图2)。

图2 不同启动子组个体活体注射后的荧光检测
2.2 定量分析
对注射个体以对照组为参照,以β-Actin基因为内参对3个不同启动子组质粒注射个体eGFP基因表达量进行比较分析,结果表明,hr5-IE1组eGFP基因的相对表达量极显著高于SV40组,显著高于IE1组,而IE1组也显著高于SV40组(图3)。

*和**分别表示差异达到显著(P<0.05)和极显著(P<0.01)水平。图3 不同启动子组eGFP相对表达量比较结果
3 小结与讨论
同一个启动子在不同物种之间存在着显著转录效率和关键保守域上的差异[8],也具有在不同物种之间活化和引导特异性RNA聚合酶进行下游基因表达的调控功能[9]。因此,进行不同物种启动子转录活性研究是进行外源基因体内表达的重要依据。罗氏沼虾作为重要的淡水养殖生物,特别是其单基因调控性别决定机制的独特性,成为性别决定分子机制研究的重要对象。而本文章通过对常见节肢动物启动子IE1、hr5-IE1及Sv40携带外源基因表达效率的研究,筛选出了罗氏沼虾活体表达更加高效的启动子。
IE1是罗氏沼虾白斑病毒研究中发现的在其体内复制组装的关键调控元件[10],并且在家蚕等动物中都具有转录外源基因的活性[7],瞬时转录活性较家蚕肌动蛋白Actin4(A4)、α微管蛋白、丝素H链(Fib-H)启动子较弱[11],在家蚕遗传转化研究中其转录活性也较hr5-IE1有所下降,该结果与本研究结果一致,表明插入了增强子hr5的IE1启动子携带外源基因进行转录表达的效率显著提高,也表明hr5这个来源于苜蓿丫纹夜蛾核型多角体病毒的转录调控元件[12],在罗氏沼虾水生动物体内也具有增强下游启动子的功能,和RNA聚合酶结合增强表达的效率可以达到219%以上。
SV40启动子是来源于哺乳动物猿猴病毒40的启动子,是哺乳动物分子生物工程重要的强启动元件[13],也在植物细胞中具有转录启动活性[14],在水生动物上的转录启动活性还未见报道,在本研究中该启动子和对照组不具有启动外源基因在罗氏沼虾体内进行转录表达的作用,因此,在罗氏沼虾体内进行外源基因表达研究时建议不作为主要考虑启动子,而IE1启动子和含有hr5增强子的启动子可以重点考虑,但对于hr5为何在罗氏沼虾体内具有增强IE1启动子转录活性的作用机制还尚不清楚,还需进一步探索研究。
