雄激素受体相互作用因子在前列腺癌中的表达及其临床意义
2022-12-27曾卫湘张建文张剑波
曾卫湘,张 颖,张建文,邓 琼,梁 辉,张剑波,王 铸
(1.河源长安医院泌尿外科,广东河源 517000; 2.南方医科大学附属深圳龙华医院泌尿外科,广东深圳 518109)
前列腺癌(prostate cancer, PCa)是最常见的男性恶性肿瘤之一[1]。雄激素剥夺治疗(androgen deprivation therapy,ADT)可以有效减缓肿瘤进展、提高患者生活质量,但是随着病程进展,激素依赖型转化为去势抵抗前列腺癌(castration-resistant prostate cancer,CRPC)[2-3]。研究表明,多种细胞因子、激酶以及下游级联信号因子通过雄激素受体(androgenreceptor,AR)相互作用或雄激素非依赖途径促进肿瘤细胞生长[2]。在低水平激素环境下其他替代途径,包括MAPK通路、Wnt/β-catenin以及c-Myc等信号在促进CRPC转化过程中也发挥重要作用[2, 4]。目前针对AR介导的CRPC转化,人们已开发了多个靶向药物,如AR拮抗剂恩杂鲁胺、雄激素合成关键酶CYPl7阻断剂阿比特龙、PARP抑制剂等[5-6];多靶点药物如Cabozantinib封闭c-Met、VEGFR2、KIT等多个蛋白[7];Galeterone同时阻断AR及CYPl7A1活性[8],但是针对AR相互作用因子的综合性研究尚鲜见报道。本研究筛选了AR及其9个相互作用因子,系统分析了AR及其相互作用因子在PCa中的表达及其与患者预后的关系,揭示了其相互作用及GO功能富集,为PCa进展机制研究及其预后评估提供了一定的依据。
1 材料与方法
1.1 STRING 分析STRING数据库(http://string-db.org/)是一个旨在收集、评估和整合蛋白质之间相互作用的网络平台。目前该数据库存储约14 094个物种的6 760万个蛋白质,有超过20亿个蛋白相互作用信息。本研究通过STRING数据库分析AR蛋白相互作用网络,其中不同颜色连线代表相互作用确定的不同依据,包括基于认证过的数据库、实验验证、基因邻近、共表达、同源推测和文本挖掘等。基本参数设置为Interaction score 大于0.4,物种设定为 Homo sapiens。
1.2 UALCAN 分析UALCAN(http://ualcan.path.uab.edu)是一个用于分析癌症组学数据的全面、交互式网络平台。UALCAN可访问包括TCGA和CBTTC等数据库,可提供诸如描述蛋白质编码、miRNA编码和lincRNA编码基因的表达谱和患者生存信息的图表和绘图等功能。本研究利用从癌症基因组图谱(The Cancer Genome Atlas,TCGA)项目获得的数据,输入Prostatecancer,获得正常对照组样本52例,肿瘤样本497例,分别比较分析了AR及其相互作用因子基因在对照组以及肿瘤组中的表达水平。
1.3 cBioPortal分析cBioPortal(https://www.cbioportal.org/)是基于TCGA数据库,集数据挖掘、数据整合及可视化的综合性开放平台。整合了包括TCGA,GEO和ICGC等肿瘤研究项目。数据类型包括体细胞突变、DNA copy-number alterations(CNAs)、mRNA和microRNA(miRNA)表达、DNA甲基化、蛋白质富集、磷酸化蛋白富集等。本研究以prostatecancer为关键词提取了全部16个PCa相关研究的基因测序数据,总计5 937例患者的6 222个样本。分析了AR及其相互作用因子在不同类型PCa样本中的表达变异情况及其总生存率。
1.4 GO富集分析GO Term分为3大类,每一类从不同的层面解释基因的生物学功能,分别包括生物途径(biology process,BP)、分子功能(molecular function,MF)、细胞组分(cellular component,CC)3部分。横坐标富集指数为Log10(observed/expected),表示该GO term的富集强度。使用Benjamini-Hochberg程序对每个类别内的多次试验进行校正,P<0.05为差异具有统计学意义。
2 结 果
2.1 AR及其相互作用因子的蛋白相互作用网络STRING分析显示,AR与NCOR1、NCOR2、NCOA2、NRIP1、RAN、EP300、SOX9、PXN以及TNK2的相互作用均经过实验验证并有相关文献验证(图1)。其相互作用网络节点为10,边数21,平均节点度4.2,平均局部聚类系数0.89,预期边数4,PPI富集(P<0.000 1)。
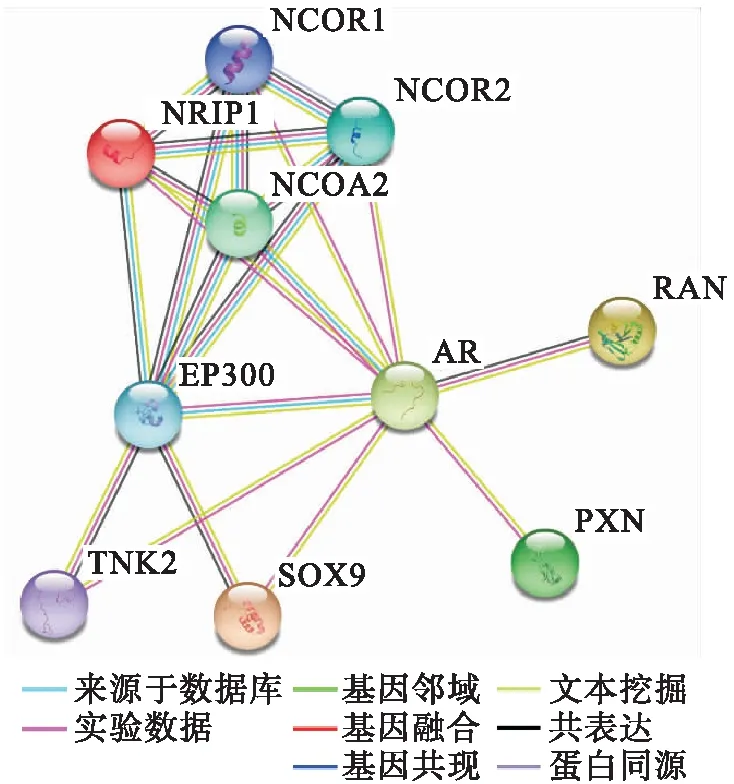
图1 AR及其相互作用因子的STRING蛋白相互作用网络
2.2 AR及其相互作用因子在PCa中的表达水平UALCAN分析显示RAN、TNK2、PXN以及NRIP1在前列腺癌组织中显著上调表达(P<0.05);相反NCOR1在前列腺癌组织中显著下调(P<0.05)。NCOR2、NCOA2、EP300、SOX9、RAN表达水平改变不显著(图2)。
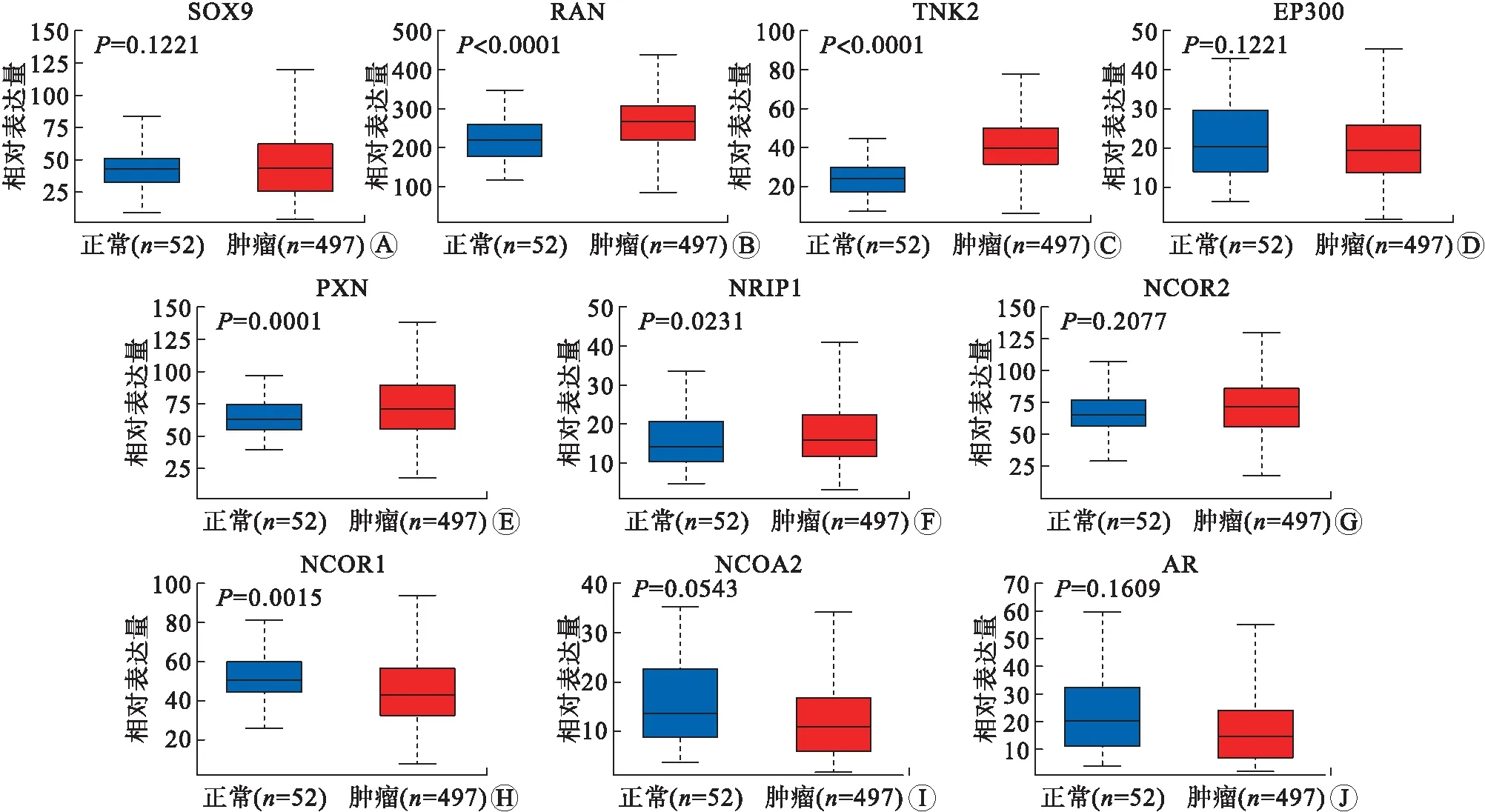
A:SOX9;B:RAN;C:TNK2;D:EP300;E:PXN;F:NRIP1; G:NCOR2;H:NCOR1;I:NCOA2;J:AR。图2 AR及其相互作用因子在PCa中的表达
2.3 AR及相互作用因子在不同PCa类型中的变异结果表明,在近30%的各类PCa样本中存在AR及其相互作用因子的表达变异,主要包括基因扩增、基因突变、深度缺失以及多重变异4个类型。其中AR的变异率为18%,主要包括基因扩增和突变。NCOA2的变异率为9%,主要变异类型为基因扩增。在神经内分泌前列腺癌中的变异类型主要表现为基因扩增(8.7%),而在CRPC中则主要表现为基因突变(11.43%,图3)。
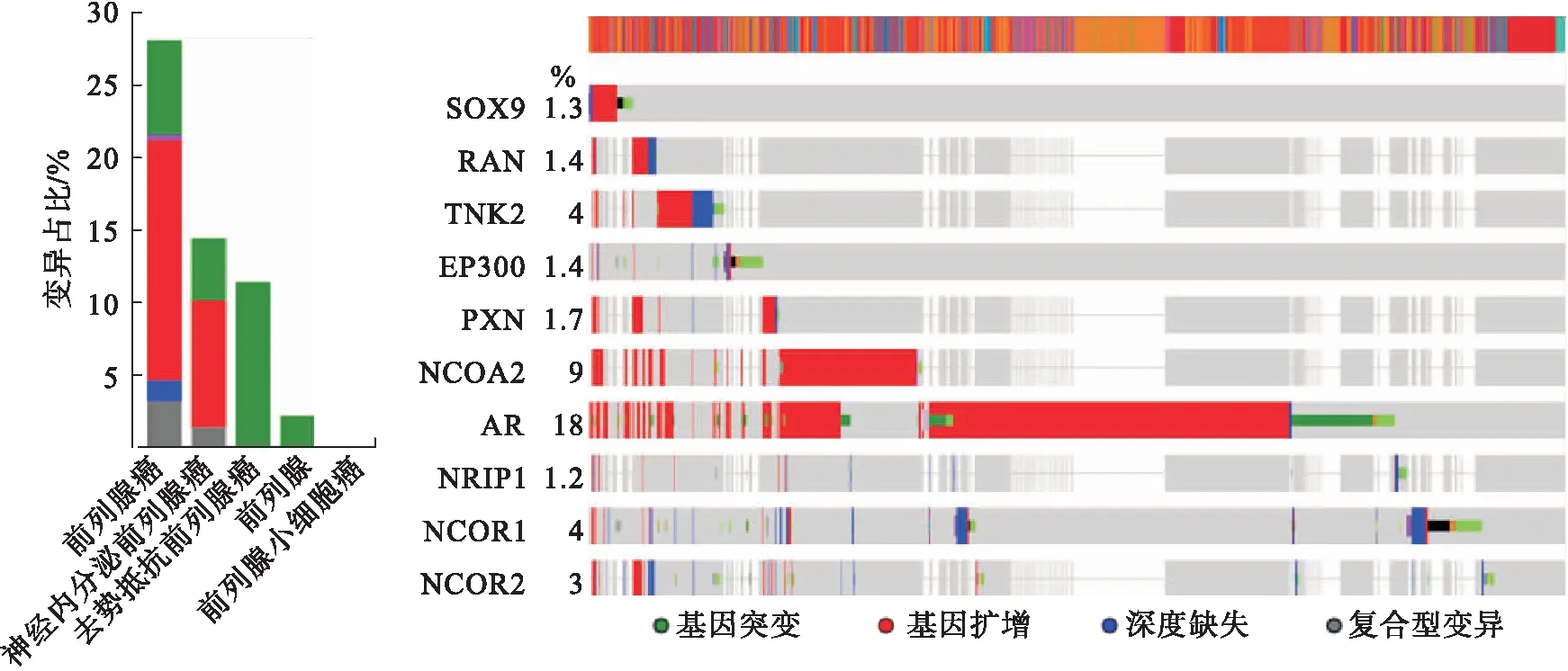
图3 AR及其相互作用因子在PCa中的表达变异分析
2.4 AR及其相互作用因子在不同PCa类型中的表达变异及对预后的影响cBioPortal结果表明,AR的主要变异类型是基因扩增和突变。其中突变主要发生在CRPC:NCOR1突变主要存在于NEPC,而PXN主要存在于CRPC;NCOA2的主要变异类型为基因扩增,主要发生于PCa。其中AR、TNK2、NCOR1、PXN、NCOA2表达异常对患者总生存率均存在显著影响(图4)。
2.5 AR及其相互作用因子变异组对PCa预后的影响结果显示AR及其相互作用因子变异的PCa总生存率显著下降,变异组(n=95)的中位生存期为70个月(95%CI,60~105个月),而未变异组(n=45)的中位生存期为141个月(95%CI,115.13~NA个月)(P<0.001)(图5A);变异组(n=22)无病生存期110.16个月[95%CI,64.66个月未观察到(not available, NA)],未变异组(n=93)无病生存期NA,P=0.010 2(图5B)。
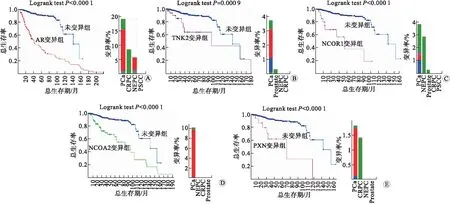
A:AR;B:TNK2;C:NCOR1;D:NCOA2;E:PXN图4 AR及其相互作用因子在不同前列腺癌类型中的变异情况及其对总生存期的影响
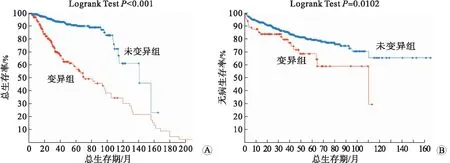
A:总生存期分析;B:无病生存期分析图5 综合分析AR及其相互作用因子变异与前列腺癌预后关系
2.6 AR及其相互作用因子的GO富集见图6。
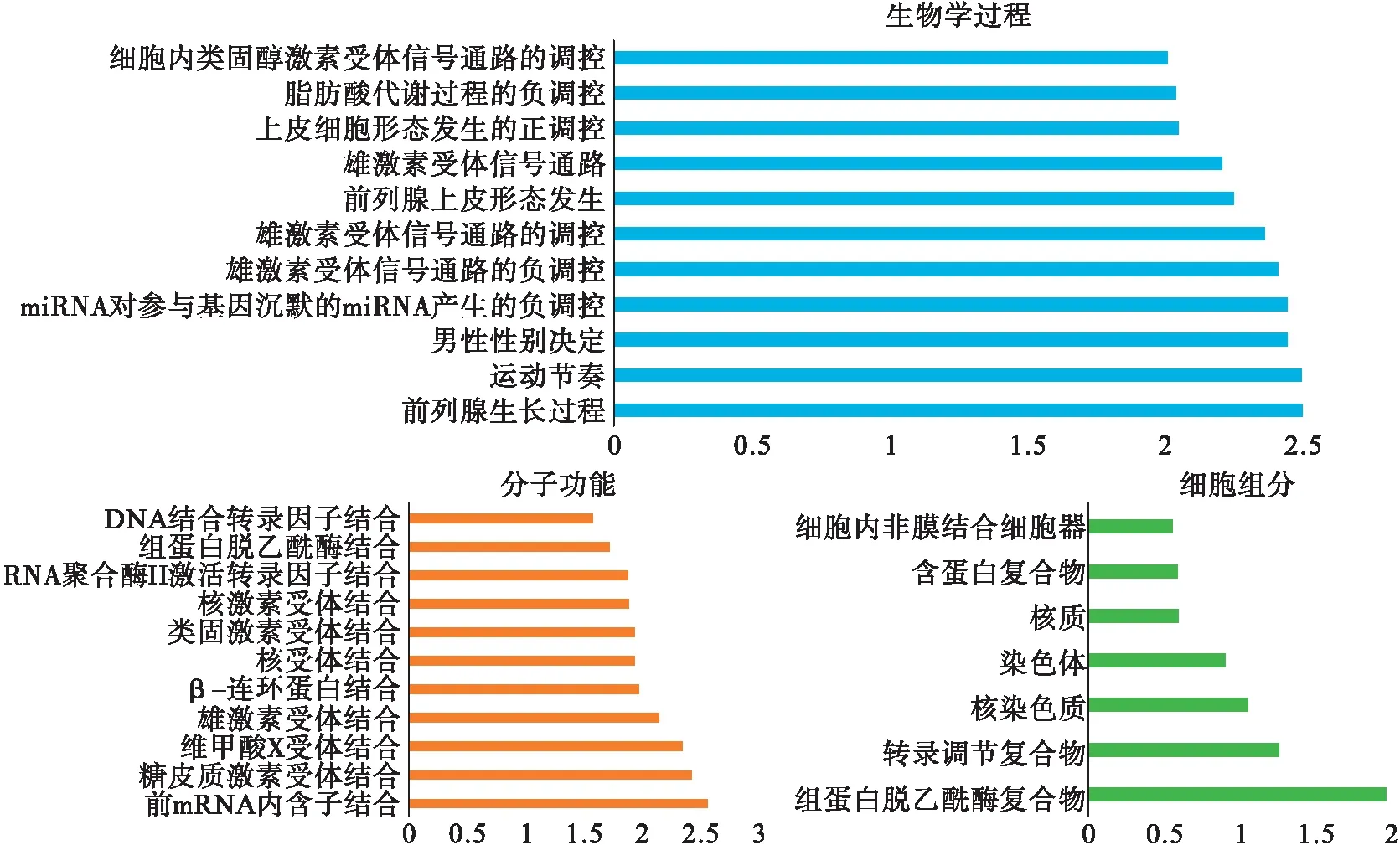
图6 AR及其相互作用因子GO富集分析
GO富集分析显示前列腺生长时pre-mRNA内含子结合以及组蛋白脱乙酰酶复合物具有最高的富集指数。其中,AR和SOX9与前列腺生长有关,SOX9和EP300与pre-mRNA内含子结合有关,而NCOR1、NRIP1以及NCOR2与组蛋白脱乙酰酶复合物相关(图6)。
3 讨 论
AR信号通路的异常活化被认为是PCa进展及复发的关键因素[9]。研究认为CRPC进展机制可概括为AR依赖型和AR非依赖型两种[10]。AR蛋白作为网络的一个节点,在接受抗AR药物阻断后,网络中其他蛋白的信号仍然能够通过其他节点和途径进行传导[4]。除了经典的AR信号通路外,AR旁路以及替代途径是目前研究的难点和热点。目前的研究以及药物开发靶点多集中在阻断AR信号或者雄激素合成途径,但是针对AR相互作用因子的检测或者治疗靶点研究较少,尤其是AR相互作用因子的综合性研究尚鲜见报道。
本研究系统地分析了AR及其9个相互作用蛋白分子在PCa中的表达、相互作用及其对PCa预后的影响。研究发现NRIP1、TNK2、PXN、RAN 4个蛋白在PCa组织中显著上调表达,NCOR1显著下调表达;TNK2、PXN以及NCOR1的表达改变均显著降低总生存率。TNK2作为非受体酪氨酸蛋白和丝氨酸/苏氨酸蛋白激酶,通过磷酸化AR的pTyr(267)位点,促进肿瘤细胞扩散和迁移、细胞存活、细胞生长和增殖[11]。有研究认为通过TNK2抑制剂阻断TNK2,使恩扎鲁胺的PCa细胞致敏,并降低AR和AR-V7水平,可以有效减缓CRPC肿瘤的生长[12];TNK2阻断有望成为靶向PCa干细胞(prostate cancer stem cell, PCSC)的一种新的治疗方法[13];PXN作为核外MAPK信号与雄激素以及生长因子调控的核转录事件之间的关键蛋白,是影响PCa去势敏感和去势抵抗的关键因子[14-15];NCOR1参与PCa细胞线粒体膜电位的维持,NCOR1的低表达有助于PCa的进展[16-17]。因此,靶向TNK2、PXN以及NCOR1在内的AR相互作用因子有望作为ADT治疗的有益补充,进一步减缓CRPC进展。
本研究将AR及其9个相互作用因子的表达及变异进行了综合分析,发现其在PCa中的变异类型主要为基因扩增和基因突变,而且显著降低总生存率以及无病生存期。因此,AR及其相互作用因子的表达及变异有可能作为一个有效指标用来评估PCa的进展及其预后。另外,将AR及其相互作用因子综合分析其GO功能富集,发现富集指数最高的是与前列腺生长相关的pre-mRNA内含子结合以及组蛋白脱乙酰酶复合物等功能。其中,AR和SOX9参与前列腺细胞生长调控,SOX9和EP300与pre-mRNA内含子结合有关;而NCOR1、NRIP1以及NCOR2与组蛋白脱乙酰酶复合物相关。有研究表明组蛋白乙酰转移酶(HATs)和组蛋白脱乙酰基酶(HDACs)催化的蛋白质乙酰化是基因转录的主要表观遗传调控机制[18],因此NCOR1、NCOR2以及NRIP1可能参与了CRPC表观遗传调控过程。
综上所述,AR相互作用因子有望作为AR之外的候选靶点,通过小分子抑制剂阻断AR相互作用因子可作为ADT治疗手段的有益补充;AR及其相互作用因子的综合分析也为揭示CRPC进展的分子机制提供了一定的依据。但是本研究也存在一定的局限性,分析的样本数据来源多个项目研究或者多个数据库,不同研究在数据采集和处理方面可能存在一定的差异;研究结论有待实验研究和大规模临床数据进一步的验证。
