胡桃夹综合征的诊断和治疗策略
2022-12-27何大立
张 波,何大立,焦 勇
(空军军医大学唐都医院泌尿外科,陕西西安 710038)
胡桃夹综合征(nutcracker syndrome, NCS),也称左肾静脉受压综合征,用于描述腹主动脉(abdominal artery, AA)与肠系膜上动脉(superior mesenteric artery, SMA)之间的夹角压迫左肾静脉,使其血液回流受阻,导致左肾静脉高压,从而引起腹部静脉淤血的症状和体征。随着人们对该疾病的不断了解,更多NCS的类型被逐渐发现,包括前位NCS与后位NCS,以及其他更为罕见的类型。由于目前缺乏统一诊断标准,NCS的发病率尚不明确。虽然传统认为女性多发,但最新研究显示不同性别的发病率无明显差异[1]。此外,NCS的临床表现多种多样,除了常见的血尿、蛋白尿、左侧腰腹疼痛之外,还有许多其他未被充分认识的临床症状。保守治疗为该疾病的主要治疗方案之一,当疾病进展或严重影响患者生活质量时,需积极采取外科干预。本文就NCS的发病机制、临床表现、诊断策略及治疗进展等几个方面进行论述。
1 发病机制
左肾静脉长约6~10 cm,接受来自左肾、输尿管、左肾上腺静脉、左性腺静脉以及腰静脉的血液回流。正常解剖情况下,左肾静脉穿行于AA与SMA夹角下方注入下腔静脉,该夹角通常在80°~190°;AA与SMA之间有丰富的脂肪、淋巴结和神经纤维丛填充,在此状况下左肾静脉回流通畅,无受压情况。但在某些情况下,如儿童青春期身高快速增长、脊柱纵行延展过快,导致AA与SMA夹角缩小,卡压左肾静脉,使其血液回流受阻,造成左肾静脉内高压状态,从而容易产生一系列临床症状。最典型的类型就是AA和SMA之间的左肾静脉受压,称为前位NCS;当变异的左肾静脉穿行于AA和脊柱之间受到挤压时,称为后位NCS。除了以上两种类型之外,还有一些更为罕见的NCS类型,如双下腔静脉NCS,环主动脉NCS等(图1);此外,左肾下垂、高位左肾静脉、肠系膜上动脉走形变异、十二指肠水平部位置过高、胰腺肿瘤、主动脉旁淋巴结病、腹膜后肿瘤、夹角处的纤维淋巴结缔组织绞锁均可导致左肾静脉受压。因此我们认为,对于NCS更准确的定义应描述为“左肾静脉受到各种外源性压迫,引起血液回流受阻,造成左肾静脉高压状态,表现为血尿、蛋白尿、腰腹疼痛、女性盆腔淤血综合征、男性左侧精索静脉曲张、慢性疲劳综合征等,甚至可发展为血栓或慢性肾病(chronic kidney disease,CKD)临床症候群”。需要注意的是,若只有左肾静脉受压而无临床表现者为“胡桃夹现象”,通常被认为是正常变异。
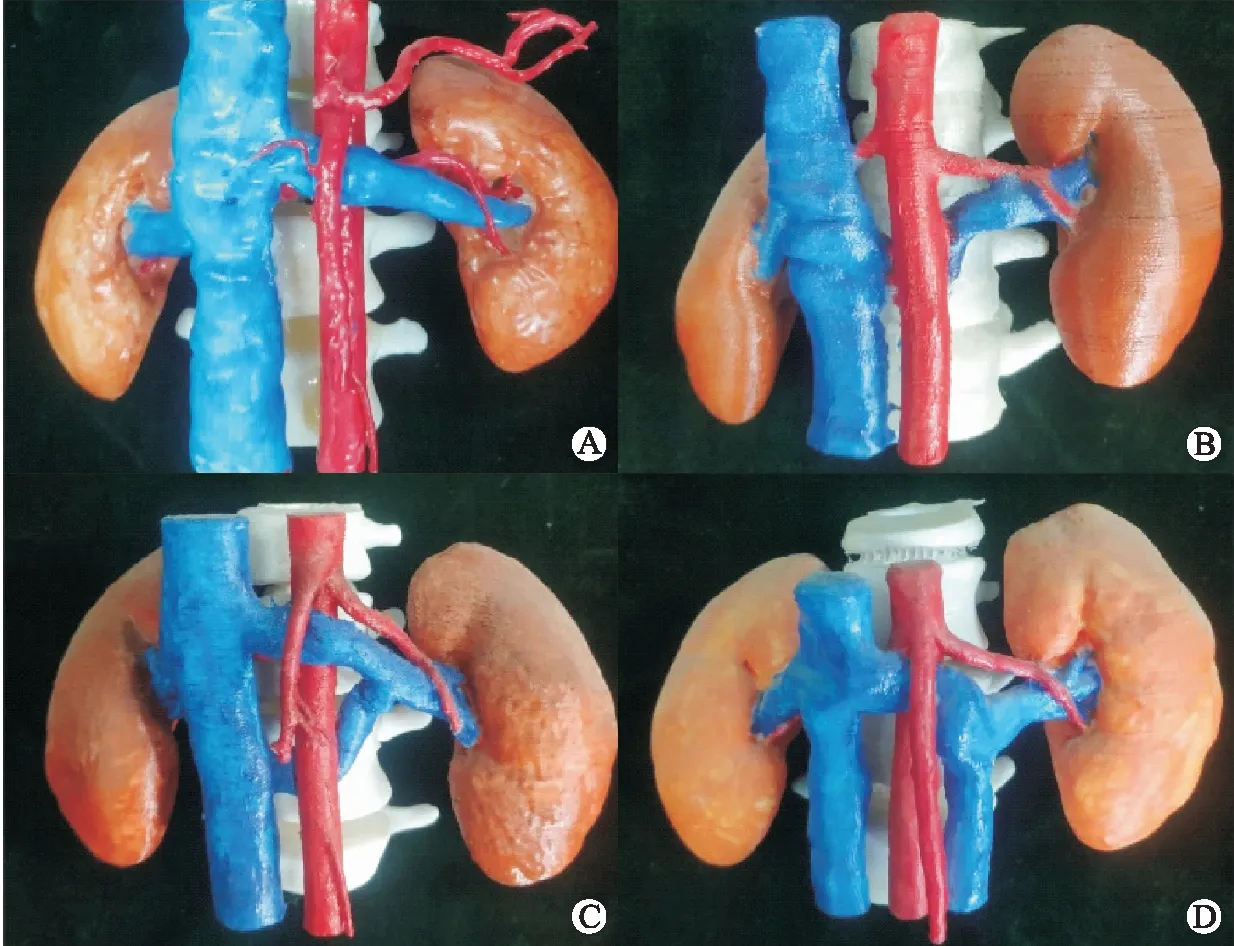
A:前位NCS;B:后位NCS;C:环主动脉NCS;D:双下腔静脉NCS。图1 不同类型胡桃夹综合征的3D打印模型图(基于胡桃夹综合征患者CT血管造影数据)
NCS是导致肾脏的静脉流出受阻的常见原因之一,肾脏的静脉流出是肾血流动力学的一个被低估的因素。在当前的文献报道中,相对没有强调有效肾脏灌注的重要性。从肾脏角度看,除了优化心输出量外,还应该使肾脏灌注最大化。肾静脉流出的受阻可从总体上限制肾脏的血液供应、氧气输送和肾单位的功能完整性。关于静脉血流阻滞作用的第一个实验数据可以追溯到1931年WINTON等[2]的研究,该研究曾在狗心肺肾模型中进行,并描述了将静脉压升高24 mmHg(1 mmHg=0.133 kPa)会损害肾功能,而将平均动脉压降低15 mmHg也可出现类似结果。在肾小球中,净滤过压的生理值仅为10 mmHg,因此,中心静脉压或腹腔内压力的任何升高都会导致肾小球净滤过压降低,甚至略微升高也可能导致肾功能不全,具体取决于它们传递至肾小球的程度。由于肾脏包膜紧实,即使体积的小幅度增加也将造成肾实质内压力大幅度升高,严重可导致急性肾间隔室综合征[3]。NCS引起的持续性左肾静脉流出受阻或可直接导致肾脏淤血性损伤,这与静脉压升高、肾小球滤过率降低,以及炎性介质释放、氧自由基增多密切相关;当缺乏有效治疗时,或可导致肾功能进一步受损。因此,肾灌注和功能受损不仅仅归因于心力衰竭或动脉供血的不足,而是灌注减少和静脉压升高的结合[4]。
2 临床表现
血尿、蛋白尿、腰腹疼痛作为NCS的典型临床表现,可能与左肾静脉高压、交通静脉结构内压力增加有关。在肾集合系统内,输尿管周围和肾盂周围静脉曲张破裂,导致肉眼或显微镜下血尿。在肾单位内,通常认为静脉性高血压会在血管壁中诱发亚临床免疫级联反应,使站立时的去甲肾上腺素和血管紧张素II的局部释放超过必要水平,这种突然造成肾脏血流动力学改变的生理反应被认为会导致直立性蛋白尿[5]。需要注意的是,直立性蛋白尿在整个儿童群体中相对常见,其中大多数人都呈现出良性发展与结果。
左肾静脉与腰静脉丛、左侧性腺静脉直接相连,这些静脉作为回流入左肾静脉的主要通路,比较容易出现扩张。当病程进展时,左侧性腺静脉充血可发展为女性盆腔淤血综合征。该疾病定义为非周期性慢性盆腔疼痛,或性腺静脉回流扩张引起的重度疼痛。此外,性腺静脉直接与卵巢静脉丛相通,随后与子宫静脉丛相通,最终通过内脏支或壁支经臀-外阴-会阴静脉回流至下腹静脉,其中任意环节出了问题都可导致盆腔疼痛不适。在男性患者中, NCS通常与左肾静脉高压和侧支循环引起的左侧精索静脉曲张有关。
静脉血栓是NCS少见但最严重的并发症。MALLAT等[6]报道1例24岁女性因左侧腰痛伴肉眼血尿3 d就诊,经计算机断层扫描(computed tomography,CT)血管成像确诊为NCS合并左肾静脉血栓,患者经抗凝治疗3周后血栓消失。此外,左侧精索静脉血栓亦有报道。1例12岁男童因左侧睾丸渐进性疼痛3 d就诊,经腹部B超确诊为左侧精索静脉血栓合并NCS,入院后给予依诺肝素,规律治疗后血栓消失[7]。以上两起个案都与NCS引起的血栓相关,虽然经保守治疗都取得了不错的疗效,但临床上应引起高度重视。
3 诊断策略
即使患者的临床表现与NCS高度重合,确诊为NCS也相当具有挑战性。因优先排除更常见的病因,如泌尿系感染、肿瘤、结石、自身免疫性疾病等。CT、磁共振成像(magnetic resonance imaging,MRI)和多普勒超声(Doppler ultrasound,DUS)都是对疑似NCS患者应采取的影像学检查,若诊断困难,仍需要通过左肾静脉造影和压力梯度测量等侵入性检查来确诊[1]。因此,探寻更简单高效的诊断策略将具有重要意义。
多普勒超声不仅可以评估左肾静脉的形态学特点,同时还可以测量血流动力学,且兼备无辐射、易于使用、经济性强等优点,应作为首选的筛查方案。分别测量左肾静脉在AA与SMA夹角处和肾门处的血液峰值流速,并计算其比值,从4∶1到5∶1不等[8]。然而,这项技术也存在不确定因素,当患者分别采取卧位与站立位时测量结果有很大的差异,其中站立位时的相关测量数据值较高,归结于肠管、肠系膜等上腹部脏器的重力作用将SMA向下牵拉,导致左肾静脉受压加重。所以超声检查易受患者体位以及医师的主观因素影响,一定程度上限制了它的准确度。
CT作为诊断NCS的另一种重要方法,结果极具参考价值,应当用于所有侵入性检查之前。CT血管成像不仅能清晰地显示出病变部位的形态学特点,同时可为有手术指征的患者提供重要影像学数据。其横断面成像主要用于测量左肾静脉不同部位的血管内径及其比值。有报道指出,AA与SMA夹角处左肾静脉的标志性“鸟喙”征诊断NCS的敏感性为91.7%,特异性为88.9%[9]。由于左肾静脉内径值因人而异,其受压严重程度难以评估,所以研究重点应落到左肾静脉在肾门扩张处与夹角受压狭窄处的内径比值≥4.9对诊断NCS的敏感性为66.7%,特异性为100%[10]。因此,CT横断面上的“鸟喙”征或左肾静脉内径比≥4.9均可作为诊断NCS的重要依据。
MRI诊断NCS的标准与CT相似,其优势在于无辐射,同时保留了评估邻近异常血管结构的能力,通过对各种MRI序列的比较,真稳态进动快速成像(true fast imaging with steady-state-free precession,T2-TRUFI)在评估左肾静脉时具有特别好的图像质量,非常适用于儿童和青少年。
左肾静脉造影与血管内超声均为有创检查,也是诊断NCS的“金标准”,应用于其他检查都无法确诊的时候。左肾静脉和下腔静脉之间压力梯度升高(≥3 mmHg)是诊断NCS的标准参考值[1]。然而需要注意的是,一些患者可能因代偿性建立侧支循环,当分担的压力足够大时,仅存在较低的压力梯度,使诊断难度加大。此外,侵入性的检查方法应尽量避免用于怀疑NCS的儿童患者。
4 治疗进展
一旦患者被诊断为NCS,治疗方案的选择应根据患者的年龄、症状严重程度,以及方案的可实施性。对于≤18岁体型消瘦的患者,或病程<6个月且症状较轻的成年患者,保守治疗是优先推荐的,包括增加体重、药物治疗(血管紧张素转换酶抑制剂和阿司匹林可以增加肾脏血流灌注)、主动检测等。然而,无论年龄大小,症状严重的患者必须进行全方面的临床评估,必要时应积极采取外科干预措施。PASTERSHANK等[11]于1974年首次通过开放手术治疗1例血尿合并左侧腰痛的NCS患者,术中主要通过分离AA与SMA之间的纤维组织,游离受压的左肾静脉。目前使用的术式包括开放手术、腹腔镜或机器人辅助的左肾静脉或SMA移位术、自体肾移植术、肾固定术、性腺-腔静脉吻合术、左性腺静脉结扎术、近端睾丸-髂-隐静脉吻合术、血管内支架置入术和血管外支架置入术[1]。尽管这些外科手术已在 NCS 患者中取得了技术上的成功和显著的症状缓解率,但仍没有足够的证据证明这些手术可以作为标准外科治疗。值得一提的是,各种血管重建手术、转流术等因其创伤大、并发症多,近几年来临床已较少采用。随着科学技术不断发展,微创手术是现代外科的发展方向,介入和腔镜技术作为微创手术中的热门,在临床上的应用将会进一步发展和深化。考虑到NCS的发生机制为SMA和AA对左肾静脉的外在压迫,血管内支架和血管外支架作为两种以支撑AA、SMA夹角为目的的手术方式,逻辑上更加合理,也是目前临床上采取最多的两种治疗方案。
4.1 左肾静脉血管内支架置入术左肾静脉血管内支架置入术操作简单,通常可在局麻下完成(图2)。目前有多种内支架型号被采用,包括SMART Control支架、Wallstent支架、Zilver Vena支架等,但理想的内支架尚未发现(它应具有足够的径向强度以防止支架内狭窄;良好的贴合性以适应血管内皮;几乎没有长度收缩,便于定位;防移位设计等)。为了避免支架移位,DE MACEDO等[12]建议支架应该比肾门处左肾静脉内径宽20%。据文献报道,血管内支架在术后随访1~60个月内的症状缓解率在61.1%~100%,血尿缓解率在61.7%~92.8%,再次干预发生率为3%[13-14]。
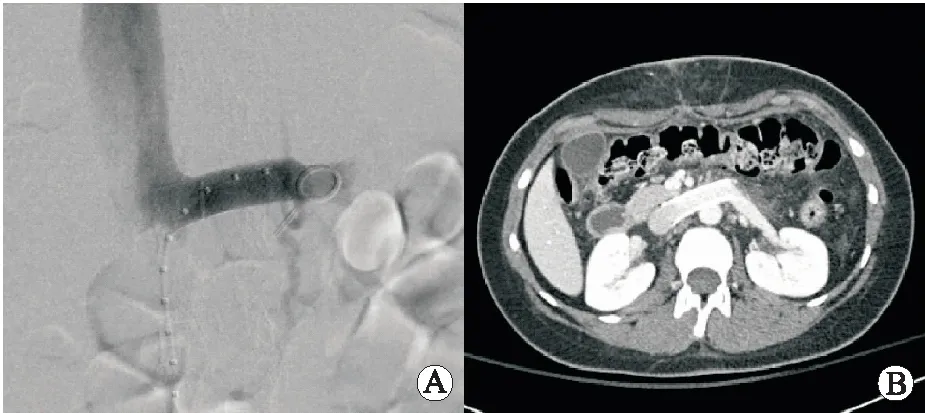
A:左肾静脉内置入自膨式血管内支架;B:CT横断面显示血管内支架固定在位。图2 左肾静脉血管内支架置入术术中及术后影像(由美国佛罗里达梅奥诊所YOUNG ERBEN教授提供)
尽管尚无理想的内支架,但近乎无创的优点使其非常有吸引力。该技术的潜在风险是支架移位,可以发生在短距离或脱落至下腔静脉,甚至到右心房/心室,这是很严重的并发症。WU等[15]的研究显示,在平均55个月(6~126个月)的随访期内,6.7%的NCS患者出现了内支架移位;TIAN等[16]首先报道了1例NCS患者血管内支架移位后,再次手术放置血管外支架作为补救措施;支架内再狭窄和血栓形成可能是由于支架表面出现假内膜或血栓沉积,也可能由于内支架持续受压所致。据报道,血管内支架断裂可发生在严重受力区域,并且由于该区域持续受压,内支架置入时可能无法完全打开[17]。对于正处于生长发育期的儿童患者,左肾静脉内径值也处于动态变化中,医生更应充分考虑与内支架相关的潜在风险。此外,血管内支架置入术后,患者需长期或终身进行抗血小板治疗。
4.2 腹腔镜下左肾静脉血管外支架植入术血管外支架置入术是很有前景的治疗方案。对于腹腔镜下血管外支架置入术,使用了两种不同的技术。第一种使用聚四氟乙烯(poly tetra fluoroethylene,PTFE)人造血管充当外支架,最早由BARNES等[18]于1988年首次通过开放入路实施该技术;第二种使用3D打印技术制作血管外支架(图3),是近年来新兴的技术[14, 19]。两种技术手术步骤相似,以腹腔镜3D打印聚醚醚酮(polyetheretherketone,PEEK)血管外支架置入术为例(图4),术中充分解剖游离左肾静脉至下腔静脉入口处,分离AA与SMA夹角周围的纤维条索和主动脉结缔组织,视具体情况保留或离断左侧性腺静脉、肾上腺中央静脉和腰静脉;置入血管外支架,将左肾静脉套入其中,并沿长轴将其固定到目标位置,充分支撑AA与SMA的夹角,避免左肾静脉受压,术后复查CT提示支架固定在位,支架内血流通畅(图5)。据报道,血管外支架的症状缓解率在71.4%~100%,血尿缓解率在89%~92.3%,随访时间为3~52个月,且术后没有再次干预[13-14, 19]。
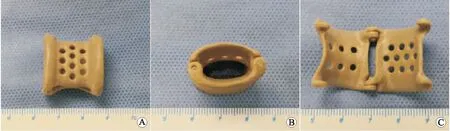
A:正面;B:侧面;C:内部。图3 3D打印PEEK血管外支架俯视图
5 个人经验与体会
在我们目前诊治的170余例NCS患者中,血尿(包括肉眼血尿、镜下血尿)、蛋白尿、左侧腰腹部疼痛是主要症状,男性患者中左侧精索静脉曲张占比较高,女性中盆腔淤血综合征也有一定的比例;其余的症状还有疲乏无力、左侧肾功能减退,以及植物神经功能紊乱等。值得注意的是,大多数前来就诊的患者都伴有严重的焦虑不安或抑郁倾向,这可能与NCS病程长、症状多、易误诊、治疗不当等因素相关。
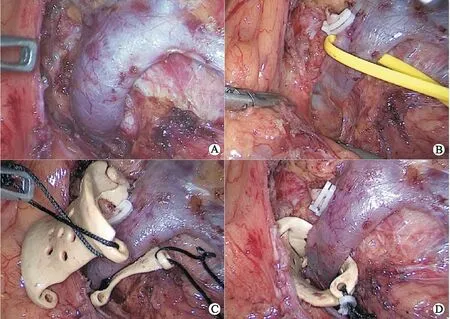
A:充分游离左肾静脉;B:分离夹角周围的纤维条索和主动脉结缔组织;C:将3D打印PEEK血管外支架套入左肾静脉;D:固定至目标夹角处。图4 腹腔镜3D打印PEEK血管外支架植入术手术截图
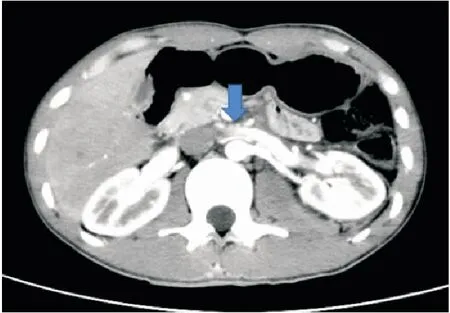
图5 3D打印PEEK血管外支架置入术后增强CT横断面成像
治疗NCS的首要任务是明确诊断,侵入性检查虽然作为诊断该疾病的“金标准”,但在实际临床工作中很少应用。通过一些常规检查如尿常规、尿蛋白定量、彩超、CT、MRI等,结合患者病史,经验丰富的医生不难做出判断。AA与SMA的夹角测量虽有重要诊断意义,但查阅文献后发现该夹角的度数区间差异较大,尚未统一;此外,由于NCS影像表现的多样化,我们在临床工作中经常遇到夹角小但症状轻、夹角大却症状重的情况。所以我们认为,NCS的影像学诊断应侧重于左肾静脉在夹角受压处与肾门扩张处的血管内径比和峰值流速比,夹角大小可作为辅助判断。
血管外支架微创植入术与血管内支架相比具有独特的优势。考虑到PTFE人造血管的设计特点,充当血管外支架或许并不适合。首先是径向强度不足,PTFE的设计初衷用于血管的替代治疗, 需要兼顾良好的弹性以及血管的生理学特性, 其抗压性能显然不足;术中需要将PTFE管壁纵向劈开以便套入左肾静脉, 进一步降低其径向强度。其次是血管腐蚀,PTFE内壁有微小的孔隙(为了血管内皮细胞嵌入空隙里而内皮化),可能导致左肾静脉外壁粘连性腐蚀。第三是移位,由于PTFE弹性模量较高,夹在两根连续搏动的大动脉之间,易发生搏动甚至共振,可能导致支架移位。特别是在前腹壁受到较大压力时,人造血管发生弹性形变,压力解除时突然发生弹性回缩,更容易发生移位。第四是固定困难,因特殊的解剖学特点,左肾静脉穿过AA、SMA夹角后与下腔静脉之间的距离很短,很难在该处固定外支架,只能截取较长的PTFE,套入肾静脉后将其推至右侧顶住下腔静脉,并于PTFE左侧远端固定,这样便有潜在移位风险。此外,人造血管形状单一,难以与NCS的解剖多样性相匹配,或可对左肾静脉造成一些不利影响。与PTFE人造血管相比,3D打印血管外支架的优点在于材料及模型可定制,且专门为患者量身定做,极大提升了治疗的精准性,这是由于定制植入物更加贴合人体内的目标结构,从而避免影响周围其它重要组织器官。目前,3D打印血管外支架的材料可选择钛合金、聚醚醚酮等,都拥有良好的生物相容性。聚醚醚酮材料的优势在于它不仅具备媲美钛合金的力学性能,同时密度与人体软组织接近,并且在体内更好地促进细胞增殖与活力[20]。我团队于2020年报道了28例NCS患者接受腹腔镜下3D打印PEEK血管外支架植入术[19],截至目前共有170余例患者接受该手术,术后均呈现出良好的安全性与治疗效果,且无支架移位等并发症的发生。
对于血管外支架的选择,所有植入材料必须符合人体植入物标准,并且其结构或性能不能轻易改变。虽然目前没有足够的证据表明哪种支架最安全,但3D打印血管外支架不仅具备了材料的刚性,同时兼备了治疗的精准性,这种个体化的治疗方式或许是更优的选择。目前3D打印技术尚未普及或许是制约该治疗方式的主要原因。
6 展 望
NCS患者在接受严格的诊断、评估后,具有手术指征者应该接受外科治疗。目前多种治疗方案在数据回顾性研究中初步得到肯定。但这些研究缺少循证医学证据,需要前瞻性研究进一步提高证据水平。随着科学技术不断发展,介入治疗、血管外支架技术将日臻完善,其他新方法也将不断出现。关于NCS的诊断标准、治疗方案仍需进一步探索[21-22]。
