多菌种分段发酵工艺制备玉米发酵酱
2022-12-26王斌黄巧屈明成杨莉赵珠莲李洪军李洁肖琳
王斌,黄巧,屈明成,杨莉,赵珠莲,李洪军*,李洁,肖琳
1(聚慧食品科技(重庆)有限公司,重庆,401147)2(西南大学 食品科学学院,重庆,400715)3(重庆食品工业研究所,重庆,400000)
玉米(ZeamaysL.) 是主要的粮食和能源作物[1]。玉米有着极高的营养价值,其含有64%~78%的淀粉、8%~14%蛋白质、3.5%~5.7%脂肪与1.8%~3.5%膳食纤维,此外还含有钙、铁、镁、维生素、亚油酸、谷胱甘肽、酚类化合物等营养保健物质,具有明显的防癌、抗氧化和促消化作用[2]。所以玉米有着延年益寿食品的美称,在营养高且生物学功能强的食品开发中具有非常大的潜力[3-4]。
味精和5-核糖核苷酸(如肌苷-5-单磷酸)通常被添加到烹饪产品中增鲜[5]。这些化合物自然存在于许多食物中如晒干的西红柿、干鲣鱼、香菇、海藻或帕尔马干酪等[6],当作为纯原料添加时,它们有时会引起消费者对增味剂的排斥。如今,由玉米、麦麸和大豆等原料进行发酵或水解所得的促味剂或调味剂相继而出[7]。发酵食品最终的风味都是由微生物(细菌、真菌和酵母菌)的代谢驱动,并由顺序或伴随发生的30多种反应所产生,改变了食物的固有口感、味道,并转化为赋予味道的化合物[6]。尽管代谢途径中导致味觉化合物产生的机制尚未完全了解,但由于微生物对原料中碳水化合物的消耗分解及其代谢所产生的酶引起的蛋白质与多肽的水解是产生味道化合物的主要途径[8]。
目前关于应用多菌种分段发酵技术制备玉米发酵酱还未见报道,本研究采用分段发酵法,先接种米根霉菌对玉米进行水解后,以其为原料,选择植物乳杆菌与希腊魏斯氏菌株作为外加菌种进行发酵,以期开发一款天然、营养、健康的酸鲜玉米酱,为玉米酱加工提供新方法。
1 材料与方法
1.1 材料、菌种、培养基与试剂
黄玉米,市售。
希腊魏斯氏菌和米根霉菌株由本实验室筛选;植物乳杆菌,湖北省工业微生物菌种保藏与研究中心。
MRS培养基(g/L):蛋白胨10、酵母提取物5、牛肉膏10、葡萄糖20、K2HPO42、柠檬酸三铵2、乙酸钠5、吐温-80 1 mL、MgSO4·7H2O 0.58、MnSO4·4H2O 0.25,pH 6.2~6.4;121 ℃灭菌20 min。固体培养基加入15 g/L琼脂。
PDA培养基:称取去皮土豆200 g,切成小块,加水1 L,煮沸1 h,双层纱布过滤澄清液,按蔗糖2%和琼脂2%(均为质量分数)加入滤液中,煮沸溶解后补加蒸发水分,分装三角瓶。
蛋白胨、琼脂,山东拓普生物工程有限公司;酵母提取物、吐温-80(分析纯),成都市科隆化学品有限公司;牛肉膏、福林试剂、没食子酸、甲醛,上海麦克林生化科技有限公司;K2HPO4、柠檬酸铵、乙酸钠、葡萄糖、MgSO4、MnSO4、NaCl(均为分析纯),重庆川东化工集团有限公司。
1.2 仪器与设备
SJ-CJ-2FD超净工作台,苏州苏洁净化设备有限公司;SPX-250B-Z生化培养箱、GZX-9140MBE电热恒温鼓风干燥箱,上海博讯实业有限公司医疗设备厂;HYQX-II厌氧培养箱,上海跃进医疗器械有限公司;MAS-II plus微波合成萃取反应工作站,上海新仪微波化学科技有限公司;PHS-3C型pH计,上海佑科仪器仪表有限公司;ATY224电子天平,Shimadzu Corporation;DW-HL100超低温冷冻冰箱,中科美菱低温科技股份有限公司;LDZH-100L立式高压蒸汽灭菌锅,上海申安医疗器械厂;纯水机,四川优普超纯科技有限公司。
1.3 试验方法
1.3.1 细菌菌悬液的制备
米根霉菌株接种于PDA培养基上35 ℃活化培养96 h,使用0.9%生理盐水洗脱孢子制备孢子悬浮液,放入4 ℃冰箱中保存备用;将植物乳杆菌和希腊魏斯氏菌株接种于MRS固体培养基上35 ℃培养24 h,用牙签取菌体接种于含有100 mL的MRS液体培养基的250 mL三角瓶中,35 ℃、80 r/min振荡培养18 h,直至菌液浓度达到108CFU/mL,备用。
1.3.2 玉米发酵酱制备
将市售黄玉米去掉玉米芯,用自来水洗净后,将玉米粒与水以2∶1的质量比打浆,121 ℃灭菌15 min,冷却后备用。
将上述玉米酱300 g置于500 mL灭菌三角瓶中(n=9),接入6 mL米根霉孢子悬液,使得最后孢子浓度为106个孢子/g玉米酱,置于恒温培养箱中25 ℃发酵3 d。115 ℃灭菌20 min后,3瓶为1组。一组接入6 mL植物乳杆菌;一组接入6 mL希腊魏斯氏菌;一组接入植物乳杆菌与希腊魏斯氏菌各3 mL,置于恒温培养箱中25 ℃发酵。从第1天开始定期取样,一直取样至第5天。
1.3.3 微生物分析和pH值测定
将每天取出的样品用无菌水分别稀释成10-4、10-5、10-6、10-7、10-8的悬浮液,用移液枪吸取100 μL置于MRS固体平板培养基中,每个梯度悬浮液重复3次,混合均匀后,翻转平板,置于35 ℃培养箱中培养48 h,菌落计数,每个平板中的菌落数乘以稀释倍数即为每个发酵时间点的菌落总数(参考GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》)。将每天取出的样品用pH计测定pH值[9]。
1.3.4 还原糖含量的测定
采用快速直接滴定法测定样品中的还原糖含量[10]。
1.3.5 总酸含量的测定
采用滴定法[11]测定样品中总酸含量,以乳酸计。
1.3.6 总酚含量的测定
样品中总酚测定采用Folin-Ciocalteu法[12],稍加改进。称取1 g发酵样品,溶于9 mL的80%(体积分数)乙醇中。用移液枪吸取上述待测样品0.5 mL置于10 mL具塞比色管中,加入0.5 mL去离子水,摇匀后加入0.5 mL福林试剂,混匀,1 min后加入1.5 mL的20%(质量分数)NaCO3溶液,混合均匀,用去离子水定容至10 mL,放于70 ℃恒温水浴锅中加热10 min,冷却后于紫外分光光度计中765 nm下测定OD值。以没食子酸为标准品进行比对。
1.3.7 氨基酸态氮含量的测定
采用甲醛滴定法[12]测定样品中的氨基酸态氮含量。
1.3.8 感官评价
对发酵结束后的玉米酱样品进行了消费者可接受性测试,感官评定主要参照肖欣欣[13]的方法,采取十分制,评分强度0~9(0:无;1~2:非常弱;3~4:普通;5~6:较好;7~8:好;9:很好)。
2 结果与分析
2.1 玉米酱后发酵过程中微生物与pH变化
在玉米酱后发酵过程中,所有样品中的乳酸菌菌落总数在1 d内迅速增加。初期单独接种希腊魏斯氏菌的菌落总数高于单独接种植物乳杆菌;接种2种菌剂的菌落总数明显高于二者单独接种(图1-a)。植物乳杆菌是典型的同型乳酸菌,希腊魏斯氏菌是异型乳酸菌,在蔬菜发酵初期,异型乳酸菌能够快速启动发酵[14],其繁殖速度非常快,所以单独接种希腊魏斯氏菌的活菌数迅速增长,但随着发酵的进行,由于异型乳酸菌希腊魏斯氏菌不耐酸,其乳酸菌数量又迅速减少。植物乳杆菌本身就是耐酸能力较强的同型乳酸菌,所以在接种中后期,植物乳杆菌乳酸菌含量都要高于单独接种希腊魏斯氏菌组。异型乳酸菌在发酵代谢中可以提供丰富的营养物质,促进植物乳杆菌的繁殖[15],因此接种2种菌剂的菌落总数不会随着体系中希腊魏斯氏菌数量的减少而减少,反而是维持在一定范围内,直至发酵结束。
在发酵过程中,3种不同菌剂发酵玉米酱的pH值在发酵前2 d呈快速下降趋势,然后缓慢下降,直至稳定,说明植物乳杆菌和希腊魏斯氏菌可以利用玉米酱中的营养物质生长,同时产生酸性代谢物质,促使环境pH值随着发酵的进行不断降低。其中,接种2种菌剂的玉米酱比单独接种的玉米酱pH下降的程度要大(图1-b),说明同型乳酸菌与异型乳酸菌的协同作用可以改变发酵条件,增加玉米酱的酸化程度。

a-菌落总数;b-pH图1 玉米后发酵过程中菌落总数和pH值变化Fig.1 Changes in total bacterial count and pH value during post-fermentation of corn注:不同小写英文字母表示组间显著差异(P<0.05)(下同)
2.2 玉米酱后发酵过程中还原糖含量变化
玉米中可用于发酵的游离糖含量很少[16],但含有较高的淀粉[17],于是本研究在实验前期使用米根霉先发酵水解3 d,米根霉菌丝体在生长过程中可以通过淀粉酶将玉米中的淀粉分解为还原糖,还原糖含量由未发酵的0.878 mg/g增加到了12.87 mg/g。在后发酵过程中,3种不同菌剂发酵的玉米酱中还原糖含量都不断下降,其中,接种植物乳杆菌后,还原糖含量降低了77.69%;接种希腊魏斯氏菌后,还原糖含量降低了73.24%;接种2种菌剂后还原糖含量降低了89.66%,如图2所示。米根霉水解后,玉米中的碳源十分利于2种菌剂的定殖,被其发酵利用。
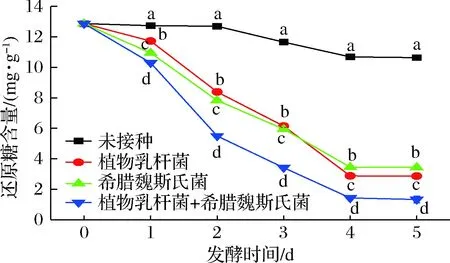
图2 玉米后发酵过程中还原糖变化Fig.2 Changes of reducing sugar during post-fermentation of corn
2.3 玉米酱后发酵过程中总酸含量变化
由图3可知,单独接种希腊魏斯氏菌的玉米酱中总酸含量要低于单独接种植物乳杆菌组,这可能是因为希腊魏斯氏菌的产酸能力较弱。接种2种菌剂的玉米酱中的总酸含量高于其他2组,异型乳酸菌希腊魏斯氏菌虽然产酸能力较弱,但其代谢活动会促进植物乳杆菌的生长繁殖与乳酸代谢,因此乳酸含量高。随着体系中可发酵的糖类物质不断被消耗,乳酸含量不断升高,最后又呈现下降趋势,这可能是因为在发酵过程中产生的其他代谢物质,如乙醇等,会使乳酸在酯化作用下形成酯香类物质,因此乳酸量会相应减少。

图3 玉米后发酵过程中总酸含量变化Fig.3 Changes of total acid during post-fermentation of corn
2.4 玉米酱后发酵过程中总酚含量变化
酚酸会通过酚环上或者分子结构上的羧基与其他聚合物发生酯化反应,变为不可溶物质,而发酵可以充分利用微生物所产生的酶断开此链,释放出酚酸[18],使总酚含量得以提高。由于菌种的不同,酶的数量与活性也不同,所以不同菌剂发酵的玉米酱中总酚含量增长不同。在后发酵第4天时,3种不同菌剂发酵的玉米酱中的总酚含量都增长到最高值,其中,接种植物乳杆菌组的总酚含量为第0天的4.34倍;希腊魏斯氏菌组为1.48倍;2种菌剂组为5.05倍(图4)。
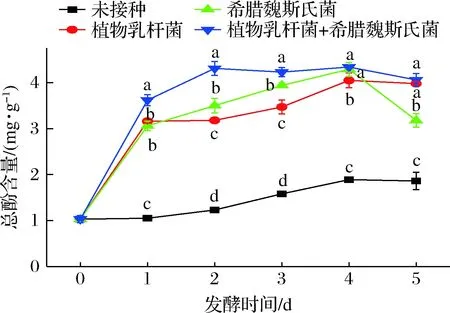
图4 玉米后发酵过程中总酚含量变化Fig.4 Changes of total phenols during post-fermentation of corn
2.5 玉米酱后发酵过程中氨基酸态氮含量变化
由图5可以看出,玉米酱中氨基酸态氮含量随着后发酵时间的延长呈现逐步增加的趋势,到第4天时,3种不同菌剂发酵的玉米酱中的氨基酸态氮含量均达到最高,与第0天时相比,单独接种植物乳杆菌组的氨基酸态氮提高了2.54倍;单独接种希腊魏斯氏菌组的氨基酸态氮提高了2.20倍;接种2种菌剂组的氨基酸态氮提高了3.04倍。进一步延长发酵时间,氨基酸态氮的含量缓慢下降,这可能是因为前期微生物所分泌的蛋白酶非常活跃,其分解蛋白质产生氨基酸的速度就快[19],随着发酵的进行,体系中会不断生成乙醇等物质,高浓度的乙醇量会抑制蛋白酶活力,此外,氨基酸也会参与到一些生理生化反应中,所以氨基酸总量会不断减少。

图5 玉米后发酵过程中氨基酸态氮含量变化Fig.5 Changes of amino acid nitrogen during post-fermentation of corn
2.6 玉米发酵酱感官品质评价
对玉米后发酵第4天的3组样品进行感官分析,评价其感官品质。图6表明,接种2种菌剂发酵的玉米酱,尽管其色泽的分数低于单独接种植物乳杆菌与希腊魏斯氏菌的玉米酱,但其具有明显成熟玉米发酵的柔和、酸鲜和回甘滋味,其酸度、形态、鲜味、玉米香味和复合香味方面都要优于其他2组。希腊魏斯氏菌经过戊糖磷酸途径发酵后除主要产乳酸外还可以产生大量乙酸、乙醇与甘露醇等风味物质,具有产物多样性的特点,可以赋予产品更好的风味[20]。其协同同型乳酸发酵菌植物乳杆菌可明显改善2种菌剂单独接种发酵玉米酱风味贫乏的缺点。

图6 玉米发酵酱感官品质评价Fig.6 Sensory characteristics of corn fermented sauce
3 结论
本文使用分段发酵技术充分利用玉米原料中各组分,促进糖类、酚类、有机酸与氨基酸态氮等风味物质的释放,增加产物的酸鲜底蕴。实验证明,利用米根霉将玉米中淀粉降解为多糖后,有利于植物乳杆菌、希腊魏斯氏菌进行乳酸发酵,并且植物乳杆菌和希腊魏斯氏菌混合发酵效果明显高于单独用1种菌发酵的效果。混合发酵第4天时,玉米酱中的还原糖含量最低,总酸、总酚、氨基酸态氮以及感官评价分数最高,玉米酱的品质最好。多菌种分段式发酵工艺是未来玉米酱加工的必然趋势,本研究的试验结果为制备玉米发酵酱提供了新的方法。
